La vacunación sistemática infantil frente al meningococo C ha tenido un impacto considerable en la enfermedad meningocócica invasiva (EMI). El objetivo de este estudio es analizar la epidemiología, las manifestaciones clínicas y los factores asociados a un peor pronóstico de la EMI en la era de la vacuna antimeningocócica C.
Material y métodosSe analizaron los casos de EMI confirmados en menores de 15 años diagnosticados en Navarra entre 2008 y 2014, y se evaluó el riesgo de muerte o secuelas permanentes, según la presencia de determinados hallazgos clínicos o analíticos al diagnóstico.
ResultadosLa incidencia media anual fue 7,9 casos por 100.000 niños, con mayor tasa de ataque en niños < 1 año. De 53 casos analizados, el 87% fueron por meningococo B. Fiebre (100%), exantema (91%) y elevación de la procalcitonina (94%) fueron los hallazgos más frecuentes al diagnóstico. El 70% de los casos presentaba algún signo de shock a su llegada al hospital. La letalidad fue del 3,8% y un 10% sobrevivió con secuelas permanentes. Una puntuación en la escala de coma de Glasgow < 15 (odds ratio [OR]=9,2), convulsión (OR=8,3), sepsis sin meningitis (OR=9,1), trombocitopenia (OR=30,5) y coagulación intravascular diseminada (OR=10,9) se asociaron con un peor pronóstico.
ConclusiónLa EMI continúa causando una morbimortalidad importante en la población infantil, por lo que sigue siendo necesario avanzar en su prevención, en su diagnóstico temprano y en reconocer los factores asociados a mal pronóstico.
Systematic childhood vaccination against meningococcus C has had a considerable impact on meningococcal invasive disease (MID). The aim of this study is to perform an analysis on the epidemiology, the clinical features, and the factors associated with a worse prognosis of MID, in the era of a meningococcal C vaccine.
Material and methodsThe study included confirmed cases of MID in children less than 15 years of age in Navarra, Spain, between 2008 and 2014. The risk of death or permanent sequelae was evaluated according to the presence of clinical features and analytical parameters at diagnosis.
ResultsThe average annual incidence was 7.9 cases per 100,000 children, with the highest attack rate in children < 1 year. Of 53 cases analysed, 87% were due to meningococcus B. Fever (100%), rash (91%), and elevation of procalcitonin (94%) were the most frequent findings at diagnosis. Some sign of shock was observed in 70% upon arrival at the hospital. The case-fatality rate was 3.8% and 10 % survived with permanent sequelae. Glasgow coma scale < 15 (odds ratio [OR]= 9.2), seizure (OR=8.3), sepsis without meningitis (OR=9.1), thrombocytopenia (OR=30.5), and disseminated intravascular coagulation (OR= 10.9) showed a greater association with a worse prognosis.
ConclusionThe MID continues to be a significant cause of morbidity and mortality in children. Therefore, new advances are needed in the prevention, early diagnosis, and detection of the factors associated with poor prognosis.
La enfermedad meningocócica invasiva (EMI), producida por la bacteria Neisseria meningitidis (N. meningitidis) (meningococo), es una infección grave que afecta principalmente a niños pequeños1-4.
En España, tras la introducción de la vacuna conjugada frente al serogrupo C (MenCC) en el calendario de vacunación infantil en 2001, la incidencia de EMI descendió, hasta situarse en torno a 0,8 casos anuales por 100.000 habitantes en 2012-20135. Sin embargo, respecto a otras enfermedades infecto-contagiosas, causa un importante impacto social, médico y económico, siendo considerada una prioridad sanitaria de primer orden6,7.
La EMI suele manifestarse como un cuadro agudo de sepsis y/o meningitis que puede desencadenar la muerte del enfermo en pocas horas2. En nuestro medio, aún con el tratamiento adecuado, la letalidad ronda el 10%, y el 10-20% de los casos que sobreviven presentan secuelas8,9.
La EMI supone un reto para los clínicos, por un lado, porque el diagnóstico temprano en ocasiones es complicado, y por otro lado, por la complejidad terapéutica de los casos más graves. Las manifestaciones clínicas iniciales a menudo son inespecíficas, sobre todo en los lactantes10, dificultando el diagnóstico diferencial11,12. La administración temprana de antibióticos y la instauración de medidas de soporte son los pilares terapéuticos7,13,14. En esta enfermedad, resulta de vital importancia el reconocimiento temprano de los pacientes con peor pronóstico desde la primera atención sanitaria12, ya que el tratamiento precoz y el traslado a unidades de cuidados intensivos, aumentan las probabilidades de supervivencia y reducen las secuelas15. Con este propósito, se han propuesto diversos factores predictores de gravedad16.
El objetivo de este estudio es conocer la epidemiología y la clínica de la EMI en la población infantil de Navarra en la era de vacunación universal frente al meningococo C e identificar los hallazgos clínicos y analíticos al diagnóstico que predicen a una peor evolución.
Material y métodosEstudio retrospectivo desde 2008 hasta 2014, años en los que el programa de vacunación infantil frente al meningococo C estaba completamente asentado, considerando que el periodo pudiera resultar suficiente para reflejar la situación de la EMI. La población de estudio fueron todos los menores de 15 años residentes en Navarra, unos 95.500 habitantes. Se consideró caso a todo paciente menor de 15 años con clínica compatible con EMI y confirmación microbiológica de identificación de N. meningitidis (aislamiento en cultivo, detección de ADN por reacción en cadena de la polimerasa o del antígeno por técnicas inmunológicas) en sangre o líquido cefalorraquídeo.
Los datos epidemiológicos y microbiológicos de todos los casos se obtuvieron del sistema de vigilancia activa de la EMI a través del Registro de Enfermedades de Declaración Obligatoria de Navarra. Esta información se completó con los datos de la historia clínica en 46 de los casos.
Las tasas de incidencia se calcularon tomando como denominador la población del padrón a 1 de enero para cada grupo de edad y año, según el Instituto Nacional de Estadística.
Se definió sepsis, shock séptico, sepsis grave y disfunción orgánica según los criterios publicados en el consenso de la Conferencia Internacional de Sepsis Pediátrica de 200517. Los pacientes en los que, sin cumplir criterios de sepsis, se aislaron bacterias viables en sangre se clasificaron como bacteriemias. Se tuvieron en cuenta los signos clínicos de shock según la Guía española de Práctica Clínica sobre el Manejo de la Enfermedad Meningocócica Invasiva7 (color anómalo de la piel, frialdad acra, relleno capilar >2”, confusión mental o disminución del nivel de consciencia, taquicardia o hipotensión, dificultad respiratoria o dolor de extremidades). Se definió el estado de coagulación intravascular diseminada (CID) por la presencia de hallazgos de laboratorio propios de esta entidad18.
Se consideró mala evolución la presencia de secuelas permanentes (presentes 3 meses después del alta) o la muerte. Los factores analizados por su posible asociación con una mala evolución fueron: el tiempo de evolución de los síntomas hasta la llegada al hospital (<12; 12-23 y ≥ 24 h), la clínica de sepsis sin meningitis, las lesiones cutáneas extensas (generalizadas o diseminadas incluyendo el tronco y las extremidades) o evolucionadas (púrpura o equimosis), la puntuación < 15 en la escala de coma de Glasgow, uno o más episodios convulsivos, criterios clínicos de sepsis grave, leucopenia (leucocitos < 4.500/mm3), neutropenia (neutrófilos < 900/mm3), trombocitopenia (plaquetas < 150.000/mm3), producto de plaquetas×neutrófilos (PN) <40×109/L, exceso de bases (EB) < –8, procalcitonina (PCT) > 100ng/mL y CID.
Todos los casos recibieron asistencia hospitalaria en la red sanitaria pública de Navarra, compuesta por un hospital de referencia y 2 hospitales comarcales. Para evaluar los factores pronósticos, se analizaron los valores registrados en el momento del ingreso en cualquiera de los centros hospitalarios (primera anamnesis, exploración física y analítica de sangre), excepto para la CID, en la que se tuvo en cuenta la presencia de los criterios diagnósticos en cualquier momento del episodio clínico.
Para estudiar los factores asociados a mala evolución, se realizó un análisis bivariante entre cada hallazgo clínico o analítico (variable independiente) y el desenlace de mala evolución (variable dependiente). En este análisis, se incluyeron los 46 casos de los cuales se dispuso de la información clínica. La comparación se realizó empleando el test exacto de Fisher. La significación estadística se consideró a partir del valor de p < 0,05.
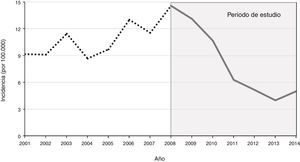
ResultadosEpidemiologíaEntre 2008 y 2014 se incluyeron un total de 53 casos de EMI. La incidencia siguió una tendencia predominantemente decreciente (fig. 1). La incidencia media anual fue de 7,9 casos por 100.000 habitantes. Los casos se presentaron predominantemente durante los meses de invierno (semanas 1 a 4, y 45 a 53). No hubo diferencias significativas en la distribución por sexo (58% varones y 42% mujeres). La media de edad de los casos fue de 2,7 años (desviación estándar [DE] 4,5 años), siendo el 83 % de los niños menores de 5 años. La incidencia media anual más alta se registró en los menores de un año con 40,7 casos por 100.000, seguidos de los de 1 a 4 años con 13,3 por 100.000 y los de 5 a 14 años con 2,1 casos por 100.000. En el 87% de los pacientes se aisló el meningococo serogrupo B, en el 4% el serogrupo C y en el 2% el serogrupo Y. El 8% de ellos fueron debidos a meningococos no grupados. El 93% de los casos habían recibido la vacuna MenCC. De los 2 casos por serogrupo C, uno fue un fallo vacunal (paciente correctamente vacunado para su edad) y el otro fue un niño no vacunado por decisión paterna.
Hallazgos clínicos y analíticos al diagnósticoLa forma clínica más frecuente fue la mixta de sepsis-meningitis (36%), seguida de la sepsis (34%), la meningitis (17%) y la bacteriemia (13%).
El tiempo medio ± DE transcurrido desde el inicio de los síntomas hasta la consulta fue de 23 ± 6,3 h. Consultaron en < 12 h un 22%, en 12-23 h un 48% y en ≥ 24 h un 30% de los casos. El 81% de los casos de sepsis y sepsis-meningitis consultaron en las primeras 24 h frente al 43 % de las meningitis y bacteriemias (p=0,026).
De los síntomas y signos al diagnóstico, los más frecuentes fueron la fiebre, el exantema (en su mayoría hemorrágico) y los signos de shock (tabla 1). En el 48% de los casos en los que posteriormente se confirmó meningitis o sepsis-meningitis, los signos meníngeos fueron negativos.
Hallazgos clínicos y analíticos presentes al diagnóstico en pacientes menores de 15 años con enfermedad meningocócica invasiva en Navarra, 2008-2014
| Manifestaciones clínicas | Total, N.° | Hallazgo presente N.° (%) |
|---|---|---|
| Temperatura axilar ≥ 38°C | 46 | 46 (100) |
| Temperatura axilar ≥ 39°C | 46 | 35 (76) |
| Exantema | 46 | 42 (91) |
| Exantema hemorrágico | 46 | 33 (72) |
| Signos de shock | 46 | 32 (70) |
| Puntuación escala de coma de Glasgow < 15 | 46 | 21 (46) |
| Convulsión | 46 | 6 (13) |
| Parámetros analíticos en sangre | ||
| Procalcitonina > 0,5ng/mL | 32 | 30 (94) |
| Leucocitos > 10.000/mm3 | 45 | 37 (82) |
| Exceso de base < –2 | 20 | 14 (70) |
| Leucocitos polimorfonucleares >70% | 45 | 27 (60) |
| Proteína C reactiva >10mg/dL | 45 | 25 (53) |
| Plaquetas < 150.000/mm3 | 45 | 5 (11) |
| Leucocitos < 4.500/mm3 | 45 | 4 (9) |
| Neutrófilos < 900/mm3 | 45 | 3 (7) |
Un caso falleció al ingreso en el hospital, por lo que no se obtuvieron datos analíticos.
La determinación de procalcitonina se inició en 2009.
En el hemograma, el 82% de los pacientes presentaron leucocitosis, el 60% neutrofilia y el 11% trombocitopenia. Se encontró elevación de la PCT en el 94% de los casos en los que se determinó y de la proteína C reactiva en el 53%. La pH-metría mostró acidosis metabólica en el 70% de los casos (tabla 1).
Evolución y tratamientoTodos los casos ingresaron en la planta de hospitalización pediátrica y el 68% también en la Unidad de Cuidados Intensivos Pediátrica (UCIP) (100% de las sepsis-meningitis, 67% de las sepsis y 56% de las meningitis). La media ± DE de estancia hospitalaria total fue de 12 ± 9,8 días y de 6 ± 7,2 días en la UCIP.
La disfunción orgánica más frecuente fue la cardiovascular (60%), seguida de la hematológica (58%), la respiratoria (42%), la neurológica (36%) y la renal (9%). Ningún paciente desarrolló disfunción hepática. Un 13% de los casos presentaron CID y un tercio de los pacientes tuvo afectación multiorgánica.
Todos los enfermos recibieron tratamiento antibiótico por vía intravenosa (98% cefotaxima y 2% ceftriaxona). Algunos casos también precisaron tratamiento con expansores del plasma (69%), fármacos vasoactivos e inotrópicos (67%), oxigenoterapia (65%), corticoterapia (42%), intubación (10%) y transfusiones de hemoderivados (9%).
Estado al altaFallecieron 2 pacientes de 10 y 12 meses de edad, siendo la letalidad del 3,8% y la tasa de mortalidad media anual de 0,3 muertes por cada 100.000 habitantes (2,1 muertes por cada 100.000 niños < 2 años). Los dos fallecimientos presentaron un fallo multiorgánico secundario a un shock séptico refractario al tratamiento. En uno se aisló un meningococo serogrupo B y en otro un meningococo no grupado. En ambos casos la muerte se produjo en las primeras 12 h desde el inicio de los síntomas.
De los 51 pacientes que sobrevivieron, presentó algún tipo de secuela el 24% (39% de las sepsis, 32% de las sepsis-meningitis y 11% de las meningitis), que fueron permanentes en el 10%. Las secuelas temporales más frecuentes fueron las debidas a necrosis de tejidos blandos. Las secuelas permanentes fueron sordera (40%), amputaciones en miembros (40%) y otros déficits neurológicos (20%).
Signos asociados a mala evoluciónUna puntuación en la escala de coma de Glasgow < 15 (odds ratio [OR]=9,2), haber presentado al menos una convulsión (OR=8,3), la clínica de sepsis sin meningitis (OR=9,1), la trombocitopenia (OR=30,5) y la CID (OR=10,9) se asociaron significativamente a una peor evolución (tablas 2 y 3). Las lesiones cutáneas extensas o evolucionadas no alcanzaron la significación estadística.
Factores clínicos asociados a la mala evolución en pacientes menores de 15 años con enfermedad meningocócica invasiva en Navarra, 2008-2014
| Factores clínicos | Total N.° | Mala evolución N.° (%) | Odds ratio cruda (intervalo de confianza del 95%) | pa |
|---|---|---|---|---|
| Sepsis sin meningitis | ||||
| No | 33 | 2 (6,1) | 1 | |
| Sí | 13 | 5 (38,5) | 9,1 (1,5-78,2) | 0,015 |
| Sepsis grave | ||||
| No | 17 | 1 (5,9) | 1 | |
| Sí | 29 | 6 (20,7) | 4,1 (0,5-102,3) | 0,209 |
| Lesiones cutáneas extensas/evolucionadas | ||||
| No | 23 | 1 (4,3) | 1 | |
| Sí | 23 | 6 (26,1) | 7,5 (1,0-187,2) | 0,053 |
| Puntuación escala de coma de Glasgow < 15 | ||||
| No | 25 | 1 (4,0) | 1 | |
| Sí | 21 | 6 (28,6) | 9,2 (1,2-230,6) | 0,030 |
| Evolución | ||||
| < 12 h | 10 | 1 (10,0) | 1 | |
| 12-23 h | 22 | 4 (18,2) | 2,0 (0,2-4,6) | 1,000 |
| ≥ 24 h | 14 | 2 (14,3) | 1,5 (0,1-19,2) | 1,000 |
| Convulsión | ||||
| No | 40 | 4 (10,0) | 1 | |
| Sí | 6 | 3 (50,0) | 8,3 (1,1-65,3) | 0,040 |
Factores analíticos asociados a la mala evolución en pacientes menores de 15 años con enfermedad meningocócica invasiva en Navarra, 2008-2014
| Factores analíticos (en sangre, excepto el último) | Total N.° | Mala evolución N.° (%) | Odds ratio cruda (intervalo de confianza del 95%) | pa |
|---|---|---|---|---|
| Leucocitos < 4.500/mm3 | ||||
| No | 41 | 5 (12,2) | 1 | |
| Sí | 4 | 1 (25,0) | 2,3 (0,1-27,0) | 0,528 |
| Neutrófilos < 900/mm3 | ||||
| No | 42 | 5 (11,9) | 1 | |
| Sí | 3 | 1 (33,3) | 3,6 (0,1-54,4) | 0,399 |
| Plaquetas < 150.000/mm3 | ||||
| No | 39 | 2 (5,1) | 1 | |
| Sí | 6 | 4 (66,7) | 30,5 (3,6-377,1) | 0,001 |
| Procalcitonina > 100ng/mL | ||||
| No | 27 | 1 (3,7) | 1 | |
| Sí | 5 | 2 (40,0) | 14,7 (0,9-526,1) | 0,068 |
| Coagulación intravascular diseminada | ||||
| No | 39 | 3 (7,7) | 1 | |
| Sí | 6 | 3 (50,0) | 10,9 (1,4-94,7) | 0,025 |
| Exceso bases < –8 | ||||
| No | 16 | 1 (6,2) | 1 | |
| Sí | 4 | 1 (25,0) | 4,5 (0,1-206,4) | 0,400 |
| Producto plaquetas x neutrófilos < 40×109/L | ||||
| No | 44 | 5 (11,4) | 1 | |
| Sí | 1 | 1 (100,0) | No disponible | 0,133 |
| Leucocitos en líquido cefalorraquídeo < 10/mm3 | ||||
| No | 38 | 4 (10,5) | 1 | |
| Sí | 2 | 0 (0,0) | 0 (0,0-34,3) | 0,808 |
Entre 2008 y 2014 en Navarra se registró una incidencia decreciente de EMI en niños, de la misma forma que en el resto de España4. El aumento de los casos en invierno3 y la mayor carga de enfermedad en niños pequeños, concuerdan con lo descrito1,2. Como en otros países occidentales, existe un predominio importante del serogrupo B19. La baja incidencia de casos por serogrupo C se relaciona con la elevada cobertura de la vacuna MenCC en nuestro entorno20.
La forma clínica más frecuente fue la sepsis, pero en la literatura varía el predominio de sepsis o de meningitis según estudios11,21. Los casos de sepsis y sepsis-meningitis consultaron antes que otras formas de enfermedad, probablemente por la rapidez y la gravedad con la que evolucionan. La fiebre y el exantema, síntomas habitualmente descritos en los casos15,21,22, fueron las manifestaciones más frecuentes al diagnóstico. En 2 de cada 10 pacientes el exantema no fue hemorrágico, dato que resulta relevante7, porque, frecuentemente, infecciones menos graves en niños se manifiestan de esta manera. Como en otros estudios10, un elevado porcentaje de casos presentaba algún signo de shock a su llegada al hospital. Este hecho es destacable, ya que algunos de estos signos se presentan precozmente7, y saber reconocerlos es importante para realizar un diagnóstico temprano11,12. En casi uno de cada 2 casos de sepsis-meningitis o meningitis, los signos meníngeos fueron negativos, posiblemente porque aparecen más tardíamente o porque en lactantes a menudo son negativos7,11.
Las alteraciones analíticas encontradas son concordantes con lo publicado15,23. El porcentaje de casos con la PCT elevada fue superior al de casos con elevación de la proteína C reactiva. Este hecho puede relacionarse con la corta evolución clínica de la mayoría de casos y apoya la idea de que, por su elevación precoz24, la PCT resulta más útil en el diagnóstico de la enfermedad25.
En la EMI se produce una activación masiva de la cascada inflamatoria y del sistema de la coagulación, induciéndose daños en los órganos internos de los pacientes2. La gravedad de la enfermedad se refleja en el porcentaje de ingresos en UCIP y en la necesidad de medidas terapéuticas de soporte. Nuestros resultados coinciden con los de otros autores en letalidad, mortalidad y media de estancia hospitalaria6, en que la mayoría de los casos que fallecen lo hacen en las primeras 24 h11,21, y en la frecuencia y tipos de secuelas encontradas8,9.
Numerosos trabajos han analizado posibles marcadores pronósticos clínicos y analíticos en la EMI, aislados o en forma de escalas16,26-32. En nuestro estudio, la sepsis sin meningitis, la convulsión y la puntuación en la escala de coma de Glasgow < 15 fueron los factores clínicos que mostraron mayor valor para predecir un mal pronóstico. El tiempo de evolución de los síntomas no mostró una asociación significativa con tener una mala evolución, probablemente porque los casos más graves tienden a consultar antes y compensan su peor pronóstico inicial con un tratamiento más temprano. La presencia de un exantema extenso o evolucionado, con nuestros datos, tampoco alcanzó la significación estadística, pero sí se considera relevante para el pronóstico7,30,33. La trombocitopenia y la CID fueron los factores analíticos que mostraron mejor capacidad para predecir un mal pronóstico. Este es un hecho relevante, ya que el recuento de plaquetas es una determinación accesible, poco costosa y que ha demostrado valor pronóstico27, empleándose en escalas compuestas como la del PN29.
En los protocolos de manejo del paciente pediátrico con EMI, la trombocitopenia puede servir como un indicador de peor pronóstico y ser especialmente útil en centros que no dispongan de marcadores analíticos más sofisticados. Los niños con esta alteración analítica, u otras compatibles con CID, así como los que presenten sepsis sin meningitis, una puntuación en la escala de coma de Glasgow<15 o una convulsión, deberían ser considerados de alto riesgo.
Los resultados de este trabajo deben de ser interpretados en el contexto de sus limitaciones. Aunque el estudio englobó todos los casos de EMI en Navarra, el tamaño muestral fue pequeño y se limitó a una zona geográfica concreta. La recogida retrospectiva de los datos pudo inducir sesgos. No se tuvo en cuenta si los casos habían consultado con anterioridad en su centro de atención primaria, ni se recogieron otros síntomas como cefalea, vómitos o fotofobia15,21. No se pudieron determinar los parámetros analíticos en todos los pacientes. En algunos de los casos con secuelas permanentes o muerte, no se dispuso de los valores de PCT, EB y leucocitos en el líquido cefalorraquídeo, por lo que la asociación de estos parámetros con un mal desenlace podría ser mayor a la encontrada. Además, en la mayoría de los casos, el EB se determinó en sangre venosa y la presencia de CID, al recogerse en un momento más avanzado de la enfermedad, pudo tener cierta ventaja sobre otros factores. No se recogieron las secuelas psicológicas.
En España, con la reciente comercialización de la vacuna frente al meningococo B, se inicia una nueva era en la prevención de la EMI. Ante este nuevo escenario, es probable que se sucedan cambios en esta enfermedad en un futuro próximo, por lo que la situación descrita es el punto de partida para nuevos estudios que evalúen en los próximos años el impacto de la nueva vacuna.
Como conclusión, pese a los importantes avances realizados en la prevención de EMI mediante la vacunación universal frente al meningococo C en la infancia, la enfermedad continúa siendo un grave problema de salud infantil. El reconocimiento precoz de los síntomas, la optimización del tratamiento inicial en los servicios de urgencias y el trasladado urgente de los pacientes a centros que dispongan de una UCIP son estrategias fundamentales para conseguir disminuir la mortalidad y las secuelas de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento al Dr. Federico Martinón-Torres (extensivo a sus compañeros), corresponsable del estudio ESIGEM, por su buena disposición a colaborar con los autores de este trabajo.