La enfermedad de Kikuchi-Fujimoto (EKF) o linfadenitis histiocítica necrotizante, es una rara patología, en general de características benignas y autolimitadas. Aunque de distribución mundial, su prevalencia es más elevada en Japón, donde fue descrita simultáneamente por Kikuchi y Fujimoto en 1972. El curso clínico1 puede ser agudo o subagudo. Las adenopatías suelen situarse en el triángulo cervical posterior y ser dolorosas y refractarias al tratamiento antibiótico. Un 30-50% desarrollan fiebre y síntomas de vías respiratorias altas. Menos frecuentemente tienen pérdida de peso, náuseas y vómitos, odinofagia o sudoración nocturna. Típicamente es autolimitada, con resolución completa en uno a 4 meses. El diagnóstico se realiza tras biopsia de un nódulo cervical. La EKF presenta un patrón histológico diferencial con procesos infecciosos y linfoproliferativos. La EKF podría llegar a suponer entre un 0,5-5% de las adenopatías analizadas histológicamente2, y probablemente estemos ante una entidad infradiagnosticada. Se recomienda seguimiento para descartar el desarrollo de lupus eritematoso sistémico3, o de linfohistiocitosis hemofagocítica4. El tratamiento es sintomático y no existe consenso sobre la indicación de corticoides, aunque se contempla en casos severos.
Los afectos son generalmente adultos menores de 30 años. Es poco frecuente en la edad pediátrica5. En portadores del virus de la inmunodeficiencia humana (VIH) es aún más excepcional, con pocos casos descritos en adultos6,7 (tabla 1). Un estudio de 108 pacientes8 describe 2 casos de EKF relacionada con el sida.
Pacientes VIH positivos con enfermedad de Kikuchi-Fujimoto reportados en la literatura
| Referencia | N° de casos | Edad | Sexo | Localización | Patrón histológico | CD30 | Seguimiento |
| Abad et al. | 2 | SI | SI | SI | SI | SI | Fallecimiento de uno de los pacientes |
| Pasquinucci et al. | 1 (ADVP) | 26 | Mujer | Cervical | Necrosis y blastos | SI | Recuperación sin secuelas en 25 días |
| Pileri et al. | 1 (ADVP) | 17 | Mujer | Generalizados | Necrosis y proliferación blástica e histiocítica | + | Recuperación sin secuelas |
| Cossu et al | 3 | 26-35 | 2 hombres, 1 mujer | Cervical/axilar/múltiples | Necrosis e histiocitos | SI | SI |
| Ereno et al | 1 (ADVP) | 34 | Mujer | Cervical y axilar | Necrosis | SI | Recuperación sin secuelas |
| Vasallo et al | 1 | 37 | Hombre | Cervical | Necrosis, proliferación blástica e histiocítica | + | Recuperación sin secuelas en 3 semanas |
| Caso descrito | 1 | 14 | Mujer | Cervical | Extensas áreas de necrosis | + | Recuperación sin secuelas en 8 semanas |
ADVP: adictos a drogas por vía parenteral; SI: sin información.
Presentamos el caso clínico de una adolescente de 14 años portadora del VIH-1 a seguimiento desde los 7 años de edad. Estadio clínico (clasificación CDC: B2) no modificado hasta la actualidad. Tratamiento actual: zidovudina, lamivudina y efavirenz. En el control de seguimiento previo presentaba carga viral<40copias/mL y cifra total de CD4 615/μL. Entre sus antecedentes personales (previo al seguimiento en nuestra consulta): recibió profilaxis de tuberculosis (TBC) con isoniazida durante 6 meses (PPD positivo con radiografía de tórax normal), meningitis purulenta sin confirmación bacteriológica, y varicela, todo ello a los 5 años de edad.
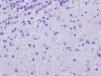
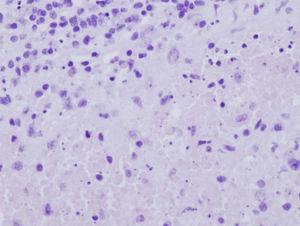
Refería fiebre intermitente de 2-3 semanas de evolución, adenopatías laterocervicales y supraclaviculares derechas, y un síndrome constitucional (astenia, anorexia y pérdida de peso de 3kg). La exploración física mostraba afectación moderada del estado general, y varias adenopatías laterocervicales bilaterales rodaderas y móviles, la mayor de 3×2cm, dolorosa y adherida a planos profundos. En las pruebas de laboratorio destacaba una hemoglobina de 11,3g/dL y hematocrito de 33,5% con volumen corpuscular medio de 105U. El estudio de coagulación fue normal. VSG y PCR elevadas, 80mm/primera hora y 21,07mg/L, respectivamente, con procalcitonina normal. El frotis de sangre periférica no mostró alteraciones significativas. Presentaba elevación de la LDH (1.310UI/L) con valores de enzimas hepáticas en límites elevados de la normalidad. No se identificó ningún agente infeccioso ni en los estudios de despistaje de TBC ni en los serológicos (Toxoplasma, Bartonella henselae, Brucella, Borrelia burgdorferi, Leishmania donovani, Rickettsia conorii, parvovirus B19, VHH-6, citomegalovirus y virus de Epstein-Barr [VEB]). Una tomografía axial toracoabdominopélvica puso de manifiesto nódulos calcificados en parénquima pulmonar, mediastino y pleura en probable relación con TBC previa, identificándose 3 granulomas hepáticos calcificados y discreta hepatoesplenomegalia. Se realizó punción-aspiración con aguja fina y posterior exéresis quirúrgica para biopsia de la adenopatía de mayor tamaño, en la que el estudio anatomopatológico definió extensas áreas de necrosis no neutrofílica que alteraban la arquitectura ganglionar, observándose tan solo algunos folículos linfoides residuales. Las áreas de necrosis presentaban una intensa cariorrexis, sin que se observasen eosinófilos o células plasmáticas en número significativo (fig. 1). Se observaban abundantes células linfoides blásticas CD30+, CD15-. No se percibieron BAAR y la hibridación in situ para VEB y el estudio de PCR para clonalidad de linfocitos B fueron negativos. Ante los hallazgos clínicos e histológicos se estableció el diagnóstico de linfadenitis histiocítica necrotizante. La evolución fue tórpida, manteniéndose inicialmente una conducta expectante con tratamiento sintomático de soporte (antiinflamatorios no esteroideos), y ante la persistencia del síndrome constitucional se inició una pauta con prednisolona 1mg/kg/día durante 2 semanas, resolviéndose progresivamente el proceso hasta la recuperación total a las 8 semanas del inicio del cuadro. En los 5 años de seguimiento posterior ha permanecido asintomática.
El diagnóstico diferencial de las adenopatías puede suponer un reto. En los pacientes VIH es prioritario descartar un proceso linfoproliferativo, así como infecciones que cursan con sintomatología similar (TBC).
El sustrato etiológico y fisiopatológico de la EKF es una incógnita. Su infrecuente patrón de linfadenitis pudiera reflejar una respuesta inmunitaria diferente, secundaria a una predisposición genética individual (mayor incidencia si HLA tipo ii9,10) y/o a un estado inmunitario singular precipitado por una infección.