¿Por qué la décima sinfonía de Gustav Mahler quedó inacabada?
Gustav Mahler 1,2 nace el 7 de julio de 1860 en Kalista (Bohemia) cerca de Moravia. Su primera obra como músico es una polca que compuso a la edad de 6 años. Mahler continúa sus estudios en el Conservatorio de música de Viena. Autor muy criticado por la prensa. En 1901, al borde de la depresión, conoce a Alma María Schindler, de 23 años, inteligente y culta. Tienen 2 hijas, María y Anna. María muere a los 4 años de escarlatina. En el momento que está profundamente afectado por la muerte de su hija, Mahler es diagnosticado de un soplo cardíaco. En 1907, firma un contrato con la Ópera Metropolitana de Nueva York y abandona Europa. Cuatro años más tarde, comienza a presentar episodios de fiebre. Un hemocultivo de 200 ml demuestra un crecimiento de Streptococcus viridans. Lo envían a París para ser evaluado por los mejores médicos de la época, que lo tratan, en ausencia de antibióticos, con "Metchnikoff's Bulgarian milk" (Lactobacillus bulgaricus), los probióticos de la época. Mahler presenta un dolor en el corazón, se ahoga. La enfermedad se extiende a diferentes partes del cuerpo, presenta una inflamación por encima de la rodilla. Mahler sufría una endocarditis infecciosa con osteomielitis de la rodilla. Desgraciadamente, el diagnóstico se estableció, pero no existían los antibióticos necesarios para tratarle correctamente. Fue enviado a Viena, donde murió el 18 de mayo de 1911 a la edad de 51 años. Su décima sinfonía quedó inacabada.
Introducción
La endocarditis infecciosa es una infección importante del endocardio, en particular de las válvulas cardíacas. Durante mucho tiempo se la llamó endocarditis bacteriana. Además de las bacterias, actualmente se sabe que la endocarditis infecciosa puede estar causada por otros agentes microbiológicos. Los cambios producidos en la población susceptible de la enfermedad, en los factores de predisposición y en la evolución de los microorganismos, explican los cambios presentados en esta enfermedad. A pesar de los progresos realizados en las últimas décadas, es una enfermedad cuyo diagnóstico y tratamiento continúan siendo difíciles.
Aspectos históricos
El francés Jean François Fernel 3 (1497-1558), en su libro Medicina, publicado en 1554, es el primer médico que señala ciertos síntomas que hacen pensar en el diagnóstico de endocarditis. En esa época, los autores citan ciertas anomalías de las válvulas cardíacas en las autopsias. Anomalía es una palabra que deriva del griego, "an-omalos", válvula rugosa, irregular 2. En 1669, Richard Lower en Inglaterra diagnostica una endocarditis de la válvula tricúspide. Jean Nicolas Corvisart (1755-1821), es el primero, en 1806, que describe las "vegetaciones" 2. El estetoscopio cilíndrico, inventado en 1816 por Théophile Laënnec 1, permite auscultar los soplos cardíacos. En 1835 Jean-Baptiste Bouillaud 2, en su Traité des maladies du cur define el endocardio y describe la endocarditis. Los trabajos de Pasteur a finales del siglo xix permiten la introducción y el uso de los hemocultivos de rutina 1. La penicilina es descubierta por Alexander Fleming en 1929 2.
Epidemiología
Actualmente la incidencia se sitúa en 1-4 casos/100.000 o en 1 de cada 1.300 admisiones pediátricas anuales 4,5. La endocarditis ha aumentado en los últimos años, debido a un aumento de la supervivencia de niños con cardiopatías, de los recién nacidos y de otros niños muy enfermos. Ha habido un aumento en la proporción de niños con cardiopatía congénita operada, con o sin conductos vasculares, parches o valvuloplastia 6. Otro factor de riesgo lo constituyen los catéteres utilizados en niños críticamente enfermos o con inmunodeficiencia, en neonatología o en cuidados intensivos pediátricos 7. Entre el 8 y el 10 % de las endocarditis infecciosas pediátricas se producen en corazones sanos. En edad pediátrica, la endocarditis causada por utilización de fármacos es rara. La enfermedad reumática era un factor de riesgo de endocarditis en el pasado, que ha ido desapareciendo del mundo occidental. La epidemiología de la endocarditis también ha cambiado gracias al desarrollo y a la evolución de la cardiología pediátrica.
Patogenia
Una lesión en el endotelio es la inductora de una trombogénesis 4 que provoca que las bacterias se puedan adherir y formar una vegetación. En los niños con malformaciones cardíacas y con turbulencias o flujo anormal pueden producirse fácilmente lesiones en el endotelio. Los catéteres pueden traumatizar el endocardio 8. Durante una bacteriemia, si hay suficiente cantidad de bacterias que sobreviven en la sangre, éstas pueden propagarse y adherirse al endocardio. Durante la trombogénesis se producen depósitos de plaquetas, fibrina, células sanguíneas y se forman trombos asépticos. Las bacterias se adhieren al trombo aséptico y por encima de estos organismos se depositan plaquetas, fibrina y células inflamatorias, que provoca un aumento del tamaño de la vegetación. Los microorganismos atrapados en la vegetación están protegidos contra las células fagocitarias y los mecanismos de defensa 4.
La endocarditis neonatal con frecuencia se produce en el corazón derecho del recién nacido. El origen de la bacteriemia en el recién nacido son las lesiones cutáneas o en la mucosa, la succión endotraqueal, la alimentación parenteral y los catéteres umbilicales o periféricos 4.
Sintomatología
La presentación puede ser insidiosa, con fiebre prolongada y síntomas inespecíficos, fatiga, debilidad, anorexia, pérdida de peso y sudores nocturnos. Otras veces puede ser fulminante, y esos niños están terriblemente enfermos.
La endocarditis presenta cuatro fenómenos:
1. La bacteriemia o fungemia.
2. La valvulitis: nuevo soplo o insuficiencia cardíaca.
3. Las respuestas inmunológicas, mucho menos frecuentes en niños que en adultos: petequias, hemorragias, lesiones de Roth, lesiones de Janeway, nódulos de Osler o esplenomegalia.
4. Las embolias: renales, en víscera abdominal, cerebro o corazón.
En el recién nacido la presentación es inespecífica. Los fenómenos de embolia séptica son frecuentes, con localizaciones exteriores al corazón, la osteomielitis, la meningitis o la neumonía 4.
Pruebas de laboratorio
El hemocultivo está indicado en todo niño con fiebre de origen desconocido, con soplo patológico, historia de malformación cardíaca o antecedentes de endocarditis. En los casos de endocarditis, la bacteriemia es continua; así, los hemocultivos pueden realizarse en cualquier momento 9. Es importante obtener un buen volumen sanguíneo; en niños pequeños puede variar entre 1-3 ml y en niños mayores 5-7 ml. Tres hemocultivos 4,5 antes de comenzar el tratamiento antibiótico detectan más del 95 % de las endocarditis en niños sin antecedentes de toma de antibióticos y 90 % de niños que han recibido antibiótico la semana anterior 10-13.
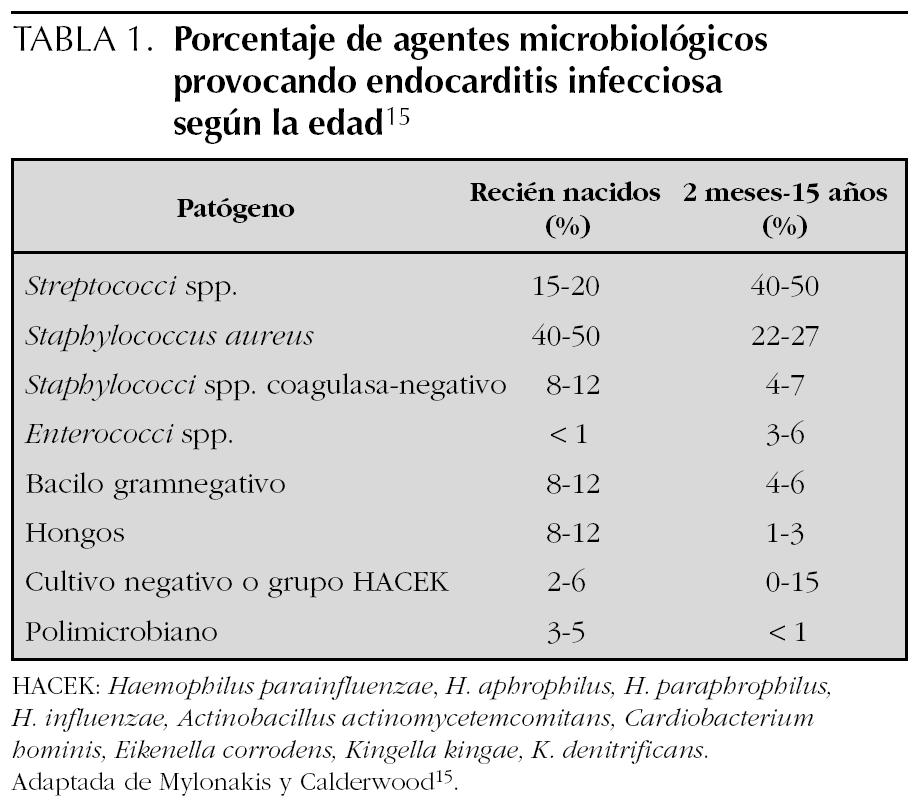
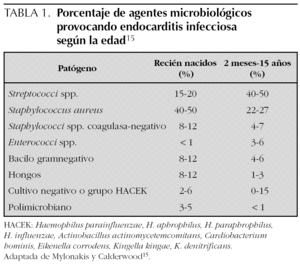
La mayoría de agentes que provocan endocarditis son cocos grampositivos 14: Streptococci, Staphylococci y Enterococci. S. viridans y S. aureus son los organismos más frecuentes en la endocarditis infecciosa 4. En las endocarditis provocadas por catéteres, S. aureus y Staphylococcus coagulasa-negativo son frecuentes. A esos dos agentes, en los recién nacidos hay que añadir la presencia de Candida, Klebsiella y Enterobacter 14. Los organismos clasificados en el grupo HACEK son poco frecuentes en pediatría (Haemophilus parainfluenzae, H. aphrophilus, H. paraphrophilus, H. influenzae, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae, K. denitrificans) 4. Los hongos están representados con Candida y Aspergillus. Mylonakis y Calderwood 15 dan el porcentaje de agentes microbiológicos encontrados según la edad del paciente (tabla 1).
A pesar de hemocultivo negativo, puede establecerse el diagnóstico si la sintomatología y la ecocardiografía muestran signos evidentes de endocarditis infecciosa. La incidencia de hemocultivo negativo es aproximadamente del 5-7 % 4. Generalmente esos casos se presentan cuando el paciente está tomando antibióticos o si la endocarditis no está producida por una bacteria 16. El cultivo de la vegetación puede ayudar al diagnóstico 16.
Otros resultados de laboratorio son inespecíficos: anemia, leucocitosis, velocidad de sedimentación, proteína C reactiva, hipergammaglobulinemia, hematuria, proteinuria.
Ecocardiografía
Desde hace más de 15 años la ecocardiografía ha revolucionado el diagnóstico de endocarditis. Esta técnica permite visualizar el lugar de infección, la vegetación, la extensión de la lesión valvular y la función cardíaca. Esta técnica también valora la gravedad de la enfermedad e influencia las decisiones de un tratamiento médico o quirúrgico. La técnica Doppler permite el diagnóstico de estenosis e insuficiencias valvulares. La ecocardiografía transtorácica, con una sensibilidad del 81 %, es de gran utilidad en el diagnóstico de la endocarditis infantil 16. La ecocardiografía esofágica es menos utilizada en pediatría y realizada en casos en que la técnica transtorácica es incapaz de detectar la vegetación 17-19. Una ausencia de vegetación no excluye un diagnóstico de endocarditis. La endocarditis afecta a las válvulas, pero también puede localizarse en un defecto del septum, en las cuerdas tendinosas o en la pared del endocardio.
El diagnóstico de endocarditis es difícil 20. Las manifestaciones clínicas son numerosas, pero inespecíficas. Eso explica por qué el diagnóstico diferencial de la endocarditis es importante. Teniendo en cuenta las consecuencias de una endocarditis no diagnosticada, el diagnóstico falsamente positivo no es extraordinario. En los países con mucha inmigración, no hay que olvidar que una recurrencia de fiebre reumática puede presentarse con la misma sintomatología que una endocarditis 21,22. La ecocardiografía en conjunción con la sospecha clínica es el mejor criterio diagnóstico de endocarditis.
Criterios diagnósticos
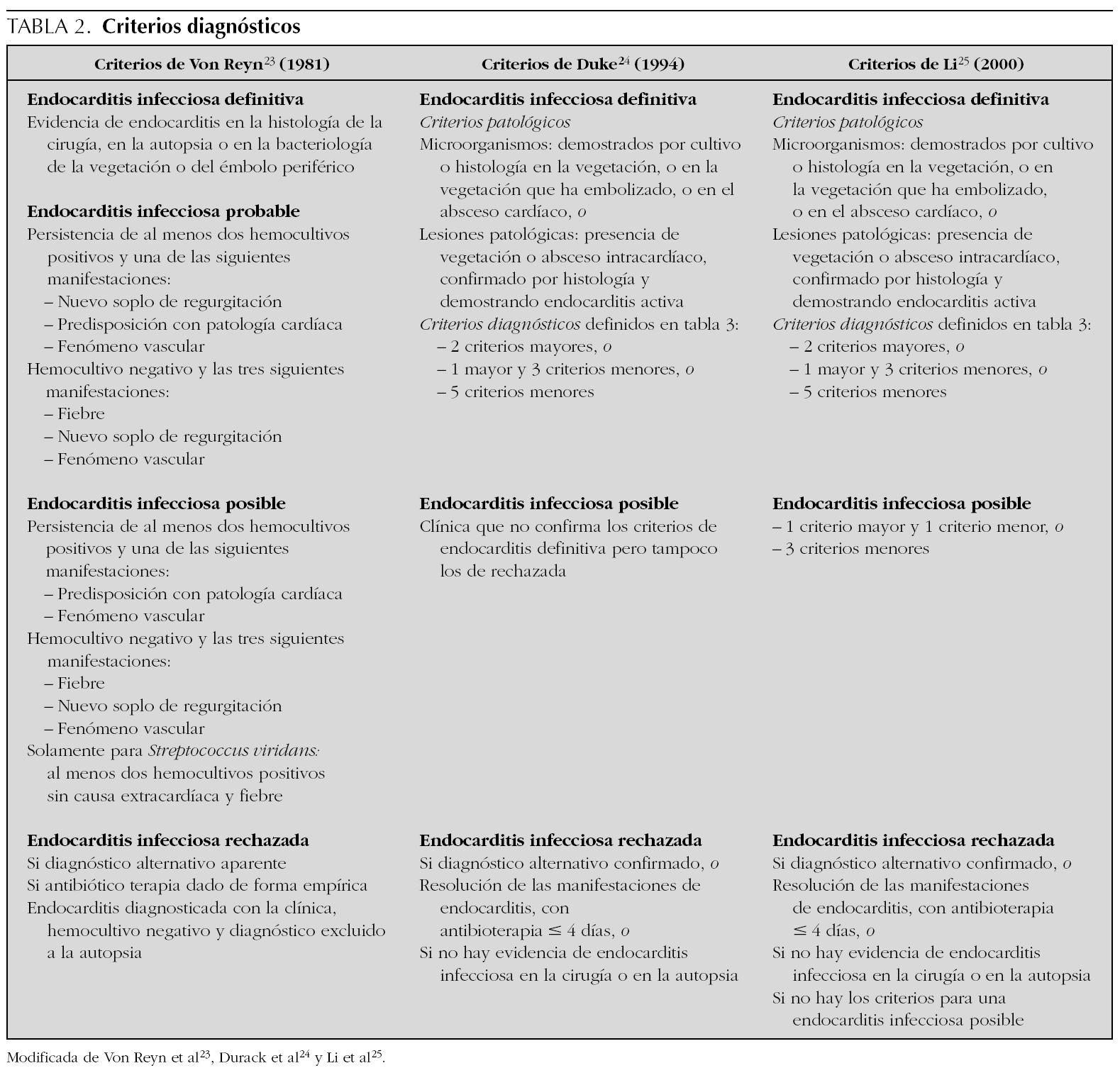
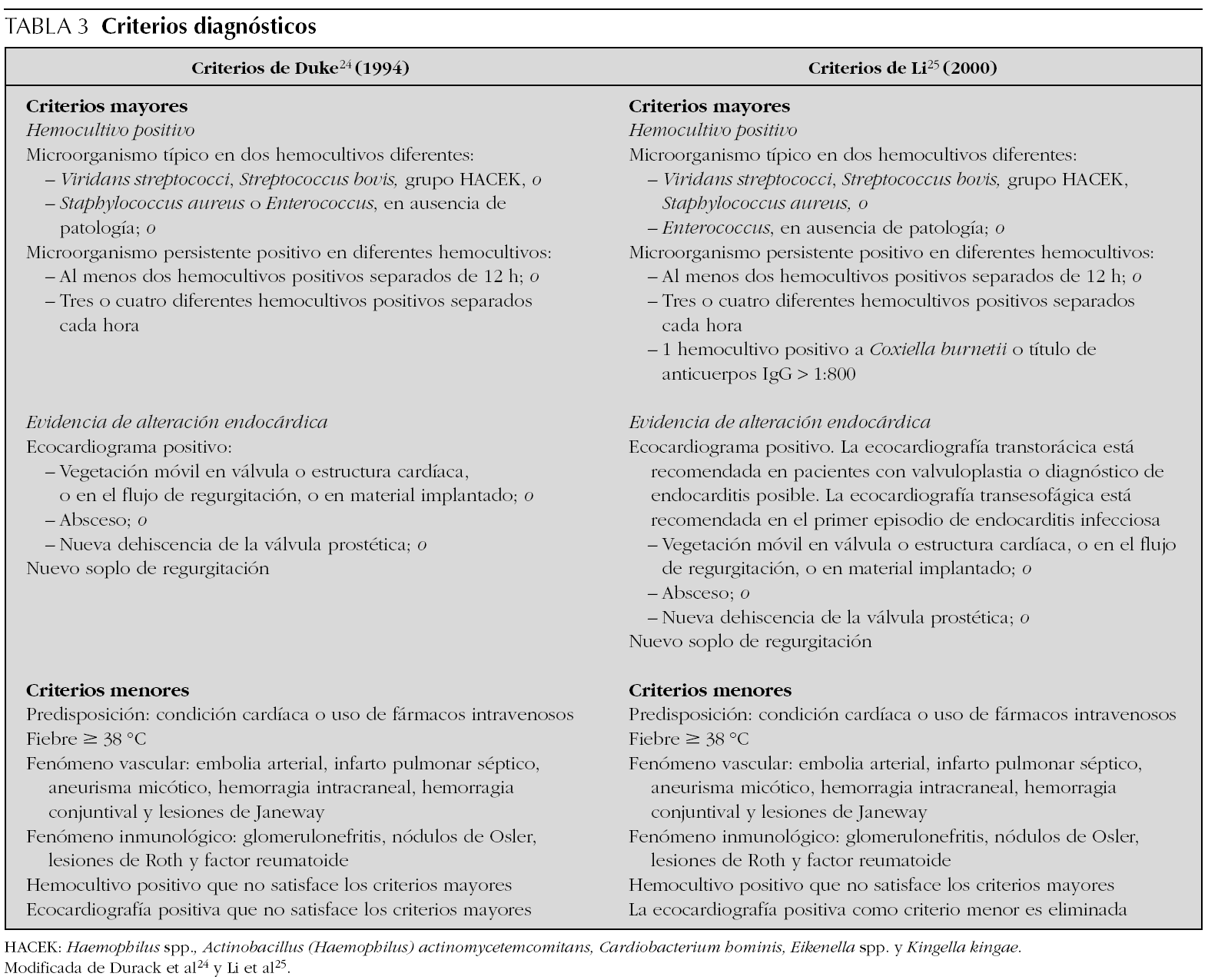
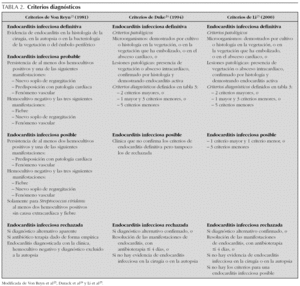
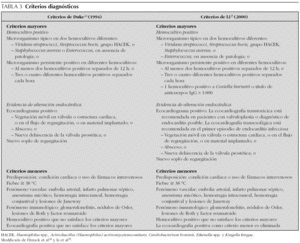
En 1909, Sir Thomas Horder 1 describe en Inglaterra los primeros criterios diagnósticos: los signos y síntomas de la endocarditis. A lo largo del siglo xx esos criterios han sufrido diferentes modificaciones. En 1981, Von Reyn et al 1,23 (tabla 2) proponen criterios para facilitar el diagnóstico de la enfermedad. Estos autores presentan 123 adultos tratados en el Hospital Beth Israel de Boston y clasifican la endocarditis en: definitiva, probable, posible y rechazada. En 1994, en la Universidad de Duke de North Carolina, Durack et al 1,24 (tablas 2 y 3), con la introducción de la ecocardiografía, proponen nuevos criterios diagnósticos: endocarditis definitiva, posible o rechazada. Con los criterios de Durack 24, cualquier caso de endocarditis no rechazado debe ser considerado posible. Esos criterios parecen presentar una buena sensibilidad, pero son poco específicos. En 2000, Li et al 1,25 (tablas 2 y 3) intentan ser más estrictos en el diagnóstico de endocarditis y vuelven a modificar los criterios de Durack 24.
Los criterios diagnósticos citados anteriormente han sido validados para el uso en cardiología de adultos 26. Algunos autores han intentado validar esos criterios en cardiología pediátrica 27-29. La endocarditis infecciosa es una enfermedad con una presentación clínica muy variable. El uso aislado de criterios no es suficiente para establecer un diagnóstico de endocarditis. Los criterios son una guía clínica para ayudar al diagnóstico, pero no remplazan el juicio del facultativo.
El diagnóstico molecular puede ser útil en casos con hemocultivo negativo 30. La ecocardiografía ha sido de gran utilidad en el diagnóstico de endocarditis. En la edad pediátrica, la ecocardiografía transtorácica facilita mucha información y la ecocardiografía transesofágica es raramente necesaria 17-19. Sin embargo, la ecocardiografía no está indicada si no existe evidencia clínica que soporta el diagnóstico de endocarditis. Todo paciente en el que se sospeche una endocarditis merece una evaluación crítica, para mejorar el diagnóstico clínico-microbiológico y el tratamiento 31.
Complicaciones
Las situaciones clínicas que favorecen las complicaciones 4,31 y las indicaciones quirúrgicas según las anomalías encontradas a la ecocardiografía se refieren en la tabla 4.
Tratamiento
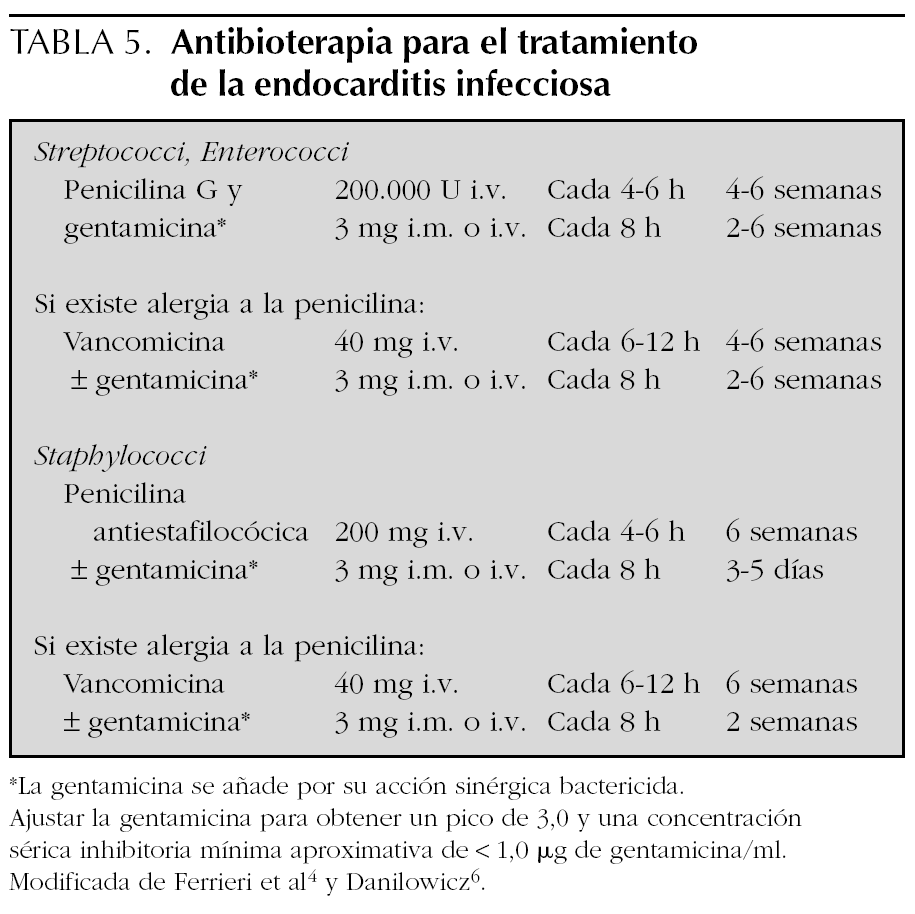
En general es de 4 semanas y se prolonga hasta seis si la sintomatología de presentación ha durado más de 3 meses (tabla 5) 4,6,15,32. El tratamiento se inicia en el hospital, pero actualmente se completa con la antibioterapia a domicilio.
Evolución de la enfermedad
Coward et al 33 dan una incidencia de complicaciones del 49 %. Mylonakis y Calderwood 15 citan cifras de mortalidad en el adulto de 20-25 %. Danilowicz 6 da una incidencia de mortalidad en pediatría del 20-30 %, pero recientemente 33 se han publicado cifras del 12 %.
Profilaxis
Las indicaciones de profilaxis y las dosis de tratamiento antibiótico 4-6,34-38 para prevenir la endocarditis infecciosa se encuentran en la tabla 6.
En conclusión:
1. La endocarditis infecciosa es rara en pediatría pero su incidencia aumenta gracias a la supervivencia de niños con cardiopatías congénitas operadas.
2. La población pediátrica con riesgo de endocarditis ha cambiado en los últimos tiempos, con un aumento de niños con inmunodeficiencia y niños de cuidados intensivos neonatales y pediátricos.
3. La endocarditis infecciosa en niños sanos es rara, pero no excepcional.
4. Las complicaciones continúan siendo frecuentes.
5. Los criterios diagnósticos son una guía que no remplazan el juicio clínico.