La enfermedad de Kawasaki (EK) es una vasculitis aguda autolimitada relativamente frecuente en la infancia. La etiología de la EK es aún desconocida, aunque los datos clínicos y de laboratorio y las características epidemiológicas sugieren un origen infeccioso. Las diferencias en la incidencia entre los países se han relacionado con factores genéticos, étnicos y otros factores socioculturales y ambientales. Presentamos un estudio poblacional sobre la incidencia de la EK en Cataluña (España), centrándose en las diferencias entre los pacientes en zonas rurales y no rurales de la región.
MétodosEstudio observacional poblacional incluyendo todas las unidades pediátricas en los hospitales catalanes, entre 2004 y 2014. Recogida prospectiva de nuevos casos de EK durante 12 meses (marzo de 2013-marzo de 2014) para determinar la incidencia de la EK. El resto de los datos se recuperaron de forma retrospectiva. Se analizaron los datos de 399 pacientes durante el período de estudio de 10 años.
ResultadosEntre el total de pacientes con EK, 353 (88,5%) vivían en zonas no rurales y 46 (11,5%) en zonas rurales. Se encontró una diferencia significativa (p<0,001) entre el porcentaje de la población rural observada en los pacientes con EK (11,5%), y el esperado 5% para la población catalana.
ConclusiónEste es el primer estudio poblacional que muestra diferencias significativas entre las tasas de incidencia de EK entre las zonas rurales y no rurales.
Kawasaki disease (KD) is an acute self-limited systemic vasculitis relatively common in childhood. The etiology of KD is still unknown, although clinical, laboratory and epidemiological features suggest an infectious origin or trigger. Differences on incidence between countries have been related to specific genetic factors, ethnicity, country of birth and some other sociocultural and environmental factors. We present a population-based study on incidence of KD in Catalonia (Spain), focusing on differences between patients in rural and non-rural areas of the region.
MethodsObservational population-based study including all Pediatric Units in Catalan hospitals, between 2004 and 2014. A 12-month (March 2013–March 2014) prospective collection of new cases of KD was carried out to determine the incidence of KD. The rest of the data was retrieved retrospectively.
ResultsData from 399 patients over the 10-year study period was analyzed. Among the total KD patients, 353 (88.5%) lived in non-rural areas and 46 (11.5%) in rural areas. It was found that there is a significant difference (P<.001) between the percentage of rural population observed in patients with KD (11.5%), and the expected 5% of the Catalan population.
ConclusionThis is the first population-based study showing significant differences on KD incidence rates between rural and non-rural areas.
La enfermedad de Kawasaki (EK) es una vasculitits aguda autolimitada de etiología desconocida descrita por Tomisaku Kawasaki en 1967. Afecta predominantemente a niños de entre 6 meses y 5 años, y es la vasculitis más frecuente en la infancia después de la vasculitis mediada por IgA.
La EK es un proceso inflamatorio autolimitado, pero puede llegar a ser mortal dependiendo del grado de afectación coronaria. Su diagnóstico se basa en criterios clínicos que incluyen fiebre, exantema, conjuntivitis, cambios en las extremidades, eritema de la mucosa oral y labial y linfadenopatía cervical. El diagnóstico precoz es importante para establecer un tratamiento temprano y reducir el riesgo de complicaciones cardíacas.
La etiología de la EK todavía se desconoce, aunque sus características clínicas, analíticas y epidemiológicas sugieren un origen o desencadenante infeccioso1. No obstante, hasta la fecha han sido numerosos los estudios que han fracasado en el intento de identificar un agente etiológico infeccioso único, no habiéndose podido demostrar que la enfermedad vaya asociada a la exposición a algún fármaco, o que se desarrolle en respuesta a un superantígeno1,2. Por el contrario, la activación del sistema inmunológico es una característica evidente de la EK, y se están estudiando los niveles de múltiples citocinas y quimiocinas proinfamatorias en pacientes con EK, lo que posiblemente lleve a futuras mejoras en la terapia antiinflamatoria3,4. En función del agrupamiento espacial y/o temporal de casos, entre otros patrones, una hipótesis razonable —aunque aún en fase de discusión— es que la EK podría ser causada por un desencadenante (probablemente un agente infeccioso) que solo produciría enfermedad o generaría una respuesta inmunológica en individuos con predisposición genética, especialmente de origen asiático.
Estudios recientes5,6 sugieren que el agente causal de la EK podría ser un agente medioambiental transportado por vientos troposféricos, posiblemente una toxina fúngica. En Japón la carga de enfermedad se ha asociado frecuentemente a corrientes de viento con origen en tierras de cultivo intensivo de cereales del nordeste de China.
Para evaluar la posible predominancia de pacientes de zonas rurales similar a la de otras regiones del mundo en las que se da la enfermedad, realizamos un estudio poblacional de la incidencia de la EK en Cataluña (España) centrado en las diferencias entre los pacientes de zonas rurales y no rurales de la región.
Cataluña es una comunidad autónoma situada en el nordeste de España y en el área noroccidental de la cuenca mediterránea. Comprende un área de 32.108km2, con una población de 7,5 millones de habitantes en 2015, año en que los inmigrantes ascendían al 19% y aproximadamente un millón de los habitantes eran menores de 16 años. Cataluña tiene un clima y topografía diversos. Las áreas más pobladas, a lo largo de las costas de las provincias de Tarragona, Barcelona y Girona, tienen un clima mediterráneo y una economía basada en la industria, el turismo y el sector terciario. Las zonas interiores (incluyendo la provincia de Lleida y el interior de la provincia de Barcelona) presentan un clima predominantemente continental y los sectores económicos predominantes son la agricultura y la ganadería. La zona de los Pirineos se caracteriza por un clima de montaña en los picos más altos y atlántico en los valles. La economía también se basa en la agricultura, aunque el turismo también es un sector importante.
MétodosFuente de datosSe obtuvieron datos epidemiológicos, clínicos y analíticos en un estudio poblacional observacional que incluyó a pacientes de todas las unidades pediátricas de 33 hospitales públicos y privados de Cataluña. Se recuperaron datos de manera retrospectiva para un total de 10 años (2004-2013) y se recogieron datos de manera prospectiva durante 12 meses (marzo de 2013-marzo de 2014) de casos nuevos de EK para determinar la incidencia poblacional de esta enfermedad.
El estudio fue aprobado por el comité de ética del centro coordinador (Hospital Sant Joan de Déu, Esplugues de Llobregat, España) y se obtuvo el consentimiento informado de los pacientes o sus padres o tutores legales antes de realizar el estudio.
Definición de casoEl estudio incluyó a todos los pacientes menores de 16 años diagnosticados de EK en sus hospitales de origen. La EK completa se definió como presencia de fiebre de ≥5 días de evolución y al menos 4 de los 5 criterios clásicos para la EK. Estos criterios clásicos incluyeron: 1) inyección conjuntival bilateral no exudativa; 2) cambios en la mucosa oral, como eritema labial o lengua aframbuesada; 3) cambios en las extremidades (edema, eritema y/o descamación); 4) exantema polimorfo; y 5) linfadenopatía cervical. Los casos de EK incompleta se definieron de acuerdo con las guías de la American Heart Association2 como pacientes con fiebre de ≥5 días de evolución y 2 o 3 criterios clásicos con presencia de aneurismas coronarios (AC) en la ecocardiografía. La EK atípica se definió como enfermedad que, aun cumpliendo los criterios clásicos, se presentaba con manifestaciones atípicas de la enfermedad, como insuficiencia renal o deterioro pulmonar.
Criterios de exclusión: pacientes que no cumplían los criterios de EK, pacientes en los que los que no se habían especificado los días de fiebre al inicio y pacientes en los que, a pesar de haberse diagnosticado la EK, fueron ingresados en algún hospital de otra comunidad autónoma para obtener una segunda opinión. De los pacientes incluidos en la fase prospectiva del estudio se excluyeron aquellos para los que no se obtuvo consentimiento informado.
Se recogieron datos epidemiológicos, clínicos y analíticos para todos los pacientes. Cada centro colaborador recogió la presencia de AC conforme a los criterios establecidos en las guías de la American Heart Association2 en la mayoría de los casos.
Las tasas anuales de incidencia de EK en Cataluña y la comparación de poblaciones rurales y grupos étnicos se calcularon en función de los datos censales del Institut d’Estadística de Catalunya (IDESCAT). En el estudio se definió área rural como municipio de menos de 2.000 habitantes7.
AnálisisLa recogida de datos se realizó mediante un cuestionario estandarizado en una base de datos de Microsoft Office Access 2007. El análisis estadístico se realizó con el paquete estadístico SPSS 19.0 (Armonk, NY: IBM Corp.).
Las variables se expresaron como media±desviación típica, mediana y rango, o frecuencias y porcentajes según correspondiera. Las comparaciones de variables entre grupos se realizaron mediante pruebas paramétricas y no paramétricas para variables continuas y la prueba de la Chi al cuadrado para variables categóricas. El nivel de significación estadística se fijó en p<0,05.
ResultadosEn el período 2004-2014 se diagnosticaron un total de 399 casos de EK en Cataluña. Se recuperaron datos de 33 hospitales con unidades pediátricas en todo el territorio catalán. Del total de 399 pacientes, 233 (58,4%) tenían EK completa, 159 (39,8%) EK incompleta y 7 (1,7%) se diagnosticaron de EK atípica. La incidencia anual media fue de 8/100.000 niños menores de 5 años. Se detectó AC en 25 pacientes (6,3%) y hubo una diferencia significativa (p<0,001) entre los porcentajes de distintos grupos étnicos, con una incidencia mayor en pacientes procedentes de Asia y del Norte de África.
Del total de pacientes con EK, 353 (88,5%) vivían en zonas no rurales y 46 (11,5%) en zonas rurales. Se observó una diferencia significativa (p<0,001) entre el porcentaje de la población rural observada en los pacientes con EK (11,5%) y el 5% esperado para la población catalana en función del censo.
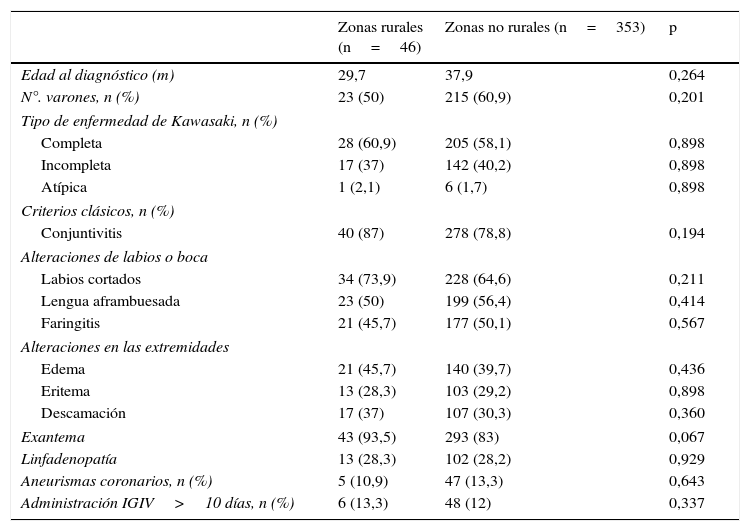
En cambio, no se encontraron diferencias en la edad, el grupo étnico, el sexo, el subtipo de EK, la presencia de criterios clínicos al inicio de la enfermedad, el riesgo de AC o día de administración de la primera dosis de IGIV entre niños residentes en zonas rurales y zonas no rurales. Las características basales de los pacientes se muestran en la tabla 1.
Comparación de características de base entre pacientes de zonas rurales y no rurales
| Zonas rurales (n=46) | Zonas no rurales (n=353) | p | |
|---|---|---|---|
| Edad al diagnóstico (m) | 29,7 | 37,9 | 0,264 |
| N°. varones, n (%) | 23 (50) | 215 (60,9) | 0,201 |
| Tipo de enfermedad de Kawasaki, n (%) | |||
| Completa | 28 (60,9) | 205 (58,1) | 0,898 |
| Incompleta | 17 (37) | 142 (40,2) | 0,898 |
| Atípica | 1 (2,1) | 6 (1,7) | 0,898 |
| Criterios clásicos, n (%) | |||
| Conjuntivitis | 40 (87) | 278 (78,8) | 0,194 |
| Alteraciones de labios o boca | |||
| Labios cortados | 34 (73,9) | 228 (64,6) | 0,211 |
| Lengua aframbuesada | 23 (50) | 199 (56,4) | 0,414 |
| Faringitis | 21 (45,7) | 177 (50,1) | 0,567 |
| Alteraciones en las extremidades | |||
| Edema | 21 (45,7) | 140 (39,7) | 0,436 |
| Eritema | 13 (28,3) | 103 (29,2) | 0,898 |
| Descamación | 17 (37) | 107 (30,3) | 0,360 |
| Exantema | 43 (93,5) | 293 (83) | 0,067 |
| Linfadenopatía | 13 (28,3) | 102 (28,2) | 0,929 |
| Aneurismas coronarios, n (%) | 5 (10,9) | 47 (13,3) | 0,643 |
| Administración IGIV>10 días, n (%) | 6 (13,3) | 48 (12) | 0,337 |
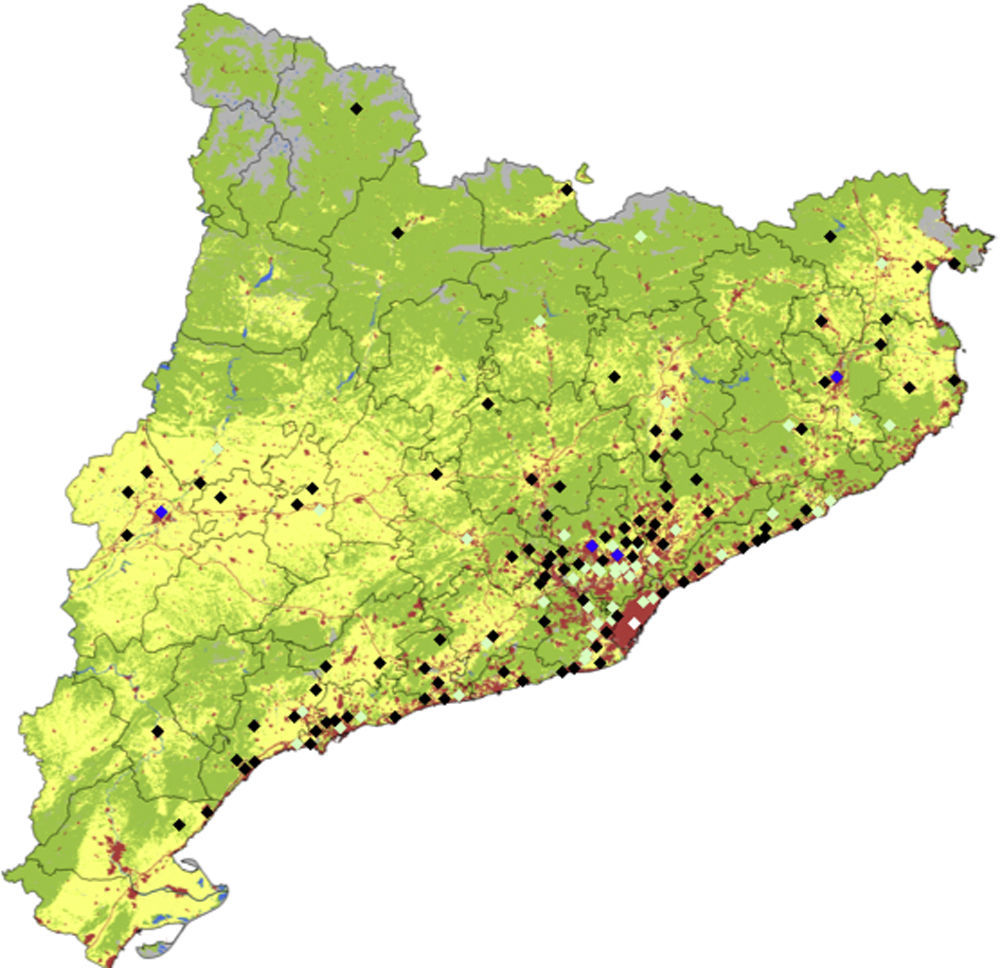
La distribución de los casos durante el período de estudio, ajustada al total de la población, se muestra en la figura 1. Aunque la mayoría de los casos se concentran en las zonas más pobladas alrededor de Barcelona, hay un número significativamente mayor de casos en regiones menos pobladas, como las zonas rurales de Lleida y Girona.
Mapa de usos de suelo de Cataluña con la localización y número de casos de enfermedad de Kawasaki.
Los colores de los rombos representan lo siguiente: blanco: más de 50 casos; azul: 11-25 casos; verde claro: 2-10 casos; negro: un caso. En cuanto a los usos de suelos el verde denota bosques, claros y vegetación húmeda, el gris arenales, nieve y suelos improductivos, el amarillo cultivos y el rojo núcleos urbanos e industriales (los datos de usos de suelo se obtuvieron de la Generalitat de Catalunya, Departamento de Medio Ambiente y Vivienda).
Hasta donde sabemos, este es el primer estudio epidemiológico poblacional sobre la EK que plantea la posibilidad de que existan diferencias en la incidencia de la EK entre zonas rurales y no rurales. Encontramos que en nuestra población hay una diferencia significativa (p<0,001) en el porcentaje de pacientes que viven en zonas rurales (11,5%), comparado con el 5% esperado para la población catalana en función de los datos epidemiológicos obtenidos del censo de IDESCAT7.
Cabe resaltar que el estudio que presentamos incluye pacientes con EK de todo el territorio catalán gracias al carácter público de la sanidad de nuestro país y a la colaboración de los 33 hospitales de Cataluña con unidades pediátricas.
La asociación entre otras de las denominadas enfermedades autoinmunes y una mayor incidencia en zonas rurales también se ha descrito en el pasado. Por ejemplo, en el caso de la vasculitis sistémica primaria (VSP), un estudio realizado en el Reino Unido por Lane et al.8 encontró que el trabajo agrícola en cualquier momento de la vida laboral se asociaba de manera significativa al riesgo de VSP. Otros estudios no han conseguido demostrar esta asociación en España9 o Japón10, y no encontraron diferencias entre las tasas de incidencia de VSP en zonas rurales y urbanas. En contraposición, un estudio alemán11 encontró una prevalencia mayor de arteritis de células gigantes en zonas urbanas que en zonas rurales de Alemania. En cuanto a la sarcoidosis, hay datos que sugieren que la exposición a bioaerosoles o insecticidas podría estar asociada a frecuencias elevadas de sarcoidosis en Estados Unidos12. Otro estudio llevado a cabo en Suiza13 asoció la frecuencia regional de sarcoidosis con la presencia de extensas zonas de cultivo de cereales y patatas.
Las diferencias en la incidencia de la EK entre zonas rurales y no rurales también podrían estar asociadas a la presencia de zonas extensas de agricultura intensiva6, diferencias socioculturales o de ingresos familiares14, u otros factores ambientales o genéticos desconocidos con efectos aditivos.
Un estudio reciente de Rodo et al.6 proponía como posible agente etiológico de la EK una toxina ambiental transportada por el viento que provendría del nordeste de China, un territorio de densa actividad agrícola. Los autores llegaban a esta conclusión tras inferir las procedencias del viento para todos los días con una incidencia alta de EK, practicando simulaciones inversas a partir de mediciones diarias de partículas atmosféricas. Un estudio realizado en la provincia de Sichuan15, uno de los mayores centros de producción agrícola de China, encontró una incidencia de EK de 7,1/100.000 niños, menor que las tasas descritas en regiones urbanas en China16,17 o en Japón18. Queda por aclarar si esta menor incidencia es real o simplemente refleja un menor acceso a servicios de salud en esta región. Un estudio epidemiológico realizado en Corea entre 2006 y 200819 encontró diferencias significativas en la incidencia de la EK según la región geográfica, con la mayor proporción de casos en la provincia de Kangwon, al nordeste del país, y la menor proporción en la isla de Jeju, al sur de la península. Ambas regiones tienen economías basadas en el sector primario (agricultura y pesca). Por el contrario, otro estudio sobre la epidemiología de la EK realizado en los Países Bajos20 encontró una mayor incidencia de EK en provincias más densamente pobladas y con menor predominancia del sector agrícola.
Por lo que sabemos, pocos estudios han descrito diferencias en las tasas de incidencia de la EK entre zonas rurales y no rurales. También sería necesario inferir la procedencia de las masas de aire que se encontraban en el lugar y momento en que vivían los niños con EK al inicio de la enfermedad para comprobar si apoya la etiología relacionada con la actividad agrícola propuesta en estudios previos. En el futuro serán necesarios estudios epidemiológicos a gran escala para establecer las causas de las diferencias encontradas entre las zonas rurales y no rurales, con objeto de investigar posibles mecanismos etiopatogénicos y establecer sus implicaciones clínicas para las políticas de salud y la sensibilización sanitaria.
ConclusionesEste es el primer estudio poblacional que muestra diferencias significativas entre las tasas de incidencia de EK entre las zonas rurales y no rurales. Se observó que la incidencia de EK en niños residentes en zonas no urbanas era mayor de la esperada. Son necesarios más estudios para establecer las causas exactas de estas diferencias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los pediatras del Grupo de Trabajo en Enfermedad de Kawasaki de Cataluña y al Dr. Daniel Cuadras por su ayuda en el análisis estadístico.
A continuación presentamos a los miembros del Grupo de Trabajo en Enfermedad de Kawasaki de Cataluña: Lourdes García (Consorci Sanitari de Mataró), Imma Caubet (Espitau Val d’Aran), Jordi Fàbrega (Fundació Sant Hospital de La Seu d’Urgell), Anna Fernández (Hospital Arnau de Vilanova, Lleida), Adolfo Alegre (Hospital de Campdevànol), Isabel Zambudio (Hospital Comarcal Igualada-Consorci Sanitari de l’Anoia), Lluis Delgado (Hospital Comarcal Alt Penedès), Pablo Garcia y Angelita Serrano (Hospital Comarcal Mora d’Ebre), Pere Sala (Hospital de Barcelona), Pilar Villalobos (Hospital de Figueres), Álvaro Diaz Conradi (Hospital de Nens), Joan Agulló (Hospital de Palamós), Socorro Uriz y Aina Sánchez (Consorci Sanitari de Terrassa), Mariona Bonet (Hospital del Mar), Montserrat Gispert-Saüch (Hospital Doctor Josep Trueta, Girona), Sonia Corral (Hospital General de Granollers), Zulema Lobato (Althaia Consorci Sanitari de Manresa), Pere Domenech (Hospital General de Vic), Maria Méndez (Hospital Germans Trias i Pujol, Badalona), Olga Calavia (Hospital Joan XXIII, Tarragona), Marc Tobeña (Hospital Materno Infantil Vall d’Hebron, Barcelona), Emiliano Mora Muñoz (Hospital Mutua de Terrassa), Gemma Sans y Montse Carrera (Hospital Puigcerdà), Ernesto Mónaco (Hospital Sant Camil Sant Pere de Ribes), Anna Ballester (Hospital Sant Jaume de Calella), Anton Foguet (Hospital Sant Jaume, Olot), Joaquín Escribano y Neus Rius (Hospital Sant Joan, Reus), Angel Moral (Hospital Sant Joan de Déu, Martorell), Roser Álvarez (Hospital Sant Pau, Barcelona), Toni Sorní (Hospital Verge de la Cinta, Tortosa), Vicente Molina (Institut Dexeus, Barcelona), Mario Sanz (Parc Sanitari Sant Joan de Déu, Sant Boi de Lobregat), Pilar Terradas (Pius Hospital Valls), Salvador Salcedo (Hospital Quirón, Barcelona), Olga Martínez (Centre Mèdic Teknon, Barcelona).