Introducción
La hemorragia en el postoperatorio de cirugía cardíaca es generalmente de origen multifactorial. Además de los problemas de sutura quirúrgica, los factores implicados más frecuentemente son el consumo de plaquetas, la alteración de la función plaquetaria, la dilución de los factores de coagulación y el estímulo de la fibrinólisis secundarios a la circulación extracorpórea y la heparinización1,2. Para prevenir la hemorragia posquirúrgica, al finalizar la circulación extracorpórea se administran protamina, aprotinina, plaquetas y plasma fresco congelado. Si a pesar de ello en el postoperatorio aparece hemorragia importante se transfunden inicialmente plaquetas, hasta alcanzar cifras superiores a 100.000/μl y plasma fresco congelado, y según los estudios de coagulación, vitamina K y crioprecipitado. Si tras optimizar el tratamiento médico existe un sangrado mayor de 10 ml/kg/h durante 2 h es necesario valorar la revisión quirúrgica.
El concentrado de factor VII activado recombinante (FVIIaR), se utilizó inicialmente para el tratamiento de los pacientes hemofílicos con inhibidores de los factores de la coagulación VIII y IX3,4. Sin embargo, en los últimos años ha demostrado su eficacia en el tratamiento de la hemorragia grave en otras situaciones (trastornos plaquetarios, trauma, trasplantes y diversas cirugías)5-12. Sin embargo, existe todavía poca experiencia con la administración de FVIIaR en la hemorragia tras cirugía cardíaca en niños1,13-15 y en niños sometidos a oxigenación con membrana extracorpórea (ECMO)16,17.
Observación clínica
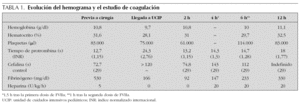
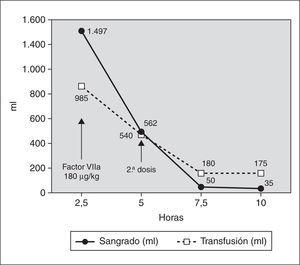
Niña de 4 años y 13,4 kg de peso diagnosticada de miocardiopatía dilatada que ingresó en nuestra unidad de cuidados intensivos pediátricos (UCIP) tras la realización de trasplante cardíaco. La paciente llegó con ECMO tras varios intentos fallidos de salida de bomba extracorpórea, y en anuria por lo que se inició hemodiafiltración venovenosa continua (HDVVC). En la exploración inicial destacaba no respuesta a estímulos dolorosos y anisocoria, pero estaba sedada y relajada. La tabla 1 resume la coagulación a su ingreso y su evolución. En las primeras 2,5 h de postoperatorio presentó hemorragia grave por los tubos de drenaje torácicos, 1.500 ml (45 ml/kg/h), a pesar de transfusiones de plasma fresco congelado (20 ml/kg), concentrado de hematíes (40 ml/kg) y plaquetas (3 U), por lo que no se inició heparinización del circuito de ECMO ni del de HDVVC. Como tratamiento compasivo, se administró una dosis de 2,4 mg de concentrado de FVIIaR (180 μg/kg) en 5 min por vía intravenosa central, con lo que disminuyó rápidamente la hemorragia por drenajes pleurales, transfundiéndose además otras 3 U de plaquetas (3 U) y 25 ml/kg de plasma fresco congelado. El sangrado en las 2,5 h siguientes a la administración del FVIIaR se redujo a 560 ml (17 ml/kg/h) (fig. 1). A las 5 h del ingreso se administró una segunda dosis de 180 mg/kg de FVIIaR con lo que la hemorragia desapareció bruscamente, y permitió iniciar tratamiento con heparina, bolo de 30 U/kg y perfusión de 20 U/kg/h y del circuito de hemofiltración venovenosa a 5 U/kg/h, para mantener un tiempo de coagulación activado entre 180 y 220 s. A pesar de la heparinización y de mantener unas cifras similares de plaquetas, la hemorragia no volvió a aumentar. El sangrado por drenajes en los siguientes períodos de 2,5 h fue de 50 ml (1,5 ml/ kg/h) y 35 ml (1 ml/kg/h) y en las siguientes 13 h de 110 ml (0,6 ml/kg/h) (fig. 1). No se observaron efectos secundarios a la administración del FVIIaR ni signos de trombosis sistémica ni en el circuito de ECMO.
Figura 1. Evolución del volumen de la hemorragia por los drenajes torácicos y la necesidad de transfusión de hemoderivados con la administración de FVIIaR.
La paciente falleció a las 24 h tras retirarse la asistencia al confirmarse la muerte cerebral, probablemente secundaria a las alteraciones hemodinámicas durante la cirugía.
Discusión
El FVIIa actúa aumentando la producción de trombina sobre las membranas celulares en respuesta a la expresión del factor tisular en el vaso sanguíneo dañado3. El FVIIa es capaz de activar directamente el factor X e incrementar la producción de trombina en la superficie de las plaquetas activadas en ausencia de factor VIII o IX. Este efecto explica la utilidad del FVIIa en los pacientes con inhibidores de factor VIII y IX4 y en la trombocitopenia y alteraciones plaquetarias10. Además aumenta la resistencia de la fibrina a la fibrinólisis. El FVIIa tiene una acción exclusivamente local en los sitios donde el factor tisular y los fosfolípidos están expuestos, por lo que el riesgo de trombosis generalizada es mínimo. Debido a que el FVIIa actúa en un punto clave de la cascada de la coagulación puede ser eficaz en múltiples alteraciones de la coagulación12.
Múltiples casos clínicos, algunas series pequeñas7,10 y algún estudio controlado18 han demostrado que el concentrado de FVIIaR disminuye la hemorragia y reduce la necesidad de transfusiones en diversas situaciones clínicas. Las ventajas del FVIIaR son su rapidez de acción, su seguridad y su efecto independiente del estado de coagulación del paciente3. El FVIIaR fue diseñado para el tratamiento de los pacientes hemofílicos con inhibidores antifactor VIII y IX que requieran cirugía o presentan hemorragias importantes4. Posteriormente ha demostrado su utilidad en otras coagulopatías (deficiencia de factor VII, trombopenias y trombopatías, enfermedad de Von Villebrand, coagulopatía de la insuficiencia renal y de la insuficiencia hepática)3,7,12. En adultos se ha utilizado con éxito en la hemorragia posquirúrgica de tumores cerebrales6, trasplante pulmonar y hepático7, cirugía cardíaca2,7, urológica18 y trauma7. En niños se ha utilizado en neonatos prematuros con hemorragia hepática y pulmonar5, rotura de la arteria umbilical11, trasplante hepático9 y trastornos plaquetarios10,12. Sin embargo, Blatt et al8 encontraron sólo una disminución transitoria del sangrado en niños con trasplante de médula ósea con hemorragia gastrointestinal, vesical y pulmonar a pesar de dosis repetidas de FVIIaR8.
Existen pocos trabajos que hayan analizado el efecto del FVIIaR en la hemorragia tras cirugía cardíaca en niños. Egan administró 180 μg/kg de FVIIa en 6 niños1. Pychinska-Pokorska et al13 utilizaron dosis de 30 a 60 μg/kg en 7 pacientes y sólo uno de ellos requirió reexploración quirúrgica. Tobias et al14 administraron 70 μg/kg en un niño tras cirugía de comunicación interauricular y Leibovitch et al15 100 μg/kg de concentrado de FVIIaR en un niño con hemorragia pulmonar en el postoperatorio de cirugía cardíaca. En ninguno de los niños tratados se observaron efectos secundarios. Sólo hemos encontrado dos referencias de la utilización de FVIIaR en niños con ECMO. En los pacientes sometidos a ECMO la circulación extracorpórea y la anticoagulación del sistema aumentan el riesgo de hemorragia, pero la administración coagulante puede producir la coagulación del sistema. Verrijckt et al16 administraron 30 μg/kg de FVIIaR en un niño en ECMO con hemorragia grave tras cirugía de transposición de los grandes vasos, disminuyendo la hemorragia. Sin embargo, Bui et al17 han descrito un caso trombosis masiva del circuito de ECMO y muerte después de la administración de complejo protrombínico activado en un niño que había recibido previamente 90 μg/kg de FVIIaR17. Nuestra paciente no recibió heparina inicialmente debido a la hemorragia y coagulopatía graves. Tras la segunda dosis de FVIIaR se inició la heparinización de los circuitos de ECMO y hemodiafiltración venovenosa continua sin aumentar la hemorragia, a pesar de conseguir anticoagulación sistémica y del circuito (tabla 1).
La dosis eficaz del concentrado de FVIIaR todavía no está bien establecida. Generalmente se recomienda una dosis inicial de 90 μg/kg, intravenosa lenta en 2 a 5 min3,7,10. Sin embargo, en pacientes con hemorragia grave se han administrado hasta 270 μg/kg. Los niños tienen un aclaramiento más rápido del FVIIaR que los adultos y probablemente requieran dosis más elevadas19. Nosotros, debido a la intensidad de la hemorragia, administramos una dosis de 180 μg/kg, igual a la utilizada por Egan et al1. La dosis de concentrado de FVIIaR se puede repetir cada 2 a 6 h o utilizar una perfusión continua a 16-50 μg/kg/h. En los pacientes hemofílicos suelen ser necesarias 2 o 3 dosis para controlar la hemorragia. Sin embargo, en casos de cirugía mayor o hemorragia grave puede requerirse una dosis cada 2 h durante 24 h3.
La administración del concentrado de FVIIaR es segura. Se han descrito efectos adversos serios en menos del 1 % de los pacientes3,7,20. El mayor riesgo teórico es la aparición de trombosis en pacientes con prótesis vasculares o con coagulación intravascular diseminada (CID). Sin embargo, no se han encontrado evidencias clínicas ni analíticas de activación sistémica de la coagulación, y la mayoría de las trombosis descritas tras su administración han sido por mejoría de la coagulación o tras la administración de otros productos coagulantes17 y no por efecto directo del fármaco20. A pesar de ello, hasta que no exista más experiencia en pacientes con CID, el FVIIaR debería restringirse a aquellos con hemorragias graves incontrolables y realizar una vigilancia muy cuidadosa de los signos de trombosis y monitorización frecuente del estudio de coagulación. Además, el FVIIaR tiene un elevado coste económico. Por ello, hasta que no existan estudios que analicen la relación coste-beneficio, su administración debe restringirse a la hemorragia grave que no cede con el tratamiento convencional.
Concluimos que el concentrado de FVIIaR puede ser útil en algunos casos de hemorragia intensa en el postoperatorio de cirugía cardíaca en niños. Sin embargo, son necesarios estudios comparativos que analicen la eficacia, eficiencia y seguridad del FVIIaR en cada una de las enfermedades y determinen cuál es la dosis más efectiva en niños.