La infección fúngica invasiva es una infección de tipo oportunista que afecta principalmente al paciente inmunodeprimido y crítico y que, a pesar de los avances en el diagnóstico y tratamiento, sigue comportando una elevada morbimortalidad. Esto ha determinado la investigación de tratamientos coadyuvantes a la terapia antifúngica estándar. Entre ellos, destaca el tratamiento basado en la respuesta inmunológica, que comprende el tratamiento inmunomodulador (transfusión de células T y de células dendríticas, factores estimuladores de colonias, interferón gamma, interleucina 12, vacunas antifúngicas, factores de transferencia y ciertos fármacos como la cloroquina) y el tratamiento inmunoterápico que incluye la transfusión de granulocitos, los anticuerpos monoclonales y la inmunoglobulina endovenosa.
El presente documento recoge una revisión y actualización de los datos disponibles sobre esta modalidad terapéutica y aporta los conocimientos básicos de la respuesta inmune frente a la infección fúngica para poder comprender mejor el papel de dicha estrategia terapéutica en la respuesta al tratamiento antifúngico convencional, así como sus potenciales indicaciones en el paciente pediátrico. Existen pocos datos sobre evidencia científica y grado de recomendación para su uso.
Despite the emergence of new diagnostic and therapeutic methods, invasive fungal infections are still a major cause of morbidity and mortality in immunocompromised and critical patients. Therefore, adjuvant treatments to the standard antifungal therapy are being investigated, with immunity-based therapy being one of the most important. Both immunomodulatory (dendritic and T cells transfusions, colony stimulating factors, interferón-gamma, interleukin 12, fungal vaccines, transfer factors and certain drugs such as chloroquine) and immunotherapeutic modalities (granulocyte transfusions, monoclonal antibodies and intravenous immunoglobulin) have been described.
This document aims to summarise currently available data on immunity-based therapy of fungal infections and to provide basic knowledge on the immune response to fungal infections. This helps to understand how, in selected cases, immunity-based therapy may improve the response to standard antifungal treatment. The potential indications of immunity-based therapy in the paediatric patient are reviewed, although there is still a lack of scientific evidence for its use in children.
A pesar de que los fármacos antifúngicos constituyen la base del tratamiento de la infección fúngica invasiva (IFI) y de que sus resultados han mejorado ostensiblemente en los últimos años, la gravedad de esta entidad (sobre todo en el paciente inmunodeprimido) ha llevado al estudio de tratamientos coadyuvantes entre los que destaca el tratamiento basado en la respuesta inmunológica1, motivo del presente documento.
La respuesta inmunológica frente a la IFI se basa en primer lugar en la inmunidad innata y en un segundo tiempo en la inmunidad adaptativa.
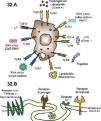
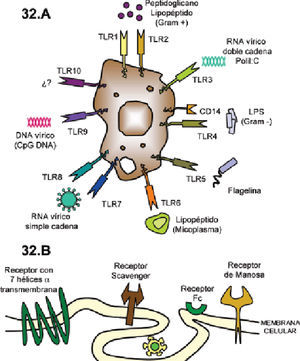
Dentro de la inmunidad innata encontramos las barreras físicas (piel, mucosas, etc.), el «antagonismo bacteriano» (Lactobacillus spp. y bifidobacterias), las células fagocíticas con el complejo NADPH oxidasa y la cadena oxidativa, que consiguen la destrucción de los microorganismos, y las células presentadoras de antígeno que actúan como mediadoras entre la inmunidad innata y adaptativa. Son especialmente importantes las vías mediadas por los Toll-like receptors (TLR), sobre todo TLR-2, TLR-4 y TLR-92 que forman parte de una cascada de señalización intracelular con la consiguiente producción de una serie de citocinas y la activación y diferenciación de células T naive en linfocitos T colaboradores (Th) CD4 y CD8 (fig. 1).
Esta respuesta inmunológica va encaminada a impedir la invasión de los tejidos mediante, entre otros mecanismos, el reclutamiento en las zonas de infección de neutrófilos y macrófagos.
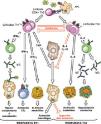
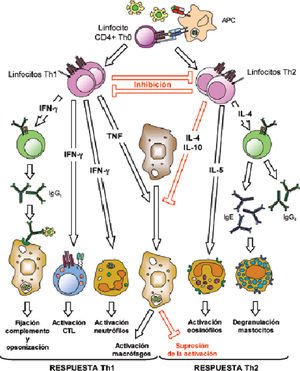
En un segundo paso, se desarrolla la inmunidad adaptativa con la respuesta Th específica (Th1-Th2) y la producción de citocinas como interleucina 10 (IL-10) e interferón gamma (IFN-γ), que a su vez estimulan de nuevo a las células fagocíticas y a los linfocitos B productores de inmunoglobulinas, determinando la neutralización de los microorganismos, la activación del complemento y su opsonización y fagocitosis con la consiguiente resistencia a la infección (fig. 2).
IFI: respuesta inmune y factores predisponentesLos principales defectos inmunológicos que predisponen de manera global a la IFI son la ruptura de la inmunidad de barrera, la neutropenia o disfunción neutrofílica y la inmunodeficiencia de tipo celular3,4.
Los mecanismos del sistema inmunológico implicados en la respuesta frente a la infección fúngica están bien definidos en la infección por Aspergillus spp., Candida spp., Cryptococcus neoformans y zigomicetos5.
Respuesta inmunológica frente a Aspergillus spp.Los principales componentes de esta respuesta frente a Aspergillus spp. son:
- 1)
Macrófagos alveolares: fagocitosis de las conidias de Aspergillus inhaladas (evitando que se formen las hifas) produciéndose luego su destrucción mediante la cadena oxidativa (NADPH oxidasa) y otros mecanismos no oxidativos.
- 2)
Activación del complemento (vía de la lectina), gracias a la lectina fijadora de manosa (MBL) induciendo la formación de C3b que se une al microorganismo y sirve de opsonina para favorecer su fagocitosis6,7.
- 3)
Activación de los TLR (superficie de macrófagos y células dendríticas) capaces de reconocer fragmentos de ciertos microorganismos desencadenando cada receptor una señalización diferente; así TLR-4 reconoce a Aspergillus en forma de conidia originando la producción de citoquinas proinflamatorias (TNF-α…), y TLR-2 reconoce a Aspergillus en forma de hifa desencadenando la producción de IL-10.
- 4)
Respuesta celular Th1 desencadenada por parte de las células dendríticas liberando citocinas protectoras contra la infección y moléculas señalizadoras proinflamatorias como el factor estimulante de colonias granulocíticas (G-CSF) y sobre todo el IFN-γ, que estimula, a su vez, la actividad antifúngica de monocitos y neutrófilos.
El factor más importante que contribuye a la germinación de la conidia y la ulterior formación de hifas (forma invasiva) es la alteración cuantitativa o cualitativa de las células fagocíticas (tratamiento con corticoides, neutropenia, enfermedad granulomatosa crónica, etc.).
Respuesta inmunológica frente a Candida spp.Las especies de Candida, particularmente Candida albicans, colonizan el tracto gastrointestinal, el aparato respiratorio, la vagina y la piel. La transición de la colonización a la infección depende de factores del huésped y del propio microorganismo.
Los principales componentes de la respuesta inmunológica frente a Candida spp. son:
- 1)
Inmunidad innata (neutrófilos, monocitos) con el reconocimiento de las levaduras, hifas y pseudohifas por una serie de receptores (TLR, beta-glucanos) desencadenando una respuesta que lleva a la destrucción de los microorganismos por mecanismos oxidativos y no oxidativos.
- 2)
Activación del complemento por las vías clásica, alterna y de la lectina (gracias a la proteína MBL)8, facilitando la fagocitosis del microorganismo.
- 3)
Fagocitosis de las esporas por parte de células dendríticas que inducen una respuesta celular Th1; las hifas desencadenan una respuesta de los linfocitos Th2. Las células NK inducen la actividad «anti-candida» en los fagocitos, mediante la síntesis de IFN-γ.
Los factores predisponentes más importantes a infección por Candida spp. son: edades extremas de la vida, diabetes mellitus, carencias nutricionales, uso prolongado de antibióticos e inmunosupresión, sobre todo de tipo celular. La inmunidad celular es el mecanismo más importante para prevenir la candidiasis a nivel gastrointestinal; así, por ejemplo, en los pacientes con infección por VIH la aparición de candidiasis orofaríngea se correlaciona con cifras bajas de linfocitos T CD4.
Respuesta inmunológica frente a Cryptococcus neoformansLa primera exposición a este microorganismo suele producirse tras la inhalación de partículas aerosolizadas y a su llegada al parénquima pulmonar, en el paciente inmunocompetente son «eliminadas» formando granulomas donde pueden persistir en forma latente durante mucho tiempo. En el paciente inmunodeprimido se produciría una neumonitis con posterior diseminación.
Los componentes de la respuesta inmune frente a C. neoformans son:
- 1)
Macrófagos y células dendríticas que eliminan directamente el microorganismo y desencadenan la respuesta linfocitaria específica.
- 2)
Reconocimiento del microorganismo mediante diferentes receptores (CD14, CD18, TLR-2, TLR-4, TLR-MyD88) y presentación a macrófagos que liberan citocinas proinflamatorias como IL-1 que, a su vez, regulan la activación y proliferación de los linfocitos T participantes en el aclaramiento pulmonar.
- 3)
Respuesta linfocitaria Th1 a través de IL-12 e IFN-γ.
- 4)
Eliminación mediante una reacción oxidativa como no oxidativa por parte de los neutrófilos.
- 5)
Activación del complemento (vía alterna) con el depósito de C3 en la cápsula fúngica facilitando su adhesión a receptores del complemento y su posterior eliminación.
- 6)
Parece que in vivo los anticuerpos disminuyen la cantidad de cápsula fúngica circulante inhibiendo su formación y favoreciendo su aclaración, pero su papel real es discutido.
Los géneros más frecuentes que ocasionan infección en el ser humano son Mucor, Rhizopus, Absidia y Rhizomucor.
Los mecanismos inmunes implicados se resumen en:
- 1)
Fagocitosis por parte de los macrófagos del epitelio broncoalveolar para evitar la germinación de las esporas con la posterior destrucción de las mismas mediante reducción oxidativa.
- 2)
Activación de la vía alternativa del complemento e inducción de la quimiotaxis de los neutrófilos.
Atendiendo a su nivel y mecanismo de actuación, el tratamiento de la IFI se basa en 2 grupos de agentes terapéuticos:
- 1.
Agentes inmunomoduladores: actúan reactivando-estimulando las propias defensas del huésped. Dentro de este grupo encontramos las vacunas, la terapia basada en citocinas y la transferencia de linfocitos T entre otras.
- 2.
Agentes inmunoterapeúticos o inmunoterapia: actúan directamente contra el agente patógeno. Dentro de este grupo encontramos la transfusión de granulocitos, los anticuerpos monoclonales y las inmunoglobulinas.
La diferenciación de los linfocitos T colaboradores en Th1 tras la presentación del antígeno, da lugar a la liberación de citocinas proinflamatorias (IFN-γ, IL-6 e IL-12) que son esenciales para la protección antifúngica9. De aquí que la inmunomodulación mediante transfusión de células T activadas frente a determinados antígenos fúngicos prometa ser una opción en pacientes inmunocomprometidos. En la actualidad se han conseguido cultivos de células Th1 activas sensibilizadas frente a antígenos de Aspergillus spp. y Candida spp.9,10. Sin embargo, se requieren más estudios que permitan establecer, entre otras cosas, que subpoblación de pacientes podría beneficiarse de estas terapias.
Transfusión de células dendríticasInvestigaciones recientes sugieren que la transferencia de células dendríticas correctamente activadas mediante antígenos fúngicos a pacientes receptores de trasplante de progenitores hematopoyéticos podría convertirse en una estrategia terapéutica útil en el tratamiento antifúngico11. Este procedimiento se encuentra en fase experimental y se necesitan más estudios antes de su uso en ensayos clínicos.
Cloroquina/mefloquinaCloroquina: este fármaco usado contra la malaria tiene también propiedades antifúngicas, debido a su capacidad de modificar la función macrofágica frente a los hongos. En modelos animales es efectiva frente a H. capsulatum, limitando la disponibilidad de hierro dentro de los macrófagos y promoviendo la lisis del hongo, y frente a C. neoformans inhibiendo su crecimiento intracelular a través de cambios en el pH de los lisosomas12. Se desconocen muchos aspectos acerca de su posible uso en humanos, como la dosis a utilizar y sus posibles efectos adversos. Recientes trabajos muestran que la mefloquina también podría tener utilidad antifúngica13.
Factores estimuladores de colonias (GM-CSF, G-CSF) e interferón gamma (IFN-γ)Mediante la activación de la fagocitosis14, ciertas citocinas como los factores estimuladores de colonias (GM-CSF, G-CSF) y el IFN-γ (potente estimulador de la actividad bactericida de estas células), han demostrando su efectividad antiinfecciosa en series de casos15 y en trabajos experimentales16.
Los datos de eficacia acerca de su uso en la IFI están limitados a series de pocos pacientes y a casos clínicos17 por lo que no se pueden establecer unas indicaciones de tratamiento con evidencia científica (punto 4).
Interleucina 12 (IL-12)La IL-12 parece esencial en el desarrollo de una correcta respuesta Th1 contra las infecciones fúngicas gracias a su inducción en la producción de IFN-γ e IL-18. Hay diversos estudios sobre la administración de esta citocina en pacientes VIH con respuesta variable en cuanto al aumento en la concentración de IFN-γ, de células NK y de linfocitos CD818,19.
Hay que tener en cuenta que esta citocina es un potente estimulador inmunológico, que puede presentar importantes efectos adversos y, por tanto, debe valorarse individualmente su uso. Falta evidencia científica para dar recomendaciones sobre su uso.
Vacunas20,21En los últimos años, el incremento de las infecciones fúngicas y el lento desarrollo de nuevos fármacos antifúngicos eficaces, han renovado el interés en la búsqueda de vacunas contra hongos patógenos. El mejor conocimiento de la respuesta inmune, la proteómica, la secuenciación del genoma y la mejoría en la selección de adyuvantes, constituyen los pilares necesarios en el desarrollo de vacunas fúngicas que puedan utilizarse posteriormente en la práctica clínica.
La población diana es amplia:
- •
Pacientes candidatos a trasplante de médula ósea: antes o después del injerto.
- •
Pacientes candidatos a trasplante de órgano sólido: inmunización previa.
- •
Pacientes diagnosticados de leucemia aguda mieloide o tumores sólidos.
- •
Pacientes con enfermedad inflamatoria intestinal, previamente a la utilización de agentes inmunosupresores (corticoesteroides) y anticuerpos anti-TNF.
- •
Pacientes sometidos a cirugía cardíaca, digestiva y/o pacientes críticos.
Sin embargo, las estrategias de inmunización activa, muy útiles en la población inmunocompetente, no parecen ser las más adecuadas en estos grupos de riesgo, por el estado de inmunosupresión subyacente.
Actualmente, todavía no existe ninguna vacuna antifúngica aprobada o en fase de ensayo clínico avanzado para la inmunización activa en humanos, aunque existen 2 formulaciones de vacunas que son objeto de ensayos clínicos: el primero, frente a la candidiasis vulvovaginal22 (ensayo fase II) y el segundo frente a la criptococosis23 (toxoide tetánicoconjugado y glucoronoxilomanano), precisando de mayores datos sobre inmunogenicidad, toxicidad y eficacia para su validación. Existen modelos experimentales para el desarrollo de una vacuna frente a Aspergillus24.
Factores de transferencia25El uso de los factores de transferencia («moléculas mensajeras del sistema inmune») como terapia antifúngica es controvertido, pero existen varios trabajos en la literatura médica que avalan su utilidad en infecciones fúngicas refractarias26,27. Sin embargo, no existe una evidencia científica suficiente para recomendar su utilización, precisándose más estudios que confirmen su utilidad.
InmunoterapiaTransfusión de granulocitosYa en los años 70, al observarse la asociación entre neutropenia e infección fúngica grave, se consideró la transfusión de granulocitos como una estrategia lógica en la lucha frente a estas infecciones en pacientes inmunocomprometidos. Los escasos éxitos obtenidos, la aparición de efectos secundarios graves (reacciones alérgicas y aloinmunización), la escasez de donantes y el desarrollo de nuevos antifúngicos, llevaron al abandono de esta técnica. En la actualidad asistimos a un creciente interés por el uso de este tratamiento debido a las mejoras en las técnicas de recolección y el uso de factores estimulantes de colonias de granulocitos en donantes28, lo que parece mejorar de forma clara la eficacia de la transfusión. La metodología del tratamiento es compleja y consiste en:
- a)
Preparación del donante: la administración de G-CSF en donantes de granulocitos aumenta el número de estas células en sangre periférica, obteniéndose preparados más ricos. También se ha demostrado que los granulocitos de donantes estimulados tienen mayor capacidad antimicrobiana y antifúngica: mejoría de la adherencia celular, fagocitosis y citotoxicidad mediada por anticuerpos28. En la mayoría de los estudios se usan dosis de G-CSF de 5mcg/kg/d, asociado o no a la administración de corticoides29.
- b)
Dosis: no hay consenso con respecto a la dosis mínima efectiva de granulocitos a transfundir, aunque se sabe que cuanto mayor es el número de células transfundidas mejor es la respuesta en el receptor. La OMS recomienda transfundir preparados con una celularidad mínima de 3×108/kg de peso29.
- c)
Efectos secundarios: se han detectado reacciones febriles, aloinmunización HLA, y disfunción pulmonar manifestada en forma de hipoxia y aparición de infiltrados pulmonares («Transfusion-related acute lung injury» o «TRALI»)30. El daño pulmonar parece más frecuente en pacientes que reciben concomitantemente tratamiento con anfotericina B, por lo que se recomienda que ambas infusiones se administren separadas al menos 4–6h28.
- d)
Indicaciones de tratamiento: léase el punto 4.
- e)
Calidad de la evidencia científica: el uso de transfusiones de granulocitos sigue siendo controvertido, no existiendo pruebas concluyentes procedentes de estudios clínicos aleatorizados y controlados que apoyen o refuten su uso en pacientes con neutropenia e infección fúngica grave29. Una reciente revisión de la Cochrane31 analiza los ensayos aleatorizados y controlados realizados hasta ahora, comprobando que no existe una modificación significativa de la supervivencia en pacientes neutropénicos según se traten o no con transfusión de granulocitos.
Los avances tecnológicos han permitido el desarrollo de anticuerpos monoclonales con un potencial interés frente a las infecciones fúngicas, como mecanismo de inmunización pasiva. Al proporcionar una protección inmediata e independiente del estado inmunitario del huésped, constituyen una vía potencialmente útil en pacientes inmunodeprimidos, aunque de un elevado coste económico.
EfungumabDiseñado para unirse a una proteína específica de la superficie de las células fúngicas (hsp90: Heat shock protein 90), que participa en la formación y reparación de la pared celular. Al bloquear su actividad normal se debilita la pared celular, aumentado su fragilidad e impidiendo su crecimiento. Se ha utilizado junto a anfotericina B en el tratamiento de pacientes adultos con candidiasis invasiva33. Sin embargo, se ha descrito un síndrome de liberación de citocinas e hipertensión arterial después de la primera dosis por lo que en marzo de 2007 la EMEA consideró que los beneficios de la utilización de efungumab como tratamiento de la candidiasis invasiva no eran mayores que sus riesgos, recomendando denegar su autorización para su comercialización.
Mab C7En los últimos años, se ha desarrollado este anticuerpo monoclonal que potencia la acción de la IgA secretora de la saliva contra un epitope proteico de una proteína de superficie expresada predominantemente en la pared celular del tubo germinal de C. albicans, lo cual inhibe la adhesión de esta a HEp-2 y a células epiteliales, así como también produce una disminución de la filamentación de Candida spp. mostrando un potente efecto fungicida solo o asociado a otros antifúngicos. Se precisan más estudios para su validación en la práctica clínica.
MoAb 18B7Existe un ensayo clínico en fase I de determinación de dosis, seguridad, farmacocinética de este anticuerpo murino IgG1 (MoAb 18B7) como terapia adyuvante frente a la meningitis criptocócica en pacientes infectados por VIH34. Sin embargo, se requieren más estudios para evaluar la eficacia de MoAb 18B7 y su utilidad en la práctica clínica.
Inmunoglobulina intravenosa1El uso de inmunoglobulina intravenosa como parte del tratamiento de la IFI (asumiendo que las inmunoglobulinas administradas son efectivas frente a diferentes patógenos), podría considerarse en el caso de pacientes inmunodeprimidos; suponiendo además un efecto de regulación sobre la inmunidad celular35 y presentando una serie de ventajas (baja toxicidad, efecto neutralizante de ciertos microorganismos o sus componentes, efecto inmunomodulador, efecto sinérgico con tratamientos antimicrobianos), e inconvenientes (tratamiento biológico [riesgo de transmisión de infecciones], elevado coste, administración intravenosa).
Tan solo se ha descrito su uso en el tratamiento de la meningitis criptocócica36 y en la diarrea por Cryptosporidium spp. en pacientes con SIDA37.
De todos modos, su efecto protector contra la infección fúngica depende a su vez de la integridad de la inmunidad celular y no existen indicaciones basadas en la evidencia científica.
Indicaciones de tratamientoLos únicos tratamientos en los que se han definido unas indicaciones (aunque sin evidencia científica ni grado de recomendación en la mayoría de ellas), se describen en la tabla 1.
Indicaciones y tipos de tratamiento
| Tipos de tratamiento | Indicaciones | Dosis |
| 1. Indicado en el paciente que cumpla todos los siguientes criterios11: | ||
|
| Transfundir preparados con una celularidad mínima de 3×108/kg de peso29 |
| 2. Valorar en: | |
| ||
| Meningitis por C. neoformans en pacientes SIDA (junto con el tratamiento antifúngico convencional); estudio en fase II doble ciego40 | Dosis según superficie corporal: |
| Valorar en Aspergilosis invasiva refractaria al tratamiento convencional y en otras infecciones en pacientes con enfermedad granulomatosa crónica41 | ≤0,5m2: 1,5mcg/kg/48h >0,5m2: 50mcg/m2/48h | |
| No está indicado de rutina en pacientes con fiebre y neutropenia, pero debe de considerarse si se asocian factores de riesgo como es el caso de una infección fúngica invasiva42 | GM-CSF: 100–250mcg/m2/d |
| G-CSF: 5mcg/kg/d | ||
| Tratamiento de meningitis por C. neoformans; estudio en fase I43 | 0,01–1mg/kg (1 sola infusión) |
Recomendación IIC: evidencia de al menos un ensayo clínico bien diseñado sin aleatorización, estudios analíticos de cohortes o casos-control (preferiblemente multicéntrico). La evidencia de eficacia es insuficiente para recomendar o no su uso o la evidencia de eficacia supera a las reacciones adversas o el coste del tratamiento. Opcional.
Los autores declaran no tener ningún conflicto de intereses.
Grupo de Estudio de la Infección Fúngica Invasiva de la Sociedad Española de Infectología Pediátrica (SEIP): Fernando Álvez: Servicio de Pediatría, Hospital Clínico Universitario, Santiago de Compostela, España. Cristina Diaz-Heredia: Servicio de Oncología y Hematología Pediátrica, Hospital Universitari Vall d'Hebron, Barcelona, España. María Espiau Guarner: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España. Concepción Figueras Nadal: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España. Antoinette Frick: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España. Juan José García Garcia: Unidad de Infectología Pediátrica. Servicio de Pediatría, Hospital Sant Joan de Déu, Barcelona, España. Miguel Lanaspa: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España. Andrea Martín Nalda: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España. Marisa Navarro Gómez: Unidad de Enfermedades Infecciosas de Pediatria, Hospital Universitario Gregorio Marañón, Madrid, España. Eva Ma Roselló Mayans: Servicio de Microbiología y Parasitología, Hospital Universitari Vall d'Hebron, Barcelona, España. José Rumbao Aguirre: Unidad Clínica de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Universitario Reina Sofía, Córdoba, España. Pere Soler-Palacín: Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Universitari Vall d'Hebron, Barcelona, España.