Influencia de la epidemiología en el tratamiento de la tuberculosis
La diferenciación entre tuberculosis (TB) latente y enfermedad tuberculosa, presenta una especial importancia en la edad pediátrica. Los niños pequeños muestran un mayor riesgo de progresión a enfermedad, aproximadamente un 40 %, cifra muy superior al 10 % estimado en adultos1. La actitud y el régimen terapéutico, en la prevención y tratamiento de la TB en cada área geográfica, viene determinado prioritariamente por la tasa de enfermedad tuberculosa y el grado de resistencia del Mycobacterium tuberculosis a isoniazida. La TB infantil está íntimamente ligada a la del adulto y se puede considerar que los casos pediátricos son los centinelas de la comunidad. Estos parámetros están estrechamente relacionados con el desarrollo socioeconómico, la situación de la infección por el virus de la inmunodeficiencia humana (VIH), y las medidas adoptadas por las autoridades sanitarias en cada zona. En los países de renta alta, el porcentaje de personas inmigrantes procedentes de países de endemia elevada para TB es, en la actualidad, otro factor que hay que considerar, no sólo al llegar, sino durante los primeros 5 años en el país de acogida; las precarias condiciones de vivienda, el hacinamiento, el trasiego constante de familiares y los viajes a los países de origen son elementos favorecedores en este grupo de población.
En España los datos publicados por el Centro Nacional de Epidemiología2 en 2005 reflejan una tasa anual de enfermedad tuberculosa del 17,02 por 100.000 habitantes y una tasa de meningitis tuberculosa del 0,23 por 100.000 habitantes; sin embargo, la tasa real estimada se calcula en nuestro país entre 25-30 casos por cada 100.000 habitantes, datos que demuestran que la TB no está controlada en nuestro país. El porcentaje de resistencia a isoniazida en nuestro medio se sitúa en el 3,3 % en la población general, en el 6,6 % en la población de inmigrantes y alrededor del 7 % en la población infectada por VIH3.
El porcentaje de población inmigrante a finales de 2005 en España se calcula en un 8,4 % de la población, es decir, alrededor de 3,5 millones de habitantes4. Los países de origen de los inmigrantes a nuestro país son prioritariamente Ecuador, Marruecos, Colombia, Perú, países del este de Europa y países del sudeste asiático, todos ellos con tasas de enfermedad tuberculosa estimadas superiores a 80 casos por 100.000 habitantes y con tasas de resistencia a isoniazida muy por encima del 4 %5.
El diagnóstico, aislamiento y terapia adecuada de los enfermos así como el correcto tratamiento de la exposición y la infección tuberculosa es el último determinante que puede modificar la situación epidemiológica de la tuberculosis en cada país, siendo dos aspectos fundamentales un régimen terapéutico óptimo y el cumplimiento del mismo. Actualmente, en algunos países es una práctica más o menos frecuente la "terapia directamente observada", como medida para asegurar un correcto cumplimiento, especialmente en niños, y es obligada en pautas de días alternos o en pacientes de riesgo. El régimen terapéutico de una TB deberá ser elaborado y consensuado por una unidad de expertos pediátricos en la materia, siendo obligado en las formas graves de la enfermedad: meningitis, TB miliar, TB multirresistente y en infectados por VIH6.
El régimen terapéutico lo determina: la tasa de enfermedad TB y la resistencia a isoniazida en la zona. La infección por VIH o la procedencia de área de alta endemia de TB del caso inicial, son factores que también hay que considerar.
Enfermedad tuberculosa y actividad de los fármacos
Mycobacterium tuberculosis sólo puede ser destruido durante la replicación, esto es cuando está metabólicamente activo. En la enfermedad tuberculosa coexisten diferentes poblaciones bacilares que necesitan ser consideradas: a) bacilos de multiplicación rápida, extracelular: responsables de la formación de las cavernas, población en la que las resistencias se desarrollan con más prontitud; b) bacilos de multiplicación lenta intracelular que proliferan en los macrófagos en un medio ácido y en el que algunos fármacos pueden no ser activos; c) bacilos de multiplicación lenta e intermitente: forman el caseum y la población de bacilos extracelulares en un medio con pH neutro; d) un grupo de población de volumen no conocido, que no parece activa metabólicamente, resistente a la acción de los fármacos y cuya eliminación queda reservada a los propios mecanismos inmunológicos del huésped. Las del grupo a) condicionan el fracaso terapéutico con una aplicación incorrecta de la quimioterapia, ya que permiten la multiplicación selectiva de los mutantes resistentes que sustituyen a la población bacilar sensible y las de los grupos b) y c) son las responsables de las recidivas, si la duración no es suficiente para acabar con el crecimiento lento o a intervalos.
Los principios básicos que rigen el tratamiento se resumen en: a) conocer la densidad y tipo de estas poblaciones bacilares pues es el mayor determinante microbiológico en el éxito terapéutico, considerando la presencia o no de bacilos mutantes resistentes antes de iniciar el tratamiento y b) utilizar una combinación de fármacos con actividad bactericida precoz, es decir conseguir un descenso rápido en el número de bacilos en los primeros días y emplear fármacos con actividad esterilizante, que por consiguiente sean capaces de disminuir sensiblemente la carga bacilar en las poblaciones intracelulares de multiplicación lenta en los macrófagos y lesiones caseosas.
Los medicamentos antituberculosos de acción bactericida precoz son isoniazida y rifampicina y son activos frente a bacilos de multiplicación rápida y son capaces de disminuir rápidamente la carga bacilar a la vez que reducir la población con riesgo de mutantes dobles. Los fármacos de acción esterilizante son rifampicina, pirazinamida e isoniazida y son activos frente a bacilos de multiplicación lenta e intermitente.
Los objetivos que pretende el tratamiento son: a) disminución rápida de la capacidad infectante, para lo cual se utilizarán fármacos de acción bactericida precoz; b) curar sin recidivas, para lo que se utilizarán fármacos con efecto esterilizante y se mantendrá un tratamiento prolongado, y c) evitar la selección de resistencias, para ello se utilizarán asociaciones de fármacos.
Tratamiento de la tuberculosis pulmonar en niños
Ante la imposibilidad muchas veces de obtener muestras para cultivo, junto con la demora de los resultados cuando se disponen, el diagnóstico de TB pulmonar en un niño, se basará en la epidemiología, prueba de tuberculina positiva (en 5-10 % es negativa por anergia u otra razón) junto con imágenes radiológicas compatibles con TB. La clínica puede ser sugestiva o el niño puede estar asintomático. En ocasiones el diagnóstico se apoya con la información microbiológica precoz de técnicas de reacción en cadena de la polimerasa (RCP) y bacilos ácido-alcohol resistentes (BAAR) en jugo gástrico o esputo. En más de la mitad de los niños no se encuentra el caso inicial.
El tratamiento de la tuberculosis tiene dos fases: a) la inicial o de inducción o bactericida, tiene una duración de 2 meses; en esta fase existe reducción de abundante población de bacilos, una rápida mejoría clínica y biológica y disminución franca de la capacidad contagiante del sujeto bacilífero; b) la de mantenimiento o esterilización que tiene una duración de 4 meses o más; en esta fase se produce una disminución de los bacilos que están en estado quiescente7.
Los niños, pero no los adolescentes, tienen una menor carga de bacilos, no suelen ser bacilíferos y es difícil orientar y seguir la evolución terapéutica mediante la negativización de los cultivos como se hace en los adultos. En la actualidad existen estudios prometedores en cuanto a la rentabilidad diagnóstica del esputo inducido en niños8 pero hasta que no se estandarice la técnica es necesario estudiar 3 jugos gástricos, valorar lavado broncoalveolar o biopsia y hacer baciloscopia y cultivo de todas las muestras para obtener, siempre que sea posible, el diagnóstico de confirmación y el estudio de sensibilidad de la cepa7. Si no se consigue obtener baciloscopia ni cultivo positivo de las muestras del niño, se considera igualmente una enfermedad tuberculosa activa, es fundamental investigar la sensibilidad obtenida en los cultivos del adulto considerado caso índice9.
El régimen de elección para el tratamiento de cualquier forma de TB pulmonar en niños (por bacilos no resistentes y en niños no pertenecientes a grupos de riesgo de bacilos resistentes) es una pauta diaria de 2 meses (8 semanas, 56 dosis) de isoniazida a 10 mg/kg/día + rifampicina a 10 mg/kg/día + pirazinamida 25-35 mg/kg/día, seguido de 4 meses (18 semanas, 126 dosis) de isoniazida + rifampicina a la misma dosis7,9,10. Este tratamiento consigue más del 95 % de curación con menos del 2 % de efectos adversos11. La referencia a las dosis se basa en que tiene tanto interés como la duración total del tratamiento. El máximo tiempo permisible para conseguir las 182 dosis de rifampicina más isoniazida, con el régimen diario de 7 días semanales durante 6 meses, sería de 9 meses desde el inicio, con la condición de que no se
mantenga una monoterapia, ya que 15 días de ésta invalida al fármaco. Si la interrupción es superior a un mes, la duración será la del nuevo tratamiento instaurado.
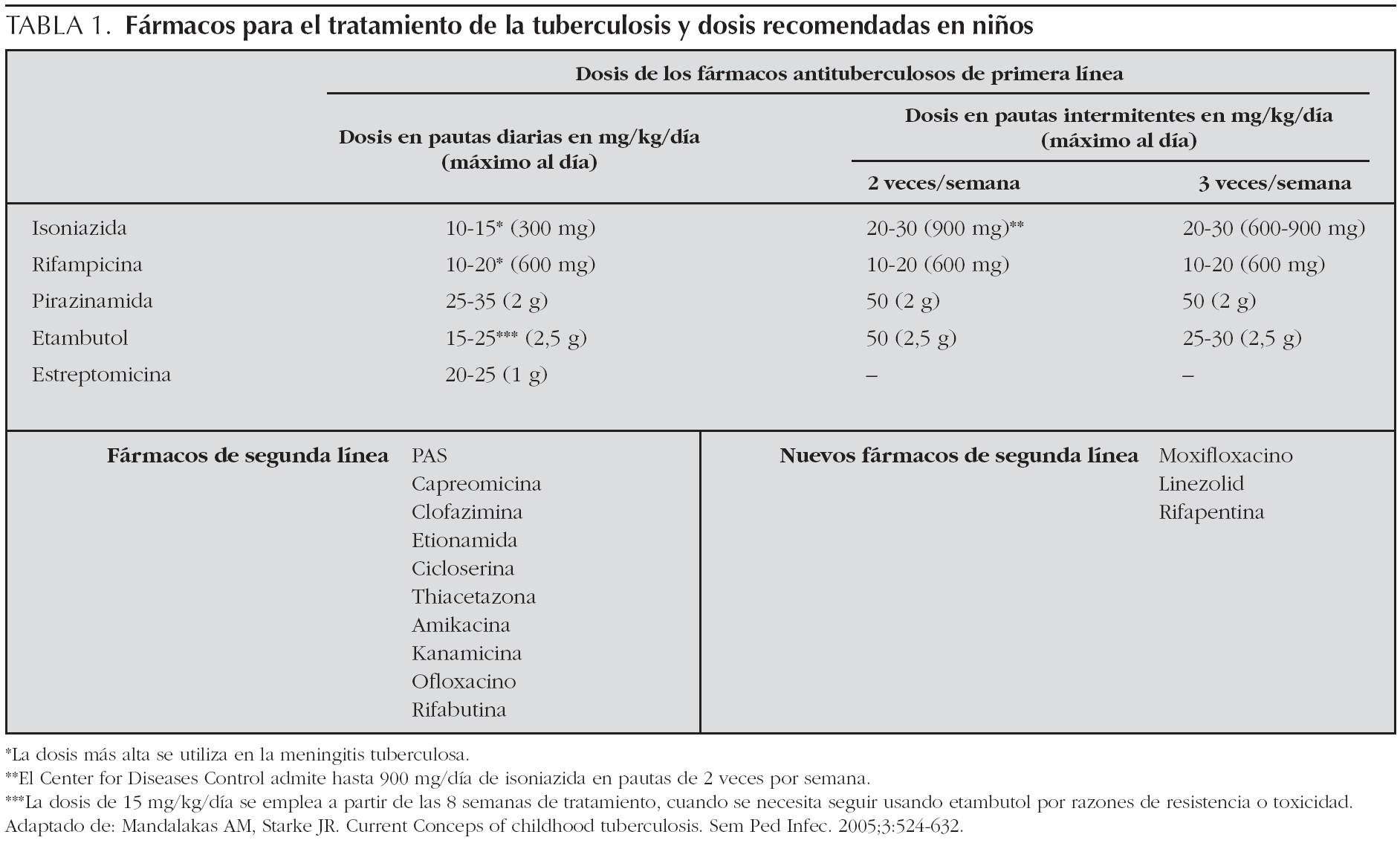
La pauta recomendada en niños es la diaria, aunque en casos especiales puede utilizarse la pauta de 2 o 3 días por semana con las dosis más altas de los intervalos antes indicados (se prefieren siempre pautas de 3 días semanales frente a 2 días semanales), y en estos casos es obligada la terapia directamente observada (TDO), que ha demostrado buenos resultados12. A pesar de la insistencia de expertos como los de WHO, ATS, etc., de que el personal sanitario supervise cada dosis (TDO), una revisión de Cochrane de estudios clínicos no ha sido capaz de mostrar que tal vigilancia asegura mejores resultados que los obtenidos con otras formas de dar el tratamiento13. No obstante, la American Academy of Pediatrics y la American Thoracic Society siguen aconsejando que todos los niños, independientemente del régimen de tratamiento, deberían usar TDO6,7,12,14. Con todas las ventajas de la TDO, en el momento actual en nuestro medio, no existe la suficiente infraestructura en muchas áreas de las diferentes comunidades que permita llevar a cabo tal estrategia y deberá reservarse para casos seleccionados. Los fármacos antituberculosos de primera y segunda línea y las dosis aconsejadas en niños10 se exponen en la tabla 1.
El régimen de elección para el tratamiento de la TB pulmonar en niños, sin factores de riesgo de resistencia, es una pauta diaria de 2 meses o 56 dosis de isoniazida+rifampicina+pirazinamida, seguido de 4 meses o 126 dosis de isoniazida + rifampicina.
Pautas terapéuticas aconsejadas por la SEIP para el tratamiento de la tuberculosis pulmonar
Tanto los casos que presenten lesión pulmonar como aquellos que sólo muestren adenopatías parahiliares de origen tuberculoso, deben de tratarse con la misma pauta1,9,15.
1.Pauta estándar diaria de 6 meses (26 semanas): 2 meses isoniazida + rifampicina + pirazinamida y 4 meses isoniazida + rifampicina.
2.Pauta intermitente de 6 meses (3 días en semana): 2 meses (8 semanas) isoniazida + rifampicina + pirazinamida diaria a la misma dosis y 4 meses más, administrar tres veces por semana isoniazida + rifampicina. En niños sin factores de riesgo, pueden utilizarse pautas de tratamiento intermitente, con TDO obligatoria, que constan de una fase intensiva de 5 días a la semana de 40 dosis y una fase de continuación de 2 días a la semana de 36 dosis.
3.En el caso de niños españoles que conviven con inmigrantes adultos o niños inmigrantes cuya procedencia sea de países con porcentajes de resistencia a isoniazida superior al 4 % se procederá a iniciar el tratamiento con 4 fármacos hasta conocer la sensibilidad real del caso o del caso índice. El fármaco que hay que añadir será etambutol a 15-20 mg/kg/día o estreptomicina a 15-25 mg/kg/ día16,17.
4.Niños y adolescentes infectados por VIH: se desconoce el tratamiento óptimo. La fase inicial debe realizarse al menos con 3 fármacos y la duración total debe abarcar por lo menos 9 meses. Es importante recordar la interacción de la rifampicina con los inhibidores de las proteasas, con disminución del área bajo la curva así como con los no análogos de nucleósidos, efavirenz y nevirapina. Las pautas de tratamiento se exponen en la tabla 2.
Consideraciones al régimen terapéutico
En la actualidad, cada vez es más frecuente el diagnóstico de TB en niños en contacto con adulto bacilífero con riesgo elevado de TB resistente a fármacos. En estos niños puede recomendarse añadir al régimen inicial un cuarto fármaco hasta conocer la sensibilidad a éstos. El fármaco de elección puede ser etambutol o estreptomicina, según la edad16. Actualmente el uso de etambutol en niños está mucho más extendido, a pesar del riesgo conocido de que cause neuritis óptica, no se han citado casos totalmente confirmados de tal toxicidad en niños en la literatura médica. Esta patología se ha descrito en el 18 % de los casos en adultos y es reversible, estando relacionado con la dosis de 30 mg/kg/día. Cuando la toxicidad no pueda ser monitorizada de forma óptima en niños pequeños, se recomienda una dosis de 15-20 mg/kg/día17. La Academia de Pediatría, recomienda su uso, pues este fármaco se ha demostrado seguro, incluso si no se puede realizar estudio oftalmológico7.
La falta de presentaciones pediátricas de algunos fármacos antituberculosos, incluso dentro de los de primera línea es un problema para el cumplimiento terapéutico. La fórmula preferente es que se tomen los fármacos todos juntos en ayunas, a primera hora de la mañana. Esto favorece el cumplimiento y consigue unos niveles séricos óptimos de los fármacos minimizando la posibilidad de resistencia. Si existe mala tolerancia, puede tomarse la medicación con alimentos ya que su repercusión sobre la biodisponibilidad de los fármacos no es demasiado importante. Debe evitarse disolver los comprimidos de isoniazida en líquidos azucarados debido a la inestabilidad de la mezcla. También puede optarse por administrar el tratamiento antes de una comida distinta del desayuno, si esta práctica consiguiera mejorar la tolerancia o el cumplimiento1,7,10.
Se debe intentar evitar el cambio a fármacos de segunda línea, por cuestiones de intolerancia o toxicidad. Siempre es mejor cambios de horario, mezclar los fármacos con alimentos, disminuir dosis, utilizar regímenes de 3 días por semana, hacer pautas de desensibilización, etc., y seguir utilizando los fármacos de primera línea, que son, con diferencia, más eficaces y habitualmente menos tóxicos que los de segunda línea7,9,10. En el supuesto de que se tengan que usar los de segunda línea es imprescindible que se dirija el tratamiento desde un centro especializado.
En todas las formas de enfermedad tuberculosa en niños, máxime si se trata de un cuadro de enfermedad grave o si el paciente es de corta edad, son parámetros asociados al éxito terapéutico, el compromiso de cumplimiento que se obtenga de los responsables del niño y el grado de refuerzo positivo que realiza el pediatra con las visitas repetidas durante el seguimiento. Las implicaciones legales de la responsabilidad de los profesionales sanitarios y las autoridades en el cumplimiento terapéutico son aspectos que tendremos que tener presente18.
Es preferible tomar todos los fármacos juntos en ayunas a primera hora de la mañana. Esta práctica favorece el cumplimiento, consigue niveles séricos óptimos de los fármacos y minimiza la posibilidad de resistencia.
Toxicidad de fármacos
Los posibles efectos adversos deben valorarse en las primeras semanas de tratamiento. El efecto secundario más importante de los fármacos es la toxicidad hepática. La hepatotoxicidad posible de rifampicina, isoniazida y pirazinamida raras veces suele provocar manifestaciones clínicas en el niño sano e incluso las elevaciones de transaminasas son poco habituales. Actualmente no se recomienda monitorización de enzimas hepáticas si el paciente no presenta ningún factor de riesgo para desarrollo de hepatitis. Se debe valorar una modificación del tratamiento si existe elevación de transaminasas superior a tres veces con síntomas o superior a cinco veces con o sin síntomas. En estas situaciones deberá de retirarse la medicación una semana y volver a reiniciar con pautas de 2-3 días semanales. Si persistiera la toxicidad, se recomienda sustituir por estreptomicina o etambutol y realizar controles clínicos más estrechos. Las posibles opciones son7,19:
1.Rifampicina + pirazinamida + etambutol 6 meses.
2.Isoniazida + rifampicina 9 meses, con etambutol o estreptomicina hasta que se verifique sensibilidad.
3.Rifampicina + etambutol 12 meses, con estreptomicina o fluorquinolona los primeros 2 meses.
La toxicidad más importante de etambutol es la neuritis óptica. Es difícil de percibir antes de los 6 años, a esta edad una opción adecuada podría ser la exploración mediante potenciales evocados visuales. En niños desnutridos, donde la coexistencia de avitaminosis puede estar presente se recomienda la prescripción de vitamina B1.
El efecto adverso más importante de los fármacos antituberculosos es la toxicidad hepática, que es poco frecuente y puede solventarse con modificaciones del régimen terapéutico.
Interrupciones terapéuticas
Si se produce interrupción terapéutica durante la fase inicial (primeros 2 meses)7,19:
1.Interrupción menor de 14 días: seguir igual régimen y completar todas las dosis que faltan.
2.Interrupción superior de 14 días: comenzar de nuevo el régimen desde el principio.
Si se produce interrupción del tratamiento durante la fase de mantenimiento7,19:
1.El paciente ha recibido más del 80 % de todas las dosis planeadas y está clínica y radiológicamente bien, suspender el tratamiento.
2.El paciente ha recibido menos del 80 % de todas las dosis planeadas:
a)Interrupción menor de 3 meses: continuar régimen igual completando el total de las dosis planeadas.
b)Interrupción superior de 3 meses: reiniciar de nuevo el tratamiento.
Interrupciones terapéuticas superiores a 2 semanas durante la fase de inducción y superiores a 3 meses durante la fase de mantenimiento, obligan a reiniciar el tratamiento.
Seguimiento de los niños en tratamiento
Los principales objetivos del seguimiento durante el tratamiento son asegurar el cumplimiento, vigilar los efectos secundarios de los fármacos y las posibles interacciones con otros medicamentos y evaluar la respuesta clínica y radiológica.
1.Se aconseja realizar control médico mensual, con información a la persona a cargo del niño sobre los síntomas clínicos que necesiten atención médica.
2.Exámenes analíticos rutinarios no son necesarios al menos que los pacientes presenten mala evolución clínica, signos de toxicidad medicamentosa, enfermedad hepática subyacente o si toma otros medicamentos con riesgo de interacciones o toxicidades similares a los fármacos antituberculosos17.
3.Controles radiológicos. Se recomienda un control radiológico a los 2 meses si la evolución clínica es favorable. En algunos niños asintomáticos y adherentes al tratamiento, puede existir empeoramiento radiológico transitorio, que no indica mala evolución. Al final del tratamiento, nuevo control radiológico recordando que aunque es de esperar una mejoría importante, más del 50 % de los niños no tendrán radiografías normales al final del tratamiento lo que no significa una mala respuesta a la terapia establecida ni necesidad de prolongar más tiempo el tratamiento, si existió cumplimiento y el niño no tiene evidencia clínica de enfermedad. Las radiografías se normalizarán con el paso del tiempo y tampoco es de extrañar que las adenopatías hiliares y algunas atelectasias tarden hasta 2-3 años en desaparecer7,17.
Es obligado el seguimiento estrecho de los niños en tratamiento de tuberculosis. Si el paciente ha completado correctamente el tratamiento y está asintomático la persistencia de alteraciones radiológicas no implica mala evolución.
Grupo de trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica (SEIP)
Ángel Alejo García-Mauricio, Hospital Virgen Macarena (Sevilla). Javier Arístegui Fernández, Hospital de Basurto (Bilbao). Fernando Álvez González, Hospital Clínico Universitario (Santiago de Compostela). Fernando del Castillo Martín, Hospital Infantil La Paz (Madrid). Josep María Corretger Rauet, Hospital Sant Joan de Déu (Esplugues. Barcelona). Teresa Hernández-Sampelayo Matos, Hospital Gregorio Marañón (Madrid). María Jesús García de Miguel, Hospital Infantil La Paz (Madrid). Raúl González Montero, Hospital Sant Joan d'Alacant (Alicante). Leticia Martínez Campos, Hospital La Inmaculada (Huercal Overa, Almería). Antoni Martínez-Roig, Hospital del Mar (Barcelona). María José Mellado Peña, Hospital Carlos III (Madrid). David Moreno Pérez, Hospital Materno-Infantil Carlos Haya (Málaga). Carlos Rodrigo Gonzalo de Liria, Hospital Universitario Germans Trias i Pujol (Badalona, Barcelona).
Correspondencia: Dra. M.ªJ. Mellado Peña.
Servicio de Pediatría. Hospital Carlos III.
Sinesio Delgado, 10. 28029 Madrid. España.
Correo electrónico: mmellado.hciii@salud.madrid.org
Recibido en enero de 2007.
Aceptado para su publicación en enero de 2007.