Las infecciones de las derivaciones de líquido cefalorraquídeo (ID-LCR) tienen una incidencia del 5-10% en niños1–5, con baja mortalidad cuando el diagnóstico y tratamiento son precoces3. Estas infecciones suelen ocurrir durante la inserción del dispositivo por microorganismos de la flora cutánea, con frecuencia poco virulentos2,3, aunque pueden producirse por infección distal del catéter o bacteriemia3,6. Su diagnóstico es difícil debido a la clínica inespecífica y las pruebas complementarias poco rentables2,7.
Presentamos 2 casos de ID-LCR cuyo interés radica en su dificultad diagnóstica.
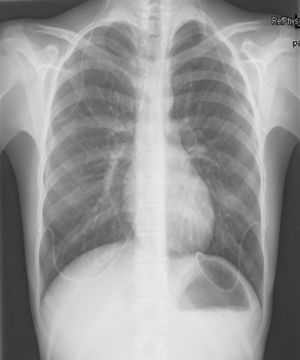
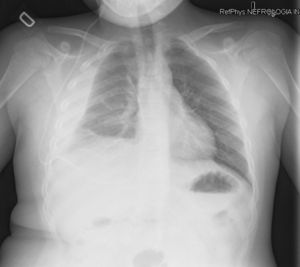
Caso n.° 1: niña de 13 años con 2 dispositivos de derivación ventrículo-peritoneales (DVPT) por hidrocefalia neonatal, con dolor abdominal de 15 días de evolución, fiebre, vómitos y cefalea. Tras varias visitas al hospital se sospecha abdomen agudo, objetivándose por medio de tomografía abdominal quistes de evacuación pericatéter. En la analítica destacaban 8.900 leucocitos/μl (80% neutrófilos), velocidad de sedimentación globular (VSG) >50mm y proteína C reactiva (PCR) de 36,4mg/dl. Ante la sospecha de infección de la DVPT, se recogieron muestras de LCR (bioquímica normal; cultivos negativos), se externalizaron los catéteres y se inició antibioterapia con vancomicina, cefotaxima y metronidazol, sustituyéndose posteriormente por piperacilina-tazobactam. Únicamente se aisló E. faecalis en la punta del catéter. A los 18 días se recolocaron 2 válvulas de derivación ventriculopleurales (DVPL) (fig. 1), manteniéndose 7 días más el tratamiento antibiótico, con buena evolución.
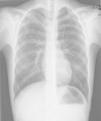
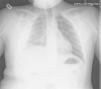
Caso n.° 2: niño de 11 años con mielomeningocele, portador de una DVPL durante 5 meses, que había presentado una neumonía 2 meses antes (fig. 2), con mejoría clínica tras recibir antibiótico, pero con reaparición intermitente de la fiebre al suspenderlo. El paciente presentó cefalea y pérdida de visión 24h antes del ingreso, objetivándose una fístula cutánea en la zona del reservorio. La analítica presentaba 14.400 leucocitos/μl (neutrófilos 56%), PCR de 10,6mg/dl y VSG de 79mm, decidiéndose la externalización del catéter. El LCR presentaba 230 leucocitos/μl (10% neutrófilos), aislándose repetidamente Corynebacterium spp. (inicialmente interpretado como contaminación) sensible a penicilina. Los hemocultivos y el cultivo del catéter fueron estériles. Se inició tratamiento con vancomicina, sustituyéndose posteriormente por ampicilina. A pesar de ello, los cultivos persistieron positivos, por lo que se retiró la derivación y se colocó un drenaje externo. Tras 10 días con LCR estéril, se reimplantó una derivación ventrículo-auricular, manteniéndose el antibiótico 15 días más, con buena evolución.
Los casos presentados son un ejemplo de la dificultad diagnóstica y terapéutica de las ID-LCR en niños. El primer caso es una infección tardía de la zona distal del catéter, mientras que el segundo es consecuencia de una fístula cutánea en la zona del reservorio.
Se recomienda descartar infección en todo paciente con ID-LCR y malfunción valvular y/o fiebre2. Las infecciones de DVPT pueden cursar con signos de peritonitis, en ocasiones tiempo después de su inserción2,3,7. Los seudoquistes abdominales aparecen en relación con infección o malposición del catéter8, aislándose alguna bacteria en el 25-80% de los casos2,7,8.
Existe poca bibliografía sobre las infecciones de DVPL, pudiendo cursar con derrame pleural, empiema o neumotórax6,9. La neumonía inicial del segundo paciente fue consecuencia de la infección pleural desde el DVPL.
Es frecuente el retraso diagnóstico de estas infecciones debido a su curso indolente2,3 y a la dificultad de interpretar las pruebas complementarias2,3,6,7. Es importante analizar el LCR (incluyendo cultivos) y realizar pruebas de imagen. Aunque ningún parámetro citobioquímico del LCR predice o excluye infección completamente6 >100 leucocitos/μl con >10% de neutrófilos parece tener un valor predictivo positivo elevado. La mayoría (90%) de estas infecciones diagnostican los primeros 6 meses tras la implantación2, pero puede existir un importante retraso entre la infección y la sintomatología, como ocurrió en nuestros pacientes.
Los microorganismos más frecuentemente aislados en las ID-LCR son cocos grampositivos, bacilos gramnegativos (BGN) y anaerobios2,3. Suelen ser bacterias poco virulentas que forman biopelículas dentro del catéter que los protegen de los antibióticos. La sintomatología suele ser más florida con S. aureus o BGN3. El aislamiento repetido de un microorganismo debería considerarse causa de infección3.
No existen estudios aleatorizados de tratamiento ni su duración para estas infecciones3,7, consiguiéndose el mayor porcentaje de éxitos con la retirada de la parte distal de la derivación, externalización del catéter, antibioterapia hasta la esterilización del LCR y reemplazo de la derivación3,6,10. El tratamiento empírico consiste en la asociación de glucopéptido y cefalosporinas de tercera/cuarta generación, o meropenem3,7, siendo el tratamiento más recomendado en niños vancomicina y cefotaxima3,6. En nuestro segundo caso, y dada la persistencia del crecimiento de Corynebacterium en el LCR, se requirió la retirada completa del DVPL, con inserción de un drenaje transitorio para su esterilización.
La duración del tratamiento depende del microorganismo. En el caso de Staphylococcus coagulasa negativo, 7 días tras cultivos negativos, o 3 días con un LCR normal, suele ser suficiente. Las infecciones por S. aureus y BGN suelen requerir 14-21 días antes de reimplantar el catéter2,7.
En resumen, se presentan dos casos de la patogenia de la ID-LCR en niños, reflejando su complejidad diagnóstica y terapéutica.