La hormona de crecimiento humana recombinante biosimilar (rhGH) fue el primer medicamento autorizado por la Agencia Europea del Medicamento (EMA), en el año 2006, por la vía de registro biosimilar. Se aprobó su uso para el tratamiento del déficit de hormona de crecimiento, trastorno de crecimiento asociado al síndrome de Turner, trastorno de crecimiento asociado a insuficiencia renal crónica, síndrome de Prader-Willi, trastorno de crecimiento en niños/adolescentes nacidos pequeños para su edad gestacional y como terapia de sustitución en adultos con deficiencia pronunciada de hormona de crecimiento.
Materiales y métodosEsta revisión se centra en las evidencias científicas publicadas en los últimos 10 años, incluyendo los ensayos clínicos utilizados para conseguir la aprobación por parte de la EMA y los estudios más relevantes que evalúan el medicamento en la práctica clínica habitual.
ResultadosLa equivalencia entre este biosimilar de rhGH y su producto de referencia ha sido demostrada en los ensayos clínicos publicados por Romer et al. y López-Siguero et al. Asimismo, los estudios del fármaco realizados en condiciones de práctica clínica habitual confirman su eficacia y seguridad a largo plazo, así como la ausencia de impacto clínico al cambiar el producto original por el biosimilar.
ConclusiónDesde su aprobación, el número de pacientes que reciben esta medicación ha experimentado un continuo crecimiento. Los datos preliminares del estudio postautorización PATRO indican que la eficacia y seguridad del fármaco se correlaciona con la obtenida en los ensayos clínicos. No obstante, aún queda pendiente evaluar los resultados definitivos del estudio que aportarán información adicional sobre la eficacia y seguridad del fármaco a largo plazo.
Recombinant human growth hormone (rhGH) is the first biosimilar drug approved by the European Medicines Agency in 2006, using the biosimilar registration process. It was authorised for the treatment of growth hormone deficiency, and growth disorders associated with Turner's syndrome, chronic renal failure, Prader-Willi syndrome, and growth disorders in children/adolescents born small for gestational age, and replacement therapy in adults with pronounced growth hormone deficiency.
Materials and methodsThis review is focused on the scientific evidence published about this drug in the last ten years, including the clinical trials on which the approval of the regulatory authority is based, and the most relevant studies evaluating the clinical impact of the drug in clinical practice.
ResultsThe equivalence between biosimilar and original product has been confirmed in the clinical trials published by Romer et al. and López-Siguero et al. Furthermore, studies carried out in real-life conditions confirm its long-term efficacy and safety, as well as the absence of clinical impact by switching treatment from the original to the biosimilar product.
ConclusionThe number of patients receiving this medication has continuously increased since its approval. Its equivalence with the original product has been verified. Preliminary data from the post-authorisation PATRO study confirm the efficacy and safety of the biosimilar product in comparison with data from clinical trials. However, final results must be evaluated at the end of the study, which will provide additional information about the long-term efficacy and safety of the biosimilar drug.
La Agencia Europea del Medicamento (EMA) define como medicamentos biosimilares aquellos productos farmacéuticos que han sido aprobados bajo un procedimiento regulatorio específico bien definido y que son equivalentes a un medicamento biológico ya aprobado1.
El principio activo de un biosimilar y su medicamento de referencia es esencialmente la misma sustancia biológica, aunque existen ligeras diferencias debido a la complejidad de su naturaleza2 y a los métodos de producción (fig. 1)3. Para conseguir la autorización hay que demostrar que la variabilidad y las diferencias entre él y su medicamento de referencia no afectan ni a la seguridad ni a la eficacia del tratamiento2.
Esquema de la producción de un medicamento biosimilar.
Fuente: adaptado de Agencia Europea del Medicamento3.
Los primeros tratamientos para pacientes con déficit de hormona de crecimiento (GHD, del inglés growth hormone deficiency), se llevaron a cabo con una hormona obtenida de hipófisis procedentes de cadáveres humanos (pit-GH). A pesar de obtenerse mejoras significativas en el crecimiento de los pacientes tratados, el uso de pit-GH generó problemas relacionados con la enfermedad de Creutzfeldt-Jakob. A finales de 1980, una hormona de crecimiento (GH, del inglés growth hormone) biosintética, obtenida con ADN recombinante, sustituyó a la pit-GH, proporcionando un producto seguro, sin los problemas previamente descritos y, además, al ser un producto de síntesis, sin las limitaciones de producción que tenía la pit-GH al depender de la disponibilidad de pituitarias humanas. Pero esta hormona de crecimiento humana recombinante biosimilar (rhGH) supuso un aumento considerable del coste del tratamiento4.
Actualmente, la mayor parte de los países se enfrentan a una situación de control estricto del gasto sanitario y el aumento de este se debe, en parte, a los nuevos productos biofarmacéuticos de alto coste. Por este motivo, la razón principal para el uso de medicamentos biosimilares es el ahorro de costes y facilitar un mayor acceso a estos fármacos. La cobertura de los biosimilares dependerá del grado de ahorro de costes que sea requerido por los sistemas sanitarios y del ahorro absoluto que podrían obtener al cambiar los fármacos originales1.
El biosimilar de rhGH fue el primer biosimilar aprobado por la EMA; la autorización se concedió en 2006 con base en la calidad, seguridad y eficacia demostradas en los estudios de bioequivalencia con el producto de referencia1,5-7.
Basado en la guía de rhGH elaborada por la EMA, el biosimilar de rhGH está aprobado en Europa para las mismas indicaciones que el producto de referencia: GHD, trastorno de crecimiento asociado a síndrome de Turner (ST), trastorno de crecimiento asociado a insuficiencia renal crónica, síndrome de Prader-Willi (SPW), trastorno de crecimiento en niños/adolescentes nacidos pequeños para su edad gestacional (PEG), y terapia de sustitución en adultos con deficiencia pronunciada de GH8.
Materiales y métodosSe realizó una revisión de la literatura científica acerca del impacto clínico del biosimilar de rhGH, desde su aprobación en el año 2006 hasta su situación actual en la práctica clínica habitual.
Para ello, se llevó a cabo una búsqueda bibliográfica en la base de datos PubMed, aplicando los siguientes límites a la estrategia de búsqueda: artículos publicados desde el año 2010, en humanos, en lengua inglesa o española, incluyendo la evidencia científica publicada de mayor impacto, considerando los ensayos clínicos que constituyen la base de la aprobación del medicamento, así como los estudios más relevantes sobre la utilización del medicamento en la práctica clínica habitual, y el estudio poscomercialización (PATRO) sobre los efectos a largo plazo del medicamento.
Se cumplimentó la búsqueda con la información más relevante sobre el biosimilar de rhGH publicada por la EMA y con la presentada tanto en el congreso de la Sociedad Española de Farmacia Hospitalaria (SEFH) como en el congreso de la Sociedad Española de Endocrinología Pediátrica (SEEP).
ResultadosEstudios de registroSiguiendo las exigencias de la EMA para conseguir la aprobación del biosimilar de rhGH, Romer et al.4 llevaron a cabo un ensayo clínico que permitió obtener la autorización de comercialización del primer biosimilar al presentar los resultados obtenidos en los primeros 9 meses del estudio, aunque este se prolongó hasta un total de 7 años demostrando su eficacia y seguridad a largo plazo8. Posteriormente, López-Siguero et al.6 publicaron otro estudio multicéntrico, llevado a cabo en España, en el que confirmaron los datos obtenidos por Romer et al.4 en cuanto a equivalencia, eficacia y seguridad.
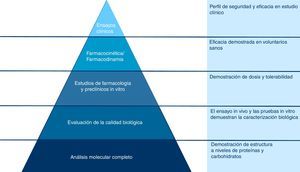
Estudio de Romer et al.El estudio llevado a cabo por Romer et al.4 describe la eficacia y seguridad del biosimilar de rhGH a través de un ensayo abierto, multicéntrico y aleatorizado de fase III. En el ensayo se incluyeron 89 pacientes con GHD sin tratamiento previo con rhGH, con una altura de, al menos, 2 desviaciones estándar por debajo de la media de su grupo de edad y género y una velocidad de crecimiento de, al menos, una desviación estándar por debajo de la media4.
El estudio contó con 3 partes llevadas a cabo en el mismo grupo de pacientes (fig. 2). Durante la primera parte se comparó la eficacia y seguridad del biosimilar de rhGH, en su formulación liofilizada, con la de la rhGH de referencia. No se encontraron diferencias significativas entre ambos grupos, lo que posibilitó la autorización del biosimilar4.
Esquema del diseño del estudio de Romer et al.
Fuente: adaptado de Romer et al.4.
En la segunda parte del ensayo se demostró que la respuesta al tratamiento no se vio afectada por el cambio de la rhGH de referencia al biosimilar. La última parte del estudio tuvo una duración de 69 meses. En este caso, se cambió el biosimilar de rhGH liofilizada por biosimilar en solución. El cambio de forma farmacéutica se decidió por el aumento en la formación de anticuerpos anti-hGH asociado al uso del biosimilar de rhGH liofilizada. No se observaron diferencias significativas entre ambos grupos en los parámetros auxológicos analizados4.
La terapia con el biosimilar de rhGH demostró ser igualmente segura que el fármaco con el que se comparó y no se observaron diferencias significativas en cuanto a la frecuencia, distribución, intensidad y resolución de los efectos adversos. Durante los 84 meses de estudio se reportaron 323 efectos adversos relacionados con el medicamento; la mayoría de estos fueron de carácter leve a moderado en intensidad. La principal diferencia en cuanto a la seguridad fue la formación de anticuerpos anti-hGH durante los primeros 9 meses de tratamiento con la formulación del biosimilar de rhGH liofilizada4.
El origen de este aumento de anticuerpos anti-hGH se debió a una alta concentración de proteínas originarias del microorganismo de producción en la formulación liofilizada. Basándose en estos hallazgos, el proceso de producción se modificó introduciendo 2 etapas de purificación, sin cambiar ninguna otra característica de la sustancia4.
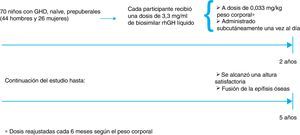
Estudio de López-Siguero et al.A nivel nacional, López-Siguero et al.6 publicaron otro de los estudios pivotales que confirmaron la eficacia y seguridad a largo plazo del biosimilar de rhGH para el tratamiento de niños con GHD. Este ensayo, al igual que el de Romer et al.4, fue un ensayo abierto multicéntrico de fase III, desarrollado en centros españoles. Incluyó a 70 pacientes con GHD sin tratamiento previo con GH, y tuvo una duración de 5 años. En este caso, todos los participantes recibieron el biosimilar de rhGH en solución, y la dosis se fue ajustando en función del peso del paciente. El periodo de tratamiento inicial fue de 2 años. Los participantes que lo completaron siguieron en tratamiento hasta la comercialización del biosimilar de rhGH, y se interrumpió cuando se alcanzó una altura satisfactoria, o dio lugar a la fusión de las epífisis óseas (fig. 3)6.
Esquema del diseño del estudio de López-Siguero et al.
Fuente: adaptado de López-Siguero et al.6.
El mayor impacto del biosimilar de rhGH en el crecimiento se vio reflejado con la altura final proyectada tras 4 años de tratamiento, ya que fue 10cm más elevada que la esperada en sujetos con GHD sin tratamiento. Respecto a la seguridad, la tasa de efectos adversos registrados fue comparable a la publicada en el estudio de Romer et al.4. Por lo tanto, se pudo concluir que el tratamiento a largo plazo con el biosimilar de rhGH es bien tolerado y la generación de anticuerpos anti-hGH es baja y está dentro del rango observado con otros tratamientos de GH6.
Experiencia clínicaDesde el año de aprobación del medicamento por parte de la EMA el número de pacientes que han ido recibiendo este tratamiento ha ido en aumento. Con el inicio del empleo del fármaco en la práctica clínica habitual, se han hecho necesarios estudios de farmacovigilancia que respaldan su utilización9.
Real-world evidence (RWE): estudio PATH y estudios de switchingEn la valoración de la experiencia en la práctica clínica habitual, resulta relevante destacar el estudio PATH5, desarrollado en España. Se trata de un estudio de seguimiento retrospectivo, observacional y multicéntrico en pacientes provenientes del estudio de fase III de López-Siguero et al.6 —expuesto en el punto previo de la revisión—6, en el que se evaluó la eficacia y la seguridad del biosimilar a largo plazo, los cuales se monitorizaron hasta que suspendían el tratamiento5.
Cada vez que los pacientes acudían a su respectiva revisión médica, se medía la altura de los mismos y se registraban los efectos adversos que hubiesen podido padecer. La altura, los valores de desviación estándar de la misma y la velocidad de crecimiento (expresada en cm/año) constituyeron los parámetros para determinar la eficacia del tratamiento5.
Los resultados mostraron que el tratamiento con rhGH biosimilar permitía la normalización en los valores de altura, obteniéndose una media de crecimiento durante el seguimiento de 11,6cm en las mujeres y de 18,9cm en los hombres. Por tanto, la cohorte de pacientes que conformaba este estudio de seguimiento mostró una respuesta positiva con el biosimilar de rhGH5, alcanzando una talla adulta dentro del intervalo considerado normal para la población española10. No se reportó ningún efecto adverso relacionado con la medicación5.
Existen varios estudios publicados que extrapolan datos de seguridad y eficacia tras el reemplazo del tratamiento. En el año 2014, Rashid et al.11 publicaron un estudio retrospectivo de la práctica clínica habitual que evaluaba la efectividad del cambio al biosimilar en niños con GHD, ST y talla baja idiopática (TBI). Los pacientes estudiados eran menores de 18 años en el momento del cambio, habían estado en tratamiento previo al cambio con rhGH durante al menos 15 meses y recibido tratamiento posterior con el biosimilar durante un mínimo de otros 15 meses. Los datos evidenciaron que el cambio de tratamiento mantenía el perfil de crecimiento mostrado con la medicación inicial11.
En un centro hospitalario en Suecia se llevó a cabo un estudio en 2009 para analizar el efecto de la implantación de un nuevo protocolo para el tratamiento de pacientes que requerían la administración de rhGH. Este nuevo protocolo consistía en la sustitución del tratamiento con el producto de referencia por el biosimilar de rhGH a través de un acuerdo entre las distintas partes implicadas1.
Como parte del protocolo de consenso se les ofreció a todos los pacientes la información referente a los motivos del cambio. Asimismo, se puso a su disposición una serie de sistemas de información y apoyo en caso de que tuviesen dudas con el biosimilar1.
Los datos del cambio de tratamiento mostraron que se mantenía el efecto iniciado por el medicamento original y no se detectó ningún efecto negativo relacionado con el mismo sobre el crecimiento, careciendo, además, de la aparición de efectos adversos graves o inesperados. Esta experiencia sugiere que este sistema puede ser un protocolo útil a la hora de implementar el cambio de medicación en los pacientes1.
De acuerdo con los posicionamientos de diversas sociedades científicas a nivel nacional, el cambio de un fármaco biológico tan solo debe realizarse bajo la supervisión y responsabilidad del médico prescriptor12. En este sentido se han publicado datos de práctica clínica en los que se han mostrado resultados de eficacia y seguridad tras el reemplazo de un tratamiento por el biosimilar1,11.
Estudio PATRO en niñosEnglobado dentro del Plan de Gestión de Riesgos del biosimilar de rhGH, el estudio PATRO consiste en un estudio poscomercialización que evalúa la eficacia y la seguridad a largo plazo del medicamento biosimilar en niños y adolescentes con problemas de crecimiento, que reciben dicha medicación en la práctica clínica habitual. Se trata de un estudio multicéntrico, observacional, abierto y longitudinal, llevado a cabo en 14 países en los que el medicamento está aprobado. Los pacientes que se incluyeron en el estudio recibieron tratamiento con el biosimilar de rhGH (incluyendo aquellos que recibían otro medicamento con GH previo al biosimilar), manteniéndose el tratamiento hasta que alcanzaban la altura adulta. En la actualidad sigue en marcha el estudio7.
El objetivo primario del estudio fue la valoración de la seguridad del tratamiento a largo plazo, haciendo especial hincapié en el potencial diabetogénico de la terapia con rhGH en niños que al nacer eran PEG, en la aparición de tumores malignos en los pacientes tratados, en los efectos secundarios respiratorios y diabetogénicos de pacientes tratados que padecían SPW, y en las implicaciones clínicas de los anticuerpos anti-hGH, siendo el objetivo secundario la eficacia del tratamiento a largo plazo7.
Los primeros datos extraídos del estudio, en el año 2012, confirmaban los resultados obtenidos en los ensayos de fase III previos. No se apreciaron signos de incremento del potencial diabetogénico, ni del incremento del riesgo de desarrollar tumores malignos, ni en el incremento del riesgo de desarrollar anticuerpos anti-hGH. Asimismo, los resultados sugirieron la posible eficacia del medicamento en otras indicaciones para las que no había sido estudiado en ensayos clínicos, como el SPW, insuficiencia renal crónica, niños PEG y ST7.
En centros hospitalarios españoles, a fecha de octubre de 2013, se habían incluido 34 pacientes (19 con GHD, 12 con PEG y 3 con otras indicaciones) y no se habían registrado hasta ese momento casos de diabetes mellitus (DM) de novo, disminución de la tolerancia a la glucosa, ni alteración de los niveles de glucemia en ayunas. En cuanto a la eficacia, a dicha fecha no había sido posible realizar un análisis de la misma debido al escaso tiempo de seguimiento13.
De cara al futuro, la gran cohorte que conforma el estudio, amén de la extensión del mismo, permitirán obtener información adicional sobre el potencial diabetogénico del medicamento y su implicación en el riesgo de padecer tumores malignos. También resultará de relevancia la aportación que suponga el estudio PATRO en los efectos del tratamiento en pacientes con SPW, así como para el conocimiento de las implicaciones clínicas que tenga la producción de anticuerpos anti-hGH7.
Estudio PATRO en adultosDe idéntico diseño al desarrollado en niños, está en curso el estudio PATRO en adultos, con el objetivo de evaluar la seguridad y la eficacia del biosimilar de rhGH en adultos tratados con dicho medicamento en la práctica clínica habitual. El objetivo fundamental del estudio es la obtención de información adicional del fármaco en su uso a largo plazo, con atención especial a la seguridad del tratamiento, fundamentalmente lo concerniente al riesgo de desarrollar DM y al riesgo de desarrollar tumores malignos14.
El síndrome metabólico constituye un importante predictor del riesgo de desarrollar DM tipo 214. En este sentido, otros estudios de farmacovigilancia en pacientes tratados con rhGH indican que la prevalencia del síndrome metabólico es mayor en pacientes con GHD que en la población general15,16. Por otro lado, tanto la GH como el IGF-1 presentan propiedades mitogénicas, por lo que el riesgo de desarrollar tumores malignos es otro de los parámetros de seguridad a evaluar más importantes, ya sea recurrencia de tumores del eje hipotálamo-hipófisis, o bien desarrollo de tumores de novo. Los estudios realizados hasta la fecha postulan que la terapia con GH no incrementa el riesgo de recurrencias de tumores del eje hipotálamo-hipófisis14.
ConclusionesLa situación económica global ha generado la necesidad de ahorrar costes por parte de las autoridades sanitarias, situación que ha motivado la investigación y el desarrollo de medicamentos biosimilares1. En el año 2006, la EMA aprobó el primer medicamento biosimilar, el biosimilar de rhGH, y desde el momento de su aprobación, el número de pacientes que reciben esta medicación ha ido experimentando un continuo crecimiento9.
La eficacia y seguridad de este fármaco han sido estudiadas en ensayos clínicos de equivalencia, demostrándose que eran comparables a las del producto de referencia, y que constituyeron la base del dosier presentado a la EMA para conseguir la autorización de comercialización4,7.
Su incorporación en la práctica clínica diaria provocó la necesidad de llevar a cabo estudios de farmacovigilancia de cara a confirmar lo mostrado en los estudios de fase III previos; que en condiciones reales de utilización, la eficacia y la seguridad del fármaco a largo plazo eran idénticas a las del medicamento de referencia7,9. En este sentido, destaca el estudio PATH, realizado en España, y que confirma la eficacia del biosimilar en niños con GHD (principales receptores de este tipo de medicación) con una seguridad y tolerancia aceptables, comparables al fármaco de referencia5.
Además, en la actualidad continúan en marcha los 2 estudios observacionales PATRO, uno llevado a cabo en niños y otro en adultos, que proporcionarán información adicional sobre la eficacia y seguridad de este fármaco biosimilar a largo plazo en la práctica clínica habitual. Entre otros aspectos, serán de especial utilidad en algunas situaciones en las que aún no se dispone de información suficiente, como la relación entre la medicación y un posible potencial diabetogénico o el desarrollo de tumores malignos, así como el conocimiento del impacto clínico de los anticuerpos anti-hGH. Pese a que aún no han finalizado dichos estudios, los datos preliminares sugieren que la eficacia y seguridad del biosimilar a largo plazo se correlaciona con los datos obtenidos en estudios previos, cumpliendo las expectativas generadas7,14.
FinanciaciónEl estudio ha sido financiado por Sandoz Farmacéutica SA.
Conflicto de interesesJPLS y MP declaran no tener ningún conflicto de intereses. MPG, EMB y FJR son empleados a tiempo completo en Sandoz Farmacéutica SA.