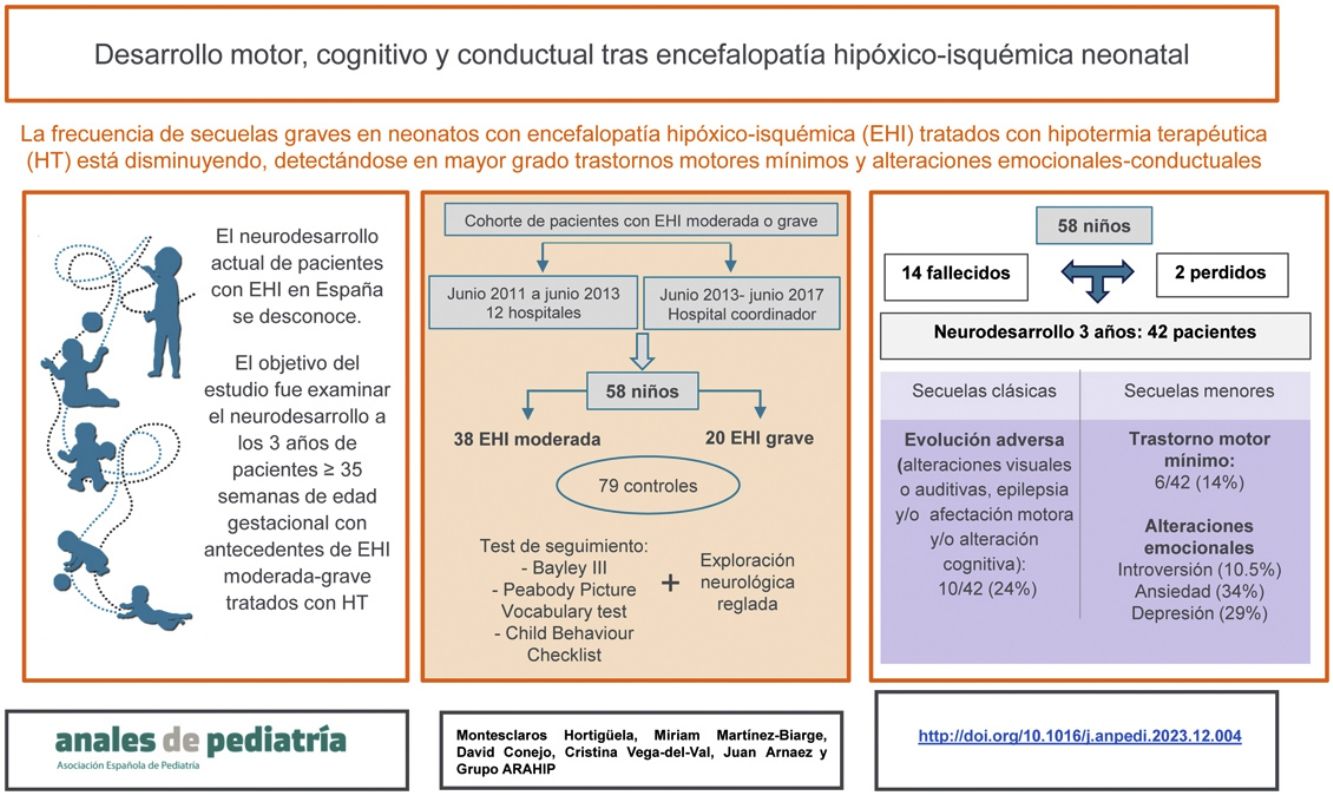
El neurodesarrollo actual de pacientes con encefalopatía hipóxico-isquémica (EHI) neonatal en España se desconoce. Recientes estudios europeos destacan el desplazamiento de la patología grave hacia trastornos motores leves y problemas emocionales. El objetivo de este estudio fue analizar el estado neuroevolutivo integral a los 3años de una cohorte de neonatos con EHI.
Pacientes y métodosEstudio observacional multicéntrico de neonatos ≥35 semanas de edad gestacional con EHI moderada-grave nacidos entre 2011 y 2013 en 12 hospitales de una extensa región española (91.217m2) y ampliado hasta 2017 en el hospital coordinador. Se evaluaron los estudios de neuroimagen neonatal y del neurodesarrollo a los 3años mediante Bayley-III, Peabody Picture Vocabulary Test y Child Behaviour Checklist. Se incluyeron 79 controles sin asfixia perinatal.
ResultadosSe reclutaron 63 pacientes, de los cuales 5/63 (7,9%) se excluyeron por presentar otra patología, y 14/58 (24%) fallecieron. De los 44 supervivientes, 42/44 (95,5%) fueron evaluados. De ellos, 10/42 (24%) presentaron evolución adversa (alteraciones visuales o auditivas, epilepsia, parálisis cerebral [PC] o retraso del desarrollo). Adicionalmente se detectaron otras alteraciones: trastorno motor mínimo (TMM) en 6/42 (14%) y más problemas de introversión (10,5% vs 1,3%), ansiedad (34,2% vs 11,7%) y depresión (28,9% vs 7,8%) que los controles (p<0,05). La gravedad de las lesiones en neuroimagen fue significativamente mayor en pacientes con trastorno motor (PC o TMM) (p=0,004) y muerte o evolución adversa (p=0,027).
ConclusionesAdemás de las secuelas clásicas, el seguimiento de los pacientes con EHI neonatal debería incluir el diagnóstico y el manejo de trastornos motores mínimos y problemas emocionales.
The current neurodevelopmental status of patients with neonatal hypoxic-ischaemic encephalopathy (HIE) in Spain is unknown. Recent European studies highlight a shift of severe pathology towards mild motor disorders and emotional problems. The aim of this study was to analyse neurodevelopmental outcomes in a cohort of neonates with HIE at age 3years.
Patients and methodMulticentre observational study of neonates born at 35 or more weeks of gestation with moderate to severe HIE in 2011-2013 in 12 hospitals in a large Spanish region (91,217m2), with the recruitment extended through 2017 in the coordinating hospital. We analysed the findings of neonatal neuroimaging and neurodevelopmental test scores at 3years (Bayley-III, Peabody Picture Vocabulary Test and Child Behavior Checklist). The sample included 79 controls with no history of perinatal asphyxia.
ResultsSixty-three patients were recruited, of whom 5 (7.9%) were excluded due to other pathology and 14 (24%) died. Of the 44 survivors, 42 (95.5%) were evaluated. Of these 42, 10 (24%) had adverse outcomes (visual or hearing impairment, epilepsy, cerebral palsy or developmental delay). Other detected problems were minor neurological signs in 6 of the 42 (14%) and a higher incidence of emotional problems compared to controls: introversion (10.5% vs. 1.3%), anxiety (34.2% vs. 11.7%) and depression (28.9% vs. 7.8%) (P<.05). The severity of the lesions on neuroimaging was significantly higher in patients with motor impairment (P=.004) or who died or had an adverse outcome (P=.027).
ConclusionIn addition to classical sequelae, the follow-up of patients with neonatal HIE should include the diagnosis and treatment of minor motor disorders and social and emotional problems.
La hipotermia terapéutica (HT) en la encefalopatía hipóxico-isquémica (EHI) moderada o grave ha cambiado significativamente el pronóstico de los neonatos con esta condición y actualmente se considera el tratamiento estándar en los países de rentas altas1-3. Algunos estudios de cohortes europeas han sugerido que los resultados podrían ser incluso mejores que los datos comunicados en los ensayos clínicos originales, aunque las razones no son del todo conocidas4,5.
Desde la publicación de las recomendaciones de seguimiento específico para esta entidad en el año 20146, no conocemos estudios poblacionales que examinen la evolución neurológica a medio-largo plazo de los neonatos con EHI moderada o grave tratados con HT en España. Por otro lado, algunos estudios recientes en otros países han destacado la presencia de otras secuelas neurológicas, como los problemas emocionales-conductuales, además de la existencia de alteraciones en áreas más conocidas, como la motora o la cognitiva7,8.
Disponer de datos poblacionales actualizados en nuestro medio sobre el estado de las diferentes áreas del neurodesarrollo en niños con EHI tratados con HT es importante si queremos implementar programas de seguimiento y de intervención eficientes. Además, la comparación de datos de cohortes de diferentes países y modelos de atención sanitaria permitiría explorar posibles factores de riego o de protección en la EHI.
El objetivo de este estudio fue examinar el neurodesarrollo integral a los 3años de una cohorte de neonatos ≥35 semanas de edad gestacional (EG) diagnosticados de EHI moderada o grave durante los años 2010 a 2017 en una región española.
Pacientes y métodosPoblación del estudioEste estudio formó parte de un programa poblacional diseñado para mejorar la atención del neonato con asfixia perinatal en una región española de 91.217m29. Es un estudio de cohortes multicéntrico observacional que incluyó a los recién nacidos vivos ≥35 semanas de EG y ≥1.800g con EHI moderada o grave, nacidos entre junio de 2011 y junio de 2013 en 12 hospitales: 5 de ellos de nivelIII, 5 de nivelII y 2 de nivelI. El hospital coordinador amplió el reclutamiento hasta diciembre de 2017, siguiendo el mismo protocolo de estudio.
Se consideró EHI moderada o grave si se cumplía al menos un criterioA y el criterioB. Los criteriosA incluían: 1)pH de cordón umbilical o en la primera hora de vida ≤7,00; 2)Apgar a los 5min ≤5, y 3)necesidad de reanimación avanzada (intubación, masaje cardiaco y/o ventilación más allá de los 5minutos de vida). El criterioB fue la presencia de EHI moderada o grave, definida como un nivel anormal de conciencia (letargia, estupor o coma) en las primeras seis horas posnatales, y graduada mediante la puntuación modificada de Sarnat10. Para garantizar la solidez de esta clasificación se grabaron los exámenes neurológicos, con consentimiento de los padres. Al finalizar el programa, se graduó la gravedad de la EHI de los vídeos por dos neuroneonatólogos (A.GA, J.A.), ciegos a los resultados del neurodesarrollo11.
Los neonatos con EHI moderada o grave recibieron HT corporal servocontrolada (Techotherm TSmed 200N o Criticool, MTRE Ltd.) con temperatura central diana en 33-34°C durante 72horas siguiendo las directrices nacionales españolas12. Los pacientes que recibieron HT fueron monitorizados con electroencefalograma integrado por amplitud (aEEG).
Las decisiones sobre la adecuación del esfuerzo terapéutico (AET) se tomaron en base a una combinación de los siguientes hallazgos: coma persistente, aEEG patológico tras las primeras 48horas de vida, los hallazgos graves en la neuroimagen (ecografía cerebral y/o resonancia magnética [RM] cerebral); en algunos casos se determinaron niveles de enolasa neuronal específica en el líquido cefalorraquídeo13.
Se excluyeron del análisis los neonatos con síndromes polimalformativos, errores innatos del metabolismo, infarto perinatal, enfermedades neuromusculares o lesiones medulares.
Resonancia magnéticaSe realizó en una unidad de 1,5Tesla. Como mínimo, se adquirieron imágenes axiales y sagitales ponderadas en T1, coronales ponderadas en T2 y axiales ponderadas en difusión. Dos investigadores (M.M.-B., J.A.) puntuaron a ciegas según la clasificación de Rutherford et al.14 la presencia y la gravedad de lesiones en los ganglios basales (GB), la sustancia blanca (SB) y la corteza, así como la señal de mielina en la rama posterior de la cápsula interna (RPCI). La puntuación lesional total (PLT) y el producto SBxGB se calcularon según lo propuesto por Thoresen et al.15. Las discrepancias se resolvieron por consenso.
NeurodesarrolloLas evaluaciones fueron realizadas por una investigadora (M.M.H.), neuropediatra específicamente entrenada, que desconocía la gravedad de la EHI y los estudios de RM. Los pacientes fueron evaluados a los 36meses mediante un examen neurológico estructurado y las escalas Bayley de desarrollo infantil-III (Bayley-III), tercera edición, que proporciona puntuaciones compuestas (estandarizadas con una media de 100 y desviación estándar [DE] de 15) para las habilidades cognitivas y motoras16. Las habilidades lingüísticas se evaluaron mediante las puntuaciones compuestas (estandarizadas con media de 100 y DE 15) del Peabody Picture Vocabulary Test (PPVT-III), tercera edición en español17.
En aquellos que no pudieron ser evaluados antes de los 42meses de edad, la evaluación cognitiva se realizó utilizando la Escala de Inteligencia Wechsler para Preescolar y Primaria, tercera edición (WPPSI-III)18, versión española (estandarizada con media de 100 y DE 20) o la Escala de Inteligencia de Wechsler para Niños, cuarta edición (WISC-IV)19 (estandarizada con media de 100 y DE 20), versión española. En ellos, la función motora se evaluó utilizando la Batería de Evaluación del Movimiento para Niños, segunda edición (MABC-2); las puntuaciones se presentaron con el percentil correspondiente20.
La parálisis cerebral (PC) se diagnosticó utilizando los criterios de la European PC Network21 y la gravedad se determinó mediante el Sistema de Clasificación de la Función Motora Gruesa (GFMCS)22.
Un resultado desfavorable se definió como muerte o evolución adversa. Se definió evolución adversa como la presencia de alteraciones visuales o auditivas, epilepsia y/o afectación motora (cualquier paciente con PC y/o puntuación compuesta motora <85 en Bayley-III o percentil ≤15 en MABC-2) y/o alteración cognitiva (puntuación compuesta cognitiva <85 en Bayley-III, cociente intelectual [CI] <85 en PPVT-III o CI total <80 en las pruebas WPPSI-III o WISC-IV).
Fuera de la definición de evolución adversa, se evaluaron otros problemas neuroevolutivos, como el trastorno motor mínimo (TMM) y las alteraciones en la esfera afectivo-conductual. El TMM se diagnosticó en aquellos pacientes sin PC y con al menos dos de los siguientes: alteración de la marcha, posturas distónicas, gestos distónicos orofaciales, temblor intencional, dificultades en la coordinación motora gruesa y/o fina. Los trastornos de comportamiento se identificaron mediante el cuestionario de 1,5-5años, Child Behaviour Checklist (CBCL) 1.5/523.
Dos familias fueron entrevistadas por teléfono mediante un cuestionario estructurado con preguntas sobre la salud general y los hitos del desarrollo. Además, se recibieron informes de seguimiento del hospital de origen. Sus resultados se clasificaron como normales o adversos, sin asignarles puntuaciones.
Grupo controlSe reclutaron aleatoriamente mediante muestreo por conveniencia 79 neonatos a término no emparejados, sin antecedentes de asfixia perinatal según la definición anterior, sin ingreso en el periodo neonatal y con exploración normal al alta de la maternidad. Los controles se reclutaron en el hospital coordinador y fueron evaluados a los 36meses de edad con el mismo protocolo que los casos.
Todos los participantes (EHI y controles) fueron evaluados antes de la pandemia de COVID-19.
Análisis estadísticoLas variables cualitativas se resumieron con frecuencias absolutas y relativas, y las cuantitativas, con mediana y rango intercuartílico (RIC) o media y DE. Las variables continuas se compararon mediante la prueba de la U de Mann-Whitney o la prueba de Kruskal-Wallis, según procediera. Las variables categóricas se compararon mediante la prueba de chi-cuadrado o la prueba exacta de Fisher. Se utilizaron coeficientes de correlación de Spearman (rs) para evaluar la correlación entre variables cuantitativas. Para determinar el valor de corte óptimo para la puntuación de la RM en relación con la evolución adversa se realizó un análisis de la curva de características operativas del receptor (ROC) y se expresaron como área bajo la curva (AUC), sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN). Se realizaron también modelos predictivos para el resto de variables neonatales. Se consideró que un valor p<0,05 indicaba significación estadística y se utilizó el paquete estadístico SPSS versión20 (IBM, Armonk, Nueva York, NY, EE.UU.).
Aprobación éticaSe obtuvo el consentimiento por escrito de los padres, y el estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital coordinador (número 1243).
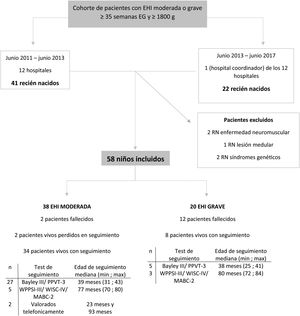
ResultadosSe reclutaron 63 pacientes consecutivos con EHI moderada o grave. Se excluyeron 5 pacientes debido a lesión medular (1), enfermedad neuromuscular (2) y síndrome genético (2) (fig. 1). Las principales características perinatales de los 58 neonatos incluidos (38 con EHI moderada y 20 con EHI grave) se muestran en la tabla suplementaria 1.
Diagrama de flujo de la cohorte de pacientes con EHI moderada o grave.
Bayley-III: Escalas Bayley de desarrollo infantil-III (Bayley-III), tercera edición; EG: edad gestacional; EHI: encefalopatía hipóxico isquémica; MABC-2: Batería de Evaluación del Movimiento para Niños, segunda edición; max: edad máxima de seguimiento; min: edad mínima de seguimiento; PPVT-3: Peabody Picture Vocabulary Test, tercera edición en español; RIC: rango intercuartílico; RN: recién nacido; WISC-IV: Escala de Inteligencia de Wechsler para Niños, cuarta edición; WPPSI-III: Escala de Inteligencia Wechsler para Preescolar y Primaria, tercera edición.
Se aplicó HT a 49 neonatos (84%) en los que se alcanzó una temperatura central diana de 33-34°C a una edad (mediana; p25-75) de 1; 1-4,2horas de vida. Nueve neonatos no fueron enfriados: 2 debido a su inestabilidad clínica para ser trasladados y 7 porque se les diagnosticó EHI leve, aunque los expertos a través de la revisión posterior de las filmaciones señalaron que mostraban EHI moderada. Todos los neonatos tratados con HT, excepto dos pacientes en coma, recibieron sedación durante la HT.
Catorce neonatos fallecieron (24%), a una edad (mediana; p25-75) de 22; 22-87horas posnatales; todos ellos en periodo neonatal salvo un paciente, que falleció a los 4meses. De los 14 fallecidos, 12 tenían EHI grave. En 10, el fallecimiento se produjo como consecuencia de decisiones de AET y en 4, por fracaso del tratamiento intensivo.
NeurodesarrolloLos 42 supervivientes, excepto 2, se evaluaron a una edad (mediana; p25-75) de 39,5; 38-42,3meses; 32 de ellos con los test Bayley-III y PPVT-3, 8 con los test WPPSI-III o WISC-IV y MABC-2, y 2 de ellos telefónicamente (fig. 1). Los 79 controles fueron evaluados con los test Bayley-III y PPVT-3, a una edad (mediana; p25-75) de 39; 37-41meses.
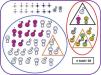
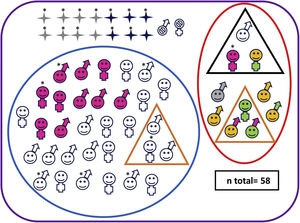
Diez de los 42 supervivientes con EHI moderada o grave (24%) presentaron evolución adversa (1/8 [12%] con EHI grave y 9/34 [26%]; p=0,655) (fig. 2 y tabla suplementaria 2), al igual que uno de los controles, que mostraba retraso del lenguaje.
Características neuroevolutivas de la cohorte completa.
Paciente fallecido sexo masculino Paciente vivo sexo masculino Paciente fallecido sexo femenino Paciente vivo sexo femenino Pacientes sin seguimiento Pacientes con evolución adversa Pacientes sin evolución adversa Pacientes con parálisis cerebral Pacientes con trastorno motor mínimo Test cognitivo patológico (Bayley-III cognitivo<85 y/o PPVT-3 <85 o WPPSI-III CIT<80 o WICS-IV CIT<80) Test motor patológico (Bayley-III motor total <85 o MABC-2 ≤ p15) Puntuaciones en rango clínico en una o varias áreas de CBCL (percentil> 97) Normalidad en todos los test de desarrollo y de comportamiento Paciente con hipoacusia severa no explicada por otra causa* Paciente con EHI grave.
Tres de los 10 niños con evolución adversa tenían PC, con deambulación independiente todos ellos: 2 tenían una disfunción motora de grado GMFCS-I y el otro, GMFCS-II (tabla 1).
Resumen de la información clínico-radiológica de los pacientes con trastorno motor (3 pacientes con parálisis cerebral y 6 con trastorno motor mínimo)
| Paciente | 1 | 2 | 3a | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|
| Evolución adversa | Sí | Sí | Sí | No | No | Sí | Sí | No | Sí |
| Tipo de trastorno motor | PC | PC | PC | TMM | TMM | TMM | TMM | TMM | TMM |
| BAYLEY-III | |||||||||
| CD cognitivo | 100 | 120 | 100 | 95 | 95 | 125 | 90 | ||
| CD motor | 103 | 121 | 100 | 103 | 70 | 110 | 85 | ||
| Puntuación escalar MF/MG | 16/5 | 16/11 | 10/10 | 11/10 | 5/5 | 15/8 | 9/10 | ||
| PPVT-III. CI | 113 | 116 | 102 | 105 | 103 | 96 | 57 | ||
| WISC-IV. CI total | 92 | ||||||||
| MABC-2. Percentil | 9 | ||||||||
| CBCL | |||||||||
| Impulsividad | p54 | p89 | p ≤ 50 | p54 | p69 | −g | p≤50 | p97 | |
| Ansiedad/depresión | p≤50 | p97 | p58 | p73 | p97 | p76 | p≤50 | p95 | |
| Somatización | p≤50 | p79 | p79 | p≤50 | p62 | p87 | p≤50 | p>97 | |
| Introversión | p≤50 | p90 | p73 | p84 | p90 | p58 | p≤50 | p>97 | |
| Problemas de sueño | p62 | p89 | p62 | p≤50 | p73 | −g | p ≤ 50 | p89 | |
| Inatención | p ≤ 50 | p49 | p76 | p89 | p76 | p62 | p54 | p96 | |
| Agresividad | p ≤ 50 | p49 | p69 | p54 | p58 | p54 | p ≤ 50 | p79 | |
| CBCL. DSMIV | |||||||||
| Problemas afectivos | p ≤ 50 | p84 | p58 | p54 | p58 | p58 | p54 | p>97 | |
| Ansiedad | p ≤ 50 | p>97 | p65 | p65 | p>97 | p90 | p ≤ 50 | p96 | |
| TGD | p58 | p97 | p ≤ 50 | p90 | p97 | p58 | p ≤ 50 | p>97 | |
| TDAH | p ≤ 50 | p ≤ 50 | p76 | p84 | p76 | p76 | p54 | p58 | |
| TOD | p54 | p ≤ 50 | p81 | p54 | p54 | p54 | p ≤ 50 | p81 | |
| Otros | −b | −b | −c | −d,e | −f | −d | − | −d | |
| RM PLT / SBxGB | 5/0 | 1/0 | 6/2 | 2/0 | 5/0 | 8/4 | 0/0 | 5/2 | 5/3 |
CBCL: Child Behaviour Checklist; CD: cociente de desarrollo. CI: cociente intelectual; MABC-2: Batería de Evaluación del Movimiento para Niños; MF: motor fino; MG: motor grueso; PC: parálisis cerebral; PLT: puntuación lesional total (0-11); PPVT-III: Peabody Picture Vocabulary Test; RM: resonancia magnética; SBxGB: producto de la lesional de sustancia blanca por ganglios de la base-tálamos (0-9). TDAH: trastorno por déficit de atención e hiperactividad; TGD: trastorno generalizado del desarrollo; TMM: trastorno motor mínimo; TOD: trastorno oposicionista desafiante; WISC-IV: Escala de Inteligencia de Wechsler para Niños.
Otros tres niños con evolución adversa fueron diagnosticados de TMM. Además, mostraban retraso del desarrollo motor (2 pacientes) o del lenguaje (1 paciente), así como puntuaciones patológicas en alguna área afectivo-conductual (2 pacientes) (tabla 1).
De los 32 supervivientes que no cumplieron criterios de evolución adversa, 3 fueron diagnosticados de TMM (tabla 1). Ninguno de los controles tuvo TMM.
Las puntuaciones medias en los test de desarrollo fueron significativamente inferiores en los pacientes con EHI comparados con los controles (tabla 2).
Comparación entre la población EHI y el grupo control de las puntuaciones medias de las diferentes áreas de desarrollo según los test Bayley-III y PPVT-III (n=32), y de las áreas en el test CBCL que mostraron diferencias estadísticamente significativas (n=38)
| Área de desarrollo | Cohorte EHIa | Grupo control (n=79) |
|---|---|---|
| CD cognitivo, media (DE) | 100,3 (11,5) | 105,1 (10,7) |
| CD motor global, media (DE) | 103,4 (14,1) | 107,9 (8,8) |
| CI lenguaje, media (DE) | 100,9 (16,4) | 108,2 (9,7) |
| CBCL introversiónb, n/N (%) | 4/38 (10,5) | 1/77 (1,3) |
| CBCL ansiedadc, n/N (%) | 13/38 (34,2) | 9/77 (11,7) |
| CBCL depresiónc, n/N (%). | 11/38 (28,9) | 6/77 (7,8) |
CBCL: Child Behaviour Checklist; CD: cociente de desarrollo; CI: cociente intelectual; DE: desviación estándar; EHI: encefalopatía hipóxico isquémica; PPVT-III: Peabody Picture Vocabulary Test.
Aunque la prevalencia global de problemas conductuales y emocionales en rango clínico (p>97) no fue estadísticamente diferente ente los niños con EHI y los controles, al analizar cada área individualmente se observó más introversión (p=0,04) en los pacientes con EHI. Además, al considerar las puntuaciones en rango límite (p93-p97), los pacientes con EHI presentaban más problemas de depresión y ansiedad que el grupo control (p<0,05) (tabla 2). Así mismo, los pacientes con EHI con evolución favorable, mostraron más problemas de depresión (8/30 [27%]) que los controles (6/77 [8%]; p=0,021) y mayores problemas de ansiedad (10/30 [33%]) que los controles (9/77 [12%]; p=0,008). No se encontraron diferencias en las variables de comportamiento de la cohorte con EHI, entre el grupo con evolución adversa y el grupo con evolución favorable (p=0,693), ni tampoco entre el grupo con TMM y sin TMM (p=1).
Se analizó si el seguimiento del grupo de 9 pacientes con EHI moderada sin HT se comportó diferente frente al grupo de 29 pacientes con EHI moderada enfriados, y no se encontraron diferencias ni en la evolución adversa (p=0,403) ni en el pronóstico desfavorable (p=0,388). Tampoco se identificaron diferencias en la evolución adversa cognitiva (p=1), ni en la presencia de PC o TMM (p=0,160), ni en la presencia de alteraciones en el comportamiento (p=0,372). Estos datos deben tomarse con precaución debido al número bajo de pacientes no enfriados.
Hallazgos de RM y neurodesarrolloLa PLT en la RM y el producto SBxGB fueron significativamente mayores, tanto en los niños con TMM o TMM/PC en comparación con aquellos con evolución motora normal, así como en los niños fallecidos o con evolución adversa frente a los supervivientes con un neurodesarrollo normal (tablas 3 y 4).
Relación entre las puntuaciones de RM y el neurodesarrollo
| Muerte o EA | EA | TMM/PC | EA motora | EA cognitiva | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Sí | No | Sí | No | Sí | No | Sí | No | Sí | No | |
| n | 12 | 27 | 9 | 27 | 9 | 27 | 6 | 30 | 4 | 32 |
| PTL, mediana (RIC) | 5 (0,3;7,8) | 1 (0;2)a | 3 (0;5,5) | 1 (0;2) | 5 (1,5;5,5) | 1 (0;2)a | 3 (0;6,5) | 1 (0;3,3) | 2,5 (0;5,8) | 1 (0;3,8) |
| SBxGB, mediana (RIC) | 1 (0; 3,8) | 0 (0;0)a | 0 (0;2,5) | 0 (0;0) | 0 (0; 2,5) | 0 (0;0)b | 0 (0;2,5) | 0 (0; 0) | 1 (0;2,8) | 0 (0; 0) |
EA: evolución adversa; PTL: puntuación total lesional (0-11); RIC: rango intercuartílico (P25; P75); SBxGB: producto de las lesiones de sustancia blanca por ganglios de la base-tálamos (0-9); TMM/PC: trastorno motor mínimo/parálisis cerebral infantil.
Puntos de corte (curva ROC) con sus valores predictivos
| Muerte o EAn/N=12/39 | EAn/N=9/36 | TMM/PCn/N=9/36 | EA motoran/N=6/36 | EA cognitivan/N=4/36 | |
|---|---|---|---|---|---|
| PTL | |||||
| Punto corte | 6 | 6 | 5 | 6 | 6 |
| AUC (IC 95%) | 0,72 (0,55-0,85) | 0,63 (0,45-0,78) | 0,813 (0,65-0,92) | 0,62 (0,45-0,78) | 0,54 (0,37-0,71) |
| S (IC 95%) | 41,7 (19,3-68) | 22,2 (6,3-54,7) | 66,7 (35,4-87,9) | 33,3 (9,68-70) | 25,0 (4,56-69,9) |
| E (IC 95%) | 96,3 (81,7-99,3) | 96,3 (81,7-99,3) | 92,6 (76,6-97,9) | 96,7 (83,3-99,4) | 93,8 (79,9-98,3) |
| VPP | 83,3 (43,6-97,0) | 66,7 (20,8-93,9) | 75 (40,9-92,9) | 66,7 (20,8-93,9) | 33,3 (6,15-79,2) |
| VPN | 78,8 (62,2-89,3) | 78,8 (62,2-89,3) | 89,3 (72,8-96,3) | 87,9 (72,7-95,2) | 90,9 (76,4-96,9) |
| SBxGB | |||||
| Punto corte | 2 | 3 | 3 | 4 | 3 |
| AUC (IC 95%) | 0,68 (0,52-0,82) | 0,59 (0,42-0,75) | 0,66 (0,48-0,81) | 0,58 (0,40-0,74) | 0,66 (0,48-0,81) |
| S (IC 95%) | 50 (25,4-74,6) | 22,2 (6,3-54,7) | 22,2 (6,3-54,7) | 16,7 (3-56,4) | 25,0 (4,6-69,9) |
| E (IC 95%) | 81,5 (63,3-91,8) | 96,3 (81,7-99,3) | 96,3 (81,7-99,3) | 100 (88,6-100) | 93,8 (79,9-98,3) |
| VPP | 54,5 (28-78,7) | 66,7 (20,8-93,9) | 66,7 (20,8-93,9) | 100 (20,7-100) | 33,3 (6,15-79,2) |
| VPN | 78,6 (60,5-89,8) | 78,8 (61,9-88,3) | 78,8 (62,2-89,3) | 85,7 (70,6-93,7) | 90,9 (76,4-96,9) |
AUC: área bajo la curva; E: especificidad; EA: evolución adversa; PTL: puntuación lesional total; S: sensibilidad; SBxGB: producto de la lesional de sustancia blanca por ganglios de la base-tálamos (0-9); TMM/PC: trastorno motor mínimo/parálisis cerebral infantil; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La PLT mostró una buena capacidad para predecir TMM/PC (AUC: 0,8127) y resultado desfavorable (muerte o evolución adversa, AUC: 0,7191). La PLT ≥7 predijo muerte o evolución adversa con un VPP del 100%, mientras que la PLT <3 tuvo un VPN del 84%. Una PLT ≤5 tuvo un VPN del 89% para predecir la ausencia de trastorno motor.
No se encontraron correlaciones significativas entre las puntuaciones de los hallazgos de neuroimagen y los resultados en los dominios cognitivo o del lenguaje; sin embargo, a mayor puntuación en el producto SBxGB, menor puntuación en la escala motora del test de Bayley-III (rs=−0,465; p=0,014).
Variables neonatales y neurodesarrolloSe examinó el valor predictivo sobre la evolución neurológica de tres variables neonatales: la presencia de crisis neonatales clínicas y/o eléctricas, el trazado de aEEG patológico (bajo voltaje, brote supresión o plano) y la variable «alcanzar la temperatura diana después de las 3horas de vida». Los VPN se mostraron adecuados, por encima del 80% en la mayoría de los resultados (tabla suplementaria 3).
DiscusiónEl porcentaje de niños supervivientes sin secuelas neurológicas en este estudio multicéntrico fue superior a lo referido en los pacientes tratados con HT en los ensayos clínicos aleatorizados (ECA)1,3,24, pero similar a los porcentajes encontrados en estudios observacionales contemporáneos4,15,25,26. El 21,4% de los pacientes de esta cohorte presentaron alteraciones motoras (PC o TMM), pero el 7,1% fueron clasificados como PC, porcentaje inferior al encontrado tanto en pacientes enfriados dentro de los ECA (26-36%)1,3,27, como en las series observacionales contemporáneas (12-17%)5,7,25,26,28,29. Además, los pacientes con PC de este estudio presentaron mejor capacidad funcional, ya que ninguno tuvo afectación motora GMFCS-III o superior, a diferencia de otras cohortes en las que los pacientes con PC muestran una afectación más grave (tabla 5).
Resumen de los resultados motores funcionales en pacientes con parálisis cerebral evaluados según el Sistema de Clasificación de la Función Motora Gruesa (GFMCS) extraídos de la literatura que incluye los ensayos clínicos aleatorizados (ECA) y estudios observacionales de pacientes que recibieron hipotermia terapéutica
| Primer autorPeriodo de reclutamientoRegión del estudio | Tipo de estudio | Edad de seguimiento | PC n/N (%) | PC GMFCS III-V | PC GMFCSn/N (%) |
|---|---|---|---|---|---|
| Azzopardi D.12002-2006Reino Unido | ECA | 18 meses | 33/120 (28) | Sí | GMFCS I-II: 11/120 (9)GMFCS III-V: 24/120 (20) |
| Jacobs S.32001-2007Australia/Nueva Zelanda/Canadá/EE.UU. | ECA | 24 meses | 21/79 (26,6) | Sí | GMFCS I:5/79 (6,3)GMFCS II-V: 16/79 (20,3) |
| Simbruner G.402001-2006Alemania/Austria/Sudáfrica/Bélgica/Francia/Singapur/Italia/ Dinamarca | ECA | 18-21 meses | DND | Sí | GMFCS III-V: 4/32 (12,5) |
| Guillet R.271999-2002USA/Reino Unido/Canadá/Nueva Zelanda | ECA | 18 meses | 49/135 (36,3) | Sí | GMFCS I-II: 17/135 (12,6)GMFCS III-V: 32/135 (23,7) |
| Jary S.52006-2012Bristol | Observacional | 18-24 meses | 18/93 (19,4) | Sí | GMFCS I:12/93 (13)GMFCS V:6/93 (6,4) |
| Garfinkle J.252008-2010Canadá | Observacional | 24 meses | 4/26 (15) | Sí | GMFCS II-V: 4/26 (15) |
| Grossmann K.292007-2009Suecia | Observacional | 6-43 meses | 10/59 (17) | Sí | GMFCS I-II: 5/59 (8,4)GMFCS III-V: 5/59 (8,4) |
| Cohorte Hortigüela M, et al.2011-2017España | Observacional | 36 meses | 3/42 (7,1) | No | GMFCS I-II: 3/42 (7,1)GMFCS III-V: 0/42 (0) |
DND: dato no disponible: este estudio40 solo registra las PC con GMFCS III-V. PC: parálisis cerebral.
Aunque las razones de esta mejoría no se conocen con claridad, una de las hipótesis es el inicio actual más temprano de la HT junto con el uso rutinario de sedación y la estricta monitorización y corrección de los distintos factores que pueden agravar el daño hipóxico-isquémico, como son la hipoglucemia y la hipocarbia30-32.
El 14,2% de nuestros pacientes tenían TMM. Esta condición clínica podría corresponder a una presentación menos grave de afectación motora como resultado de la HT. La mitad de los pacientes de este grupo presentaban además retraso en el neurodesarrollo, hallazgo observado en otros estudios y que apoyaría esta hipótesis7,33.
Los pacientes de esta cohorte con EHI moderada o grave también presentaron menor tasa de retraso cognitivo en comparación con los pacientes que recibieron HT en los ECA1-3 y con aquellos procedentes de estudios observacionales recientes5,25,26,34,35. Es posible que esto sea secundario a la disminución de la afectación motora, pues ambas secuelas suelen presentarse asociadas en pacientes con EHI5,25,26. Sin embargo, las puntuaciones medias de cada área del desarrollo en esta cohorte fueron significativamente menores que las de los controles, similar a lo descrito por otros grupos8.
Los problemas de comportamiento ya fueron descritos en pacientes con EHI incluso antes de la introducción de la HT36,37. Tras la incorporación de este tratamiento han seguido detectándose, especialmente en estudios de pacientes sin PC7,8,28, en los que también se han identificado problemas de ansiedad y depresión7,28, similar a lo encontrado en nuestra cohorte. Estos hallazgos no deberían pasar desapercibidos, ya que los trastornos ansioso-depresivos aumentan la morbimortalidad global y empeoran la calidad de vida de los afectados38.
A pesar del bajo número de pacientes con secuelas, que limitó las posibilidades de análisis, nuestro estudio confirma la utilidad de la RM neonatal en la predicción de problemas del neurodesarrollo tras EHI neonatal15,39.
Otra limitación de nuestro estudio es el bajo número de pacientes con EHI grave, que además tuvieron una mortalidad neonatal del 60%, lo que impidió obtener datos sobre su neurodesarrollo.
Las principales fortalezas de este estudio son, por un lado, el reclutamiento de los pacientes siguiendo un programa de vigilancia sistemático con definiciones homogéneas en los hospitales participantes9. Y por otro lado, la elevada tasa de seguimiento y la evaluación estructurada por una misma examinadora de múltiples áreas del neurodesarrollo. Hubiera sido deseable, sin embargo, que el total de niños hubiesen sido evaluados a la misma edad, ya que el 20% fueron evaluados a una edad posterior. Este estudio es el primero en presentar resultados por áreas del neurodesarrollo a largo plazo en una población española de recién nacidos con EHI tratados con HT.
En conclusión, nuestros resultados sugieren que el descenso de la frecuencia de secuelas graves y la menor tasa de discapacidad en neonatos con EHI moderada o grave referida en cohortes de nuestro entorno también está ocurriendo en España.
Sin embargo, pese al descenso de secuelas graves, el neurodesarrollo de la población con EHI no puede equipararse al de la población control, ya que muestra puntuaciones medias inferiores en todas las áreas de desarrollo y una mayor frecuencia de alteraciones motoras y emocionales-conductuales. Por ello, los neonatos con EHI requieren un seguimiento riguroso y estandarizado, preferiblemente hasta la edad escolar, que incluya la detección de estos nuevos perfiles neuroevolutivos33.
Son necesarios más estudios de este tipo en nuestro país con el fin de obtener una adecuada radiografía de los problemas y de las necesidades actuales de los neonatos con EHI. Esto permitirá proporcionar una información pronóstica más precisa a las familias, así como planificar de manera más eficiente los programas de seguimiento y los recursos sociosanitarios y educativos que necesita esta población.
FinanciaciónFundación Ernesto Sánchez-Villares (N.° FESV9/2014).
Fundación Burgos para la investigación de la salud (N.° 1632).
BECA 5.° año de formación en Neurología Pediátrica concedida por la Sociedad Española de Neurología Pediátrica (SENEP).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Agradecemos a Dña. Sara Calvo (Fundación Burgos por la Investigación de la Salud) por el soporte estadístico.
Elena Pilar Gutiérrez. Unidad de Neonatología, Hospital Universitario de Salamanca, Salamanca, España.
Sonia Caserío. Unidad de Neonatología, Hospital Universitario Río Hortega, Valladolid, España.
María Pilar Jiménez. Unidad de Neonatología, Hospital Nuestra Señora de Sonsoles, Ávila, España.
Leticia Castañón. Unidad de Neonatología, Hospital Universitario de León, León, España.
Inés Esteban. Unidad de Neonatología, Hospital San Pedro, Logroño, España.
Miryam Hortelano. Unidad de Neonatología, Hospital General de Segovia, Segovia, España.
Natalio Hernández. Servicio de Pediatría, Hospital General de Zamora, Zamora, España.
Marisa Serrano. Unidad de Neonatología, Hospital Santa Bárbara, Soria, España.
Tere Prada. Unidad de Neonatología. Hospital El Bierzo, Ponferrada, León, España.
Pablo Diego. Servicio de Pediatría, Hospital Santiago Apóstol, Miranda de Ebro, Burgos, España.
Florentino Barbadillo. Servicio de Pediatría, Hospital Santos Reyes, Aranda de Duero, Burgos, España.
El diseño y los objetivos de este trabajo (sin sus resultados) han sido presentados como comunicación oral en la XL reunión anual de la Sociedad Española de Neurología Pediátrica (SENEP), celebrada en Madrid del 25 al 27 de mayo de 2017, siendo agraciada como Comunicación Premio.