Los defectos de la betaoxidación de los ácidos grasos son un grupo de metabolopatías, de herencia autosómica recesiva, en los cuales falla a nivel mitocondrial la utilización de los lípidos como sustrato energético. Los tejidos más afectados son el miocardio, el hígado y el músculo esquelético, de modo que la clínica típica es hipoglucemia hipocetósica en periodos de ayuno, miocardiopatía, hepatopatía y aumento de enzimas musculares1.
Se presenta el caso de un niño de 2 meses, sin antecedentes familiares de interés, que consultó por rechazo parcial de la alimentación, decaimiento y dificultad respiratoria de 3 días de evolución. Afebril. No refería procesos infecciosos previos. Como único antecedente personal, destacaba un ingreso en las primeras 24h de vida por pérdida de bienestar fetal, en que presentó una hipoglucemia asintomática (42mg/dl), que remontó con fluidoterapia.
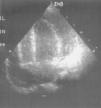
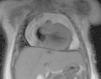
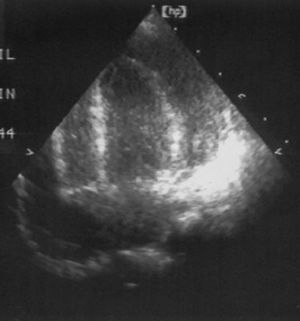
A la exploración física, el paciente tenía moderada afectación del estado general, signos de hipoperfusión periférica, tiraje subcostal, tonos cardíacos apagados y hepatomegalia de 4cm. Constantes vitales mantenidas. Se solicitó radiografía de tórax, que evidenció un aumento del tamaño cardiaco. A nivel electrocardiográfico, se observó una alteración inespecífica de la repolarización y disminución del voltaje. Mediante ecocardiografía, se diagnosticó de derrame pericárdico severo (20mm), con leve hipertrofia miocárdica y función cardíaca mantenida (fig. 1). Una hora después, aparecen signos de taponamiento cardíaco y shock cardiogénico por lo que se realizó pericardiocentesis evacuadora, con extracción de 100ml.
En la analítica existe un aumento de las transaminasas (GOT 278UI/l, GPT 210UI/l) y enzimas musculares (CK 20.358UI/l, CK-Mb>500ng/ml. Troponina T 1,30ng/ml) con acidosis metabólica, (pH 7,20 pCO2 44,6mmHg, HCO3 18mmol/l, ácido láctico 6mmol/l, EB- 8,8mmol/l). La glucemia y sedimento de orina fueron normales. Con esto, se sospechó una pericarditis viral. Se envió muestra de líquido pericárdico, sangre y moco nasal para estudio microbiológico, se inició tratamiento con ácido acetilsalicilíco y se mantuvo a dieta con fluidoterapia. El cuadro de derrame pericárdico empeoró en los días sucesivos, siendo necesarias pericardiocentesis de repetición cada 12–24h. Se constata una hipertrofia biventricular de predominio septal, presente desde el día después del ingreso, que aumenta paulatinamente.
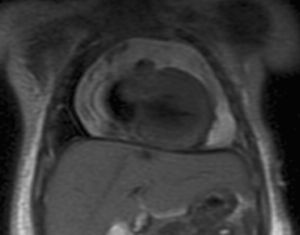
Ante la negatividad de los estudios microbiológicos y con sospecha de probable etiología metabólica por detección de hipocarnitinemia, se añadió carnitina al tratamiento (100mg/kg/d) a las 48h y un día después glucocorticoides e inmunoglobulinas. En el examen anatomopatológico del líquido pericárdico, se dudó sobre la existencia de células tumorales. Se realizó RNM, que no evidenció ninguna masa tumoral (fig. 2).
No hubo respuesta clínica favorable a las medidas adoptadas. En el quinto día del ingreso, evoluciona a insuficiencia cardíaca con necesidad de tratamiento diurético e inotropo. Se realizó una ventana pleuropericárdica para evitar las pericardiocentesis seriadas.
En el octavo día, aumentó la inestabilidad hemodinámica y empeoramiento del estado general, secundario a sepsis por Pseudomona Aeruginosa. A pesar de tratamiento antibiótico adecuado, el niño falleció 48h después.
Los estudios microbiológicos, hormonales y reumatológicos fueron negativos. Postmortem, se obtuvieron los resultados del estudio de metabolopatías. Los niveles de carnitina en sangre estaban muy disminuidos. Por espectrometría de masas en tandem, se confirmó un aumento de las acilcarnitinas en suero, compatible con un déficit de 3 hidroxiacil CoA deshidrogenada de cadena larga (LCHAD). El diagnóstico se confirmó por estudio genético del paciente y de los padres, siendo ambos portadores de la mutación c.1528G>C del gen HADHA.
La forma de debut más habitual de la LCHAD es la hipoglucemia hipocetósica con acidosis metabólica2. Durante el ingreso, no se constató hipoglucemia, probablemente debido al inicio precoz de aportes de glucosa intravenosa. La alteración cardíaca más frecuente en la LCHAD es la miocardiopatía hipertrófica, como se observó evolutivamente en el paciente, seguida de la miocardiopatía dilatada y las arritmias3. El derrame pericárdico como síntoma prínceps del LCHAD es excepcional y de ahí se deriva el interés del caso presentado; sí ha sido descrito en dos casos asociados al defecto de la beta-OAG de cadena muy larga4,5.
La mortalidad de estos pacientes en la fase aguda es del 50%6. Posteriormente, pueden evolucionar favorablemente y revertir sus lesiones con un tratamiento adecuado. Durante las crisis, es fundamental asegurar unos aportes de glucosa adecuados para evitar el catabolismo endógeno. Se debe evitar la administración de ácidos grasos de cadena larga y aconsejar una dieta hipograsa enriquecida con triglicéridos de cadena media. No se han evidenciado efectos beneficiosos del uso de carnitina, por lo que es controvertida su utilización6–8. Se recomienda evitar fármacos que consumen carnitina (ácido valproico, salicilatos, paracetamol) y con efecto lipolítico (adrenalina).