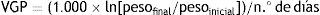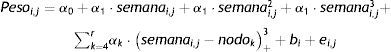La restricción posnatal del crecimiento es considerada un problema universal en recién nacidos extremadamente prematuros (RNEP), generando gran preocupación debido a la posible relación entre nutrición, crecimiento posnatal subóptimo y alteraciones del neurodesarrollo.
ObjetivosDescribir la evolución de la ganancia posnatal de peso en RNEP y conocer los cambios en la longitud y el perímetro craneal (PC) al alta hospitalaria en los supervivientes.
Pacientes y métodosSe estudió a 4.520 RNEP de raza blanca, de gestaciones únicas y sin malformaciones, nacidos en los centros participantes en la red española SEN1500 (2002-2011). El peso se registró al nacimiento, 28 días, 36 semanas de edad posmenstrual y al alta hospitalaria. La longitud y el PC se estudiaron al nacimiento y al alta.
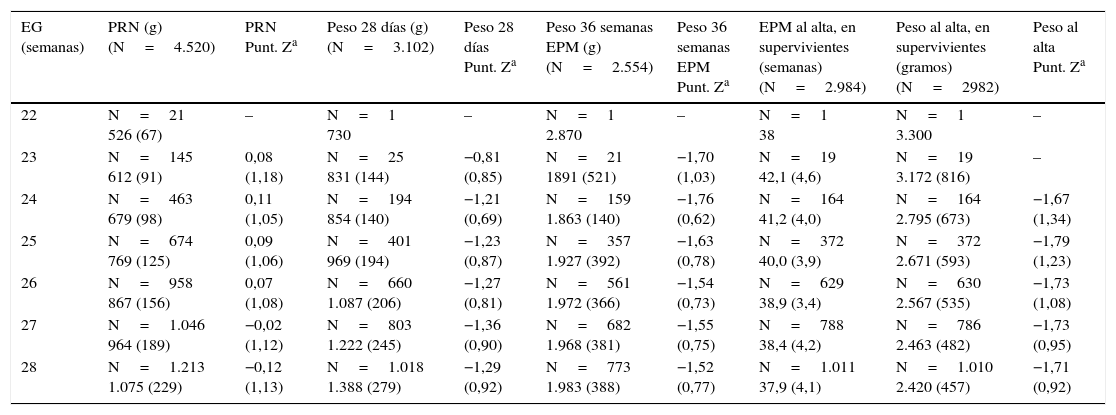
ResultadosLa velocidad de ganancia ponderal fue de 8,0g/kg/día (nacimiento-28 días); 14,3g/kg/día (28 días-36 semanas), y 11,7g/kg/día (36 semanas-alta hospitalaria). Al alta, la restricción posnatal del crecimiento fue mayor para la longitud (z-score entre −1,78 y −2,42, en función de la edad gestacional), seguida del peso (−1,67 a −1,79) y, finalmente, el PC (−0,69 a −0,81).
ConclusionesLos RNEP presentan una velocidad de ganancia ponderal lenta en las primeras semanas tras el nacimiento y una restricción posnatal del crecimiento que afecta en mayor grado a la longitud y al peso. Además del peso, un control estrecho del crecimiento longitudinal y del PC es fundamental para la valoración nutricional y la detección de pacientes de riesgo respecto al crecimiento y el neurodesarrollo tras el alta hospitalaria.
Postnatal growth restriction is considered a universal problem in extremely premature infants (EPI), and causes great concern due to the possible relationship between nutrition, sub-optimal postnatal growth, and neurodevelopment delay.
ObjectivesTo describe the weight gain in EPI and to determine the changes in the length and head circumference (HC) at hospital discharge in survivors.
Patients and methodsThe study included 4,520 Caucasian EPI from single pregnancies and without severe malformations, born in the centres participating in the Spanish SEN1500 network (2002-2011). The weight was recorded at birth, 28 days, 36 weeks post-menstrual age (PMA), and at discharge. The length and HC were measured at birth and at discharge.
ResultsThe rate of weight gain (exponential method) was 8.0g/kg/d (birth - 28 days); 14.3g/kg/d (28 days - 36 weeks); and 11.7g/kg/d (36 weeks - discharge). At discharge, postnatal growth restriction was greater for length (z-score between −1.78 and −2.42, depending on GA), followed by weight (−1.67 to −1.79), and HC (−0.69 to −0.81).
ConclusionsWeight gain in the first weeks after birth is slow in EPI, and they exhibit an almost universal postnatal growth restriction that involves mainly length and weight. In addition to weight, a close control of longitudinal growth and HC are essential for nutritional assessment and detection of patients at risk for poor growth and neurodevelopment after hospital discharge.
La restricción posnatal del crecimiento ha sido señalada como un problema universal en el recién nacido (RN) de muy bajo peso (RNMBP), independientemente del nivel o la categoría del centro donde se produzca el nacimiento1,2. Habitualmente, el crecimiento en la infancia se controla mediante la comparación con tablas antropométricas percentiladas procedentes de grandes muestras de población. En el caso de niños prematuros, las curvas derivan, por regla general, de estudios transversales de medidas obtenidas tras el nacimiento a diferentes edades gestacionales (EG)3. De acuerdo con las recomendaciones del Comité de Nutrición de la Academia Americana de Pediatría, los cuidados y la nutrición óptimos tras el nacimiento deberían permitir a los prematuros crecer, tanto en lo que se refiere a los índices antropométricos como a la composición corporal, de manera similar a como lo hace intraútero un feto de la misma EG4. Sin embargo, este hecho es escasamente observado en la práctica clínica habitual, generando gran preocupación entre los profesionales acerca de la calidad de los cuidados y la nutrición proporcionados a los pacientes5,6. Gran parte de esta preocupación es debida a la posible relación entre nutrición, crecimiento posnatal subóptimo y alteraciones motoras y/o cognitivas en etapas posteriores de la vida7-10. Embleton et al. han señalado la inevitabilidad del retraso en el crecimiento posnatal de niños prematuros debido al retraso en alcanzar la cantidad de nutrientes diarios recomendados, así como a la dificultad para cubrir el déficit adicional acumulado durante ese tiempo, siendo esto más acusado en los niños más inmaduros y en los más graves11.
En nuestro país, Krauel Vidal et al.12 estudiaron el peso, la longitud y el perímetro craneal (PC) al nacimiento y al alta en una cohorte de RNMBP, ≤ 32 semanas de EG, nacidos en 55 unidades neonatales españolas durante los años 2002 y 2003. El hallazgo principal de este estudio fue la constatación de un enlentecimiento del crecimiento posnatal, puesto de manifiesto por la disminución de las puntuaciones Z para los 3 parámetros estudiados. La restricción fue más acusada para la longitud, seguida del peso, el cual fue inferior al percentil 10 en el 77% de los RN al alta. En otro estudio llevado a cabo recientemente también en nuestro país, con 5.470 RN de 22-26 semanas de EG13, se compararon los resultados en 2 periodos (2002-2006 vs. 2007-2011). Además de un incremento en la supervivencia y en la supervivencia sin morbilidad mayor, este estudio mostró un incremento significativo en el peso al nacimiento durante el segundo periodo (758,9±160,7 vs. 773,8±158,6g [p<0,001]), así como en los supervivientes a los 28 días (991±209 vs. 1.029±211g [p<0,001]) y a las 36 semanas de edad posmentrual (EPM) (1.890±365 vs. 1.967±377g [p<0,001]). Estos datos indican una posible mejoría en el control prenatal, así como en los cuidados generales de los RN y en las prácticas nutricionales tras su ingreso en las unidades neonatales. No obstante, el patrón de crecimiento posnatal de los RN extremadamente prematuros (RNEP) durante este periodo más reciente de tiempo no ha sido nuevamente examinado. Los objetivos de nuestro estudio fueron: 1) describir la evolución de la ganancia de peso posnatal en relación con la EPM en una cohorte contemporánea de RN españoles de ≤ 28 semanas de EG durante su estancia hospitalaria inicial, y 2) conocer los cambios en la longitud y el PC entre el nacimiento y el alta hospitalaria en los supervivientes.
Pacientes y métodoSe estudió una cohorte de 4.522 RN de raza blanca, con EG ≤ 28 semanas, procedentes de gestaciones de feto único y sin malformaciones, nacidos en los centros participantes en la Base de Datos española SEN1500 entre los años 2002-201114. El peso, la longitud y el PC al nacimiento, específicos por EG y sexo, ya fueron estudiados y sirvieron para la creación de nuevas curvas poblacionales de crecimiento intrauterino en RNEP españoles15. El presente estudio analiza la evolución posnatal del peso conforme a la EPM, teniendo en cuenta las mediciones del mismo en 4 puntos significativos: nacimiento, 28 días de edad cronológica, 36 semanas de EPM y alta hospitalaria. La longitud y el PC se estudian al nacimiento y al alta. Para la valoración del crecimiento se calcularon las puntuaciones Z utilizando como patrón de referencia los valores medios de ambos sexos para cada EG de las tablas de Olsen et al.3 que, entre las 23 y 28 semanas de EG, son los que más se aproximan a nuestros valores poblacionales y están disponibles hasta las 41 semanas. La puntuación Z se calculó como: (peso, longitud o PC del paciente – peso, longitud o PC medio para la misma EG según las curvas de referencia)/desviación estándar del patrón de referencia para la misma EG. La ganancia ponderal se examinó en 3 periodos: del nacimiento a los 28 días, de los 28 días a las 36 semanas de EPM y de las 36 semanas de EPM hasta el alta hospitalaria. Para el cálculo de la velocidad de ganancia ponderal (VGP, en g/kg/día) se utilizó el método exponencial, que ha mostrado una mayor exactitud respecto a la VGP real que los métodos de 2 puntos y que los modelos de regresión lineal, tanto si se calculan o normalizan respecto al peso inicial del periodo como al peso promedio del mismo16 y, a diferencia de estos, no se afecta por el bajo peso al nacimiento o la duración de la estancia hospitalaria17. Según este modelo, la VGP entre 2 periodos se estima según la siguiente ecuación:
Análisis de datos. Las variables cuantitativas se expresan como media y desviación estándar y las diferencias entre grupos de EG se calcularon mediante el análisis de la varianza (ANOVA). Respecto a los cambios en el tiempo de los pesos, se utilizaron modelos de efectos mixtos para datos longitudinales18 y para el cálculo estadístico y la generación de gráficos se utilizó el lenguaje de programación R19. Para esta parte del estudio, debido al menor número de observaciones en pacientes < 24 semanas de EG, los pacientes más inmaduros (22 a 24 semanas) se agruparon en «≤ 24 semanas». Se obtuvieron modelos separados para la siguiente clasificación: ≤ 24 semanas (n=629); 25 semanas (n=674); 26 semanas (n=958); 27 semanas (n=1.046), y 28 semanas (n=1.213). Todos los modelos tienen la forma:
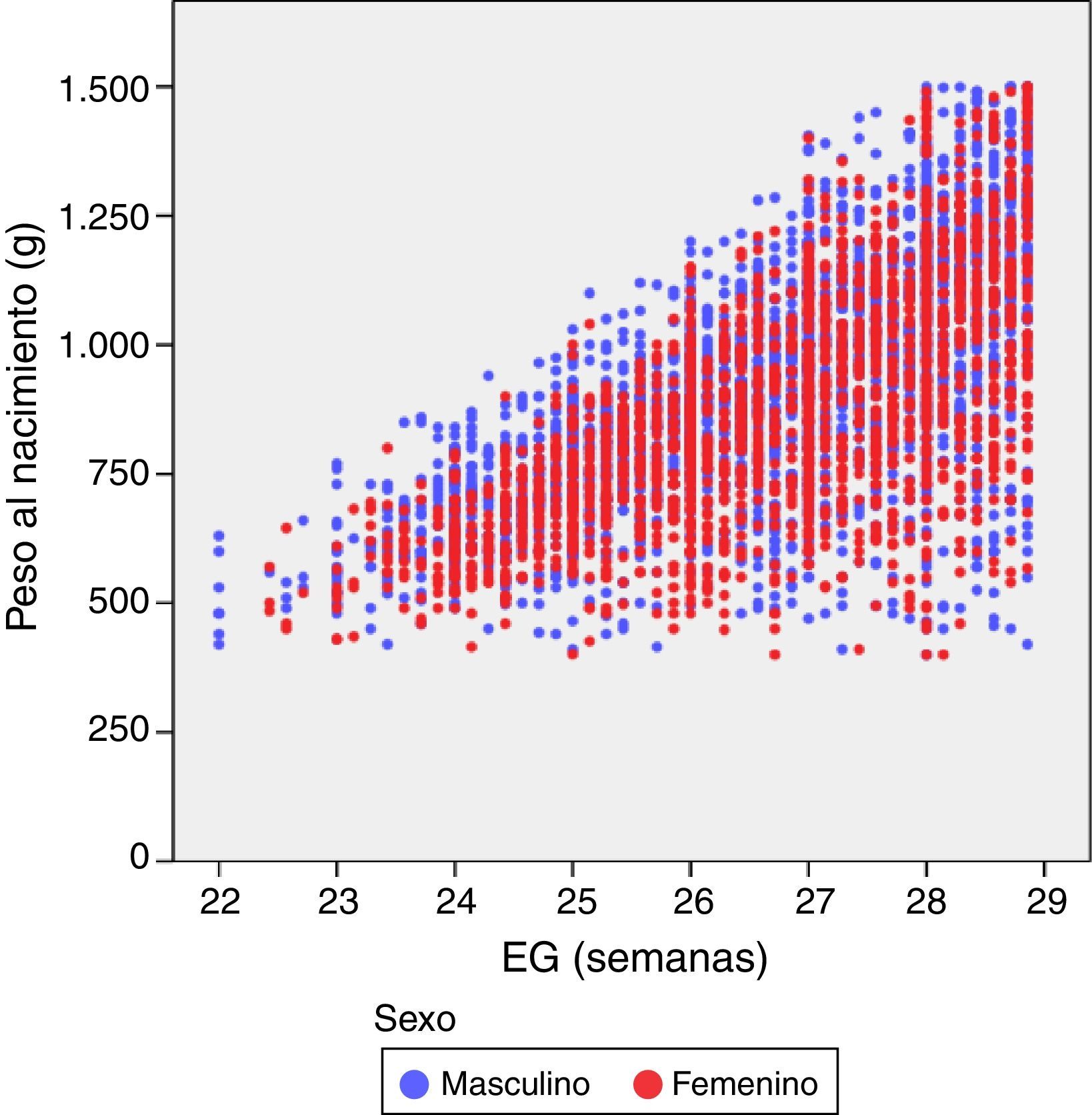
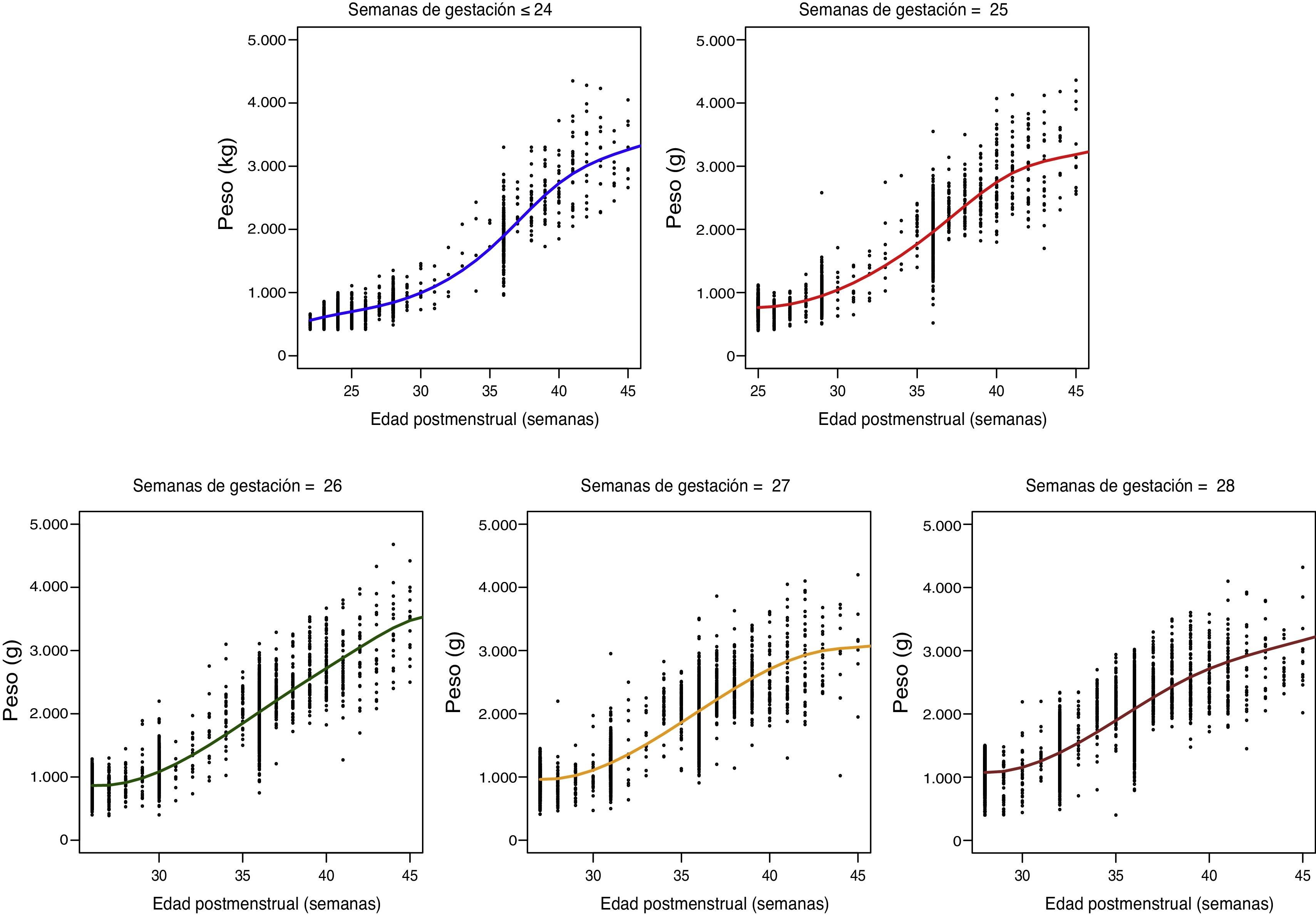
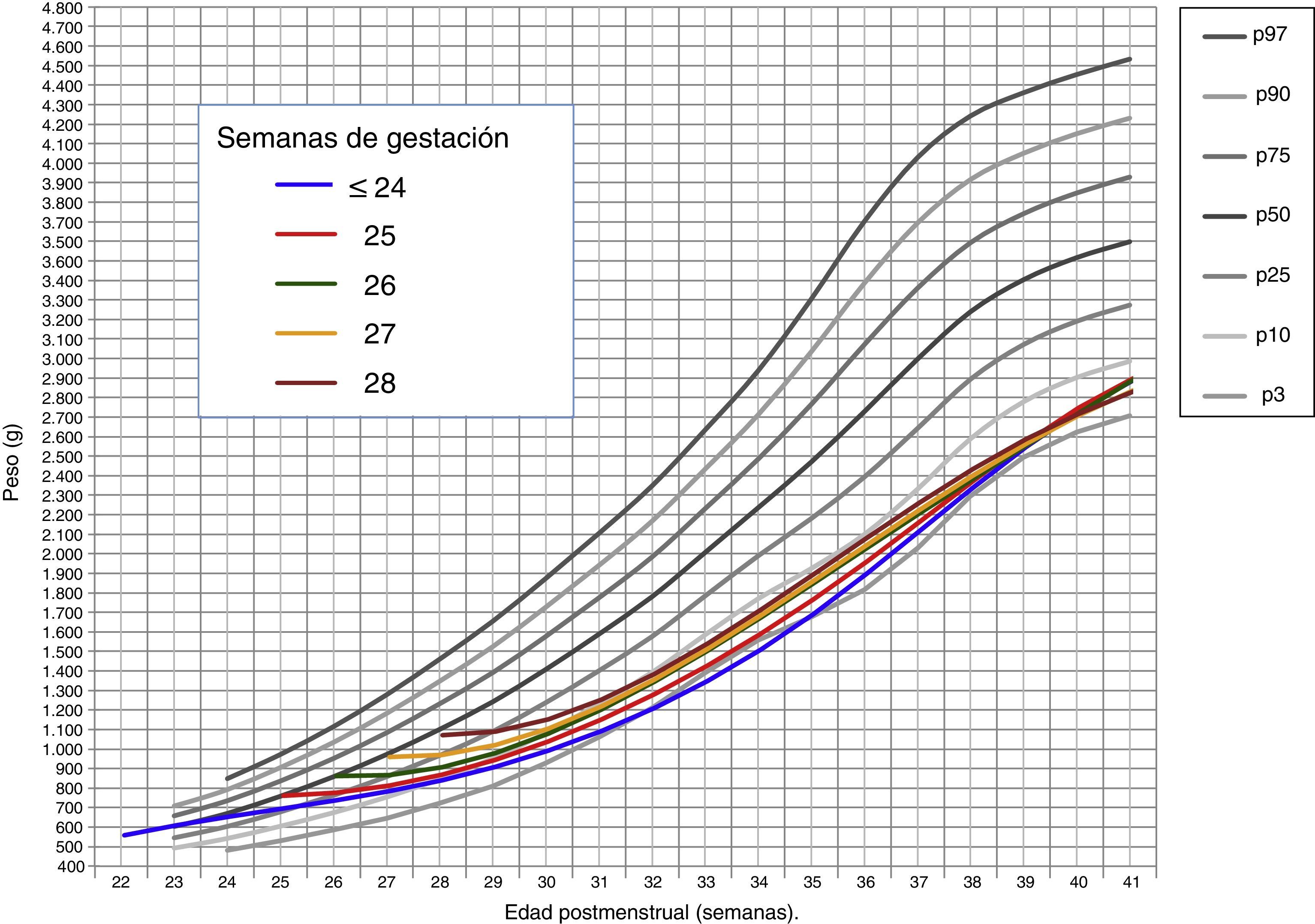
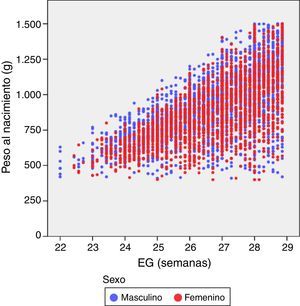
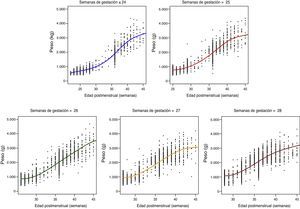
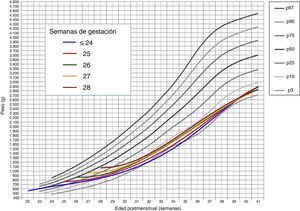
donde Pesoi,j denota el peso del i-ésimo niño en el control j, semanai,j es la semana posmenstrual, los parámetros αk representan los efectos fijos del modelo, la variable aleatorias bi es el efecto aleatorio del niño i-ésimo, ei,j su variabilidad interna y finalmente, nodok los nodos seleccionados para la construcción del spline. Aquí, z+ la parte positiva de z. El modelo se estimó bajo las suposiciones de que los efectos aleatorios bi eran independientes y con distribución N(0,σb2) y las variables aleatorias ei,j independientes entre ellas, independientes de bi y con distribución N(0,σe2).ResultadosDe los 4.522 pacientes de la cohorte original, 2 fueron excluidos por datos posnatales inválidos. La tabla 1 muestra el total de pacientes incluidos y el número total de mediciones de peso utilizadas en el cálculo y elaboración de las gráficas. De los 4.520 niños, 2.490 (55,1%) fueron varones y 2.030 (44,9%) mujeres. La distribución de pesos al nacimiento por sexos y EG se muestra en la figura 1. Las niñas pesaron por término medio un 5,6% menos que los niños (p<0,001). No obstante, para el análisis longitudinal del crecimiento se utilizaron los valores combinados de ambos sexos para cada EG (fig. 2). Esta figura muestra un patrón similar de crecimiento posnatal en todas las EG, con una fase lenta inicial desde el nacimiento hasta los 28 días de vida (VGP=8,0g/kg/día), una aceleración posterior entre los 28 días y las 36 semanas de EPM (VGP=14,3g/kg/día) y de nuevo una disminución hasta el alta hospitalaria (VGP=11,7g/kg/día). Durante los primeros 28 días, la VGP fue significativamente inferior en los RN más inmaduros, desapareciendo estas diferencias con la edad cronológica (tabla 2). La figura 3 muestra las curvas de ganancia ponderal media para cada EG desde el nacimiento hasta el alta hospitalaria, contrastadas con las tablas de Olsen et al.3 adaptadas. Puede apreciarse una curva inicial lenta con «pérdida» progresiva del percentil, pasando del p50 del nacimiento al p3 – 10 en las primeras semanas de vida posnatal. Este enlentecimiento es más prolongado en los RN más inmaduros, pero a partir de las 30-32 semanas las curvas tienden a concentrarse entre los percentiles 3-10 hasta el alta hospitalaria. La tabla 3 muestra los valores medios del peso para cada EG junto con la puntuación Z correspondiente en cada uno de los momentos estudiados. Al nacimiento, nuestros pacientes presentan una puntuación Z próxima a 0, lo que indica un valor similar al de las curvas de referencia. Posteriormente, a los 28 días las puntuaciones Z disminuyen en todas las EG alrededor de 1,25 puntos, lo que significa una restricción del crecimiento posnatal que se incrementa a las 36 semanas de EPM (alrededor de −1,6) y se mantiene hasta el alta (−1,7).
Número de sujetos y número mediciones de peso utilizadas en el análisis y elaboración de las curvas longitudinales de crecimiento por semanas completas de EG
| Edad gestacional | 22 | 23 | 24 | 25 | 26 | 27 | 28 | Total |
|---|---|---|---|---|---|---|---|---|
| Sujetos | 21 | 145 | 463 | 674 | 958 | 1.046 | 1.213 | 4.520 |
| Mediciones | 44 | 336 | 1.277 | 2.104 | 3.135 | 3.571 | 4.213 | 14.680 |
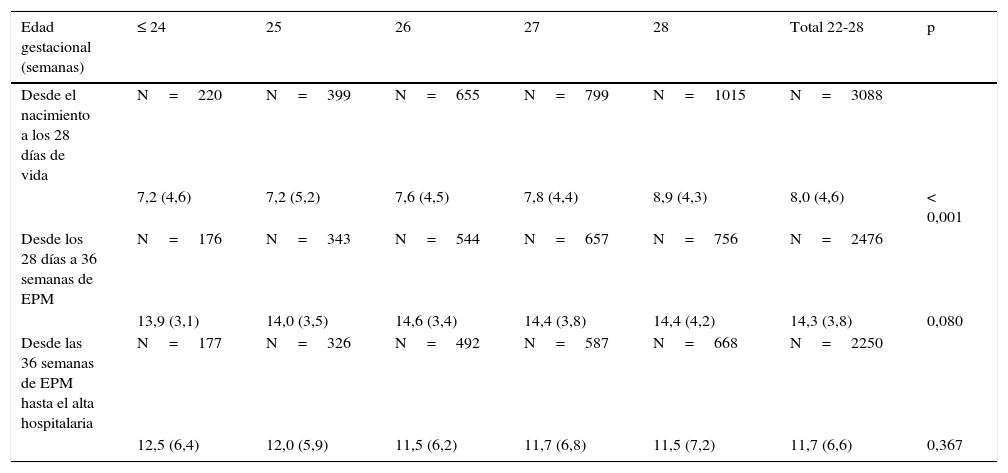
Velocidad de ganancia ponderal (eng/kg/día) por EG, en 3 tramos. Los cálculos están realizados por el método exponencial
| Edad gestacional (semanas) | ≤ 24 | 25 | 26 | 27 | 28 | Total 22-28 | p |
|---|---|---|---|---|---|---|---|
| Desde el nacimiento a los 28 días de vida | N=220 | N=399 | N=655 | N=799 | N=1015 | N=3088 | |
| 7,2 (4,6) | 7,2 (5,2) | 7,6 (4,5) | 7,8 (4,4) | 8,9 (4,3) | 8,0 (4,6) | < 0,001 | |
| Desde los 28 días a 36 semanas de EPM | N=176 | N=343 | N=544 | N=657 | N=756 | N=2476 | |
| 13,9 (3,1) | 14,0 (3,5) | 14,6 (3,4) | 14,4 (3,8) | 14,4 (4,2) | 14,3 (3,8) | 0,080 | |
| Desde las 36 semanas de EPM hasta el alta hospitalaria | N=177 | N=326 | N=492 | N=587 | N=668 | N=2250 | |
| 12,5 (6,4) | 12,0 (5,9) | 11,5 (6,2) | 11,7 (6,8) | 11,5 (7,2) | 11,7 (6,6) | 0,367 |
Todos los valores se presentan en media (desviación estándar).
Curvas de ganancia ponderal media para cada EG desde el nacimiento hasta el alta hospitalaria, contrastadas con las tablas de Olsen et al.3 adaptadas (peso medio ponderado de ambos sexos para cada EG).
Evolución del peso desde el nacimiento hasta el alta hospitalaria en RN extremadamente prematuros
| EG (semanas) | PRN (g) (N=4.520) | PRN Punt. Za | Peso 28 días (g) (N=3.102) | Peso 28 días Punt. Za | Peso 36 semanas EPM (g) (N=2.554) | Peso 36 semanas EPM Punt. Za | EPM al alta, en supervivientes (semanas) (N=2.984) | Peso al alta, en supervivientes (gramos) (N=2982) | Peso al alta Punt. Za |
|---|---|---|---|---|---|---|---|---|---|
| 22 | N=21 526 (67) | – | N=1 730 | – | N=1 2.870 | – | N=1 38 | N=1 3.300 | – |
| 23 | N=145 612 (91) | 0,08 (1,18) | N=25 831 (144) | −0,81 (0,85) | N=21 1891 (521) | −1,70 (1,03) | N=19 42,1 (4,6) | N=19 3.172 (816) | – |
| 24 | N=463 679 (98) | 0,11 (1,05) | N=194 854 (140) | −1,21 (0,69) | N=159 1.863 (140) | −1,76 (0,62) | N=164 41,2 (4,0) | N=164 2.795 (673) | −1,67 (1,34) |
| 25 | N=674 769 (125) | 0,09 (1,06) | N=401 969 (194) | −1,23 (0,87) | N=357 1.927 (392) | −1,63 (0,78) | N=372 40,0 (3,9) | N=372 2.671 (593) | −1,79 (1,23) |
| 26 | N=958 867 (156) | 0,07 (1,08) | N=660 1.087 (206) | −1,27 (0,81) | N=561 1.972 (366) | −1,54 (0,73) | N=629 38,9 (3,4) | N=630 2.567 (535) | −1,73 (1,08) |
| 27 | N=1.046 964 (189) | −0,02 (1,12) | N=803 1.222 (245) | −1,36 (0,90) | N=682 1.968 (381) | −1,55 (0,75) | N=788 38,4 (4,2) | N=786 2.463 (482) | −1,73 (0,95) |
| 28 | N=1.213 1.075 (229) | −0,12 (1,13) | N=1.018 1.388 (279) | −1,29 (0,92) | N=773 1.983 (388) | −1,52 (0,77) | N=1.011 37,9 (4,1) | N=1.010 2.420 (457) | −1,71 (0,92) |
Todos los valores se presentan como media (desviación estándar).
Las puntuaciones Z se calcularon respecto a los valores promedio combinados de ambos sexos en las tablas de Olsen et al.3.
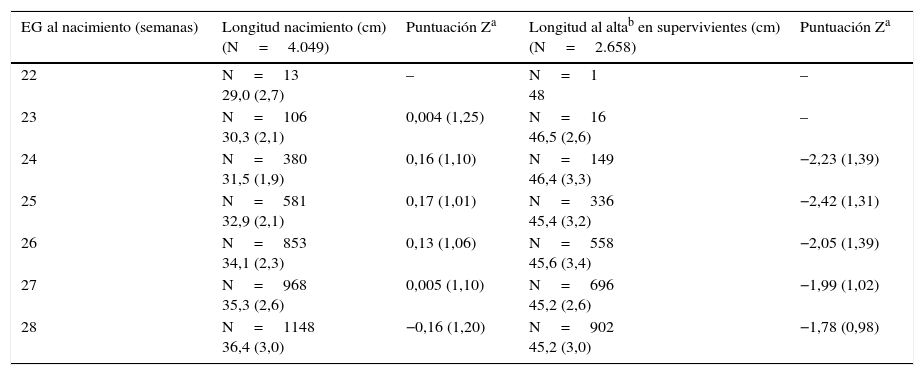
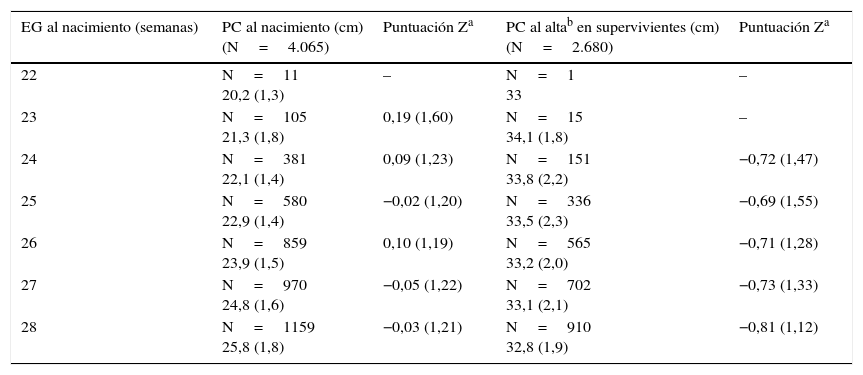
En el caso de la longitud y del PC, no pudimos obtener curvas evolutivas debido a la falta de registro de mediciones intermedias. En las tablas 4 y 5 se muestran los valores de la longitud y del PC al nacimiento y al alta con sus puntuaciones Z correspondientes. En ambos casos, los valores de las puntuaciones Z de nuestros pacientes al nacimiento son próximos a 0, es decir, se sitúan en el p50 respecto a las tablas de referencia. Sin embargo, en el momento del alta las puntuaciones Z para el PC disminuyen en torno a 0,7 puntos, lo que equivale aproximadamente al p25, y alrededor de 2 puntos para la longitud (≤ p3).
Longitud al nacimiento y al alta en RN extremadamente prematuros
| EG al nacimiento (semanas) | Longitud nacimiento (cm) (N=4.049) | Puntuación Za | Longitud al altab en supervivientes (cm) (N=2.658) | Puntuación Za |
|---|---|---|---|---|
| 22 | N=13 29,0 (2,7) | – | N=1 48 | – |
| 23 | N=106 30,3 (2,1) | 0,004 (1,25) | N=16 46,5 (2,6) | – |
| 24 | N=380 31,5 (1,9) | 0,16 (1,10) | N=149 46,4 (3,3) | −2,23 (1,39) |
| 25 | N=581 32,9 (2,1) | 0,17 (1,01) | N=336 45,4 (3,2) | −2,42 (1,31) |
| 26 | N=853 34,1 (2,3) | 0,13 (1,06) | N=558 45,6 (3,4) | −2,05 (1,39) |
| 27 | N=968 35,3 (2,6) | 0,005 (1,10) | N=696 45,2 (2,6) | −1,99 (1,02) |
| 28 | N=1148 36,4 (3,0) | −0,16 (1,20) | N=902 45,2 (3,0) | −1,78 (0,98) |
Todos los valores se presentan como media (desviación estándar).
PC al nacimiento y al alta en RN extremadamente prematuros
| EG al nacimiento (semanas) | PC al nacimiento (cm) (N=4.065) | Puntuación Za | PC al altab en supervivientes (cm) (N=2.680) | Puntuación Za |
|---|---|---|---|---|
| 22 | N=11 20,2 (1,3) | – | N=1 33 | – |
| 23 | N=105 21,3 (1,8) | 0,19 (1,60) | N=15 34,1 (1,8) | – |
| 24 | N=381 22,1 (1,4) | 0,09 (1,23) | N=151 33,8 (2,2) | −0,72 (1,47) |
| 25 | N=580 22,9 (1,4) | −0,02 (1,20) | N=336 33,5 (2,3) | −0,69 (1,55) |
| 26 | N=859 23,9 (1,5) | 0,10 (1,19) | N=565 33,2 (2,0) | −0,71 (1,28) |
| 27 | N=970 24,8 (1,6) | −0,05 (1,22) | N=702 33,1 (2,1) | −0,73 (1,33) |
| 28 | N=1159 25,8 (1,8) | −0,03 (1,21) | N=910 32,8 (1,9) | −0,81 (1,12) |
Todos los valores se presentan como media (desviación estándar).
Nuestro estudio, llevado a cabo con una amplia cohorte contemporánea de RNEP representativos de todas las áreas geográficas de nuestro país, muestra que, pese a los avances en los cuidados perinatales y las mejoras teóricas introducidas en la nutrición del gran prematuro, el crecimiento en las primeras semanas de vida fuera del útero materno es más lento que dentro del mismo. Aunque los puntos de medición de los pesos se establecieron de forma arbitraria, las curvas de VGP siguen un patrón sinusoidal, el cual podría tener una explicación en parte clínica y en parte metodológica. Durante las primeras semanas de vida se observa una ganancia ponderal lenta, que podría corresponderse con un mayor consumo metabólico durante el periodo de adaptación a la vida extrauterina y las fases más graves de la patología aguda de los pacientes, así como con las dificultades reales o percibidas para la administración de una nutrición adecuada20. Durante esta fase, además, los RN más inmaduros, probablemente más graves, crecen de forma significativamente más lenta que los niños de mayor EG. Posteriormente, observamos una fase de aceleración, con una VGP desde los 28 días de vida hasta las 36 semanas de EPM que se aproxima al crecimiento fetal para una EG similar. Durante esta fase las diferencias entre EG desaparecen. Una posible explicación es que los datos recogidos durante este periodo corresponden a los supervivientes y, por tanto, pacientes menos graves, ya que los que fallecieron lo hicieron a una mediana (RIQ) de 5 (2-14,25) días. Sin embargo, a partir de las 36 semanas, los datos derivan de pacientes todavía ingresados, probablemente con más complicaciones y patología crónica, lo que podría justificar el nuevo enlentecimiento que observamos en la ganancia ponderal. En cualquier caso, estos datos incluyen a todos los pacientes disponibles en cada momento, por lo que el patrón de crecimiento longitudinal puede ser el reflejo de múltiples circunstancias, no sólo del soporte nutricional, sino también de factores genéticos, ambientales, gravedad clínica, complicaciones, etc. De hecho, se estima que aproximadamente un 50% de la varianza en el crecimiento posnatal temprano se debe a factores no nutricionales21,22. Un estudio reciente ha mostrado que los prematuros sanos ajustan su trayectoria de crecimiento posnatal en –0,8 puntuaciones z por debajo de su percentil de crecimiento intrauterino después de su adaptación fisiológica inicial, lo cual podría ser considerado como una transición natural de la trayectoria de crecimiento intrauterina a la extrauterina23.
Una curva ponderal «adecuada» suele ser considerada indicativa de un neonato sano. Sin embargo, en el caso de los prematuros no se conocen con certeza cuáles son las referencias óptimas, ni qué patrón de crecimiento conducirá a los mejores resultados posibles a largo plazo. El propio parto prematuro puede ser el resultado final de una gestación complicada, por lo que el RN podría tener un peso menor que el de un feto de la misma EG intraútero24. Además, el ambiente extrauterino supone un cambio drástico para el paciente que exige la puesta en marcha de múltiples mecanismos de adaptación con el consiguiente gasto metabólico y coste energético, al que hay que añadir la propia patología de la prematuridad que puede complicar el inicio y la continuidad de la alimentación tanto enteral como parenteral25. Por otra parte, es preciso señalar que la ganancia de peso en sí misma no es necesariamente un indicador de adecuada nutrición, ya que no implica que los cambios en la composición corporal sean los apropiados. En la práctica clínica, y en la mayoría de los estudios, no se discrimina entre la ganancia de peso magro o el incremento en la grasa corporal. Los modernos sistemas de pletismografía por desplazamiento de aire facilitan el análisis de la composición corporal y la calidad de la ganancia ponderal26,27, lo que junto con los datos antropométricos y el seguimiento clínico de los pacientes podría permitir un mejor conocimiento o aproximación a los patrones óptimos de crecimiento28. Un crecimiento acelerado podría dar lugar a la aparición de complicaciones metabólicas y cardiovasculares, mientras que un crecimiento excesivamente lento ha sido relacionado con peores resultados en el neurodesarrollo7-10,29. Hasta el momento actual, de hecho, ningún patrón de crecimiento ha mostrado ser superior a otros en cuanto a resultados en salud a medio o largo plazo. Algunos autores recomiendan no asignar a los pacientes como objetivo de ganancia ponderal el percentil del peso al nacimiento, sino el que corresponda al peso a las 2 o 3 semanas, es decir, una vez que la ganancia ponderal se ha estabilizado30.
La relación entre el crecimiento corporal y la evolución motora y cognitiva de los pacientes sigue siendo un aspecto controvertido. Se acepta que los RNEP son un grupo de alto riesgo tanto de restricción del crecimiento posnatal, como de resultados adversos en el neurodesarrollo31,32. Sin embargo, la relación causal entre ambos fenómenos y sus posibles mecanismos continúan siendo en gran parte desconocidos. Un estudio reciente ha mostrado que una ganancia ponderal en el cuartil más bajo entre los 7 y 28 días de vida no se asocia con alteraciones en el neurodesarrollo33, planteándose la posibilidad de que, en algunos casos, fuera el propio daño cerebral subyacente el responsable de la limitación del crecimiento. Kan et al. tampoco encontraron relación entre la restricción del crecimiento intrauterino y la situación neurológica a los 8 años34. En este estudio, además, el peso al nacimiento y los cambios posteriores no influyeron significativamente en el neurodesarrollo, mientras que un menor PC a los 2 y 8 años sí lo hizo. Los autores concluyen que las prácticas nutricionales actuales no afectan negativamente a la evolución neurológica de los niños muy prematuros, aunque su desarrollo somático durante la infancia sea menor que el de sus pares nacidos a término. En este mismo sentido, finalmente, estudios de suplementación nutricional tras el alta hospitalaria tampoco han podido demostrar un beneficio evidente en el crecimiento cefálico o en el neurodesarrollo35.
Un hallazgo interesante de nuestro estudio fue que la restricción en el crecimiento longitudinal posnatal fue mayor que la del peso y el PC. Este patrón de cambios antropométricos ha sido también observado por otros36,37, quienes han mostrado que dicho patrón persiste tras el alta hospitalaria. Este patrón es diferente del clásico observado con la desnutrición en que el peso se altera más que la talla y el PC. Este dato es importante toda vez que el crecimiento longitudinal refleja el incremento de masa magra y la acreción proteica, lo que a su vez es un índice del crecimiento de los órganos, entre ellos el cerebro, en el que dicho incremento se asocia a un aumento de la velocidad de procesamiento en RNPT38. Aunque el patrón de crecimiento longitudinal óptimo tampoco es completamente conocido, existen evidencias recientes de que su restricción se asocia a peores resultados cognitivos a largo plazo37,39,40.
Una limitación de nuestro estudio es que no se registraron de forma sistemática las prácticas relativas a la fluidoterapia y a la nutrición, por lo que no podemos establecer de forma definitiva su relación con el crecimiento posnatal. Sin embargo, una de sus fortalezas es el gran tamaño de la población estudiada y el gran número de unidades participantes, lo que hace que nuestros resultados reflejen las variaciones antropométricas tras el nacimiento de una gran cohorte de prematuros extremos contemporáneos y esto, a su vez, podría ser un reflejo de las prácticas clínicas actuales. Tampoco disponemos del seguimiento a largo plazo de esta cohorte de pacientes, por lo que no podemos determinar si existe alguna posible conexión, al menos desde un punto de vista epidemiológico, entre el patrón de crecimiento y el neurodesarrollo.
En conclusión, los RNEP presentan una VGP lenta en las primeras semanas tras el nacimiento que en parte podría ser explicada como un fenómeno de adaptación a la vida extrauterina. Tal vez los objetivos de crecimiento durante la estancia hospitalaria de los pacientes deberían situarse en los percentiles no del nacimiento, sino en los que se encuentre el paciente tras esta adaptación inicial. En cualquier caso, la valoración del crecimiento en función exclusivamente de la ganancia ponderal parece inapropiada. El control estrecho del crecimiento longitudinal y del PC es fundamental para la valoración nutricional y probablemente más importante que el peso para la detección de pacientes de riesgo respecto al crecimiento y neurodesarrollo tras el alta hospitalaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA todos los investigadores y coordinadores de la red neonatal SEN1500, presidente, vicepresidente y miembros del grupo de trabajo.
Complejo Hospitalario de Albacete (Andrés Martínez Gutiérrez); Hospital U. de Basurto (Alberto Pérez Legorburu); Hospital del Bierzo (María Teresa Prada); Hospital de Cabueñes (Rafael García Mozo); Hospital Carlos Haya (Tomás Sánchez Tamayo); Hospital General de Castellón (Ramón Aguilera Olmos); Hospital Central de Asturias (Belén Fernández Colomer); Hospital Clínic de Barcelona (Josep Figuera Aloy); Hospital Clínico San Carlos (Araceli Corredera Sánchez); Hospital de Cruces (Amaya Rodríguez Serna); Hospital U. de Donostia (M. Ángel Cortajarena Altuna); Hospital de Elche (Josep Mut Buigues); Hospital General de Cataluña (Laura Castells Vilella); Hospital G. de Granollers (Israel Anquela Sanz); Hospital Germans Trias i Pujol (W. Coroleu); Hospital de Getafe (Lucía Cabanillas Vilaplana); Hospital Infanta Margarita (José María Barcía Ruiz); Hospital de Jerez (Dolores Esquivel Mora); Hospital Juan Ramón Jiménez (José Ángel Morilla Sánchez); Hospital Juan XXIII (Mar Albújar); Hospital de León (Emilio Álvaro Iglesias); Hospital Miguel Servet (Segundo Rite Gracia); Corporació Parc Taulí (Juan Badia); Hospital San Juan de Déu (Martín Iriondo Sanz); Hospital San Pedro de Logroño (Inés Esteban Díez); Hospital San Pedro de Alcántara (Mª Jesús López Cuesta); Hospital de la Santa Creu i Sant Pau (Gemma Ginovart Galiana); Hospital Severo Ochoa (María José Santos Muñoz); Hospital Txagorritxu (María Mercedes Martínez Ayucar); Hospital Universitario Arnau de Vilanova (Eduard Solé Mir); Hospital Valme (Antonio Gutiérrez Benjumea); Hospital Virgen de la Concha (Víctor Marugán Isabel); Hospital U. Virgen de la Macarena (Mercedes Granero Asencio); Hospital Virgen de la Salud (Alicia de Ureta Huertas); Hospital U. Virgen de las Nieves (M. Fernanda Moreno Galdó); Hospital Xeral de Vigo (María Suárez Albo); Hospital Universitario de Valencia (Javier Estañ Capell); Hospital Universitario de Zaragoza (Purificación Ventura Faci); Hospital Universitario de Santiago (M. Luz Couce Pico); Hospital General de Burgos (Cristina de Frutos Martínez); Hospital General Universitario de Alicante (Miriam Salvador Iglesias); Hospital Universitario de Fuenlabrada (Laura Domingo Comeche); Hospital Universitario Gregorio Marañón (Amparo Rodríguez Herreras); Hospital Universitario La Paz (M. Dolores Elorza); Hospital Materno Infantil de Canarias (Lourdes Urquía Martí); Hospital Universitario de Canarias (Pedro A. Fuster Jorge); Hospital Universitario de San Cecilio (Eduardo Narbona); Hospital Universitari i Politècnic La Fe (Isabel Izquierdo Macián); Hospital Universitario Reina Sofía (Juana María Guzmán Cabañas); Hospital Universitario Río Hortera (M. Mar Montejo Vicente); Hospital Universitario de Salamanca (Pilar García González); Hospital Universitario Virgen del Rocío (Carmen Macías Díaz); Hospital Universitario Dexeus (Roser Porta); Scias-Hospital Barcelona (Silvia Martínez-Nadal). Hospital Josep Trueta (Alberto Trujillo); Complejo Hospitalario Universitario de Pontevedra (Javier Vilas González); Hospital Universitario de Ciudad Real (Miguel Ángel Cabezas); Hospital Puerta del Mar (Antonio Segado Arenas); Hospital Doce de Octubre (Carmen R. Pallás Alonso).
Parte de este trabajo fue presentado en el XXV Congreso de Neonatología y Medicina Perinatal de la Sociedad Española de Neonatología. Sevilla, mayo del 2015.
Los nombres de los hospitales e investigadores de la red neonatal SEN1500 están relacionados en el anexo 1.