La fiebre es motivo frecuente de consulta pediátrica y en menores de 3 meses su diagnóstico etiológico es difícil, siendo un grupo de pacientes con mayor tasa de infección bacteriana grave (IBG). Nuestro objetivo es encontrar un modelo predictivo de IBG en menores de 3 meses con fiebre sin foco.
MétodosSe estudió a los niños menores de 3 meses con fiebre sin foco ingresados, realizándose pruebas complementarias según protocolo clínico. Se analizaron además los criterios de Rochester de bajo grado de IBG. Se diseñó un modelo predictivo de IBG y cultivo positivo, incluyendo las siguientes variables en el modelo máximo: proteína C reactiva (PCR), procalcitonina (PCT) y cumplimiento o no de menos de 4 criterios de Rochester.
ResultadosSe incluyó a 702 sujetos; el 22,64% presentaba IBG y el 20,65% cultivos positivos. Los que presentaban IBG y cultivo positivo presentaron más leucocitos, neutrófilos totales, PCR y PCT. Se obtuvieron significación estadística en puntuación de Rochester menor de 4 y valores de PCR y PCT para IBG (área bajo la curva [ABC] 0,877) y para cultivos positivos (ABC 0,888). Con la regresión se obtuvieron unas fórmulas de predicción de IBG y cultivo positivo con sensibilidad del 87,7 y el 91%, especificidad del 70,1 y el 87,7%, CPP de 2,93 y 3,62 y CPN de 0,17 y 0,10, respectivamente.
ConclusionesLos modelos predictivos son válidos y mejoran discretamente la validez de los criterios de Rochester para cultivo positivo en menores de 3 meses ingresados con fiebre.
Fever is a common cause of paediatric admissions in emergency departments. An aetiological diagnosis is difficult to obtain in those less than 3 months of age, as they tend to have a higher rate of serious bacterial infection (SBI). The aim of this study is to find a predictor index of SBI in children under 3 months old with fever of unknown origin.
MethodsA study was conducted on all children under 3 months of age with fever admitted to hospital, with additional tests being performed according to the clinical protocol. Rochester criteria for identifying febrile infants at low risk for SBI were also analysed.
A predictive model for SBI and positive cultures was designed, including the following variables in the maximum model: C-reactive protein (CRP), procalcitonin (PCT), and meeting not less than four of the Rochester criteria.
ResultsA total of 702 subjects were included, of which 22.64% had an SBI and 20.65% had positive cultures. Children who had SBI and a positive culture showed higher values of white cells, total neutrophils, CRP and PCT. A statistical significance was observed with less than 4 Rochester criteria, CRP and PCT levels, an SBI (area under the curve [AUC] 0.877), or for positive cultures (AUC 0.888). Using regression analysis a predictive index was calculated for SBI or a positive culture, with a sensitivity of 87.7 and 91%, a specificity of 70.1 and 87.7%, an LR+ of 2.93 and 3.62, and a LR- of 0.17 and 0.10, respectively.
ConclusionsThe predictive models are valid and slightly improve the validity of the Rochester criteria for positive culture in children less than 3 months admitted with fever.
La fiebre es uno de los principales motivos de consulta pediátricos, entre un 10 y un 20% de las Urgencias1.
En pediatría, la fiebre cobra mayor relevancia dadas la peculiaridad de los pacientes, la ambigüedad sintomática con la que en muchas ocasiones se presentan infecciones graves y la ansiedad que ello conlleva en las familias y en los propios profesionales. Estos factores crecen de forma exponencial en lactantes de corta edad, especialmente menores de 3 meses, sujetos de este trabajo, en quienes el diagnóstico de potenciales infecciones bacterianas graves cobra mayores implicaciones terapéuticas y pronósticas.
La fiebre suele ser síntoma de una infección, pero en menores de 3 meses1 las causas no infecciosas tienen mayor importancia y el diagnóstico clínico suele ser difícil. Estos pacientes tienen una escasa respuesta febril, pero su presencia puede ser signo de enfermedad grave. Mención especial merece el grupo de los neonatos (menores de 4 semanas), considerado de alto riesgo, donde aproximadamente en 1/8 de los casos puede hallarse una infección bacteriana grave (IBG). Las bacterias más frecuentes en este grupo de edad son el estreptococo β-hemolítico del grupo B (Streptococcus agalactiae [S. agalactiae]), las enterobacterias (sobre todo Escherichia coli [E. coli]) y Listeria monocytogenes (L. monocytogenes).
El objetivo principal de este trabajo es encontrar un índice predictor de IBG en menores de 3 meses con fiebre sin foco, incluyendo el estado clínico y las pruebas complementarias con reactantes de fase aguda. Asimismo, establecer un punto de corte idóneo a partir del cual nos permita recomendar tratamiento antibiótico con bastante fiabilidad y promover un uso racional de antibioterapia empírica.
Sujetos y métodosEstudio prospectivo de 5 años de lactantes entre 0 y 3 meses que acuden al Servicio de Urgencias con fiebre ≥ 38°C sin foco, en quienes, según protocolos de Urgencias, basados en las recomendaciones de la Asociación Española de Pediatría, se realizan pruebas complementarias con bacteriología, y que ingresan en planta. Se consideró fiebre sin foco de corta evolución aquella cuyo origen no se descubre tras una historia y una exploración física (EF) cuidadosas, y con una evolución inferior a 72 h. Basados en los protocolos clínicos, dado el diagnóstico de IBG, todos los pacientes recibieron tratamiento antibiótico.
A todos se les realizó hemograma con PCR, PCT y recogida de bacteriología: hemocultivo, urocultivo (por sondaje), coprocultivo (si presentaban síntomas gastrointestinales), así como estudio del líquido cefalorraquídeo (según protocolo), 302 casos, el 43,01% de los mismos.
Se consideró IBG las siguientes1: infección de vías urinarias, bacteriemia oculta, meningitis, neumonía, enteritis bacteriana, artritis séptica, osteomielitis e infecciones de tejidos blandos.
También evaluamos los criterios de Rochester, los originales, con la inclusión de parámetros analíticos, dándose un punto por cada una de las determinaciones analíticas cumplidas y otro si cumplían los datos de la anamnesis y EF.
Los criterios de Rochester fueron los siguientes:
- 1.
Temperatura ≥ 38°C.
- 2.
Anamnesis:
- a.
Recién nacido a término.
- b.
Sin antibióticos perinatales.
- c.
Sin enfermedad de base.
- d.
Sin hospitalización mayor que la madre.
- a.
- 3.
EF: buen estado general, sin signos de infección focal.
- 4.
Datos analíticos:
- a.
Leucocitos: 5.000-15.000 mm3.
- b.
Neutrófilos<1.500.
- c.
Sedimento urinario con ≤ 10 l/campo.
- a.
Como criterios de exclusión se establecieron los siguientes:
- –
Cardiopatía.
- –
Inmunodeficiencia primaria o secundaria.
- –
Ausencia de variables analíticas (62 pacientes).
Se utilizó el programa SPSS para Windows, versión 15.0. Se analizaron los resultados de las variables numéricas en medias y desviaciones estándar, y en porcentajes las variables cualitativas. Se estudiaron las diferencias de las variables numéricas, después de comprobar su ajuste a una distribución normal mediante el test de Kolmogorov-Smirnov, usando la t de Student para distribuciones paramétricas y el test de Mann-Whitney para no paramétricas. Se analizaron las tablas de contingencia para variables cualitativas utilizando el test de la chi al cuadrado. Se consideró significación estadística una p<0,05.
Se estudió, mediante regresión logística binaria, la relación con las variables analizadas, siendo la variable dependiente la presencia o no de cultivo positivo, IBG y sepsis-meningitis. El análisis se hizo siguiendo una estrategia hacia atrás, partiendo del modelo máximo, en el que se incluyeron la edad, el cumplimiento de los criterios de Rochester, la cifra de leucocitos, de neutrófilos, PCR y PCT, y sacando aquellas variables independientes cuyos coeficientes de regresión tenían una p<0,05 y conservando dentro del modelo aquellas variables que producían confusión. Se analizaron también las curvas ROC de los modelos finales de las regresiones logísticas.
Se descartó colinealidad mediante el análisis de los índices de condicionamiento y los factores de incremento de la varianza.
Se analizaron la sensibilidad (S), especificidad (E), cociente de probabilidad positivo (CPP) y negativo (CPN), y sus intervalos de confianza (IC) del 95%, utilizándose el paquete estadístico online Interactive Statistical Calculation: http://www.statpages.org/ctab2(2.html
ResultadosSe incluyó a 702 lactantes, 328 niños (46,72%). Los cultivos resultaron positivos en 145 pacientes; 115 fueron infecciones urinarias, seguido por sepsis (n=20), meningitis (n=6) y diarrea invasiva por Salmonella (n=3).
Dentro de IBG, hallamos, además, 21 neumonías, 13 celulitis y 2 onfalitis.
A continuación se expresan los porcentajes, con el IC del 95%, de cultivos positivos, sepsis-meningitis e IBG:
- –
Cultivos positivos: 20,66% (17,82-23,81).
- –
Sepsis: 2,85% (1,83-4,39)
- –
Meningitis: 0,85% (0,35-1,90).
- –
Sepsis-meningitis: 3,70% (2,52-5,39).
- –
IBG: 22,39% (19,97–26,19).
El germen más frecuente fue E. coli, el 62,75% de los cultivos (n=91, 6 como etiología de meningitis), el 73,9% de las infecciones urinarias (n=85), seguido del enterococo, en 15 pacientes. S. agalactiae supuso el 35% de las sepsis (n=7) y el 20% de las meningitis (n=1). Streptococcus pneumoniae supuso el 25% de las sepsis (n=5) y el 40% de las meningitis (n=2).
La tabla 1 recoge los datos de las variables epidemiológicas y de hemograma recogidas.
Variables epidemiológicas y de hemograma recogidas
| N | Mínimo | Máximo | Media | Desv. típica | |
|---|---|---|---|---|---|
| Edad (meses) | 702 | 0,03 | 3,00 | 1,3375 | 0,76569 |
| Leucocitos totales | 675 | 1.600 | 58.000 | 13.035 | 6,576 |
| Neutrófilos totales | 375 | 500 | 29.160 | 5.820 | 4.240 |
| PCR (mg/dl) | 641 | 0,10 | 27,80 | 2,6694 | 3,86526 |
| PCT (ng/ml) | 701 | 0,03 | 67,30 | 0,9655 | 3,99245 |
La tabla 2 recoge la edad y los parámetros analíticos según cultivos positivos o negativos, con aumento significativo en los parámetros analíticos analizados en el primer caso (p<0,0001).
Edad y parámetros analíticos según resultado del cultivo: media (desviación típica)
| Cultivo positivo | Cultivo negativo | Significación | |
|---|---|---|---|
| Edad (meses) | 1,40 (0,83) | 1,31 (0,74) | NS |
| Leucocitos totales | 15.584 (6.593) | 12.356 (6.409) | p<0,001 |
| Neutrófilos totales | 7664 (3.753) | 5447 (4.174) | p<0,001 |
| PCR (mg/dl) | 4,82 (5,56) | 2,06 (2,96) | p<0,001 |
| PCT (ng/ml) | 2,47 (7,59) | 0.57 (2,09) | p<0,001 |
La tabla 3 realiza la misma comparación respecto a la presencia o no de IBG con los mismos resultados.
Edad y parámetros analíticos según presencia de IBG: media (desviación típica)
| IBG | No IBG | Significación | |
|---|---|---|---|
| Edad (meses) | 1,44 (0,80) | 1,29 (0,74) | 0,046 |
| Leucocitos totales | 15.982 (6.980) | 11.996 (6.103) | p<0,001 |
| Neutrófilos totales | 8.139 (5.190) | 5.130 (3.646) | p<0,001 |
| PCR (mg/dl) | 4,96 (5,40) | 1,83 (2,68) | p<0,001 |
| PCT (ng/ml) | 2,23 (6,92) | 0,52 (2,04) | p<0,001 |
La tabla 4 recoge los resultados de la regresión logística binaria para cultivo positivo, IBG o diagnóstico de sepsis y/o meningitis, resultando significativo lo siguiente: PCR y PCT, parámetros analíticos y un valor inferior a 4 en los criterios de Rochester. El modelo fue menos reproducible para sepsis y/o meningitis, con un área bajo la curva (ABC) claramente inferior en el caso de sepsis y/o meningitis, y una menor significación estadística.
Resultados de la regresión logística binaria: coeficiente (intervalos de confianza)
| Cultivo + | IBG | Sepsis o meningitis | |
|---|---|---|---|
| PCR (mg/dl) | 1,058 (1-1,118) p = 0,049 | 1,124 (1,047-1,207) p = 0,001 | 1,175 (1,079-1,216) P< 0,001 |
| PCT (ng/ml) | 1,087 (0,996-1,187) p=0,063 | 1,128 (1,015-1,254) p = 0,025 | 1,106 (0,994-1,118) p = 0,066 |
| Rochester<4 | 36,097 (18-58-70,09) p<0,001 | 67,701 (33,41-137,15) p < 0,001 | 36,09 (18,58-70,09) p = 0,01 |
| R2 del modelo | 0,505 | 0,632 | 0,234 |
| Significación | p < 0,001 | p<0,001 | p = 0.005 |
| Área bajo la curva del modelo | 0,888 (0,859-0,916) | 0,877 (0,850-0,904) | 0,650 (0,573-0,727) |
pc+= 0,024+PCR×1,058+PCT×1,087+36,1 (R<4).
pIBG = 0,017+PCR×1,124+PCT×1,128+67,701(R<4).
En cuanto a los criterios de Rochester, se obtuvo un ABC (correspondiente para la ausencia de dichos criterios) para IBG de 0,69 (0,573-0,809) y para un valor inferior a 4 criterios una S = 0,917 (0,870-0,950), una E = 0,820 (0,804-0,831) y un VPN = 0,966 (0,947-0,980).
Como datos complementarios, aportamos la S y la E para otros puntos de corte con IC del 95%, dentro del modelo predictivo de IBG:
IBG 50: S: 0,75 (0,68- 0,80); E: 0,66 (0,64-0,68)
IBG 75: S: 0,86 (0,80-0,90); E: 0,68 (0,66-0,69)
Así, el modelo quedaría resumido en las siguientes fórmulas de probabilidad:
- 1.
«La probabilidad de obtener un cultivo positivo (pc+) será la obtenida al sumar una constante (0,024), más el valor obtenido de PCR×1,058, de PCT×1,087 y 36,097 si la puntuación de los criterios de Rochester es < 4» (pc+= 0,024+PCR×1,058+PCT×1,087+36,1 [R<4]).
- 2.
«La probabilidad de presentar una IBG será la obtenida al sumar una constante (0,017) más el valor obtenido de PCR×1,124, de PCT×1,128 y 67,701 si la puntuación de los criterios de Rochester es < 4» (pIBG = 0,017+PCR×1,124+PCT×1,128+67,701 (R<4]).
La tabla 5 recoge los puntos de corte para los modelos de IBG y cultivos positivos, con un CPN de 0,10 y 0,17 para unos puntos de corte de 80 y 25, respectivamente, lo que nos indica un muy bajo grado de probabilidad de obtener FN en nuestro modelo. Los VPN para IBG y cultivos positivos fueron, respectivamente, de 0,982 (0,964-0,992) y de 0,987 (0,970-0,995).
Valor de las pruebas diagnósticas para los modelos de cultivo+e IBG y punto de corte para los mismos
| Cultivo positivo | IBG | |
|---|---|---|
| Punto de corte | 25 | 80 |
| Sensibilidad | 91,9 (85-95) | 87,7 (80-92) |
| Especificidad | 74,7 (73-75) | 70,1 (68-71) |
| OR | 33,29 (16,34-69,76) | 16,70 (9,15-30,93) |
| Cociente de probabilidad positivo | 3,62 (3,19-3,92) | 2,93 (2,56-3,21) |
| Cociente de probabilidad negativo | 0,10 (0,05-0,19) | 0,17 (0,10-0,20) |
Comparativa entre el modelo para IBG y el de cultivo+:datos estadísticos.
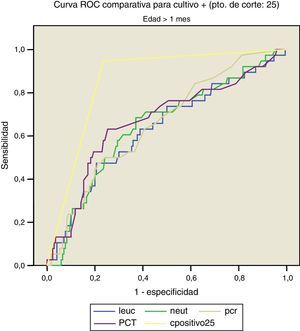
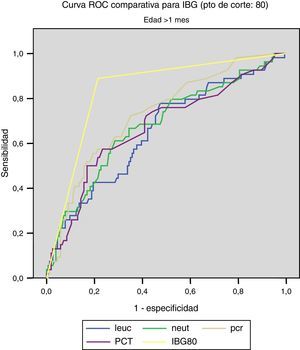
Las figuras 1 y 2 comparan nuestro modelo con los valores analíticos obtenidos, no obteniéndose diferencia significativa en dicho modelo al separar la muestra en menores y mayores de un1 mes.
Así, para cultivos positivos (punto de corte: 25):
- –
<1m: ABC: 0,862, con error típico de 0,041. IC del 95%: 0,782-0,943.
- –
>1m: ABC: 0,832, con error típico de 0,043. IC del 95%: 0,798-0,914.
Para IBG (punto de corte: 80):
- –
<1m: ABC: 0,832, con error típico de 0,043. IC del 95%: 0,747-0,916.
- –
>1m: ABC: 0,837, con error típico de 0,032. IC del 95%: 0,775-0,899.
Con este modelo, un 56,26% de los pacientes de la muestra no recibirían tratamiento antibiótico innecesario utilizando el umbral establecido para IBG y un 66,52% en el supuesto de utilizar el del cultivo positivo.
DiscusiónEn nuestra muestra hemos encontrado una prevalencia de IBG del 22,64%, con una proporción de cultivos positivos del 20,65%; además, los parámetros analíticos han evidenciado unos valores significativamente mayores de leucocitos, neutrófilos totales, PCR y PCT en los niños con cultivos positivos e IBG.
En una revisión sistemática sobre 14 publicaciones2 se encontró una prevalencia media del 20,5% (4,5-29,3%).
Analizando los parámetros de laboratorio, nuestros pacientes con IBG (n=180) tenían una cifra media de leucocitos mayor a 15.000 (15.982), una media de neutrófilos algo más baja (8.139), PCR en torno a 5mg/dl (4,96) y PCT>2 (2,23). El ABC recordemos que estaba, para IBG, entre 0,66 para leucocitos y 0,73 para PCR.
Otros estudios, como el de Cuello García et al.3 obtenía un ABC de 0,6 para neutrófilos, de 0,55 para leucocitos totales y de 0,71 para PCR, ligeramente inferior al obtenido en nuestro estudio. Aquí no se analizó la PCT. Otros trabajos, sin embargo, arrojan un ABC para estos valores superiores a los nuestros, como el de Fernández López4 et al., en 2003, ABC para PCT y PCR de 0,95 y 0,81, o el de Andreola et al.5, con ABC para PCT, PCR, leucocitos totales y neutrófilos de 0,82, 0,85, 0,81 y 0,74. En otro estudio publicado en 2008 de Maniaci et al.6 fueron de 0,66 para leucocitos (igual que la nuestra) y de 0,74 y 0,82 para neutrófilos y PCT, superiores a las calculadas por nosotros.
Un índice de validación de parámetros analíticos elaborado por Galetto-Lacour et al. en 20107 daba diferente puntuación en función de una PCT superior o inferior a 0,5 y 2, PCR superior o inferior a 40 y 100, y una tira reactiva de orina alterada o no. Este estudio (n = 106 menores de 3 meses) obtuvo un ABC de 0,91, superior a los hallados para PCT, PCR y leucocitos totales, de 0,84, 0,86 y 0,71, respectivamente.
Este último estudio, de gran relevancia, indica que la combinación de parámetros proporciona una mayor precisión diagnóstica.
Si analizamos los criterios de Rochester en nuestra muestra, 165 pacientes de los 180 en que se detectó una IBG no cumplían los criterios de bajo riesgo, con los datos de sensibilidad, especificidad, VPN y ABC expresados anteriormente. Al analizar por separado el grupo de sepsis-meningitis, obtenemos una S=63,63%, una E=63,97% y un VPN=98,19%. Estos datos, en conjunto para IBG muy buenos, son manifiestamente mejorables, fundamentalmente en cuanto a la sensibilidad, para descartar sepsis-meningitis. El escaso número de pacientes incluidos puede explicar la imprecisión en nuestros datos. Así, en el grupo de bajo riesgo, el riesgo de presentar una IBG (FN) era del 2,13% y de presentar una sepsis-meningitis del 1,80%, mientras que en el grupo de alto riesgo, el riesgo de presentar una IBG (VP) era del 65,63% y de presentar una sepsis-meningitis, 5,4%.
El modelo no excluye a ningún paciente con IBG, quizás a costa de una menor especificidad; sin embargo, enriquece dicho modelo el hecho de tener en cuenta parámetros analíticos que no se incluyen en los criterios de Rochester.
Estos datos contrastan con otros estudios publicados y el más clásico es de Baraff et al.8, en el que encontraban un riesgo similar para IBG y sepsis-meningitis en el grupo de bajo riesgo (2,6 y 1,3%), pero un riesgo mucho menor para el grupo de alto riesgo en cuanto a IBG (24,3%), en torno a un 40% menos que nosotros. En diferentes estudios prospectivos que utilizaron estos criterios, solos o combinados con los de Philadelphia, la tasa de IBG en el grupo de alto riesgo osciló entre 12,3 y el 33,9% de los pacientes9-12, contrastando igualmente con nuestro dato del 65,63%. Estos mismos trabajos, sin embargo, sí ofrecen datos semejantes del riesgo en el grupo de bajo riesgo, con una variabilidad entre el 0 y el 5,97%. Analizando todos los trabajos publicados a este respecto, en una revisión de la literatura publicada en 2010, que estudiaba 21 trabajos13, se concluyó que el riesgo estimado de IBG en el grupo de alto riesgo oscilaba entre el 19,8 y el 23,8% (prospectivos y retrospectivos), mientras que en el grupo de bajo riesgo variaba entre el 0,67 y el 2,71%. Estos datos concuerdan en gran medida con el grupo de bajo riesgo, no así con el de alto riesgo. Esta diferencia pueda ser explicada por la población estudiada, ya que nosotros incluimos población hospitalaria, y en el resto de los trabajos incluyen población general.
En nuestro análisis multivariante solo los valores del PCR, PCT y la presencia de una puntuación inferior a 4 en la escala de Rochester permanecen en los correspondientes modelos para la presencia de cultivos positivos, IBG o diagnóstico de sepsis y/o meningitis, pero en este último caso tanto la r2 del modelo (0,234) como el ABC (0,650) presentan unos resultados mediocres. Con los resultados encontrados en la regresión logística se han calculado la S, la E, la odds ratio (OR), el CPP y el CPN para puntos de corte de 25 (para cultivos +) y 80 (para IBG).
Varios han sido los «intentos» previos de establecer un modelo predictivo de IBG: comentar un trabajo de 1991, publicado por Downs et al.14, en el cual, estudiando a niños entre 2 y 24 meses, y teniendo en cuenta el estado clínico del paciente y el recuento leucocitario, superior o inferior a 15.000 leucocitos, concluyen que el mejor abordaje del lactante febril considerado de riesgo era el tratamiento antibiótico empírico a todos los pacientes. Se debe resaltar que, en este estudio, si bien mencionados, no fueron tomados en cuenta la velocidad de sedimentación globular o la PCR, y se excluía del análisis a aquellos pacientes sin clínica de meningitis. En la misma línea, 12 años después, se manifestaba Brook15 en una revisión publicada en el British Medical Journal, en la que aboga por un abordaje conservador de los lactantes febriles menores de 3 meses, en cuanto a que propone su hospitalización y tratamiento antibiótico empírico hasta el resultado de los cultivos bacteriológicos, si bien ya apunta los inconvenientes en cuanto a estancia hospitalaria, comorbilidad y efectos indeseables de la antibioterapia que podría suponer esta actitud. Un año más tarde, la AMA16 publicaba un trabajo en el que, sobre una muestra de 3.066 lactantes febriles menores de 3 meses, una muestra bastante amplia, analizaba el papel de las escalas clínicas y el recuento leucocitario sobre la actuación médica en estos pacientes. A diferencia de nuestro trabajo, incluía a pacientes que fueron dados de alta y concluía que los parámetros más relacionados con la IBG eran la edad y el estado general, e incluía el análisis del recuento leucocitario, sin analizar ni PCR ni PCT. Y, siguiendo en el repaso de modelos en la literatura que pudieran anteceder al presentado en este trabajo, se debe quizás comentar el que más similitudes presenta con el mismo, y es el publicado por Bachur y Harper17 en 2001. Este trabajo incluía en el análisis a 5.279 lactantes menores de 3 meses que acuden a Urgencias hospitalarias por fiebre. Este trabajo tampoco incluía PCR ni PCT, sí así el recuento leucocitario y el análisis de orina. Su proporción de IBG era considerablemente más baja que la nuestra: un 7% vs. 22,64%, que fue la tasa calculada en nuestra serie, que es similar a la encontrada en el trabajo antes mencionado de Brook, si bien no se especifica si se incluyen en el análisis las neumonías. El germen que encuentran con más frecuencia es el estreptococo del grupo B, a diferencia de lo encontrado en nuestra serie, con el E. coli como máximo representante, sus datos de sensibilidad son algo inferiores los nuestros (82 vs. 87%), mientras que su especificidad es ligeramente superior (76 vs. 68,3%), probablemente en relación con el punto de corte establecido por nosotros. Su OR, establecida como 12, también fue inferior a la nuestra, establecida como 14,41.
Nuestro modelo alcanza una mayor precisión diagnóstica que la hallada de manera individual para leucocitos, neutrófilos, PCR y PCT. No encontramos diferencias de aplicabilidad en menores o mayores de un mes; además, se puede establecer con bastante certeza la probabilidad de encontrar un cultivo positivo en nuestros pacientes (salvo neumonía no bacteriémica) mediante la aplicación de la variante de la fórmula para cultivos positivos.
El alto VPN y los bajos CPN (0,10 y 0,17, respectivamente, véase la tabla 5), unido al alto impacto de este modelo sobre nuestra muestra, nos permiten optar razonablemente por no instaurar tratamiento antibiótico en pacientes diagnosticados de bajo riesgo, aunque se precisa para ello una validación posterior. Además, en nuestro modelo, tan solo un 0,99 y un 0,71% de los pacientes se escaparían de ser clasificados como de presentar IBG y cultivo positivo, respectivamente.
Creemos y deseamos que pueda servir de utilidad en la práctica clínica diaria y como base para futuros estudios.
ConclusionesTras la realización de este trabajo, podemos razonablemente concluir que es posible establecer un índice predictor de IBG (IPIBG) y de obtención de cultivos positivos (IPCP) para lactantes menores de 3 meses con síndrome febril sin foco, que integre datos clínicos y analíticos. Ambos índices, para los puntos de corte establecidos, han podido diagnosticar en nuestra muestra de manera fiable la mayor parte de las IBG, con un CPN muy cercano a cero.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.