La identificación adecuada del paciente pediátrico con asma grave es esencial para su correcto manejo. Sin embargo, los criterios para definir el asma grave y las recomendaciones para su control varían mucho entre las distintas guías.
Material y métodosSe elaboró una encuesta telemática para analizar las opiniones relativas a la definición y control del asma grave pediátrica. Para lograr un consenso se siguió una metodología Delphi modificada. Con los resultados se elaboraron recomendaciones prácticas.
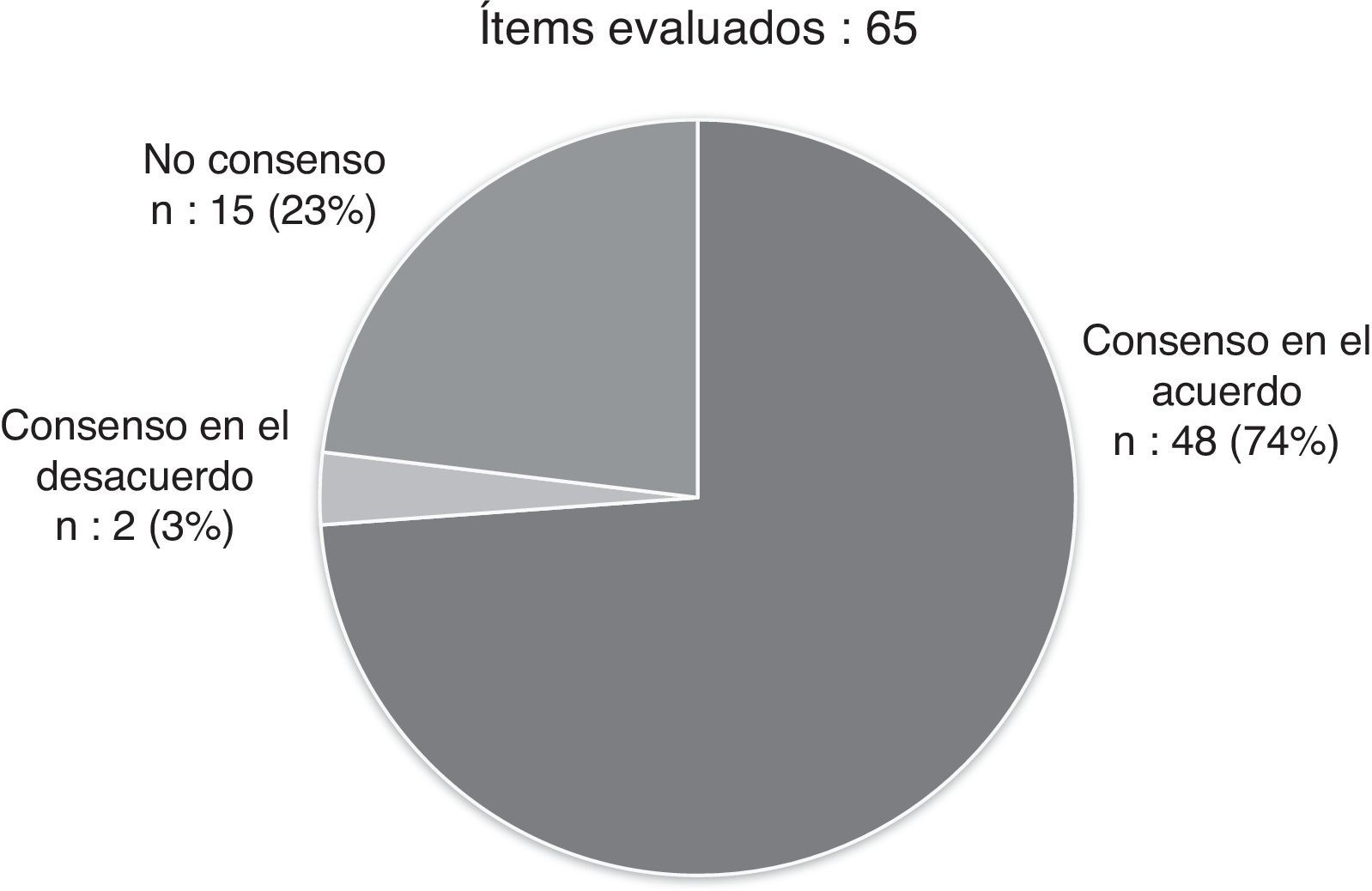
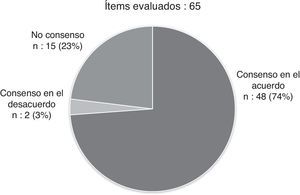
ResultadosEl cuestionario fue respondido por 11 neumólogos y alergólogos pediátricos expertos en asma grave. Hubo consenso en 50 de los 65 ítems planteados (76,92%). Se consideró que un paciente tiene asma grave si en el último año ha requerido 2 o más ciclos de corticoides orales, si requiere tratamiento diario con corticoides inhalados a dosis medias (con otra medicación controladora) o dosis altas (con o sin otra medicación controladora), si no responde a un tratamiento convencional optimizado, o si la enfermedad pone en riesgo su vida o deteriora gravemente su calidad de vida. La definición de asma grave también podría incluir a los pacientes que consumen recursos sanitarios de manera regular y justificada, o tienen factores psicosociales o ambientales que impiden su control. Para la monitorización, se recomienda usar cuestionarios específicos de población pediátrica (CAN o ACT). Respecto al tratamiento, se debería considerar el uso de omalizumab en un escalón anterior al de los corticoides orales.
ConclusionesEl presente trabajo ofrece recomendaciones consensuadas que pueden ser de utilidad en el manejo del asma grave pediátrica.
Accurate identification of paediatric patients with severe asthma is essential for an adequate management of the disease. However, criteria for defining severe asthma and recommendations for control vary among different guidelines.
Material and methodsAn online survey was conducted to explore expert opinions about the definition and management of severe paediatric asthma. To reach a consensus agreement, a modified Delphi technique was used, and practice guidelines were prepared after the analysis of the results.
ResultsEleven paediatric chest disease physicians and allergy specialists with wide expertise in severe asthma responded to the survey. Consensus was reached in 50 out of 65 questions (76.92%). It was considered that a patient has severe asthma if during the previous year they have required 2 or more cycles of oral steroids, required daily treatment with medium doses of inhaled corticosteroids (with other controller medication) or high doses (with or without other controller medication), did not respond to optimised conventional treatment, or if the disease threatened the life of the patient or seriously impairs their quality of life. The definition of severe asthma may also include patients who justifiably use health resources on a regular basis, or have psychosocial or environmental factors impeding control. For monitoring, the use of questionnaires designed specifically for paediatric population, such as CAN or ACT, is recommended. As regards treatment, the use of omalizumab should be considered prior to the use of oral corticosteroids.
ConclusionsThis paper provides consensus recommendations that may be useful in the management of severe paediatric asthma.
El asma es una de las enfermedades crónicas más frecuentes1–3. En España, la prevalencia está entre el 7,1 y el 12,9% en niños de 6-7 años, y el 7,1 y el 15,3% a los 13-14 años3. Estudios realizados fuera de España estiman una prevalencia de asma en niños del 2,5%4,5. A pesar de los avances en su tratamiento, el asma grave aún se asocia a una gran morbilidad6 y a una mortalidad que, aunque ha descendido en los últimos años, sigue siendo apreciable7. Además, el asma origina altos costes directos e indirectos8 y son los pacientes con asma grave los que consumen la mayoría de los recursos dedicados a esta enfermedad1,8.
La gravedad es una característica intrínseca de esta enfermedad que refleja la intensidad de las anomalías fisiopatológicas e implica tanto la intensidad del proceso como la respuesta al tratamiento9. Conviene distinguir el concepto de gravedad del de control. El control es el grado en el que las manifestaciones del asma están ausentes o se ven reducidas al máximo por las intervenciones terapéuticas y se cumplen los objetivos del tratamiento, se reduce el riesgo de exacerbaciones, así como los efectos secundarios derivados de la medicación1,9,10. La identificación adecuada del paciente con asma grave es esencial para un correcto manejo de la enfermedad, principalmente porque de ello depende el tratamiento y el seguimiento de los pacientes9,11. Igualmente, una evaluación correcta del nivel de control es fundamental para ajustar adecuadamente el tratamiento9. Sin embargo, las recomendaciones para definir el asma como grave y para evaluar el grado de control varían entre las guías1,9–12.
En respuesta a esta disparidad en cuanto a la evaluación de la gravedad y el control del asma, se ha planteado un proyecto que pretende obtener la visión de estos aspectos por parte de alergólogos y neumólogos pediátricos expertos en el manejo del asma grave. El objetivo no ha sido crear nuevas formas de definir la gravedad ni el control, sino homogeneizar criterios a la hora de considerar el diagnóstico de asma grave en la práctica clínica, y concretar medidas para llevar a cabo un seguimiento correcto. Además, se han consensuado recomendaciones para derivar correctamente a los niños con asma grave a atención especializada o de tercer nivel, y para realizar un tratamiento acorde con la gravedad de la enfermedad, incluyendo las novedades terapéuticas, particularmente con agentes biológicos de introducción más reciente13.
Material y métodosDiseño del estudioPara alcanzar el consenso entre expertos se utilizó el método Delphi modificado siguiendo recomendaciones de la RAND/UCLA14,15. Se siguieron los siguientes pasos:
- 1.
Revisión de la literatura, discusión presencial y elaboración de un cuestionario de aseveraciones por un comité científico.
- 2.
Selección de un panel de expertos por parte del comité científico.
- 3.
Envío al panel de expertos de una encuesta online en 2 rondas.
- 4.
Análisis de resultados y elaboración del artículo.
El comité científico realizó la revisión de la bibliografía buscando guías de práctica clínica o revisiones sistemáticas que abordaran el tema del asma grave en las siguientes fuentes: Medline, Embase, The Cochrane Library, U.S. National Guidelines Clearinghouse, Tripdatabase y GuíaSalud. La búsqueda se realizó en abril de 2014 y se limitó a estudios en español e inglés y a documentos publicados en los 5 años anteriores.
Elaboración y evaluación del cuestionarioTras el análisis de la literatura, el comité científico elaboró un cuestionario con ítems que trataban algún aspecto controvertido relacionado con el asma grave. Los ítems se evaluaron online mediante una escala ordinal de 9 puntos (1=pleno desacuerdo; 9=pleno acuerdo). Las respuestas se agruparon en 3 regiones (1-3=desacuerdo; 4-6=ni acuerdo, ni desacuerdo; 7-9=acuerdo). Todos los ítems en los que el grupo no alcanzaba un consenso en una primera ronda fueron reevaluados en una segunda ronda. Entre rondas, los panelistas fueron informados de la distribución detallada de las respuestas en la primera encuesta.
Análisis de resultadosUn ítem se consideró consensuado en el acuerdo si la mediana de respuestas entraba en la región 7-9, y se consideró consensuado en el desacuerdo si la mediana estaba incluida en la región 1-3. Además, para que un ítem se considerara consensuado, el número de panelistas que votaba fuera de la región 1-3 o 7-9 debía ser menor de 1/3 del total y el intervalo intercuartílico (IIC) debía ser ≤4. Los resultados se muestran como tablas con la mediana de las respuestas, su IIC, el grado de acuerdo entre panelistas, y el resultado final del consenso para cada ítem (consenso en el acuerdo o el desacuerdo en primera o segunda ronda, o no consenso). El grado de acuerdo indica el porcentaje de panelistas que votó dentro del rango donde está la mediana (1-3, 4-6 o 7-9). Con el fin de simplificar los resultados, se elaboró un decálogo de recomendaciones con los ítems consensuados más relevantes que fue revisado y aprobado por todo el panel de expertos.
ResultadosEl cuestionario fue respondido por 11 neumólogos y alergólogos pediátricos expertos en asma pediátrica procedentes de 7 comunidades autónomas españolas. Constaba de 65 ítems divididos en 4 bloques (tablas 1-4).
Resultados bloque I: Definición de asma pediátrica grave
| Mediana (IIC) | Grado de acuerdo % | Resultado | |
|---|---|---|---|
| 1. La definición de asma pediátrica grave no está suficientemente aclarada en la guía GEMA | 8 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
| 2. La definición de asma pediátrica grave no está suficientemente aclarada en la guía GINA | 8 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 3. La definición de asma pediátrica grave no está suficientemente aclarada en la guía ICON | 8 (7-8) | 90,91 | Acuerdo en 1.ª ronda |
| 4. El concepto de asma grave no está claro entre los pediatras y depende de cada médico | 9 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| La definición de asma pediátrica grave debe incluir aquellos pacientes pediátricos con asma (los criterios no son excluyentes): | |||
| 5. Que requieren de tratamiento diario varias veces al año con corticoides orales para el control de la enfermedad | 8 (7-8) | 90,91 | Acuerdo en 1.ª ronda |
| 6. Que requieren tratamiento con corticoides inhalados diarios a medias/altas dosis para el control de la enfermedad | 7 (6-8) | 72,73 | Acuerdo en 2.ª ronda |
| 7. Que requieren tratamiento con corticoides inhalados diarios a dosis medias/altas más otra medicación controladora (LABA o ARLT) para el control de la enfermedad | 8 (7-8) | 90,91 | Acuerdo en 1.ª ronda |
| 8. Que no responden al tratamiento convencional optimizado | 8 (5-9) | 72,73 | Acuerdo en 1.ª ronda |
| 9. Que utilizan más de 2 envases al mes de broncodilatadores de acción corta (SABA) | 7 (5-9) | 72,73 | Acuerdo en 1.ª ronda |
| 10. Que tienen un asma que está sujeta a factores psicosociales o ambientales que impiden su control (por ejemplo, falta de adherencia, mal manejo de los dispositivos, mala percepción de los síntomas y de la enfermedad, tabaquismo en el hogar, insalubridad o alérgenos no evitables) | 8 (7-8) | 90,91 | Acuerdo en 2.ª ronda |
| 11. Que padecen otra enfermedad crónica concomitante, como una enfermedad cardíaca u otra enfermedad pulmonar | 4 (3-7) | 27,27 | No consensuado |
| 12. Que han requerido un ingreso en una UCI por asma | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 13. Que han requerido más de 2 ingresos al año en planta por asma | 8 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 14. Que tienen una función pulmonar con una FEV1 inferior al 80% (en aquellos niños que puedan hacer las pruebas correctamente) | 6 (4-7) | 45,45 | No consensuado |
| 15. Que tienen un deterioro importante de la calidad de vida | 8 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
| 16. Que consumen recursos sanitarios de manera regular, frecuente y justificada (visitas al médico, al especialista, medicación…) | 8 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 17. Que inducen gastos indirectos frecuentes | 7 (5-8) | 63,64 | No consensuado |
| 18. Que alcanzan el control de la enfermedad con un tratamiento que produce demasiados efectos adversos a juicio del pediatra | 8 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
| 19. Que alcanzan el control de la enfermedad con un tratamiento que produce demasiados efectos adversos a juicio del paciente o sus padres/tutores | 6 (5-7) | 54,55 | No consensuado |
| 20. Que tienen sintomatología frecuente a pesar de realizar adecuadamente el tratamiento controlador | 8 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 21. Que tienen exacerbaciones puntuales pero graves | 8 (8-9) | 90,91 | Acuerdo en 1.ª ronda |
| 22. Que tienen una enfermedad que pone en riesgo su vida | 9 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
| 23. La definición de asma grave debe ser diferente entre lactantes, por un lado, y niños de edad preescolar, escolar o adolescentes, por otro | 8 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 24. Antes de diagnosticar asma grave hay que reevaluar y confirmar el diagnóstico de asma descartando otras enfermedades que cursen con síntomas similares | 9 (9-9) | 100 | Acuerdo en 1.ª ronda |
| 25. La clasificación de un paciente con asma grave es dinámica y puede cambiar a lo largo del tiempo | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 26. Sería útil disponer de un índice compuesto validado (valorando síntomas, exacerbaciones, función pulmonar y tratamiento requerido para el control) que permitiese identificar a los niños y adolescentes con asma grave y cuantificar la gravedad de la enfermedad | 9 (9-9) | 100 | Acuerdo en 1.ª ronda |
Resultados bloque II: Monitorización de control del asma pediátrica grave
| Mediana (IIC) | Grado de acuerdo en % | Resultado | |
|---|---|---|---|
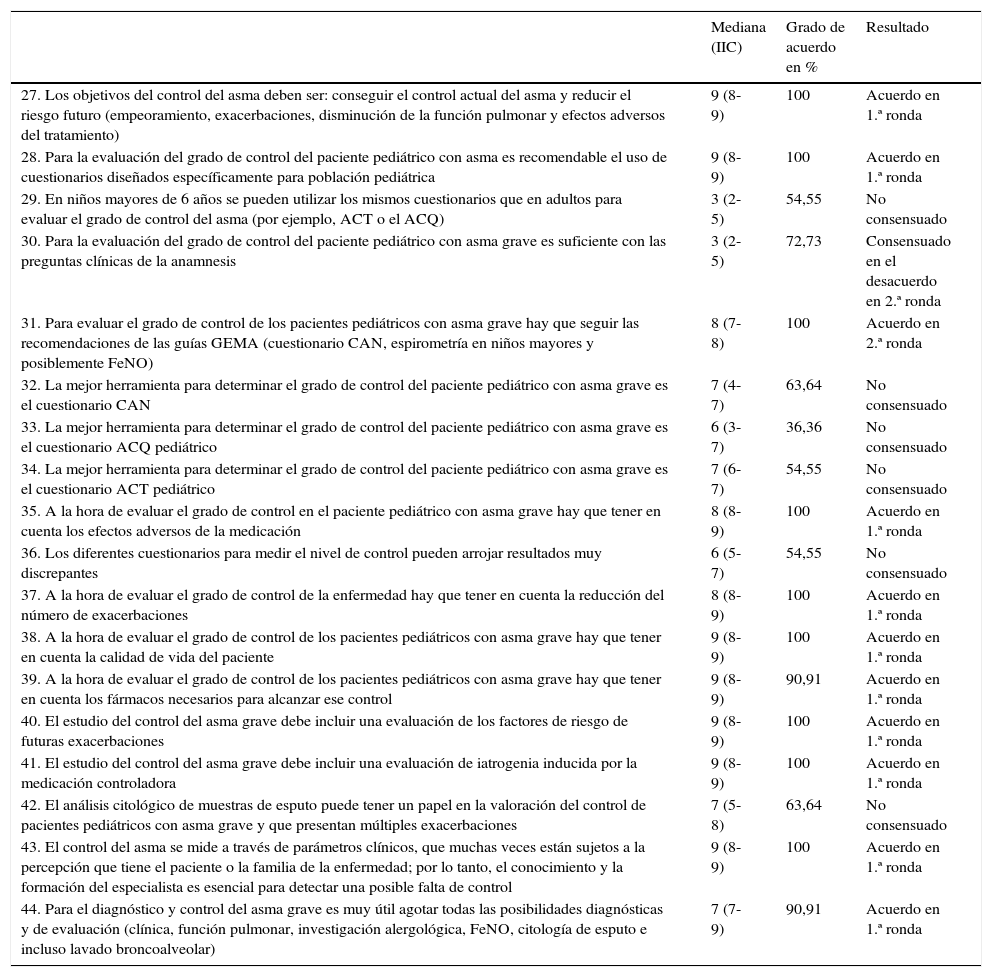
| 27. Los objetivos del control del asma deben ser: conseguir el control actual del asma y reducir el riesgo futuro (empeoramiento, exacerbaciones, disminución de la función pulmonar y efectos adversos del tratamiento) | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 28. Para la evaluación del grado de control del paciente pediátrico con asma es recomendable el uso de cuestionarios diseñados específicamente para población pediátrica | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 29. En niños mayores de 6 años se pueden utilizar los mismos cuestionarios que en adultos para evaluar el grado de control del asma (por ejemplo, ACT o el ACQ) | 3 (2-5) | 54,55 | No consensuado |
| 30. Para la evaluación del grado de control del paciente pediátrico con asma grave es suficiente con las preguntas clínicas de la anamnesis | 3 (2-5) | 72,73 | Consensuado en el desacuerdo en 2.ª ronda |
| 31. Para evaluar el grado de control de los pacientes pediátricos con asma grave hay que seguir las recomendaciones de las guías GEMA (cuestionario CAN, espirometría en niños mayores y posiblemente FeNO) | 8 (7-8) | 100 | Acuerdo en 2.ª ronda |
| 32. La mejor herramienta para determinar el grado de control del paciente pediátrico con asma grave es el cuestionario CAN | 7 (4-7) | 63,64 | No consensuado |
| 33. La mejor herramienta para determinar el grado de control del paciente pediátrico con asma grave es el cuestionario ACQ pediátrico | 6 (3-7) | 36,36 | No consensuado |
| 34. La mejor herramienta para determinar el grado de control del paciente pediátrico con asma grave es el cuestionario ACT pediátrico | 7 (6-7) | 54,55 | No consensuado |
| 35. A la hora de evaluar el grado de control en el paciente pediátrico con asma grave hay que tener en cuenta los efectos adversos de la medicación | 8 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 36. Los diferentes cuestionarios para medir el nivel de control pueden arrojar resultados muy discrepantes | 6 (5-7) | 54,55 | No consensuado |
| 37. A la hora de evaluar el grado de control de la enfermedad hay que tener en cuenta la reducción del número de exacerbaciones | 8 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 38. A la hora de evaluar el grado de control de los pacientes pediátricos con asma grave hay que tener en cuenta la calidad de vida del paciente | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 39. A la hora de evaluar el grado de control de los pacientes pediátricos con asma grave hay que tener en cuenta los fármacos necesarios para alcanzar ese control | 9 (8-9) | 90,91 | Acuerdo en 1.ª ronda |
| 40. El estudio del control del asma grave debe incluir una evaluación de los factores de riesgo de futuras exacerbaciones | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 41. El estudio del control del asma grave debe incluir una evaluación de iatrogenia inducida por la medicación controladora | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 42. El análisis citológico de muestras de esputo puede tener un papel en la valoración del control de pacientes pediátricos con asma grave y que presentan múltiples exacerbaciones | 7 (5-8) | 63,64 | No consensuado |
| 43. El control del asma se mide a través de parámetros clínicos, que muchas veces están sujetos a la percepción que tiene el paciente o la familia de la enfermedad; por lo tanto, el conocimiento y la formación del especialista es esencial para detectar una posible falta de control | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 44. Para el diagnóstico y control del asma grave es muy útil agotar todas las posibilidades diagnósticas y de evaluación (clínica, función pulmonar, investigación alergológica, FeNO, citología de esputo e incluso lavado broncoalveolar) | 7 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
Resultados bloque III: La derivación del paciente con asma grave
| Mediana (IIC) | Grado de acuerdo en % | Resultado | |
|---|---|---|---|
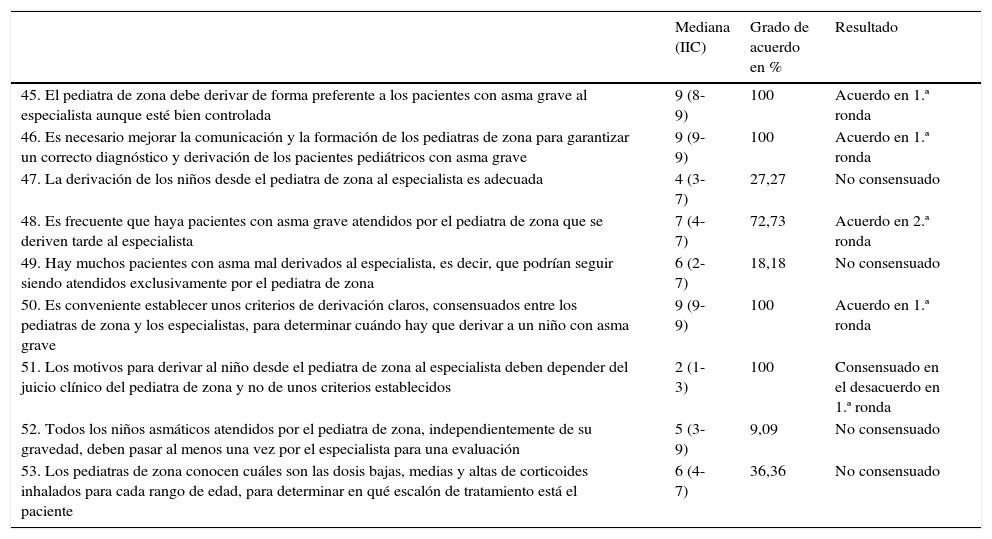
| 45. El pediatra de zona debe derivar de forma preferente a los pacientes con asma grave al especialista aunque esté bien controlada | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 46. Es necesario mejorar la comunicación y la formación de los pediatras de zona para garantizar un correcto diagnóstico y derivación de los pacientes pediátricos con asma grave | 9 (9-9) | 100 | Acuerdo en 1.ª ronda |
| 47. La derivación de los niños desde el pediatra de zona al especialista es adecuada | 4 (3-7) | 27,27 | No consensuado |
| 48. Es frecuente que haya pacientes con asma grave atendidos por el pediatra de zona que se deriven tarde al especialista | 7 (4-7) | 72,73 | Acuerdo en 2.ª ronda |
| 49. Hay muchos pacientes con asma mal derivados al especialista, es decir, que podrían seguir siendo atendidos exclusivamente por el pediatra de zona | 6 (2-7) | 18,18 | No consensuado |
| 50. Es conveniente establecer unos criterios de derivación claros, consensuados entre los pediatras de zona y los especialistas, para determinar cuándo hay que derivar a un niño con asma grave | 9 (9-9) | 100 | Acuerdo en 1.ª ronda |
| 51. Los motivos para derivar al niño desde el pediatra de zona al especialista deben depender del juicio clínico del pediatra de zona y no de unos criterios establecidos | 2 (1-3) | 100 | Consensuado en el desacuerdo en 1.ª ronda |
| 52. Todos los niños asmáticos atendidos por el pediatra de zona, independientemente de su gravedad, deben pasar al menos una vez por el especialista para una evaluación | 5 (3-9) | 9,09 | No consensuado |
| 53. Los pediatras de zona conocen cuáles son las dosis bajas, medias y altas de corticoides inhalados para cada rango de edad, para determinar en qué escalón de tratamiento está el paciente | 6 (4-7) | 36,36 | No consensuado |
Resultados bloque IV: Actitud terapéutica en el niño con asma grave
| Mediana (IIC) | Grado de acuerdo en % | Resultado | |
|---|---|---|---|
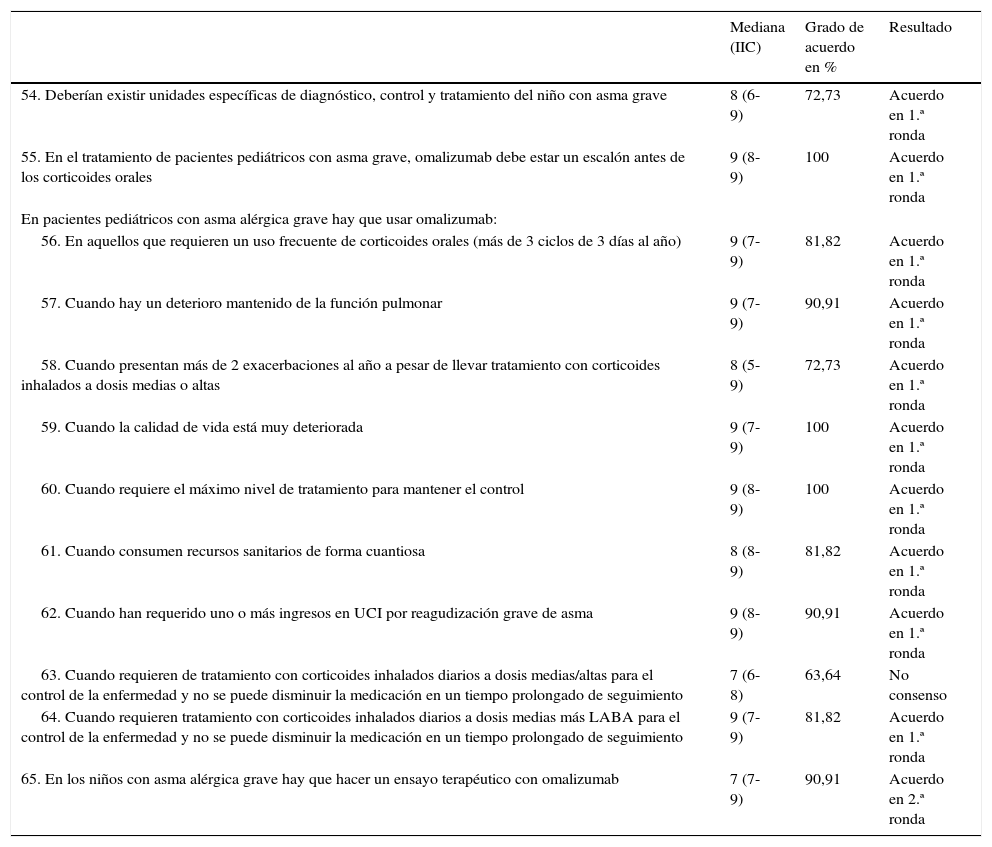
| 54. Deberían existir unidades específicas de diagnóstico, control y tratamiento del niño con asma grave | 8 (6-9) | 72,73 | Acuerdo en 1.ª ronda |
| 55. En el tratamiento de pacientes pediátricos con asma grave, omalizumab debe estar un escalón antes de los corticoides orales | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| En pacientes pediátricos con asma alérgica grave hay que usar omalizumab: | |||
| 56. En aquellos que requieren un uso frecuente de corticoides orales (más de 3 ciclos de 3 días al año) | 9 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 57. Cuando hay un deterioro mantenido de la función pulmonar | 9 (7-9) | 90,91 | Acuerdo en 1.ª ronda |
| 58. Cuando presentan más de 2 exacerbaciones al año a pesar de llevar tratamiento con corticoides inhalados a dosis medias o altas | 8 (5-9) | 72,73 | Acuerdo en 1.ª ronda |
| 59. Cuando la calidad de vida está muy deteriorada | 9 (7-9) | 100 | Acuerdo en 1.ª ronda |
| 60. Cuando requiere el máximo nivel de tratamiento para mantener el control | 9 (8-9) | 100 | Acuerdo en 1.ª ronda |
| 61. Cuando consumen recursos sanitarios de forma cuantiosa | 8 (8-9) | 81,82 | Acuerdo en 1.ª ronda |
| 62. Cuando han requerido uno o más ingresos en UCI por reagudización grave de asma | 9 (8-9) | 90,91 | Acuerdo en 1.ª ronda |
| 63. Cuando requieren de tratamiento con corticoides inhalados diarios a dosis medias/altas para el control de la enfermedad y no se puede disminuir la medicación en un tiempo prolongado de seguimiento | 7 (6-8) | 63,64 | No consenso |
| 64. Cuando requieren tratamiento con corticoides inhalados diarios a dosis medias más LABA para el control de la enfermedad y no se puede disminuir la medicación en un tiempo prolongado de seguimiento | 9 (7-9) | 81,82 | Acuerdo en 1.ª ronda |
| 65. En los niños con asma alérgica grave hay que hacer un ensayo terapéutico con omalizumab | 7 (7-9) | 90,91 | Acuerdo en 2.ª ronda |
El primer bloque trataba sobre la definición de asma pediátrica grave. Se alcanzó un consenso en el acuerdo en 22 de los 26 ítems planteados (84,6%). En el segundo bloque se abordó la monitorización del control del asma pediátrica grave y se alcanzó un consenso en 12 de los 18 ítems (66,6%): 11 en el acuerdo y uno en el desacuerdo. Los bloques III y IV trataron sobre la derivación del paciente con asma grave y la actitud terapéutica en el niño con asma grave. En el bloque III hubo consenso en 5 de los 9 ítems (55,5%, 4 en el acuerdo y uno en el desacuerdo), mientras que en el bloque IV hubo consenso en el acuerdo en 11 de los 12 ítems planteados (91,6%).
Tras las 2 rondas de evaluación, hubo finalmente consenso en 50 de los 65 ítems del cuestionario (76,92%): 48 en el acuerdo y 2 en el desacuerdo (fig. 1, tablas 1-4). Los ítems consensuados más relevantes se resumen en un decálogo de recomendaciones (tabla 5).
Decálogo de recomendaciones para el manejo del niño con asma grave
| 1. Se puede considerar que un paciente tiene asma grave si para el control de la enfermedad ha requerido durante el último año 2 o más ciclos de corticoides orales, tratamiento diario con corticoides inhalados a dosis medias (con otra medicación controladora) o altas (con o sin otra medicación controladora, como LABA o antileucotrienos) o utiliza 2 envases al año de broncodilatadores de acción corta |
| 2. También se puede considerar que tienen asma grave los pacientes que no responden a un tratamiento convencional optimizado, que realizan adecuadamente, o los pacientes que alcanzan el control de la enfermedad con un tratamiento que produce demasiados efectos adversos |
| 3. Independientemente del nivel de tratamiento para obtener el control, se puede considerar que un paciente tiene asma grave si su enfermedad pone en riesgo su vida o deteriora de forma importante su calidad de vida, si tiene exacerbaciones puntuales pero graves, o si ha requerido 2 o más hospitalizaciones al año por asma |
| 4. La definición de asma grave debe incluir a los pacientes que consumen recursos sanitarios de manera regular, frecuente y justificada |
| 5. Para la monitorización del control del paciente con asma grave no es suficiente con las preguntas clínicas de la anamnesis y se recomienda el uso de cuestionarios diseñados específicamente para población pediátrica |
| 6. Para el diagnóstico y control del asma grave es necesario tener en cuenta todas las herramientas clínicas disponibles y aplicables |
| 7. A la hora de evaluar el grado de control en el paciente pediátrico con asma grave, hay que tener en cuenta los fármacos necesarios para alcanzar ese control, los efectos adversos asociados a la medicación, la reducción del número de exacerbaciones y la calidad de vida del paciente |
| 8. La derivación al especialista del paciente con asma grave debería basarse en unos criterios claros y consensuados entre los pediatras de Atención Primaria y el especialista |
| 9. El pediatra de Atención Primaria debería derivar de forma preferente a los pacientes con asma grave al especialista, aunque la enfermedad esté bien controlada |
| 10. En el tratamiento de pacientes pediátricos con asma alérgica grave se debe considerar el uso de omalizumab en un escalón anterior al de los corticoides orales |
Este documento trata de dar una visión práctica y consensuada sobre el asma grave pediátrica centrada en su definición y nivel de control, así como en la derivación de pacientes y su tratamiento óptimo. En los 3 primeros ítems del cuestionario se puso de manifiesto que la definición de asma pediátrica grave no está suficientemente clara en diferentes guías, como la Guía Española de Manejo del Asma (GEMA)9, las guías de la Global Strategy for Asthma Management and Prevention (GINA)1 o las guías dirigidas a población pediátrica del International Consensus on Pediatric Asthma (ICON)10. Efectivamente, la nomenclatura y la clasificación de gravedad y control son diferentes no solo entre estas 3 guías, sino también en las directrices de la European Respiratory Society/American Thoracic Society (ERS/ATS)12 o de la Organización Mundial de la Salud11. La mayoría de las guías coinciden en que hay que evaluar la gravedad de la enfermedad principalmente según el escalón terapéutico que requiere el paciente para conseguir el control. Sin embargo, la definición de gravedad o control y los escalones terapéuticos no coinciden. Probablemente en relación con esta falta de homogeneidad, el panel de expertos coincidió en considerar que el concepto de asma grave no está claro y depende de cada médico, tal y como se indicaba en el ítem 4 de la encuesta.
En este sentido, es necesario tener en cuenta que la evaluación del asma grave varía entre lactantes, por un lado, y niños de edad preescolar, escolar o adolescentes, por otro. Por este motivo, antes de diagnosticar asma grave hay que reevaluar y confirmar el diagnóstico de asma, descartando otras enfermedades que cursen con síntomas similares y teniendo en cuenta que la clasificación de un paciente con asma grave es dinámica y puede cambiar a lo largo del tiempo.
En los siguientes ítems (del 5 al 22) se trataba de consensuar los elementos que debe incluir la definición de asma grave pediátrica. En este sentido, se acordó considerar como grave el asma de aquellos pacientes en los que para el control de la enfermedad se da alguna de las siguientes circunstancias: haber requerido en el último año 2 o más ciclos de corticoides orales; requerir tratamiento con corticoides inhalados diarios a dosis medias con otra medicación controladora o a dosis altas con o sin otra medicación controladora, como agonista β2 adrenérgico de larga duración (LABA) o antileucotrienos (ARLT); o necesitar un envase al mes de broncodilatadores de acción corta (SABA). En sus comentarios al cuestionario, algunos panelistas consideraron que incluso con 2 envases de SABA al año ya habría que considerarlo como asma grave, de acuerdo con las guías16,17 ya que el uso de SABA podría indicar una falta de control de la enfermedad. La inclusión de corticoides inhalados a dosis medias sin otro tratamiento acompañante (ítem consensuado en segunda ronda) y la referencia al consumo de SABA no son criterios que aparezcan en la definición de asma grave de las guías GEMA, GINA o ICON. Sin embargo, los panelistas indicaron que en la práctica clínica habitual estos pacientes se consideran graves.
Además de medir la gravedad por medio del escalón de tratamiento, el panel consensuó otras situaciones clínicas que pueden hacer que la enfermedad se considere grave en la práctica diaria y que se relacionan principalmente con la gravedad intrínseca de la enfermedad. En este sentido, se ha considerado que un paciente tiene asma grave en los siguientes casos: si la enfermedad pone en riesgo su vida o deteriora gravemente su calidad de vida; si tiene exacerbaciones puntuales pero graves, que requieren de ingreso y ponen en peligro su vida; o si ha requerido 2 o más hospitalizaciones en el último año por asma. En una reciente publicación12, incluso un solo ingreso en UCI o planta es suficiente para considerar esa asma como grave. En la misma línea, también se consideró asma grave si el paciente no responde al tratamiento convencional optimizado, que realiza adecuadamente; si alcanza el control de la enfermedad, pero con un tratamiento que produce demasiados efectos adversos a juicio del pediatra; o si tiene una sintomatología frecuente a pesar de realizar adecuadamente el tratamiento de mantenimiento. Asimismo, para completar el espectro de situaciones clínicas indicativas de asma grave, se han consensuado, en segunda ronda, factores extrínsecos a la propia enfermedad, incluyendo factores relacionados con el propio paciente o su entorno social. Así, se ha considerado que la definición de asma grave puede incluir a los pacientes que consumen recursos sanitarios de manera regular, frecuente y justificada, o que tienen un asma que empeora con factores psicosociales o ambientales que impiden su control (por ejemplo, falta de adherencia, mal manejo de los dispositivos), mala percepción de los síntomas y de la enfermedad, tabaquismo en el hogar, insalubridad o alérgenos no evitables), es decir, un asma grave de difícil control. Todos estos escenarios clínicos pueden servir de guía para ayudar al pediatra a identificar a los pacientes graves y a adaptar el manejo a esta circunstancia. Los panelistas también consideraron que sería útil disponer de un índice compuesto validado (valorando síntomas, exacerbaciones, función pulmonar y tratamiento requerido para el control) que permitiese identificar a los niños y adolescentes con asma grave y cuantificar la gravedad de la enfermedad. Esta recomendación es congruente con el alto número de situaciones clínicas que se han considerado como definitorias de asma grave en este apartado.
Entre los ítems no consensuados del bloque I destaca la exclusión de la definición de asma grave de los pacientes que tienen, como hallazgo aislado y sin otro dato objetivo de gravedad, una función pulmonar con un volumen espiratorio forzado en el primer segundo (FEV1) inferior al 80%, a pesar de que este sea un dato reiterado en numerosas guías. Asimismo, los autores consideran que un FEV1>80% no excluye la presencia de un asma grave.
En el bloque II se trató el tema de la monitorización del control del asma pediátrica grave. Es importante destacar que, siguiendo las recomendaciones de las guías GEMA o GINA, el panel consensuó que en la monitorización del paciente, además de conseguir el control actual de la enfermedad, se debe evaluar y reducir el riesgo futuro asociado a la enfermedad (empeoramiento, exacerbaciones, disminución de la función pulmonar y efectos adversos del tratamiento). Para esta monitorización se recomienda el uso de cuestionarios diseñados específicamente para población pediátrica y, además, se considera que no es suficiente con las preguntas clínicas de la anamnesis para la evaluación del grado de control del paciente pediátrico con asma grave. Sin embargo, no hubo acuerdo a la hora de elegir un cuestionario. Preguntados concretamente por la mejor herramienta para determinar el grado de control del paciente pediátrico con asma grave, no hubo consenso en si era el cuestionario Asthma Therapy Assessment Questionnaire (ACQ) pediátrico, el Asthma Control Test (ACT) pediátrico o el cuestionario Control del Asma en Niños (CAN), aunque este último estuvo en el límite del consenso.
A falta de una respuesta concreta, los panelistas se inclinaron por aceptar en segunda ronda que, para evaluar el grado de control de los pacientes pediátricos con asma grave, hay que seguir las recomendaciones de las guías GEMA (cuestionario CAN, espirometría en niños mayores y, en algunos pacientes, posiblemente FeNO)9. Además, se consideró que, para el diagnóstico y control del asma grave, es muy útil agotar todas las posibilidades diagnósticas y de evaluación (clínica, función pulmonar, investigación alergológica, FeNO, citología de esputo e, incluso, lavado broncoalveolar). Sin embargo, no se alcanzó consenso cuando se preguntó específicamente por el uso del análisis citológico de muestras de esputo en la valoración del control de pacientes pediátricos con asma grave y que presentan múltiples exacerbaciones, lo cual está en línea con otras guías como las de la ERS/ATS12, que tampoco recomiendan su uso de manera generalizada. En la práctica y a modo de resumen, los panelistas consideraron que, a la hora de evaluar el grado de control en el paciente pediátrico con asma grave, hay que tener en cuenta los fármacos necesarios para alcanzar ese control, los efectos adversos asociados a la medicación, la reducción del número de exacerbaciones y la calidad de vida del paciente. Finalmente, es interesante destacar que el panel consideró que la formación del especialista es esencial para detectar una posible falta de control, ya que la monitorización se realiza básicamente a través de parámetros clínicos, que muchas veces están sujetos a la percepción que tiene el paciente o la familia de la enfermedad.
La derivación del paciente con asma grave centró el bloque III de la encuesta. Existen directrices sobre la derivación de los pacientes asmáticos desde Atención Primaria (AP) a los servicios de urgencias7 y a atención especializada en diferentes guías1,18,19. Respecto a los ítems que indagaban si la derivación de pacientes con asma grave es la correcta, los médicos opinan que no es infrecuente que haya pacientes con asma grave atendidos por el pediatra de AP que se derivan tarde al especialista. De manera congruente, se acordó que la derivación al especialista del paciente con asma grave debería basarse en unos criterios de derivación claros y consensuados entre los pediatras de AP y los especialistas en asma pediátrica, y no en el criterio individual de cada pediatra. Además, se consideró que el pediatra de AP debería derivar al especialista, de forma preferente, a los pacientes con asma grave, aunque en ese momento estuviera bien controlada. Por el contrario, no hubo consenso ante el ítem que cuestionaba si todos los niños asmáticos atendidos por el pediatra de AP, independientemente de su gravedad, debían pasar al menos una vez por el especialista para una evaluación.
En el último bloque de la encuesta se intentó aclarar algunos conceptos sobre la actitud terapéutica ante el niño con asma grave. La mayoría de los ítems de este bloque se centraron en el uso de omalizumab, un anticuerpo monoclonal que bloquea la inmunoglobulina E libre sérica, implicada en las manifestaciones clínicas del asma alérgica20. La eficacia del omalizumab en asma grave se ha demostrado en ensayos clínicos en pacientes mayores de 6 años20–25. Concretamente, en la población pediátrica se han demostrado mejorías estadísticamente significativas en síntomas diurnos y nocturnos, reducción del uso de medicación26, días con asma24, marcadores inflamatorios, exacerbaciones, visitas a urgencias, hospitalizaciones, visitas al médico y calidad de vida, y la abolición de las exacerbaciones estacionales relacionadas con infecciones virales20–25. Los autores están de acuerdo en que probablemente los resultados en la práctica clínica habitual son superiores a los obtenidos en los ensayos clínicos27. Las guías más recientes1,10 sitúan omalizumab en el escalón previo al tratamiento con glucocorticoides orales. Esta recomendación está apoyada en un nivel de evidencia A1.
Finalmente, también hubo acuerdo en que deberían existir unidades específicas de diagnóstico, control y tratamiento del niño con asma grave, de las que ya hay experiencia en adultos28.
Este documento tiene las limitaciones propias de la metodología Delphi. Destacan la dificultad para matizar las valoraciones personales de los expertos y el hecho de no estar exento de posibles influencias de sus promotores. Sin embargo, estas limitaciones se han tratado de acotar al máximo, pues los patrocinadores no participaron en el análisis e interpretación de los resultados, ni en la redacción y corrección del documento.
En resumen, el asma grave es un problema relevante en la población pediátrica que consume una gran cantidad de recursos1,8. Aunque el conocimiento del asma ha mejorado en los últimos años, persiste un gran número de incertidumbres y controversias sobre el asma grave pediátrica29,30. Estas incertidumbres pueden deberse, al menos en parte, a la heterogeneidad de la enfermedad y a la falta de un conocimiento profundo de los mecanismos que subyacen bajo sus distintos fenotipos31. La definición de asma grave, las recomendaciones de seguimiento, derivación y tratamiento también son muy heterogéneas. Este documento aporta algunas pautas prácticas que pueden aclarar conceptos y ayudar al pediatra a optimizar el manejo de la enfermedad.
FinanciaciónEste trabajo ha sido financiado y subvencionado sin restricciones por Novartis Farmacéutica S.A.
Conflicto de interesesCS-S y AN declaran haber participado en ponencias y cursos para Novartis Pharma.
Los autores agradecen el soporte editorial en la redacción de este artículo a Nature Publishing Group Iberoamérica y al Dr. Pablo Rivas.