Presentamos una revisión de la evidencia sobre el tratamiento de la bronquiolitis aguda. Hay pruebas suficientes de la falta de eficacia de la mayoría de las intervenciones evaluadas en la bronquiolitis. Aparte de la oxigenoterapia, la fluidoterapia intravenosa, la aspiración de secreciones y la ventilación mecánica, pocas opciones de tratamiento son beneficiosas. Existen dudas sobre la eficacia de broncodilatadores inhalados (salbutamol o adrenalina), con o sin suero salino hipertónico, lo que sugiere que debe hacerse un uso selectivo de los mismos como ensayos terapéuticos en bronquiolitis moderada-graves. En casos con fracaso respiratorio parecen útiles el heliox y las técnicas de ventilación no invasiva, en pacientes con apneas las metilxantinas y en pacientes graves intubados el surfactante y la ribavirina inhalados. La evidencia disponible es contraria al uso del salbutamol vía oral, la adrenalina vía subcutánea, los fármacos anticolinérgicos, los corticoides inhalados o sistémicos, los antibióticos, la inmunoglobulina intravenosa o en aerosol, la fisioterapia respiratoria y otros (óxido nítrico, desoxirribonucleasa humana recombinante, interferón recombinante, furosemida nebulizada, etc).
A review of the evidence on treatment of acute bronchiolitis is presented. There is sufficient evidence on the lack of effectiveness of most interventions tested in bronchiolitis. Apart from oxygen therapy, fluid therapy, aspiration of secretions and ventilation support, few treatment options will be beneficial. There are doubts about the efficacy of inhaled bronchodilators (salbutamol or adrenaline), with or without hypertonic saline solution, suggesting that these options should be selectively used as therapeutic trials in moderate-severe bronchiolitis. Heliox and non-invasive ventilation techniques, methylxanthine could be used in cases with respiratory failure, in patients with apnea, and surfactant and inhaled ribavirin in intubated critically ill patients. The available evidence does not recommend the use of oral salbutamol, subcutaneous adrenaline, anticholinergic drugs, inhaled or systemic corticosteroids, antibiotics, aerosolized o intravenous immunoglobulin, respiratory physiotherapy and others (nitric oxide, recombinant human deoxyribonuclease, recombinant interferon, nebulised furosemide and so on).
Presentamos una revisión de la evidencia sobre tratamiento de la bronquiolitis aguda. Esta revisión forma parte de la documentación elaborada para la «Conferencia de Consenso sobre Bronquiolitis Aguda», en el que se sustenta el estudio de idoneidad del proyecto titulado «Variabilidad e idoneidad del manejo diagnóstico y terapéutico de la bronquiolitis aguda» (estudio «aBREVIADo»: BRonquiolitis-Estudio de Variabilidad, Idoneidad y ADecuación). La metodología de la revisión ha sido publicada en un artículo previo de esta serie1.
IntroducciónLa literatura publicada en relación con el tratamiento de la bronquiolitis aguda (BA) es muy abundante, con múltiples ensayos clínicos aleatorizados (ECA) en las distintas intervenciones analizadas. La síntesis de la información de estos ECA es también sólida, fundamentada en guías de práctica clínica (GPC) y revisiones sistemáticas (RS) con o sin metanálisis (MA)
Destacamos 3 GPC sobre BA, actuales y con rigurosa metodología: la de American Academy of Pediatrics (AAP)2, la de Scottish Intercollegiate Guideline Network (SIGN)3 y la del Cincinnati Children′s Hospital Medical Center (CCHMC)4. El repertorio de GPC National Guideline Clearinghouse acaba de publicar la síntesis comparativa de estas 3 GPC que abordan un mismo problema de salud5. Las GPC clasifican como alta la fuerza de las recomendaciones de muchas intervenciones, dado que están basadas en RS de la Colaboración Cochrane. Se reconocen al menos las siguientes revisiones de la Cochrane sobre intervenciones en BA: adrenalina6, antibióticos7, beta-2-adrenérgicos8,9 bromuro de ipratropio10,11, corticoides12–15, fisioterapia16,17, inmunoglobulinas18–20, ribavirina21,22, suero salino (SS) hipertónico23 y surfactante24. Las GPC se deben actualizar y contextualizar, pues no siempre reflejan la práctica clínica habitual para todos los países.
Otras RS no publicadas en la Colaboración Cochrane, pero de interés, han abordado el tratamiento con beta-2-adrenérgicos25, corticoides26, ribavirina27 o bien revisiones generales28. Son muy comunes también las revisiones de autor sobre este tema publicadas en los últimos años en revistas de prestigio: Pediatr Infect Dis J29, Med J Aust30, Lancet31, Arch Dis Child32 o Pediatr Clin N Am33, entre otras, así como artículos de debate34,35 y múltiples cartas al editor. También merece una mención especial la profundidad del informe de la Agency of Healthcare Research and Quality36.
En España la literatura al respecto también es recurrente. Destacamos la publicación en Anales Españoles de Pediatría de 2 artículos de revisión sobre BA fundamentados en los principios de la medicina basada en pruebas y una editorial37–39, de indudable interés. En dicha editorial ya se concluía que sería muy útil elaborar y consensuar en nuestro país recomendaciones sobre tratamiento basadas en la mayor evidencia disponible, con el objetivo de poder trabajar con el máximo rigor científico, adecuar nuestra actuación clínica a la gravedad de la BA y disminuir nuestra variabilidad asistencial (especialmente la innecesaria). En aquel momento se abogaba por un modelo de conferencia de consenso para elaborar protocolos y/o vías clínicas de calidad en nuestro trabajo diario (en atención primaria, urgencias y hospitalización)37. Es bien conocido que uno de los problemas que desde el punto de vista práctico tiene el pediatra es que no existe acuerdo global acerca del correcto tratamiento farmacológico de la BA.
La cuestión está en definir el medicamento correcto para el paciente adecuado en la dosis apropiada y en el tiempo oportuno35. La existencia de múltiples ECA en los últimos 25 años sobre las potenciales intervenciones farmacológicas en la BA (principalmente broncodilatadores, antiinflamatorios y antivíricos) y el escaso avance en el manejo de los infrecuentes casos de BA moderada-grave llegan a plantear incluso la duda de si es necesario continuar algunas líneas de investigación40. El mayor avance en el desarrollo farmacológico de la BA en los últimos años se debe al campo de la prevención (desarrollo de anticuerpos monoclonales como inmunoprofilaxis), mientras que en el tratamiento son menos las novedades (heliox, SS hipertónico, etc).
Para analizar las intervenciones terapéuticas en el tratamiento de la BA nos basamos en los estudios con diseño de ECA, tras cuyo análisis global encontramos 2 limitaciones importantes:
- a)
Existe una gran variabilidad entre los diferentes ECA en relación con los componentes de la pregunta clínica (PECOT):
- •
Pacientes (P): edad de los pacientes (<24 meses o <12 meses en la mayoría de los estudios), etiología vírica (solo por virus respiratorio sincitial [VRS] o mixtos), episodios de hiperreactividad bronquial (considerar exclusivamente primer episodio o también episodios recurrentes de sibilancias, lo que puede confundir con pacientes con asma), lugar de estudio (hospitalizados principalmente, pero también atendidos en urgencias, atención primaria y en cuidados intensivos). La utilización de distintos criterios clínicos para definir la BA hace difícil establecer comparaciones entre los diferentes estudios publicados, en particular en lo relacionado con la respuesta al tratamiento según los diagnósticos (bronquiolitis o asma del lactante) y con los efectos a largo plazo. La falta de precisión para el término «sibilancia» añade dificultades en esta área, no siendo fácil distinguir en un lactante sibilante la diferencia entre asma, bronquitis sibilante y bronquiolitis. La correcta identificación permitiría el correcto manejo clínico. Un tema crucial es cómo definir la BA. Se reconocen 2 grupos principales de «bronquiolitis»34,41:
- 1)
«UK bronchiolitis»: predomina el edema y las secreciones en vía aérea, con auscultación de crepitantes como signo guía y en lactantes <12 meses (es la definición que se sigue principalmente en Reino Unido, Oceanía y en parte de Europa).
- 2)
«USA bronchiolitis»: predomina el broncoespasmo, con auscultación de sibilancias como signo guía y en lactantes <24 meses (es la definición que se sigue principalmente en Norteamérica y en parte de Europa).
El intentar distinguir en las infecciones por VRS entre bronquiolitis (predominio de crepitantes) y bronquitis sibilante (predominio de sibilancias) implica reconocer diferencias en el proceso inflamatorio y, por tanto, en el efecto terapéutico y el seguimiento a largo plazo. En los primeros 3 años de vida no es fácil diferenciar si las sibilancias inducidas por virus son consecuencia de una enfermedad reactiva de las vías aéreas postbronquiolitis o la primera manifestación de asma del lactante. Según esto, la utilización de broncodilatadores o corticoides no tendrá efecto en el caso de la definición de «UK bronchiolitis» (edema y secreción como factores fisiopatológicos principales), pero si quizá en un 20–30% en el caso de utilizar la definición de «USA bronchiolitis», pues es el porcentaje que puede manifestar evolutivamente asma y beneficiarse de un tratamiento apropiado para esta entidad (broncoespasmo e inflamación como factores fisiopatológicos principales). El problema es reconocer correctamente cada tipo diferente de fenotipo de lactante sibilante.
- 1)
- •
Intervención o exposición (E): diferentes vías de administración de algunos fármacos (nebulizado, oral, parenteral), diferentes dosis (muy variables en ocasiones entre estudios) con distintos intervalos y tiempo de duración.
- •
Comparación (C): en su mayoría frente a placebo, pero también frente a otras intervenciones terapéuticas.
- •
Medidas de efecto (outcome) principales (O): muy variables. Se pueden clasificar en 2 grandes grupos: medidas clínicas (escalas de puntuación clínica, saturación de oxígeno (SatO2), frecuencia cardiaca (FC), frecuencia respiratoria (FR), etc.) y de gestión clínica (necesidad y días de ingreso en hospital, necesidad y días de soporte respiratorio, reingresos, uso adicional medicación, etc). Excepcionalmente otras medidas: destacar los episodios de hiperreactividad bronquial y la función pulmonar. Cabe considerar la falta de métodos estandarizados y uniformes para la evaluación del resultado (momento de la evaluación, escalas de puntuación clínica) entre los ECA. Hay múltiples escalas de puntuación clínica, como un instrumento relativamente objetivo de evaluar la gravedad de la BA, si bien hay 2 más utilizadas en los ECA sobre BA: el Respiratory Distress Assessment Instrument (RDAI), que puntúa de 0 a 1742 y el descrito por Wang, que puntúa de 0–1243. Otro factor que afecta el grado de respuesta obtenida es el tiempo transcurrido entre la aplicación del tratamiento y la determinación de la respuesta clínica o la realización de pruebas de función pulmonar. Es necesario validar una medida de resultado que refleje el estado pulmonar independientemente del nivel de alerta del participante y definir la mínima diferencia clínicamente importante de este resultado. Hay una falta de consistencia al determinar los resultados relevantes para evaluar la efectividad de las intervenciones y éstos pueden no ser clínicamente significativos. Por ejemplo, se han utilizado diferencias entre un 2–4% en la SatO2 como medida de resultado primaria, aunque la importancia clínica de este resultado es más que cuestionable. Las medidas como la necesidad de ingreso y la duración de la hospitalización, a pesar de ser importantes desde un punto de vista de utilización de los servicios sanitarios, pueden no ser adecuadamente sensibles para medir la mejoría que puede ofrecer el tratamiento44. Asimismo, los resultados de las pruebas de función pulmonar deben estandarizarse para que puedan ser sometidos a metanálisis.
Para las variables continuas (ej. puntuación clínica promedio, SatO2, duración de hospitalización) se determinó el efecto del tratamiento comparado con el grupo control (GC) por la estimación no sesgada del tamaño del efecto; se convirtieron las puntuaciones clínicas promedio a la diferencia media estandarizada (DME), debido a que se han utilizado diferentes escalas clínicas en los ECA. Para la puntuación clínica promedio, un tamaño del efecto <0 (es decir, reducción de las puntuaciones de gravedad) indica un beneficio y >0 (es decir, incremento de las puntuaciones de gravedad) indica que el tratamiento es perjudicial. Para las variables dicotómicas (ej. mejoría en la puntuación clínica, ingreso en el hospital) se determinó el efecto del tratamiento comparado con el GC a través de la odds ratio (OR). Una OR <1 indica que el tratamiento es beneficioso, mientras OR >1 que es perjudicial.
- •
Tiempo (T): mayoritariamente a corto plazo, con medidas de efecto valoradas durante el ingreso (en muchas ocasiones durante minutos u horas); excepcionalmente seguimiento durante semanas, meses o años (principalmente en estudios con corticoides, en donde se asocia el valor preventivo —y no solo terapéutico— de la intervención).
Toda esta amplia variabilidad en cada uno de los componentes del acrónimo PECOT dificulta la comparación entre diferentes estudios, limitando la posibilidad y fiabilidad de las RS con MA. En las conclusiones para la investigación de las RS de la Colaboración Cochrane sobre intervenciones terapéuticas en BA se puede extraer información relevante de cómo mejorar la calidad de los futuros ECA.
- •
- b)
La mayoría de los ECA presentan una calidad metodológica limitada. En los criterios de calidad ad-hoc creados para la valoración de los ECA detectamos que las limitaciones principales de los diferentes ECA proceden de los apartados método de aleatorización (siendo excepcional que se pueda confirmar que sigue una secuencia oculta) y estudio estadístico (no se realiza siempre un análisis por intención de tratar ni un control de covariables no equilibradas con la aleatorización). En la mayoría de los ECA no se encuentran diferencias estadísticamente significativas en sus resultados debido a su pequeño tamaño muestral (es habitual la ausencia de consideraciones sobre el tamaño de la muestra) y, por lo tanto, escasa potencia. Además, cuando los ECA de pequeño tamaño obtienen diferencias estadísticamente significativas, suelen tener una precisión muy limitada (intervalos de confianza muy amplios). Por ejemplo, para encontrar diferencias mayores al 20% entre la eficacia de 2 tratamientos utilizados en la BA (importancia clínica asumida) se necesita un tamaño muestral entre 120–200 casos (60–100 casos en cada grupo) (considerando n1=n2, con un error alfa=0,05, error beta=0,10, potencia=90%)37. El amplio margen en el tamaño de la muestra depende de la variable resultado que analicemos (puntuación clínica, SatO2, FR, FC, etc.). Un apartado esencial también es elegir medidas principales (end points) adecuadas.
Los objetivos del tratamiento de la BA son41: disminuir la morbi-mortalidad, disminuir los costes sociales y económicos (reducir los ingresos hospitalarios y días de hospitalización) y disminuir las secuelas a largo plazo (patología respiratoria recurrente y, quizás, asma).
A continuación expondremos la síntesis de la evidencia para cada intervención terapéutica en BA.
Tratamiento de soporteLas medidas generales utilizadas en el tratamiento de la BA son:
- 1.
Mantenimiento de una adecuada hidratación y nutrición: fraccionar tomas e ingesta de líquidos; si es posible por vía oral/enteral o en su defecto por vía parenteral. Se ha estudiado la cuestión de si la hidratación por vía enteral es tan segura como la vía parenteral45, dado que la vía enteral puede presentar el teórico riesgo de aumentar la resistencia de las vías aéreas. No se puede obtener una adecuada respuesta, dado que toda la información al respecto procede de 2 estudios de cohortes46,47. En el compendio resumen de National Guideline Clearinghouse sobre BA5, las 3 GPC recomiendan la fluidoterapia intravenosa cuando no es posible un adecuado aporte oral: la AAP2 lo considera en las situaciones con FR >60–70 respiraciones por minuto, con abundantes secreciones nasales y aleteo/retracción costal, que pudiera favorecer la aspiración de alimentos en caso de alimentación enteral; SIGN recomienda la posibilidad de alimentación nasogástrica3. En la fluidoterapia parece existir un balance positivo entre los beneficios (prevenir la deshidratación) y los riesgos (sobrehidratación, especialmente si se desarrolla una SIADH)2.
- 2.
Asegurar la oxigenación: administrar oxígeno suplementario en los pacientes hipóxicos (SatO2 <92%), si bien no existe consenso sobre el punto de corte crítico, que en algunos estudios es menor (<90%) o mayor (<94%). En el compendio resumen de National Guideline Clearinghouse sobre BA5, las 3 GPC recomiendan la oxigenoterapia cuando la SatO2 cae por debajo de un umbral, con pequeñas diferencias: <90% (AAP)2, <91% (CCHMC)4, o ≤92% (SIGN)3. También existen pequeñas diferencias respecto cuándo se debe retirar el suplemento de oxígeno: si SatO2 >90% con mínima dificultad respiratoria y adecuada ingesta oral (AAP)2 o si SatO2 >94% (CCHMC)4. A medida que el curso clínico mejora no se considera necesario la monitorización continua de la SatO22,4.
- 3.
Desobstrucción nasal: lavados nasales con suero fisiológico (con o sin pequeña aspiración de secreciones). La aspiración nasal es un procedimiento considerado apropiado en las 3 GPC5, con la expresa indicación en la guía de CCHCM de que esta aspiración se realice (si indicado clínicamente) antes de la alimentación y antes de los tratamientos nebulizados4.
- 4.
Posición en decúbito supino con una inclinación de 30°, ligera hiperextensión y lateralización de la cabeza. No existen estudios experimentales que apoyen esta afirmación.
- 5.
Evitar factores que empeoran la sintomatología del paciente: inhalación pasiva de tabaco y otros irritantes bronquiales.
Estas medidas, junto con una monitorización adecuada, constituyen el tratamiento de soporte de uso generalizado y uniformemente aceptado. Las pruebas científicas sobre las que se apoya esta terapia son escasas. Y la mayoría constituyen extrapolaciones derivadas de la práctica clínica habitual y datos obtenidos en otros procesos respiratorios (no exclusivamente BA), perpetuadas en sucesivas revisiones y consensos de expertos48. Es evidente que la imposibilidad ética de realizar ECA sobre estas medidas terapéuticas (no ofrecer oxigenoterapia a un GC, por ejemplo), mantiene en el rango de consenso la adopción de las mismas.
BroncodilatadoresBeta-2-agonistas (salbutamol)Se ha postulado que el efecto broncodilatador de los beta-2-agonistas podría ser beneficioso en el tratamiento sintomático de la BA y, de hecho, se utilizan de forma muy habitual en esta entidad. Es probable que su uso generalizado en la BA se deba a la semejanza de los síntomas y signos entre BA y asma. Sin embargo, la fisiopatología de la BA consiste principalmente en la inflamación de los bronquiolos terminales y alvéolos con edema de las vías respiratorias y mucosidad, lo que conlleva obstrucción de las vías respiratorias. Los mediadores de broncoespasmo se han demostrado presentes en cantidades diferentes en niños con BA, por lo que no todos tienen la misma probabilidad de presentar propensión a padecer broncoespamos e hiperreactividad bronquial.
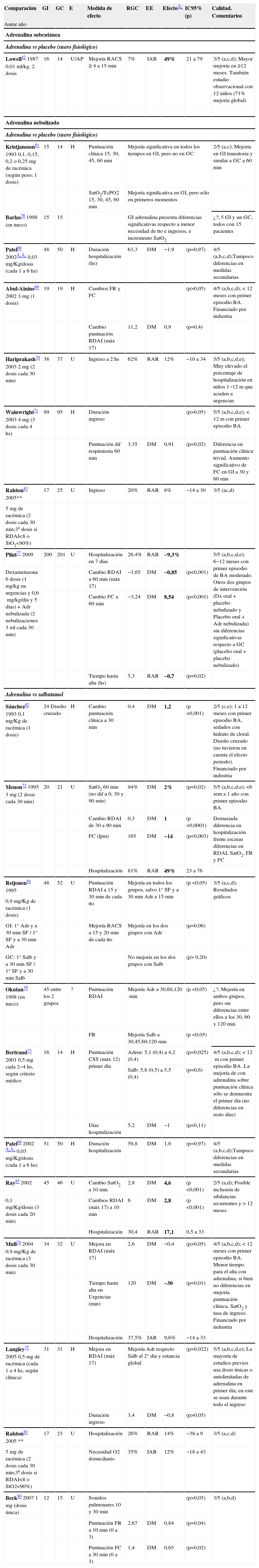
En el caso del salbutamol hay que analizar las 2 vías habituales de aplicación en la BA: nebulizada (preferente) y oral (excepcional). En la tabla 1 se exponen los resultados de todos los ECA sobre salbutamol en el tratamiento de la BA.
Tabla simplificada de tratamiento: SALBUTAMOL
| Comparación Autor año | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95%(p) | Calidad. Comentarios |
| Salbutamol nebulizado | |||||||||
| Salbutamol nebulizado vs placebo (SF) | |||||||||
| Schuh62 1990 Salbutamol 0,15mg/Kg/dosis, 3 dosis cada hora | 21 | 19 | U | Porcentaje descenso FR | 8% | IAB | 11,6 | (p=0,015) | 3/5 (b,c,d); Diferencias significativas, pero escasa importancia clínica (además, más de ingresos en GI) |
| Cambio puntuación clínica (máx 3) | 0,37 | DM | 0,49 | (p=0,007) | |||||
| Porcentaje ingresos | 5,2 | IAR | 13,8% | −5,8 a 33,4 | |||||
| Ho56 1991 Salbutamol 2,5mg, con diseño Cruzado con SF nebulizado | 11 | 8 | H | SatO2 a los 10min | 97,6% | DM | −2,6% | (p <0,05) | 3/5 (b,c,d); Disminución de la SatO2 en GI, si bien la SatO2 de todos fuez >95% en todo momento |
| SatO2 a los 30min | 97,5% | DM | −2,1% | (p <0,05) | |||||
| Klassen63 1991 Salbutamol 0,02ml/Kg (2 dosis, a 0 y 30min) | 42 | 41 | U | Puntuación RDAI 30min (máx 17) | 7,75 | DM | −1,75 | (p=0,04) | 3/5 (a,b,d); Descenso en el RDAI, pero escasa importancia clínica (además, más de ingresos en GI) |
| Pacientes con disminución RDAI ≥ 3 | RR | 1,5 | 1,06 a 2,22 | ||||||
| Porcentaje ingresos | 26% | IAR | 4,1% | −15,4 a 22,6 | |||||
| Sly55 1991 Salbutamol 5mg (una dosis) | 11 | 11 | H | Flujo máximo en la CRF | Compara el valor individual de cada niño consigo mismo | (no datos) | 1/5 (d); Estudio con muchas limitaciones | ||
| Schweich49 1992 Salbutamol 0,15mg/Kg (2 dosis, a 0 y 30min) | 13 | 12 | U | Cambio puntuación clínica (máx 17) después 1a dosis | −1,58 | DM | −0,04 | (p>0,05) | 4/5 (a,b,c,d); Dudas acerca de las características de los pacientes incluidos (BA y asma) |
| Cambio puntuación clínica tras 2a dosis | −1,33 | DM | −2,75 | (p=0,017) | |||||
| SatO2 después 1a dosis | 0,7 | DM | −4,2 | (p=0,018) | |||||
| Reingreso por patología respiratoria en 6 meses | 10,5% | IAR | 39,5% | 14 a 65 | |||||
| Gadomski54 1994¿¿ Salbutamol 0,15 mg/Kg (2 dosis, a 0 y 30 min) | 22 | 23 | U/AP | Media cambio FR a 60min | −6 | DM | −5 | (p>0,05) | 3/5 (a,c,d). Financiado por la industria |
| Media cambio FC a 60min | −4 | DM | 6 | (p>0,05) | |||||
| Media cambio SatO2 a 60min | 0,1 | DM | 0 | (p>0,05) | |||||
| Ingreso hospitalario | 11,1% | IAR | 3,3% | (p>0,05) | |||||
| Gadomski53 1994** Salbutamol 0,15mg/Kg (2 dosis, a 0 y 30min) | 32 | 32 | U/AP | (p>0,05) | 3/5 (a,c,d); Similar al anterior, pero considera un grupo abierto de 41 niños de 3−24 meses con sibilancias recurrentes y aplican 2−3 dosis de Salb: único que mejoró puntuación clínica respecto a los otros 4 grupos | ||||
| Cengizlier57 1997** Salbutamol cámara, 200mcg/dosis, cada 3hs | 12 | 12 | H | Diferencias puntuación clínica (máx 12) entre ingreso y alta | 1,8 | DM | 0,1 | (p>0,05) | 1/5 (a) |
| Goh58 1997a Salbutamol 0,75mg (si ≤ 6m) y 1,5 mg (si > 6 m) | 30 | 29 | H | Puntuación clínica (máx 15) a los 3 días | 3,1 | DM | −0,1 | (p>0,05) | 2/5 (a,d); Ni salbutamol ni bromuro de ipratropio disminuyen gravedad ni ingreso comparado con placebo u oxígeno nebulizado |
| Can64 1998 Salbutamol 0,15mg/Kg (1 dosis); si RDA > 5 a los 30min una 2a dosis | 52 | 42 | U | Puntuación clínica (máx 25) a 30min | 9,7 | DM | −2,7 | (p <0.001) | 2/5 (a,d); 7 sem a 24 meses con primer episodio BA. También se comparó con otro grupo control de humedad en tienda (n=52), con similares resultados. No diferencias entre los dos grupos control (SF y humedad en tienda). Resultados discordantes |
| Puntuación clínica (máx 25) a 60min | 10,2 | DM | −5 | (p <0.001) | |||||
| Porcentaje con RDA > 5 a los 30min | 3% | IAR | 25% | 12 a 38 | |||||
| Dobson59 1998 Salbutamol 1,25mg (si <10Kg) y 2,5mg (si > 10Kg) cada 2hs (primeras 24hs) y cada 4hs (48hs siguientes) | 23 | 29 | H | SatO2 a 24hs | 93,5% | RAR | 0,2% | (p=0,77) | 3/5 (a,c,d) |
| Alta a 72hs | 52,2% | IAB | 16,8% | (p=0,24) | |||||
| Karadag224 2008 Salbutamol 2,5mg cada 6hs | 23 | 23 | H | Diferencia en puntuación clínica Wang (máx 12) a las 24hs | 5,4 | DM | −0,9 | (p=0,006) | 4/5 (a,b,c,d); <12 meses con primer episodio BA. Considera otro GI con BI (n=22). En la comparación considera los resultados conjuntos de Salb+BI |
| Días de ingreso | 2,4 | DM | 0,1 | (p>0,05) | |||||
| Salbutamol nebulizado vs salbutamol MDI | |||||||||
| Torres51 1997 Salbutamol 1,5mg + SF MDI (4 puffs con cámara) | 11 Diseño cruzado | UCI | Porcentaje de mejoría de la resistencia respiratoria a 4 hs | 2 | DM | −12 | (p=0,05) | 5/5 (a,b,c,d,e); BA intubados. Tampoco diferencias significativas a los 0, 30min y 1 y 2 hs. Financiado por la industria | |
| Porcentaje de mejoría de la distensibilidad respiratoria a 4hs | 15 | DM | −3 | (p=1) | |||||
| Salbutamol nebulizado vs bromuro de ipratropio | |||||||||
| Goh58 1997a Salbutamol 0,75mg (si ≤6m) y 1,5 mg (si >6 m). | 30 | 30 | H | Puntuación clínica (máx 15) a los 3 días | 3,1 | DM | −0,1 | (p>0,05) | Ni Salb ni BI disminuyen gravedad ni ingreso comparado con placebo o con oxígeno nebulizado |
| Salbutamol nebulizado + bromuro de ipratropio vs placebo | |||||||||
| Schuh52 1992 Salbutamol 0,15mg/Kg + BI 250 mcg/dosis (2 dosis, separadas 1h) | 36 | 33 | U | Descenso FR a 120min (rpm) | 8,6 | DM | 2 | (p=0,42) | 6−26m con primer episodio BA. El GC era con salbutamol + SF nebulizados |
| Porcentaje ingresos | 30,3 | IAR | 13,9% | −9 a 37 | |||||
| Wang60 1992 | 14 | 16 | H | SatO2 | (p>0,05) | 2/5 (a,b); Estudio con confuso diseño y limitaciones | |||
| Salbutamol 0,15mg/Kg y 1h después SF | Puntuación clínica(máx 12) | (p>0,05) | |||||||
| Duración ingreso | (p>0,05) | ||||||||
| SF nebulizado y 1h después | 15 | 16 | H | SatO2 | (p>0,05) | ||||
| BI 125mcg (≤6m) y 250mcg (>6m) | Puntuación clínica(máx 12) | (p>0,05) | |||||||
| Duración ingreso | (p>0,05) | ||||||||
| Salbutamol + BI a dosis anteriores | 17 | 16 | H | SatO2 | Mejoría SatO2 respecto 2 grupos de intervención previos, pero no frente GC | (p>0,05) | |||
| Puntuación clínica(máx 12) | (p>0,05) | ||||||||
| Duración ingreso | (p>0,05) | ||||||||
| Chowdhury61 1995 Salbutamol 0,15mg/Kg cada 6hs (durante 36hs) | 20 | 22 | H | Descenso puntuación RDAI (máx 20) a 36hs | 3 | DM | 1,5 | (p=0,49) | 2/5 (a,d); Se consideró un tercer GI sólo con bromuro de ipratropio (n=23) |
| Duración ingreso (días) | 4,3 | DM | 0,2 | (p>0,05) | No útil el salbutamol y/o bromuro de ipratropio nebulizado (sólo o en combinación) | ||||
| Salbutamol 0,15mg/Kg + BI 12,5mcg/Kg cada 6hs (durante 36hs) | 24 | 22 | H | Descenso puntuación RDAI (máx 20) a 36hs | 2,5 | DM | 1 | (p=0,49) | |
| Duración ingreso (días) | 4,3 | DM | 0,3 | (p>0,05) | |||||
| Salbutamol oral | |||||||||
| Salbutamol oral vs placebo (SF) | |||||||||
| Gadomski54 1994¿¿ | 23 | 19 | U/AP | Media cambio FC a 60min | −5 | DM | 20 | (p=0,008) | 3/5 (a,c,d) |
| Salbutamol 0,15mg/Kg (1 dosis) | Media cambio SatO2 a 60min | 0,1 | DM | 0,9 | (p>0,05) | ||||
| Ingreso hospitalario | 18,2% | RAR | 11,5% | (p>0,05) | |||||
| Gadomski53 1994** Salbutamol 0,15mg/Kg (1 dosis) | 32 | 32 | U y AP | (p>0,05) | 3/5 (a,c,d); Similar al anterior, pero considera un grupo abierto de 41 niños de 3−24 meses con sibilancias recurrentes y aplican 2−3 dosis de Salb: único que mejoró puntuación clínica respecto a los otros 4 grupos | ||||
| Cengizlier57 1997** | 11 | 12 | H | Diferencias puntuación clínica (max 12) entre ingreso y alta | 1,8 | DM | 0,2 | (p>0,05) | 1/5 (a) |
| Salbutamol, 0,1mg/Kg/dosis cada 6hs | |||||||||
Adren.: adrenalina; AP: atención primaria ambulatorio; BA: bronquiolitis aguda; CP: cohortes prospectivo; CR: cohortes retrospectivo; DBP: displasia broncopulmonar; DM: diferencia de medias; E: entorno asistencial; Ec: estudio ecológico; ECA: ensayo clínico aleatorizado; EE: estimador de efecto; EPC: enfermedad pulmonar crónica; DAR: diferencia absoluta del riesgo; FC: frecuencia cardiaca; FR: frecuencia respiratoria; GI: grupo intervención; GC: grupo control; H: hospital; HR: hazard ratio; IC95% (p): intervalo de confianza del 95% (significación estadística); IAB: incremento absoluto del beneficio; IAR: incremento absoluto del riesgo; IO: índice de oxigenación; IV: índice ventilatorio; ns: no significativo; OR: odds ratio; P: poblacional; Prev: prevalencia; Pvz: palivizumab; RDAI: Respiratory Distress Assessment Instrument; RGC: riesgo grupo control; RX: radiografía; RAB: reducción absoluta del beneficio; RAR: reducción absoluta del riesgo; RR: riesgo relativo; salb.: salbutamol; SatO2: saturación de oxígeno; SC: serie de casos; SF: suero fisiológico; SG: semanas de gestación; SS: suero salino; U: servicio de Urgencias; UCI: unidad de cuidados intensivos; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Volumen de la evidencia: existen 16 ECA con calidad media-baja (solo 4 estudios presentaron una calidad ≥4/5)49–52 y publicados entre 1990 y 2008.
Pacientes: el tamaño muestral de los trabajos es pequeño (grupo de intervención [GI] entre 11–52 y GC entre 8–42 pacientes); un ECA con diseño cruzado con 11 pacientes51. Edad <24 meses en todos los casos (en 3 ECA no se define edad de pacientes); 4 ECA con intervalo inferior: uno en <18 meses53, uno en <15 meses54, uno en <12 meses50 y uno en <6 meses55. Doce estudios especifican primer episodio de BA. Dos estudios consideran infecciones exclusivas por VRS. Ocho ECA en niños hospitalizados50,55–61, 5 en urgencias49,52,62–64, uno en UCI51 y 2 en urgencias y atención primaria53,54.
Intervención: salbutamol nebulizado con diferentes dosis e intervalos: de 0,15mg/kg/dosis (dosis preferente en los estudios) a dosis totales de 2,5mg. Generalmente se aplican de 1–3 dosis en los estudios y con intervalos variables (30min, 1, 2, 3, 4 o 6h). La duración del tratamiento se limitó al momento de ingreso.
Comparación: se compara en 15 estudios con placebo (suero fisiológico, asociando bromuro de ipratropio en 3 de ellos)49,50,52–64, en uno con bromuro de ipratropio58 y en uno con salbutamol en dispositivo inhalador51.
Medidas principales: las medidas principales de efecto son muy variables. Principalmente diferencias en la puntuación clínica, SatO2 e ingreso. Se han utilizado muy variadas escalas de puntuación clínica, siendo pocos los que utilizaron las parcialmente validadas (RDAI o RACS). Las puntuaciones clínicas se informaron de 2 maneras: mejoría en la puntuación clínica (variable dicotómica) o puntuación clínica promedio (variable continua).
Tiempo: seguimiento a corto plazo, durante el ingreso (generalmente se miden diferencias entre las dosis de aplicación del salbutamol).
Intensidad del efecto o fuerza de la asociación: once ECA no encuentran diferencias. Dos ECA encuentran diferencias significativas a favor del GI49,50, en relación con diferencias en la puntuación de síntomas, sin relevancia clínica. Un ECA encuentra diferencias significativas en contra del GI56 con empeoramiento de la SatO2, pero también sin relevancia. Dos ECA encuentran diferencias significativas con datos discordantes63,64, con leves mejorías clínicas en el GI, pero con incremento en el porcentaje de ingresos. En general, las diferencias son clínica y estadísticamente muy poco importantes y contradictorias.
Existen 2 RS (con MA) fundamentales sobre los broncodilatadores en el tratamiento de la BA: la inicialmente publicada en Pediatrics en 1997 por Flores y Horwitz25 y la recientemente publicada en Colaboración Cochrane en 2006 por Gadomski et al8 (actualización de una previa publicada por Kellner en el año 20009).
El estudio de Flores y Horwitz25 incluye un total de 8 ECA en los que se compara únicamente beta-2-agonistas (salbutamol) con placebo en lactantes con BA (5 ECA en pacientes ambulatorios con 251 pacientes y 3 ECA en pacientes ingresados con 82 pacientes). No se combinaron los resultados de los ECA en pacientes hospitalizados debido a la heterogeneidad existente en criterios de selección, características de los pacientes, modo de administrar la intervención y variables de resultado medidas. En los ECA de pacientes ambulatorios solo se detecta una mejoría mínima en la SatO2 (diferencia de medias ponderada [DMP]=1,2; IC del 95%: 0,8–1,6) y en la FC (DMP=1,4; IC del 95%: 0,8–2), sin cambios en la FR y la tasa y duración de la hospitalización. Este efecto a corto plazo con pequeña mejoría en la SatO2 y leve incremento en la FC, aunque presentan diferencias significativas, tiene un interés clínico marginal.
El estudio de Gadomski et al8 incluye un total de 22 ECA en el que se compara cualquier tipo de broncodilatador (beta-2-agonistas, agentes adrenérgicos y anticolinérgicos, y por cualquier vía de administración) con placebo en lactantes con BA: salbutamol nebulizado en 17 ECA, salbutamol oral en 4, bromuro de ipratropio en 8, metaproterenol en uno y fenoterol en uno (hay más intervenciones que ECA, debido a que en varios estudios se compara más de un fármaco y/o varias vías de administración). Existe evidencia de efecto estadísticamente significativo (pero de muy escasa importancia clínica) de los broncodilatadores para mejorar en las BA en régimen ambulatorio la puntuación de síntomas (DME=−0,68; IC del 95%:−0,87−−0,49) y la SatO2 (DMP=−0,84; IC del 95%: −1,59−−0,10), siendo menor en BA hospitalizadas. Estos resultados, sin embargo, no se tradujeron en una disminución del porcentaje de ingresos, ni su duración. Además, el subgrupo de ECA donde el efecto beneficioso era más marcado, era también el más débil desde el punto de vista metodológico, sobre todo por la inclusión de pacientes >12 meses con sibilancias (posiblemente no todos BA, dado que un porcentaje correspondería a pacientes asmáticos). Los criterios de inclusión de la población de estudio en algunos ECA incorporaban lactantes con sibilancias recurrentes, lo que puede haber sesgado los resultados a favor de los beta-2-adrenérgicos.
Consistencia entre estudios: la consistencia de los estudios es escasa, como se aprecia en el apartado previo. De los 4 ECA de mayor calidad (≥4/5), en un caso se obtiene algún resultado significativo poco relevante a favor del GI50, pero no en los otros49,51,52.
En la RS de Gadomski et al8 se divide el análisis en 2 subgrupos (pacientes hospitalizados y ambulatorios): se obtiene inferior mejoría en la puntuación clínica y SatO2 en los pacientes hospitalizados que en los ambulatorios. Los estudios demuestran que los broncodilatadores mejoran discretamente las puntuaciones clínicas de niños con BA leve y moderada, aunque no producen una mejoría significativa en la SatO2 ni disminuyen el porcentaje y duración de los ingresos.
Precisión de las estimaciones: escasa precisión de las estimaciones por el pequeño tamaño muestral de la mayoría de los ECA, que mejora en los resultados expuestos en la RS8. El número de estudios que utilizaron medidas de resultado similares sigue siendo pequeño, lo cual limita la confianza sobre la estimación del tamaño de efecto.
Estimación de sesgos: existe un alto riesgo de sesgos, derivado de la baja calidad de la mayoría de los estudios, así como de la no diferenciación entre casos de BA y de asma del lactante, fisiopatológicamente diferentes, lo que puede condicionar la respuesta favorable al salbutamol en el segundo supuesto. Muchos de los estudios que observan mejoría después de administrar beta-2-agonistas se realizan en niños mayores de 24 meses con episodios repetidos de sibilancias; en ellos sí podría resultar beneficiosa la utilización de beta-2-agonistas por la contribución del broncoespasmo a la fisiopatología de su obstrucción bronquial. Asimismo, han podido surgir posibles asociaciones por comparaciones múltiples (subgrupos y controles diferentes, dosis) o diferentes medidas de resultado, la mayoría sin interés clínico (y a muy corto plazo). Los distintos sistemas de puntuación no han sido validados, por lo que no hay certeza de que midan diferencias clínicas fundamentales; además, la puntuación clínica podría verse afectada por la acción que los broncodilatadores pueden tener sobre estado general del niño, a través de un efecto estimulante general no relacionado con la función respiratoria54. Solo 2 estudios fueron financiados parcialmente por la industria farmacéutica51,54.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, mayoritariamente basado en pequeños cambios de las escalas de puntuación clínica y SatO2, sin correlación con otras medidas de mayor impacto clínico (ingreso y duración). Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (12 de los 16 ECA incluían primeros episodios), y en todo caso serían representativos de los pacientes atendidos a nivel hospitalario. Las dosis y pautas de administración del salbutamol son heterogéneas aunque suficientes para evaluar la intervención.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario, por lo que la aplicación al paciente de atención primaria de los resultados observados es dudosa. El efecto observado tiene un escaso impacto clínico, por lo que no podemos predecir la magnitud de la respuesta al tratamiento en nuestros pacientes. Además, con la información clínica disponible no podemos predecir los casos que se pueden beneficiar del tratamiento, por lo que cualquier intento terapéutico tendrá que ser individualizado y monitorizado.
Balance riesgo-beneficio-coste: en 6 ECA se estudian los efectos adversos, principalmente en relación con elevación de la FC (de escasa relevancia clínica). En el MA de Gadomski et al8 se constatan diferencias significativas en los efectos adversos registrados, principalmente mayor taquicardia (en 2 ECA) y disminución de la SatO2 (en 2 ECA).
Existe un predominio de riesgos (efectos adversos, coste medicación y administración) sobre beneficios (mejoría clínica a corto plazo) en el uso rutinario de salbutamol, aunque no como para rechazar el ensayo terapéutico con salbutamol. No hay estudios de costes, pero se considera que el coste directo es de unos 50 $ por niño (medicación y cámara espaciadora)8.
Estimación del impacto de futuros estudios: sería necesario la realización de estudios con una mejor definición de pacientes (<12 meses con primer episodio de BA y excluir posible asma del lactante) e intervención (concretar dosis, intervalo y modo de administración), con mayor tamaño muestral y variables clínicas de interés (escala de puntuación clínica estandarizada y validada, hospitalización). Necesidad de ECA amplios multicéntricos, de alta calidad y escalas sensibles a cambios clínicos y variables a más largo plazo.
Salbutamol oralVolumen de la evidencia: existen 3 ECA con calidad media-baja publicados entre 1969–97. Estos 3 ECA eran ramas de tratamiento diferentes incluidos en el apartado previo de salbutamol inhalado53,54,57.
Pacientes: el tamaño muestral de los trabajos es pequeño (GI entre 11–32 y GC entre 12–32 pacientes). Ningún estudio especifica primer episodio de BA y ninguno considera infecciones exclusivas por VRS. Un ECA se realizó en niños hospitalizados57 y 2 en urgencias y atención primaria53,54.
Intervención: 2 ECA realizados por Gadomski et al con salbutamol oral a 0,15mg/kg (dosis única)53,54 y el ECA de Cengizlier et al a 0,10mg/kg (cada 6h)57.
Comparación: con placebo (suero fisiológico).
Medidas principales: cambio de FR53,54 y diferencias de puntuación clínica57.
Tiempo: seguimiento durante el ingreso: cambio de FR a los 60min53,54 y diferencias clínicas entre ingreso y alta57.
Intensidad del efecto o fuerza de la asociación: ninguno de los 3 ECA encuentra cambios significativos.
Consistencia entre estudios: correcta, pues en los 3 ECA se demuestra ausencia de efecto a dosis habituales.
Precisión de las estimaciones: escasa, condicionada por el tamaño muestral.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados de la baja calidad de los estudios, así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido a los escasos estudios (que son ramas de ECA en relación con salbutamol nebulizado) y a que los 3 trabajos pueden haber incluido niños con asma. Se emplearon dosis y pautas de administración del salbutamol oral diversos, con ausencia de efecto (medidas de efecto basadas cambios de puntuación clínica y FR, sin correlación con otras medidas de mayor impacto clínico).
Validez externa y aplicabilidad de la evidencia: los pacientes no son representativos claros de los lactantes con BA (ninguno indica relacionarse con primer episodio de BA asociado a VRS). Aun así, y pese al pequeño número de estudios, el efecto observado no indica que el salbutamol oral tenga ningún beneficio en el manejo de la BA.
Balance riesgo-beneficio-coste: en un ECA se estudian los efectos adversos54, con incremento significativo de la FC en el GI. Existe un predominio de riesgos (más efectos adversos que por vía nebulizada) sobre beneficios. No hay estudios de costes.
Estimación del impacto de futuros estudios: poco probable, pues la vía oral ya se considera que no es la forma de aplicación adecuada del salbutamol y no muestra ninguna diferencia significativa en el GI.
Adrenérgicos (adrenalina)La adrenalina tiene un potencial beneficio teórico en el tratamiento de la BA por su propiedad alfa-adrenérgica (con efectos vasoconstrictores y la reducción del edema), además del efecto beta-adrenérgico (broncodilatador), en el alivio de la obstrucción al flujo aéreo. El uso de adrenalina en la BA ha sido motivo de discusión recurrente en nuestro entorno65–67.
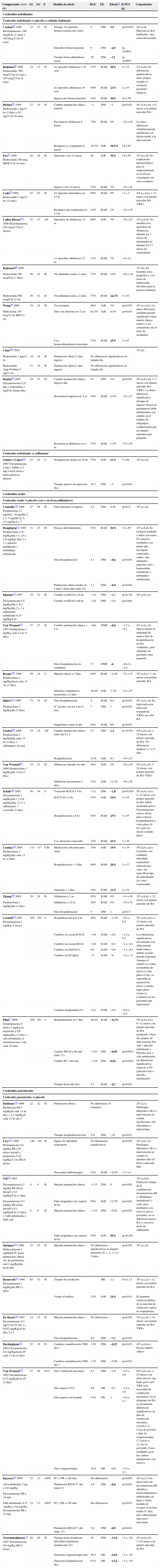
En el caso de la adrenalina analizamos la vía habitual de aplicación en la BA (nebulizada) y realizamos un breve comentario a un único estudio realizado por vía subcutánea. En la tabla 2 se exponen los resultados de todos los ECA sobre adrenalina en el tratamiento de la BA.
Tabla simplificada de tratamiento: ADRENALINA
| Comparación | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95% (p) | Calidad. Comentarios |
| Autor año | |||||||||
| Adrenalina subcutánea | |||||||||
| Adrenalina vs placebo (suero fisiológico) | |||||||||
| Lowell42 1987 0,01ml/kg, 2 dosis | 16 | 14 | U/AP | Mejoría RACS ≥ 4 a 15min | 7% | IAB | 49% | 21 a 79 | 3/5 (a,c,d); Mayor mejoría en ≥12 meses. También estudio observacional con 12 niños (71% mejoría global) |
| Adrenalina nebulizada | |||||||||
| Adrenalina vs placebo (suero fisiológico) | |||||||||
| Kristjansson81 1993 0,1, 0,15, 0,2 o 0,25mg de racémica (según peso; 1 dosis) | 15 | 14 | H | Puntuación clínica 15, 30, 45, 60min | Mejoría significativa en todos los tiempos en GI, pero no en GC | 2/5 (a,c); Mejoría en GI transitoria y similar a GC a 60min | |||
| SatO2/TcPO2 15, 30, 45, 60min | Mejoría significativa en GI, pero sólo en primeros momentos | ||||||||
| Barlas78 1998 (en turco) | 15 | 15 | GI adrenalina presenta diferencias significativas respecto a menor necesidad de tto e ingresos, e incremento SatO2 | ¿?; 5 GI y un GC, todos con 15 pacientes | |||||
| Patel68 2002¿¿ 0,03mg/Kg/dosis (cada 1 a 6hs) | 48 | 50 | H | Duración hospitalización (hs) | 63,3 | DM | −1,9 | (p=0,97) | 4/5 (a,b,c,d);Tampoco diferencias en medidas secundarias |
| Abul-Ainine69 2002 3mg (1 dosis) | 19 | 19 | H | Cambios FR y FC | (p>0,05) | 4/5 (a,b,c,d); < 12 meses con primer episodio BA. Financiado por industria | |||
| Cambio puntuación RDAI (máx 17) | 11,2 | DM | 0,9 | (p=0,4) | |||||
| Hariprakash70 2003 2mg (2 dosis cada 30min) | 38 | 37 | U | Ingreso a 2hs | 62% | RAR | 12% | −10 a 34 | 5/5 (a,b,c,d,e); Muy elevado el porcentaje de hospitalización en niños 1−12m que acuden a urgencias |
| Wainwright71 2003 4mg (3 dosis cada 4hs) | 99 | 95 | H | Duración ingreso | (p>0,05) | 5/5 (a,b,c,d,e); < 12m con primer episodio BA | |||
| Puntuación dif respiratoria 60min | 3,35 | DM | 0,91 | (p=0,02) | Diferencia en puntuación clínica trivial. Aumento significativo de FC en GI a 30 y 60min | ||||
| Ralston83 2005** | 17 | 25 | U | Ingreso | 20% | RAR | 8% | −14 a 30 | 3/5 (ac,d) |
| 5mg de racémica (2 dosis cada 30min;3a dosis si RDAI<8 o StO2<90%) | |||||||||
| Plint77 2009 | 200 | 201 | U | Hospitalización en 7 días | 26,4% | RAR | −9,3% | 5/5 (a,b,c,d,e); 6−12 meses con primer episodio de BA moderado. Otros dos grupos de intervención (Dx oral + placebo nebulizado y Placebo oral + Adr nebulizada) sin diferencias significativas respecto a GC (placebo oral + placebo nebulizado) | |
| Dexametasona 6 dosis (1mg/kg en urgencias y 0,6mg/kg/día y 5 días) + Adr nebulizada (2 nebulizaciones 3ml cada 30min) | Cambio RDAI a 60min (máx 17) | −1,65 | DM | −0,85 | (p<0,001) | ||||
| Cambio FC a 60min | −3,24 | DM | 8,54 | (p<0,001) | |||||
| Tiempo hasta alta (hs) | 5,3 | RAR | −0,7 | (p=0,02) | |||||
| Adrenalina vs salbutamol | |||||||||
| Sánchez82 1993 0,1mg/Kg de racémica (1 dosis) | 24 Diseño cruzado | H | Cambio puntuación clínica a 30min | 0,4 | DM | 1,2 | (p <0,001) | 2/5 (c,e); 1 a 12 meses con primer episodio BA, sedados con hidrato de cloral. Diseño cruzado (no tuvieron en cuenta el efecto periodo). Financiado por industria | |
| Menon72 1995 3mg (2 dosis cada 30min) | 20 | 21 | U | SatO2 60min (no dif a 0, 30 y 90min) | 94% | DM | 2% | (p=0,02) | 5/5 (a,b,c,d,e); <6 sem a 1 año con primer episodio BA. |
| Cambio RDAI de 30 a 90min | 0,3 | DM | 1 | (p <0,0001) | Demasiada diferencia en hospitalización frente escasas diferencias en RDAI, SatO2, FR y FC | ||||
| FC (lpm) | 165 | DM | −14 | (p=0,003) | |||||
| Hospitalización | 81% | RAR | 49% | 23 a 76 | |||||
| Reijonen84 1995 | 48 | 52 | U | Puntuación RDAI a 15 y 30min de cada tto | Mejoría en todos los grupos, salvo 1° SF y a 30min Adr a 15min | (p <0,05) | 3/5 (a,c,d); Resultados gráficos | ||
| 0,9mg/Kg de racémica (1 dosis) | |||||||||
| GI: 1° Adr y a 30min SF / 1° SF y a 30min Adr | Mejoría RACS a 15 y 20min de cada tto | Mejoría en los dos grupos con Adr | (p=0,06) | ||||||
| GC: 1° Salb y a 30min SF / 1° SF y a 30min Salb | No mejoría en los dos grupos con Salb | (p> 0,20) | |||||||
| Okutan79 1998 (en turco) | 45 entre los 2 grupos | ? | Puntuación RDAI | Mejoría Adr a 30,60,120min | (p <0,05) | ¿?; Mejoría en ambos grupos, pero sin diferencias entre ellos a los 30, 60 y 120min | |||
| FR | Mejoría Salb a 30,45,60,120min | (p <0,05) | |||||||
| Bertrand73 2001 0,5mg cada 2−4 hs, según criterio médico | 16 | 14 | H | Puntuación CSS (máx 12) primer día | Adren: 5,1 (0,4) a 4,2 (0,4) | (p=0,025) | 4/5 (a,b,c,d); < 12m con primer episodio BA. La mejoría de con adrenalina sobre puntuación clínica sólo se demuestra el primer día (no diferencias en resto días) | ||
| Salb: 5,8 (0,5) a 5,5 (0,4) | (p=0,6) | ||||||||
| Días hospitalización | 5,2 | DM | −1 | (p=0,11) | |||||
| Patel68 2002 ¿¿ 0,03mg/Kg/dosis (cada 1 a 6hs) | 51 | 50 | H | Duración hospitalización | 59,8 | DM | 1,6 | (p=0,97) | 4/5 (a,b,c,d);Tampoco diferencias en medidas secundarias |
| Ray85 2002 | 45 | 46 | U | Cambio SatO2 a 10min | 2,8 | DM | 4,6 | (p <0,001) | 2/5 (a,d); Posible inclusión de sibilancias recurrentes y > 12 meses |
| 0,1mg/Kg/dosis (3 dosis cada 20min) | Cambios RDAI (máx 17) a 10min | 6 | DM | 2,8 | (p <0,001) | ||||
| Hospitalización | 30,4 | RAR | 17,1 | 0,5 a 33 | |||||
| Mull74 2004 0,9mg/Kg de racémica (3 dosis cada 30min) | 34 | 32 | U | Mejora en RDAI (máx 17) | 2,6 | DM | −0,4 | (p>0,05) | 4/5 (a,b,c,d); < 12 meses con primer episodio BA. Menor tiempo para el alta con adrenalina, si bien no diferencias en mejoría puntuación clínica, SatO2 y tasa de ingreso. Financiado por industria |
| Tiempo hasta alta en Urgencias (min) | 120 | DM | −30 | (p=0,01) | |||||
| Hospitalización | 37,5% | IAR | 9,6% | −14 a 33 | |||||
| Langley75 2005 0,5mg de racémica (cada 1 a 4hs, según clínica) | 31 | 31 | H | Mejora en RDAI (máx 17) | Mejoría Adr respecto Salb al 2° día y estancia global | (p=0,022) | 5/5 (a,b,c,d,e); La mayoría de estudios previos usa dosis únicas o autolimitadas de adrenalina en primer día; en este se usan durante todo el ingreso | ||
| Duración ingreso | 3,4 | DM | −0,8 | (p>0,05) | |||||
| Ralston83 2005 ** | 17 | 23 | U | Hospitalización | 26% | RAR | 14% | −38 a 9 | 3/5 (a,c,d) |
| 5mg de racémica (2 dosis cada 30min;3a dosis si RDAI<8 o StO2<90%) | Necesidad O2 domiciliario | 35% | IAR | 12% | −18 a 43 | ||||
| Beck80 2007 1mg (dosis única) | 12 | 15 | U | Sonidos pulmonares 10 y 30min | (p>0,05) | 3/5 (a,b,d) | |||
| Puntuación FR a 10min (0 a 3) | 2,67 | DM | 0,84 | (p=0,04) | |||||
| Puntuación FC a 30min (0 a 3) | 1,4 | DM | 0,65 | (p=0,02) | |||||
Para las siglas pie de tabla 1.
Volumen de la evidencia: existen 17 ECA con calidad media-alta (10 estudios presentaron una calidad ≥4/5)68–77 y publicados entre 1995–2009. En 2 estudios no se pudo obtener toda la información (publicados en turco)78,79.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 12–99 y GC entre 14–95 pacientes), a excepción del actual ECA de Plint et al77 (alrededor de 200 pacientes en cada uno de los 4 grupos de intervención). La edad es <24 meses en todos los casos (algunos no incluyen el periodo neonatal), si bien la mayoría (11 estudios) son <12 meses. Nueve estudios especifican primer episodio de BA, que son los estudios que permiten no considerar asma del lactante entre la población. Solo un estudio considera infecciones exclusivas por VRS80. Siete ECA son en niños hospitalizados68,69,71,73,75,81,82 y 8 en urgencias70,72,74,77,80,83–85.
Intervención: 2 tipos de adrenalina (6 ECA con adrenalina racémica74,75,81–84 y 9 con L-adrenalina) con dosis e intervalos variables: dosis absolutas entre 0,1–5mg (principalmente de 3–5mg) y dosis relativas entre 0,03–0,1mg/kg. La mayoría de los estudios aplican entre 1–3 dosis, con intervalos cada 30min principalmente. La duración del tratamiento osciló entre dosis única y dosis repetidas cada 1–4h, según clínica75. El ECA de Plint et al77 estudia el efecto combinado de adrenalina nebulizada y dexametasona oral.
Comparación: en 8 casos con placebo (suero fisiológico)68–71,77,78,81,83 y en 11 casos con salbutamol68,72–75,79,80,82–85. Dos ECA68,83 tienen 2 ramas de comparación, tanto con suero fisiológico como con salbutamol.
Medidas principales: son muy variables, principalmente cambios de puntuación clínica (se utilizaron 6 escalas de puntuación clínica, siendo RDAI42 o su modalidad RACS, la más utilizada,) y hospitalización. Otras medidas principales consideradas son FR, FC, SatO2 y tiempo hasta el alta. Se consideraron más de una docena de medidas de resultado (entre primarias y secundarias), por lo que hay pocos estudios en cada rama de comparación.
Tiempo: seguimiento a corto plazo, generalmente a los pocos minutos u horas de aplicación. Salvo el estudio de Plint et al77 que estudia también las medidas de efecto hasta el día 22.
Intensidad del efecto o fuerza de la asociación: 5 ECA no encuentran diferencias. Once ECA encuentran diferencias significativas a favor del GI71–75,77–80,82,84,85, pero de interés clínico marginal. Las diferencias de mayor interés clínico se refieren a la reducción absoluta en hospitalización de un 9,377, 1785 y 49%72, si bien esta última es demasiado marcada para las diferencias clínicas encontradas entre los grupos. La mayoría son diferencias clínica y estadísticamente poco importantes, transitorias y no consistentes en el tiempo.
Los ECA publicados sugieren que en el tratamiento de la BA la adrenalina es superior a placebo71,81 (si bien son diferencias de puntuación clínica a muy corto plazo y triviales) y, sobre todo, a salbutamol72–75,79,80,82,84,85 (mejoría de la puntuación clínica y de la oxigenación72,73,75,79,80,82,84,85, beneficio sobre la función respiratoria82,86,87 y disminución en el porcentaje de ingresos72).
La RS publicada en Colaboración Cochrane en 2004 por Hartling et al6, consecuencia de un estudio previo de los mismos autores88, incluye 14 ECA (13 ECA con adrenalina nebulizada y un ECA con adrenalina subcutánea42). En nuestra revisión incluimos 3 ECA más, publicados a partir de 200575,80,83. La RS compara adrenalina con placebo (8 ECA, 5 en hospitalizados y 3 en régimen ambulatorio) o con otros broncodilatadores (8 ECA, 4 en hospitalizados y 4 en régimen ambulatorio). Las diferencias significativas detectadas en la adrenalina (frente al placebo y/o salbutamol) es más favorable en pacientes ambulatorios que en hospitalizados (quizá debidas a distinto grado de la enfermedad, con más resistencia al tratamiento por parte de los niños más graves), por lo que según estos datos no hay pruebas suficientes para apoyar su uso en BA hospitalizadas. Aún así, las diferencias detectadas tienen una importancia clínica no relevante, sin diferencias sobre el porcentaje de ingresos ni duración de la hospitalización: a) en los pacientes hospitalizados las únicas diferencias son menor puntuación clínica a los 60min (DME=−0,52; IC del 95%: −1,00−−0,03) en ECA de adrenalina vs. placebo y menor FR a los 30min (DMP=−5,15; IC del 95%: −6,83−−3,46) en ECA de adrenalina vs. salbutamol; b) en los pacientes ambulatorios se encuentran diferencias en el global de ECA respecto a menor FR a los 30min (entre 4–5rpm) y mejor SatO2 a los 30–60min (entre 2–3%), con datos discordantes en la FC (incremento en 12lpm a los 30min en ECA de adrenalina frente placebo y disminución en 14lpm a los 90min en ECA de adrenalina frente salbutamol); la sensación de mejoría es mayor en los ECA de adrenalina frente placebo (OR=25,06; IC del 95%: 4,95–16,92) que en los ECA de adrenalina frente salbutamol (OR=4,51; IC del 95%: 1,93–10,53); c) en cuanto a los efectos adversos, solo destacar la mayor palidez asociada a la intervención (OR=6,00; IC del 95%: 1,33–27,00), procedente de un ECA72.
Consistencia entre estudios: varios factores ya mencionados contribuyen a la falta de consistencia entre estudios, pudiendo existir hallazgos significativos como resultado de comparaciones múltiples. Entre los 5 ECA de mayor calidad (5/5) uno no encuentran diferencias entre grupos70,71 y otros 4 si71,72,75,77. En la RS6 se divide el análisis en adrenalina frente a placebo (5 en hospitalizados y 3 ambulatorios) y adrenalina frente a salbutamol (4 en hospitalizados y 4 ambulatorios): las diferencias significativas detectadas son más favorable en pacientes ambulatorios que en hospitalizados. En cualquier caso, son resultados que deben considerarse exploratorios, procedentes de ECA de diferente validez interna y de pequeño tamaño muestral, con gran heterogeneidad en los estudios, con diferentes escalas de puntuación clínica (hasta 6 escalas diferentes, siendo el RDAI la más utilizada) y que no permiten análisis de subgrupos (vías, dosis, número de administraciones, etc).
Precisión de las estimaciones: escasa, por el pequeño tamaño muestral de la mayoría de los ECA, aunque mejora en los resultados expuestos en la RS6.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados de la baja calidad de alguno de los estudios (ausencia ocultación del método de aleatorización, enmascaramiento, seguimiento incompleto e incorrecto análisis por intención de tratar, etc) así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes. Asimismo, podrían existir asociaciones casuales por comparaciones múltiples (subgrupos y controles diferentes, dosis) o diferentes medidas de resultado, la mayoría sin interés clínico (y a muy corto plazo). Los distintos sistemas de puntuación no han sido validados, por lo que no hay certeza de que midan diferencias clínicas fundamentales. Tres estudios fueron financiados por la industria farmacéutica69,74,82.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, mayoritariamente basado en pequeños cambios de las escalas de puntuación clínica y otras variables fisiológicas, sin correlación con otras medidas de mayor impacto clínico (solo 3 ECA encuentran mejoría en hospitalización). Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (10 de los 17 ECA incluían primeros episodios), representativos de los pacientes atendidos a nivel hospitalario o a nivel ambulatorio en urgencias. Las dosis y pautas de administración de adrenalina son heterogéneas (con adrenalina racémica y L-adrenalina), aunque suficientes para evaluar la intervención.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario y en urgencias. Las pruebas son insuficientes para apoyar el uso de adrenalina en pacientes hospitalizados por BA. Algunos estudios apoyan su uso en pacientes ambulatorios en urgencias (con mejor resultado que con placebo42,70,78 o con salbutamol72,74,85), pero se basa en un reducido número de estudios de diferente validez interna y con escasa relevancia clínica. Estas diferencias pueden ser debidas a distinto grado de la enfermedad, con más resistencia al tratamiento por parte de los niños más graves. El efecto observado tiene un escaso impacto clínico. Cuando se compara con salbutamol se aprecia un mayor beneficio de adrenalina a corto plazo, pero sin influencia en la tasa de ingresos ni en los casos de BA moderadas y/o graves. No se aconseja la adrenalina para uso en domicilio ante la ausencia de estudios, la corta duración de acción y sus potenciales efectos adversos.
Además, con la información clínica disponible no podemos predecir los casos que se pueden beneficiar del tratamiento, por lo que cualquier intento terapéutico tendrá que ser individualizado y monitorizado. Aunque las GPC y RS no aconsejan el uso rutinario de broncodilatadores inhalados en el tratamiento de la BA, sí se admite el ensayo terapéutico (principalmente adrenalina y salbutamol) y continuando el tratamiento si hay una respuesta clínica positiva documentada.
Balance riesgo-beneficio-coste: en 13 ECA se estudian los efectos adversos, que son escasos y sin importancia clínica. Un ECA detecta mayor palidez con adrenalina a los 30min72. Existe un predominio de riesgos (efectos adversos, coste medicación y administración) sobre beneficios (mejoría clínica a corto plazo) en el uso rutinario de adrenalina nebulizada, aunque no como para rechazar el ensayo terapéutico con adrenalina. No hay estudios de costes.
Estimación del impacto de futuros estudios: sería necesario la realización de estudios con mejor definición de pacientes (<12 meses con primer episodio de BA), intervención (principalmente L-adrenalina a dosis habituales −3 a 5mg−), con mayor tamaño muestral y variables clínicas de interés (escala de puntuación clínica estandarizada y validada, hospitalización). Son necesarios ECA amplios multicéntricos, de alta calidad y escalas sensibles a cambios clínicos y variables a más largo plazo.
Adrenalina subcutáneaSolo se ha estudiado en un ECA de calidad media-baja42 realizado en 1987 sobre lactantes con sibilancias atendidos en urgencias y atención primaria: compara 16 pacientes tratados con adrenalina subcutánea (0,01ml/kg, 2 dosis separadas 15min) con 14 del GC (suero fisiológico). Se constata mejoría clínicamente significativa en el GI respecto a la puntuación clínica (RDAI y RACS) a los 15min postratamiento, más llamativo en los mayores del año de edad. Los resultados obtenidos en el mismo artículo con un grupo observacional de 12 pacientes son similares.
La ausencia de otros ECA sobre esta vía de administración indica el escaso impacto de futuros estudios, ante la falta de interés de la vía subcutánea respecto a la vía nebulizada.
Tres GPC2–4 concluyen que no se aconseja el uso rutinario de broncodilatadores en el tratamiento de la BA. Dos de estas GPC2,4 consideran razonable realizar un ensayo terapéutico con salbutamol o adrenalina nebulizada y evaluar la respuesta clínica, pero de forma objetiva, y continuar con este tratamiento solo si se documenta una respuesta clínica positiva. La guía de la AAP2 especifica que el broncodilatador preferido en urgencias y en pacientes hospitalizados es la adrenalina, no así en el domicilio (en donde sería más apropiado el uso de salbutamol, según la opinión de expertos).
Anticolinérgicos (bromuro de ipratropio)Los estudios publicados sobre el uso de agentes anticolinérgicos, solos o en combinación con beta-2-agonistas, en el tratamiento de la BA no han demostrado efectos beneficiosos.
Volumen de la evidencia: existen 6 ECA con calidad media-baja (2 estudios presentaron una calidad 4/5)50,52 y publicados entre 1992 y 2007. La mayoría de ECA corresponde a ramas de tratamiento diferentes de ECA sobre salbutamol, previamente analizados.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 15–36 y GC entre 16–33 pacientes). Edad <24 meses en todos los casos (solo en un ECA <12 meses). Dos estudios especifican primer episodio de BA, que son los estudios que permiten no considerar asma del lactante entre la población. Ningún estudio considera infecciones exclusivas por VRS. Cinco ECA son en niños hospitalizados50,58,60,61,89 y uno en urgencias52.
Intervención: se ha empleado bromuro de ipratropio nebulizado con diferentes dosis e intervalos: de 80–250mcg; preferentemente 80 o 125mcg en ≤6 meses y 160 o 250mcg en >6 meses y 1 o 2 dosis. Solo un ECA aplica una dosis e intervalo diferente: 12,5mcg/kg cada 6h y durante 36h61. La duración del tratamiento se limitó a las dosis puntuales en el momento de ingreso.
Comparación: en 6 casos con placebo (suero fisiológico, asociando salbutamol en 3 de ellos52,60,61) y en un caso con salbutamol58. Uno de los ECA58 tienen 2 ramas de comparación, tanto con suero fisiológico como con salbutamol.
Medidas principales: son muy variables. Principalmente cambios de puntuación clínica (RDAI el más utilizado) y hospitalización.
Tiempo: seguimiento a corto plazo, entre los 120min y 3 días.
Intensidad del efecto o fuerza de la asociación: 5 ECA no encuentran diferencias. Solo un ECA encuentra diferencias significativas a favor del GI, pero de interés clínico marginal (−0,9 de puntuación clínica a las 24h) y no influye sobre la duración del ingreso50.
La RS publicada en Colaboración Cochrane en 2005 por Everard et al10, actualización de anteriores revisiones realizadas por los mismos autores11,90, incluye un total de 6 ECA en los que se compara bromuro de ipratropio con placebo o beta-2-adrenérgicos (3 ECA en hospitalizados con 168 pacientes, 2 ECA en urgencias con 130 pacientes y un ECA en domicilio con 23 pacientes) en lactantes <2 años con sibilancias recurrentes, excluyendo los afectados de BA (lo que crea confusión sobre cuál es la enfermedad diana objeto de este estudio). En general, existe consistencia entre estudios en cuanto a la ausencia de efecto de los anticolinérgicos, solos o en combinación con beta-2-adrenérgicos, para lograr mejoría en variables objetivas (SatO2, FR, días de ingreso). Las únicas diferencias significativas detectadas son la preferencia de los padres sobre el uso de bromuro de ipratropio frente al agua nebulizada (OR=0,15; IC del 95%: 0,04–0,64) y frente a placebo (OR=0,11; IC del 95%: 0,02–0,58) y la menor necesidad de nebulización adicional a los 45min en pacientes atendidos en urgencias (OR=0,22; IC del 95%: 0,08–0,61). En esta RS solo un estudio en urgencias pudo identificar una reducción en la disminución de tratamiento adicional a los 45min después de administrar bromuro de ipratropio con beta-2-adrenérgicos frente a placebo91, pero en un segundo estudio realizado en el mismo ámbito no se confirmó este beneficio.
Consistencia entre estudios: ningún estudio encuentra beneficios, salvo el estudio de Karadag et al50 comentado. Los ECA incluidos en la RS10 incluyen ECA en lactantes <2 años con sibilancias; aunque los autores no definen claramente qué enfermedad se pretende tratar, sus características concuerdan con BA y/o episodios recurrentes de sibilancias secundarias a un primer episodio de BA, si bien también pacientes con asma.
Precisión de las estimaciones: escasa, por el pequeño tamaño muestral de la mayoría de los ECA, sin especial mejoría en la RS10, dado que el interés de ésta no se centra en BA, sino en niños con sibilancias en general.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados de la baja calidad de la mayoría de los estudios, así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta, debido a que los ECA son ramas de tratamiento de estudios previos con salbutamol y, sobre todo, porque la RS10 incluye lactantes <2 años con sibilancias, término en el que se pueden incluir entidades diferentes a la BA.
Validez externa y aplicabilidad de la evidencia: los pacientes de los ECA analizados son representativos de los atendidos en el medio hospitalario. El único efecto observado tiene un escaso impacto clínico y no consistente. Tampoco se apoya el uso generalizado de anticolinérgicos en lactantes con sibilancias recurrentes (en muchos casos potbronquiolitis) en domicilio, urgencias y/o hospitalización.
Balance riesgo-beneficio-coste: en 3 ECA se estudian los efectos adversos, escasos y sin importancia clínica. Existe un predominio de riesgos (efectos adversos, coste medicación y administración) sobre beneficios (no mejoría clínica) en el uso rutinario de bromuro de ipratropio en la BA. No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: sería necesario la realización de estudios con una mejor definición de pacientes (<12 meses con primer episodio de BA y excluir posible asma del lactante y otras entidades englobadas en el concepto de «niño con sibilancias») y mayor tamaño muestral. También interesa diferenciar el efecto en el uso simultáneo de anticolinérgicos y broncodilatadores. Se precisa un ECA grande controlado con placebo, con población de estudio y medidas de resultado cuidadosamente elegidos.
CorticoidesA pesar del papel predominante de la inflamación en la patogénesis de la obstrucción de la vía aérea en la BA, existen numerosos ECA y RS de calidad que demuestran que los corticoides, administrados por vía sistémica (oral o parenteral) o nebulizados, no proporcionan beneficios clínicos ni durante la fase aguda ni en la evolución posterior de los lactantes previamente sanos con un primer episodio de BA. Este hecho contrasta con el uso frecuente de estos medicamentos a pesar de los reconocidos efectos adversos que presentan.
Cabe diferenciar 3 vías de administración de los corticoides en BA en la intervención terapéutica: nebulizados, orales y parenterales. En la tabla 3 se exponen los resultados de todos los ECA sobre corticoides en el tratamiento de la BA.
Tabla simplificada de tratamiento: CORTICOIDES
| Comparación Autor año | GI | GC | E | Medida de efecto | RGC | EE | Efecto¿ | IC95% (p) | Comentarios |
| Corticoides nebulizados | |||||||||
| Corticoides nebulizados vs placebo o cuidados habituales | |||||||||
| Carlsen95 1988 Beclometasona, 100mcg/6hs (2 sem) y 100mcg/12hs (6 sem) | 22 | 22 | H | Tiempo 1er episodio broncoconstricción (sem) | 4 | DM | 3,5 | (p=0,035) | 2/5 (c,d); Mayoría no BA habituales, sino asma del lactante |
| Episodios broncoespasmo | 9 | DM | −4,5 | (p <0,005) | |||||
| Tiempo broncodilatadores (sem) | 20 | DM | −13 | (p <0,005) | |||||
| Reijonen96 1996 Budesonida, 500mcg/12hs (8 sem) y 250mcg/12hs (8 sem) | 34 | 32 | H | ≥1 episodio sibilancias a 16 sem | 47% | RAR | 30% | 8 a 53 | 2/5 (a,d); No diferencias significativas entre grupos cuando se excluyen pacientes atópicos |
| ≥2 episodios sibilancias 16 sem | 40% | RAR | 21% | 2 a 43 | |||||
| Ingreso por broncoespasmo | 43% | RAR | 30% | 10 a 50 | |||||
| Richter92 1998 Budesonida 1mg/12hs (5 días) y 0,5mg/12hs (6 sem) | 21 | 19 | H | Cambio puntuación clínica (máx9) | −1 | DM | −1 | (p=0,92) | 4/5 (a,b,c,d); <12 meses con primer episodio BA. |
| Prevalencia sibilancias 6 meses | 79% | RAR | 4% | −22 a 30 | La única diferencia estadísticamente significativa es desfavorable a la intervención | ||||
| Reingreso p. respiratoria 6 meses | 10,5% | IAR | 39,5% | 14 a 65 | |||||
| Fox97 1999 Budesonida 200mcg MDI/12hs (8 sem) | 26 | 28 | H | Síntomas a los 12 meses | 50 | IAR | 34% | 19 a 59 | 3/5 (a,c,d); No explicación farmacológica para el empeoramiento en el GI (no consistente con otros estudios) |
| Ingreso a los 12 meses | 25% | RAR | 5% | −19 a 28 | |||||
| Cade93 2000 Budesonida 1mg/12hs (14 días) | 83 | 82 | H | ≥1 episodio sintomático en 12m | 99% | RAR | 0% | −3 a 3 | 4/5 a,c,d,e); < 12 meses con primer episodio BA VRS+ |
| Reingreso pat respiratoria en 12m | 18% | RAR | 2% | −14 a 10 | |||||
| Callen Blecua102 2000 Beclometasona, 250mcg/12hs (3 meses) | 47 | 47 | AP | Episodios de sibilancias 15 m | 66% | IAR | 3% | −16 a 22 | 3/5 (a,b,d); No modifica los episodios de sibilancias durante los 3 meses de tratamiento ni durante los 12 meses de seguimiento |
| >3 episodios sibilancias 15 m | 21% | RAR | 7% | −9 a 22 | |||||
| Kajosaari98 2000 | 1/5 (d); En lactantes muy pequeños y con dosis de budesonida elevadas para la práctica habitual | ||||||||
| Budesonida 500mcg/8hs (7 días) | 40 | 41 | H | Tto inhalador asma a 2 años | 37% | RAR | 19% | −0,6 a 38 | |
| Budesonida 500mcg/8hs (2m) | 36 | 41 | H | Tto inhalador asma a 2 años | 37% | RAR | 24,3% | 5 a 43 | |
| Wong99 2000 | 24 | 24 | H | Tos nocturna | 86% | IAR | 2% | (p>0,05) | 4/5 (a,c,d,e); La única diferencia estadísticamente significativa tiene interés clínico relativo y no consistente con el resto de resultados |
| Fluticasona 150mcg/12hs MDI (3m) | Días con síntomas en 12 m | 83,5% | IAR | 0,5% | (p>0,05) | ||||
| Uso broncodilatadores/corticoides | 33% | RAR | 25% | 3 a 47 | |||||
| Chao100 2003 | 1/5 (d) | ||||||||
| Budesonida 1mg/12hs | 18 | 18 | H | Puntuación clínica 5 días ingreso | No diferencias significativas en ningún día | ||||
| Budesonida 1mg+Terbuta 5mg/12hs | 21 | 16 | H | Puntuación clínica 5 días ingreso | No diferencias significativas en ningún día | ||||
| Bentur94 2005 Dexametasona 0,25mg + Adrenalina 1mg/6hs (hasta alta) | 29 | 32 | H | Cambio puntuación clínica ingreso-alta | 6,1 | DM | 5,8 | (p>0,05) | 4/5 (a,b,c,d); 3−2 meses con primer episodio BA VRS+. La única diferencia significativa (tiempo de ingreso menor en prematuros) debe interpretarse con cautela en el análisis de subgrupos, condicionado por un tamaño muestral muy pequeño |
| Recurrencia ingresos en 3 m | 44% | RAR | 2,4% | −22 a 27 | |||||
| Recurrencia sibilancias en 3 m | 53% | RAR | 1,4% | −23 a 26 | |||||
| Corticoides nebulizados vs salbutamol | |||||||||
| Gómez y López101 2007 Dexametasona 2mg + Salbut 1,5mg/ 4hs(6 dosis o hasta ausencia disnea) | 25 | 24 | U | Desaparición disnea en 24 hs | 75% | IAB | 21% | 2 a 40 | 3/5 (b,c,d) |
| Tiempo ingreso en urgencias (hs) | 18,7 | DM | −3 | (p>0,05) | |||||
| Corticoides orales | |||||||||
| Corticoides orales vs placebo (con o sin broncodilatadores) | |||||||||
| Connolly110 1969 Prednisolona 15mg/día1, 10mg/día 2 y 3, 5mg/día 4y 5, 2,5mg/día 6 y 7 | 47 | 48 | H | Días síntomas en ingreso | 5,5 | DM | 0,49 | (p>0,5) | 3/5 (a,c,d) |
| Daugbjerg111 1993 Prednisolona 4−6mg/Kg/día 1 y 1,6 a 2,6mg/Kg/ días 2 y 3 + placebo nebulizado + terbutalina nebulizada | 31 | 27 | H | Fracaso del tratamiento | 52% | RAR | 36% | 13 a 59 | 3/5 (a,b,d); Se incluyen también a niños con asma. No mejores resultados con grupo que incorpora corticoides orales, sino inhalados (placebo oral + budesonida nebulizada + terbutalina nebulizada) |
| Días hospitalización | 4,1 | DM | −0,6 | (p=0,04) | |||||
| Puntuación clínica media en 5 días o hasta alta (máx 12) | 3,1 | DM | −0,9 | (p=0,08) | |||||
| Klassen112 1997 | 35 | 32 | H | Cambio en RDAI a 24 hs | −1,6 | DM | −0,2 | (p=0,74) | 4/5 (a,b,c,d) |
| Dexametasona 0,5mg/Kg/día 1, 0,3mg/Kg/día 2 y 3 + salbutamol nebulizado 0,15mg/Kg/4hs | Cambio en RDAI a 60 hs | −2,0 | DM | −0,4 | (p=0,66) | ||||
| Van Woensel113 1997 Prednisolona 1mg/Kg cada 12hs (7 días) | 27 | 27 | H | Cambio puntuación clínica a 3 d | −0,6 | DME | −0,6 | −1,2 a −0,1 | 4/5 (a,b,c,d); Mayor interés la magnitud de menos días de hospitalización en BA ventilados, pero subgrupo de pacientes muy pequeño |
| Días hospitalización en ventilados | 17 | DME | −6 | −10,2 a −1,8 | |||||
| Berger105 1998 Prednisolona 1mg/Kg/dosis cada 12hs (3 días) | 20 | 18 | U | Mejoría clínica a 7 días | 94% | RAR | −4,4% | −21 a 14 | 3/5 (a,b,c); 1−18 meses con primer episodio BA |
| Síntomas respiratorios recurrentes a 2 años | 28,4% | IAR | 7,1% | −41 a 27 | |||||
| Bülow114 1999 | 73 | 74 | H | Días hospitalización | 4 | RAR | 0,4 | (p>0,05) | 4/5 (a,b,c,d); En ingresados por infección respiratoria VRS+, no sólo BA |
| Prednisolona 2mg/Kg/día (5 días) | N° noches con tos a las 6 sem | 7 | DM | 1 | (p>0,05) | ||||
| Diagnóstico asma al año | 64% | RAR | 6% | (p>0,05) | |||||
| Goebel106 2000 Prednisolona 2mg/Kg/día cada 12hs (5 días) + salbutamol vía oral | 24 | 24 | AP | Cambio puntuación clínica entre día 0 y 2 | 2,7 | DM | 1,3 | (p <0,05) | 4/5 (a,b,c,d); < 24 meses con primer episodio de BA. No diferencias tampoco a 3 y 6 días |
| Hospitalización | 8,3% | IAR | 8,3 | −10 a 27 | |||||
| Van Woensel107 2000 Prednisolona 1mg/Kg/día 12hs (7 días) | 24 | 23 | H | Sibilancias durante 1er año | 48% | IAR | 2% | −26 a 30 | 4/5 (a,b,c,d); < 24 meses con primer episodio de BA VRS+ |
| Sibilancias persistentes 5 años | 31% | IAR | 11,2% | −16 a 38 | |||||
| Schuh108 2002 Dexametasona 1mg/Kg/día 1 y 0,6mg/Kg/días 2 a 5 + salbutamol, 3 veces/día (5 días) | 36 | 34 | U | Variación RACS a 4hs | −3,2 | DM | −1,8 | (p=0,029) | 5/5 (a,b,c,d,e); 2−23 meses con primer episodio de BA VRS+ moderada-grave. Dexametasona oral es eficaz para evitar la hospitalización a corto plazo (4hs), pero no efecto a medio plazo |
| RACS ≤5 a 4hs | 24% | IAB | 24% | 2 a 45 | |||||
| Hospitalización a 4hs | 44% | RAR | 25% | 4 a 45 | |||||
| Uso adicional corticoides | 22% | RAR | 22% | 7 a 36 | |||||
| Csonka103 2003 Prednisolona 2mg/Kg/día cada 12hs (3 días) | 113 | 117 | U/H | Medicación adicional para asma | 18% | IAR | 19% | 4 a 34 | 5/5 (a,b,c,d,e); Lactantes con cualquier dificultad respiratoria inducida por virus, sin especificar tipo de enfermedad y/o virus responsable |
| Hospitalización > 3 días | 68% | RAR | 20% | 3 a 37 | |||||
| Síntomas > 3 dïas | 39% | RAR | 21% | 9 a 32 | |||||
| Zhang109 2003 | 28 | 24 | H | Sibilancias a 1 m | 83% | RAR | 8% | −14 a 30 | 3/5 (a,b,d); < 12 meses con primer episodio de BA |
| Prednisolona 1mg/Kg/día (5 días) | Sibilancias a 12 m | 58% | RAR | 8% | −19 a 35 | ||||
| Días hospitalización | 5 | DM | 1 | (p=0,7) | |||||
| Corneli104 2007 Dexametasona 1mg/Kg (1 dosis) | 305 | 295 | U | Hospitalización tras 4 hs | 40% | RAR | −1.3% | −9,2 a 6,5 | 5/5 (a,b,c,d,e); < 12 meses con primer episodio de BA |
| Cambios en escala RACS | −4,8 | DAR | −0,5 | −1,3 a 0,3 | Las diferencias significativas encontradas son clínicamente irrelevantes y debido al gran tamaño muestral. Aunque el estudio se centra en medidas de efecto a corto plazo (4 hs), es esperable su ausencia de efecto a medio-largo plazo (como se evidenció en los pacientes que ingresaron) | ||||
| Cambios en escala RDAI | −4,8 | DAR | −0,5 | −1 a −0,1 | |||||
| Cambios en SatO2(%) | 0,9 | DAR | −0,6 | −1 a −0,1 | |||||
| Cambios en FC(lpm) | −5 | DAR | −8 | −12 a −5 | |||||
| Cambios temperatura(°C) | −0,2 | DAR | −0,4 | −0,6 a −0,3 | |||||
| Plint77 2009 Dexametasona 6 dosis (1 mg/kg en urgencias y 0,6mg/kg/día y 5 días) + Adr nebulizada (2 nebulizaciones 3ml cada 30min) | 200 | 201 | U | Hospitalización en 7 días | 26,4% | RAR | −9,3% | 5/5 (a,b,c,d,e); 6−12 meses con primer episodio de BA moderado. Otros dos grupos de intervención (Dx oral + placebo nebulizado y Placebo oral + Adr nebulizada) sin diferencias significativas respecto a GC (placebo oral + placebo nebulizado) | |
| Cambio RDAI a 60min (máx 17) | −1,65 | DM | −0,85 | (p<0,001) | |||||
| Cambio FC a 60min | −3,24 | DM | 8,54 | (p<0,001) | |||||
| Tiempo hasta alta (hs) | 5,3 | RAR | −0,7 | (p=0,02) | |||||
| Corticoides parenterales | |||||||||
| Corticoides parenterales vs placebo | |||||||||
| Dabbous118 1966 Prednisona IM 5mg/Kg/d cada 12 hs día1 y 2,5mg/Kg/d cada 12hs día 2 | 22 | 22 | H | Puntuación clínica | No diferencias (4 semanas) | 2/5 (a,c); Patologías diferentes a BA e intervención no común (incluyendo Adr subcutánea y tetraciclina) | |||
| Tiempo hospitalización (hs) | 124 | DM | −24 | (p>0,05) | |||||
| Leer119 1969 Betametasona 0,4mg/Kg IM o IV (dosis inicial) y posteriores 0,22 mg/Kg/12hs IM (6 dosis) | 148 | 149 | H | Signos de dificultad respiratoria | No diferencias significativas | (p>0,05) | 4/5 (a,b,c,d); Patologías diferentes a BA e intervención no común en nuestros días (6 dosis corticoide IM) | ||
| Necesidad antibioterapia | 42% | RAR | −6,5% | −17 a 5 | |||||
| Tal120 1983 | 3/5 (a,b,d); Potencial ventaja de la combinación dexametasona IM y salbutamol (nebulizado + oral), pero resultados con reserva: pocos pacientes, no se diferencia asma y BA y excesiva dosis de salbutamol | ||||||||
| Dexametasona 0,3mg/Kg IM (dosis inicial) y 0,1mg/Kg/8hs (3 días) | 8 | 8 | H | Mejoría puntuación clínica | −1,35 | DM | 0 | (p>0,05) | |
| Dexametasona 0,3mg/Kg IM (dosis inicial) y 0,1mg/Kg/8hs (3 días) + Salb nebulizado + Salb oral | Fallo terapéutico (no mejora 48 h) | 50% | IAR | 12,5% | (p>0,05) | ||||
| 8 | 8 | H | Mejoría puntuación clínica | −1,35 | DM | −0,02 | (p>0,05) | ||
| Fallo terapéutico (no mejora 48 h) | 50% | IAB | 50% | (p <0,05) | |||||
| Springer121 1990 Hidrocortisona 1mg/Kg/h IV hasta puntuación clínica <6; dp prednisona oral 2mg/Kg/día hasta alta | 25 | 25 | H | Mejoría puntuación clínica | No diferencias significativas en ningún momento (0, 1, 2, 3, 4 ó 5 días) | (p>0,05) | 3/5 (a,c,d) | ||
| Roosevelt115 1996 Dexametasona 1mg/Kg/día IM (3 días) | 65 | 53 | H | Tiempo de resolución | HR | 1,3 | 0,9 a 1,3 | 3/5 (a,c,e); < 12 meses con primer episodio de BA. | |
| Visitas al médico | 12% | IAR | 24% | (p=0,01) | El aumento visitas al médico en la mayoría de visitas por causas no respiratorias | ||||
| De Boeck116 1997 Dexametasona 0,3mg/12hs IV día 1 y 0,015mg/Kg/24hs días 2 y 3 | 14 | 15 | H | Mejoría puntuación clínica | No diferencias | (p>0,05) | 3/5 (a,c,d); < 24 meses con primer episodio de BA VRS+ | ||
| Días hospitalización | 6,6 | DM | −0,6 | (p>0,05) | |||||
| Buckingham122 2002 Dexametasona 0,5mg/Kg/dosis IV cada 12hs (4 días) | 22 | 19 | H | Cambios cuantificación VRS día 2 | 1,58 | DM | −0,53 | (p=0,03) | 4/5 (a,b,d,e); Escaso interés clínico |
| Cambios cuantificación VRS día 7 | 1,78 | DM | −5,69 | (p=0,07) | |||||
| Van Woensel123 2003 Dexametasona 0,15mg/Kg/6hs IV (2 días) | 37 | 46 | UCI | Días ventilación mecánica | 8,5 | DM | −1,6 | −3,8 a 0,8 | 4/5 (a,b,c,d); < 24 meses con infección de vías bajas grave por VRS (con necesidad de ventilación mecánica). En el subgrupo de BA se encuentran diferencias significativas en días de ventilación mecánica (4,9±0,5 vs 9,2±1,6; p=0,02) y días de oxigenoterapia (7,7±0,9 vs 11,3±1,6; p=0,048). Estos resultados post-hoc deben interpretarse con reserva |
| Días ingreso UCI | 9,9 | DR | −0,7 | −3,4 a 1,8 | |||||
| Días ingreso en hospital | 14,9 | DR | 1 | −2,8 a 4,7 | |||||
| Días oxigenoterapia | 10,9 | DR | −0,9 | −3,9 a 2,1 | |||||
| Kuyucu124 2004 | 23 | 11 | AP/U | FC y FR a 120min | Sin diferencias | (p>0,05) | 2/5 (a,c); Una dosis única de dexametasona IM añadida a broncodilatadores nebulizados da lugar a mejor medida de eventos en la fase tardía (5° día), pero clínicamente muy poco relevantes | ||
| Adr nebulizada 3 mg y 0,6mg/Kg | Puntuación RDAI 5° día (máx17) | 2,9 | DM | −0,6 | (p=0,02) | ||||
| Dexametasona IM a 15min | |||||||||
| Salb nebulizado 0,15mg/Kg y 0,6mg/Kg Dexametasona IM a 15min | 23 | 12 | AP/U | FC y FR a 120min | Sin diferencias | (p>0,05) | |||
| Puntuación RDAI 5° día (máx 17) | 3,4 | DM | −0,9 | (p=0,01) | |||||
| Teeratakulpisarn117 2007 Dexametasona 0,6mg/Kg IM (1 dosis) | 89 | 85 | H | Tiempo hasta resolución dificultad respiratoria (puntuación ≤3) | 39 | DM | −11,8 | −4 a −20 | 4/5 (a,b,c,d); 1−24 meses con primer episodio de BA |
| Duración oxigenoterapia (hs) | 36,5 | DR | −14,9 | −5 a −24 | |||||
| Duración hospitalización (hs) | 67,6 | DR | −13,4 | −3 a −24 | |||||
Para las siglas ver pie de tabla 1.
Volumen de la evidencia: existen 11 ECA con calidad media-baja (solo 4 estudios presentaron una calidad 4/5) y publicados entre 1999 y 2007.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 18–83 y GC entre 18–82 pacientes). La edad es <24 meses en todos los casos (algunos no incluyen el periodo neonatal). Tres estudios especifican primer episodio de BA92–94, que son los estudios que permiten no considerar asma del lactante entre la población. Tres estudios consideran infecciones exclusivas por VRS. Nueve ECA son en niños hospitalizados92–100, uno en urgencias101 y uno en atención primaria102.
Intervención: distintos corticoides nebulizados, dosis e intervalos: 6 budesonida (entre 1.000mcg/12h a 200mcg/12h)92,93,96–98,100, 2 beclometasona (100mcg/6h95 y 250mcg/12h102), 2 dexametasona (entre 0,25mg/6h con adrenalina94 y 2mg/4h con salbutamol101) y uno fluticasona (150mcg/12h)99. La duración del tratamiento osciló entre el tiempo de ingreso y hasta 3 meses.
Comparación: en 10 casos con placebo (suero fisiológico) o cuidados habituales y en un caso con salbutamol101.
Medidas principales: las medidas principales de efecto son muy variables; principalmente síntomas a los 12–15 meses (principalmente sibilancias), cambios de puntuación clínica ingreso-alta, necesidad de tratamiento inhalador, rehospitalizaciones, etc.
Tiempo: es muy variable el seguimiento de las medidas de interés: durante el ingreso y hasta 24 meses.
Intensidad del efecto o fuerza de la asociación: 4 ECA no encuentran diferencias. Cinco ECA encuentran diferencias significativas a favor del GI, siendo las de más interés clínico: reducción de un 30% de reingreso por broncoespasmo a 16 semanas96 y reducción de un 25% de tratamiento inhalador a los 1299 y 24 meses98. Dos ECA encuentran diferencias significativas en contra del GI: incremento de un 39,5% de reingresos a los 6 meses92 y un 34% de incremento de síntomas a los 12 meses97. Las diferencias son clínica y estadísticamente poco importantes y no consistentes.
Consistencia entre estudios: la consistencia es escasa, de manera que entre los 4 ECA de mayor calidad (≥4/5), en un caso se obtiene algún resultado significativo a favor del GI99, en otro en contra92 y en 2 ningún resultado significativo93,94.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los ECA.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados de la baja calidad de la mayoría de los estudios, así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes. Dos estudios estaban financiados por la industria farmacéutica93,99.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, mayoritariamente basado en pequeños cambios a medio plazo (entre 12–24 meses, y en relación con reingresos y síntomas), pero no consistente en todos los ECA. Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (3 de los 11 ECA incluían primeros episodios), y en todo caso serían representativos de los pacientes atendidos principalmente a nivel hospitalario. Los tipos de corticoides, así como sus dosis y pautas de administración son muy heterogéneos.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario, si bien la duración del tratamiento osciló entre el tiempo de ingreso y hasta 3 meses.
Balance riesgo-beneficio-coste: en 3 ECA se estudian los efectos adversos, que son escasos y poco significativos. Existe un predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (posibilidad de mejoría en el seguimiento de algunos pacientes, pero datos contradictorios y no consistentes). No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: sería necesario la realización de estudios con mejor definición de pacientes (<12 meses con primer episodio de BA y excluir posible asma del lactante), intervención (principalmente budesonida a dosis habituales de 200−400mcg/12h), tiempo (de mantenimiento del corticoide nebulizado) y variables clínicas de interés (tiempo de ingreso y reingresos) con mayor tamaño muestral.
Corticoides oralesVolumen de la evidencia: existen 13 ECA con calidad media-alta (9 estudios presentaron una calidad ≥4/5) y publicados entre 1969 y 2009.
Pacientes: el tamaño muestral es pequeño en la mayoría de los estudios. Solo 3 estudios superan los 100 pacientes por rama en los GI y GC: 113 frente a 117103, 305 frente a 295104 y 200 frente a 200177; en el resto oscila es GI entre 20–73 y el GC entre 18–74. La edad es <24 meses (salvo un ECA en <36 meses)103. Siete estudios especifican primer episodio de BA77,104–109, que son los estudios que permiten no considerar asma del lactante entre la población. Tres estudios consideran infecciones exclusivas por VRS. Siete ECA son en niños hospitalizados107,109–114, 4 en urgencias77,104,105,108, uno en atención primaria106 y uno en urgencias y hospitalizados103.
Intervención: 2 corticoides orales: 9 con prednisolona103,105–107,109–111,113,114 y 4 con dexametasona77,104,108,112. Se han usado diferentes dosis e intervalos: prednisolona entre 1–2mg/kg/día cada 12 o 24h (en el ECA más antiguo dosis de 15mg/kg/día y con pauta descendente en una semana110) y dexametasona (0,5–1mg/kg/día con pauta descendente en 3–5 días o 1mg/kg/dosis única104). La duración del tratamiento osciló entre una dosis104 y 5 días. En el ECA de Plint et al77 se usa conjuntamente con adrenalina nebulizada.
Comparación: con placebo (suero fisiológico, con o sin broncodilatadores).
Medidas principales: son variables, pero principalmente cambios en escala clínica durante el tratamiento y días de hospitalización.
Tiempo: principalmente, el seguimiento de las medidas de interés se realizó durante el tiempo de tratamiento agudo (1−5 días). En un ECA se estudió el ingreso en los 7 días77 y en 3 ECA se consideró la presencia de sibilancias/asma al año109,114 y a los 5 años107.
Intensidad del efecto o fuerza de la asociación: 7 ECA no encuentran diferencias. El resto encuentran diferencias significativas a favor del GI, siendo las de más interés clínico la reducción en la tasa de hospitalización: de un 9,3% en los 7 días tras el tratamiento (en utilización conjunta con adrenalina nebulizada)77, de un 20% >3 días (en población no exclusiva de BA)108 y de un 25% a las 4h (en pacientes con BA moderada-grave)103; en un ECA se encontró una disminución de 6 días de hospitalización en BA con ventilación mecánica113. En el ECA de mayor tamaño muestral y calidad se encontraron diferencias significativas mínimas en variables subrogadas (RDAI, SatO2, FC y temperatura) a las 4h, pero no a medio-largo plazo104; estas diferencias son clínicamente irrelevantes y consecuencia del gran tamaño muestral.
Existen 2 RS12,26 sobre los corticoides sistémicos (vía oral, intramuscular o intravenoso) en el tratamiento de la BA que se comentarán en el capítulo de corticoides parenterales.
Consistencia entre estudios: es escasa, si bien en los 4 ECA de mayor calidad (5/5) se obtiene algún resultado significativo, en 3 casos con dexametasona108,77,104 y en uno con prednisolona103. Los 2 recientes ECA publicados en N Engl J Med con dexametasona oral (sola104 o combinada con adrenalina nebulizada77) ofrecen conclusiones diferentes, en base al efecto sinérgico del broncodilatador.
Precisión de las estimaciones: es escasa, condicionada por el tamaño muestral (salvo en el estudio de Cornelli et al104), pero mejora en los resultados expuestos en la RS12.
Estimación de sesgos: existe riesgo de sesgos intermedio, derivados de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta en general, si bien los 4 ECA de mayor calidad77,103,104,108 (más actuales y con adecuado tamaño muestral) encuentran diferencias significativas en el uso de corticoides orales en urgencias (principalmente si mantenidos 3 o 5 días) en relación con sintomatología y hospitalización. Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (7 de los 13 ECA incluían primeros episodios), y en todo caso serían representativos de los pacientes atendidos a nivel hospitalario y de urgencias. Las dosis y pautas de administración de los corticoides orales son suficientes para evaluar la intervención.
Validez externa y aplicabilidad de la evidencia: los pacientes con diferencias significativas corresponden a lactantes atendidos en urgencias, cuya diferencia es más patente cuando se usan varias dosis en los primeros 3–5 días103,108 que una dosis aislada104. Posteriormente se incluyen algunos comentarios de interés derivados de la RS sobre corticoides sistémicos12,26.
Balance riesgo-beneficio-coste: en 5 ECA se estudian los efectos adversos, que son escasos y poco significativos. Existe equilibrio entre riesgos (potenciales, aunque poco constatados por el escaso tiempo de aplicación) y beneficios (diferencias significativas en niños atendidos en urgencias con corticoides orales durante 3–5 días, principalmente). No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: podrían ser necesarios nuevos estudios para definir el papel de la dexametasona oral, sola o en combinación con broncodilatadores. Este ha sido el objetivo de los 2 últimos ECA publicados77,104, si bien presentan una buena definición de pacientes (<12 meses con primer episodio de BA y excluye posible asma del lactante), intervención (dexametasona a dosis habituales) y variables clínicas de interés (a corto y medio plazo).
Corticoides parenteralesVolumen de la evidencia: existen 10 ECA con calidad media-baja (4 estudios presentaron una calidad 4/5) y publicados entre 1966 y 2007.
Pacientes: el tamaño muestral de los estudios es, en general, pequeño, (GI entre 8−148 y GC entre 8−149 pacientes). La edad es <24 meses (salvo un ECA en que es <30 meses) y algunos no incluyen el periodo neonatal. Tres estudios especifican primer episodio de BA115–117, que son los estudios que permiten no considerar asma del lactante entre la población. Tres estudios consideran infecciones exclusivas por VRS. Ocho ECA son en niños hospitalizados115–122, uno en UCI123 y uno en urgencias y atención primaria124.
Intervención: 4 corticoides parenterales IM o IV (7 dexametasona115–117,120,122–124, uno betametasona119, uno hidrocortisona121 y uno prednisona118). Las dosis de dexametasona oscilaron entre 0,6−1mg/kg/día cada 6, 12 o 24h. La duración del tratamiento osciló entre una dosis y 3 días.
Comparación: con placebo (suero fisiológico).
Medidas principales: son variables, pero principalmente cambios en escala clínica durante el tratamiento.
Tiempo: principalmente, el seguimiento de las medidas de interés se realizó durante el tiempo de tratamiento agudo (1–5 días).
Intensidad del efecto o fuerza de la asociación: 6 ECA no encuentran diferencias. El resto encuentran pequeñas diferencias estadísticas y con marginal valor clínico: −0,9 de cambio en puntuación RDAI124 y mayores cambios en la cuantificación de VRS entre los días 1 y 7122. El ECA de Roosevelt et al115 encuentra un 24% más de visitas al médico (aunque de causa no respiratoria principalmente)115. El estudio de Teeratakulpisarn et al117 es el único que encuentra mejoría en el tiempo de resolución de la dificultad respiratoria, hospitalización y oxigenoterapia.
Existen 2 RS (con metanálisis): el estudio de Garrison et al26 incluye un total de 6 ECA en los que se comparan corticoides sistémicos (vía oral, intramuscular o intravenoso) frente a placebo en lactantes <24 meses con BA o con infección por VRS. Existe una importante heterogeneidad en las pautas de tratamiento, tanto en tipo de corticoides y dosis (se transformaron a dosis equivalentes de prednisona y oscilaron entre 0,6–6,3mg/kg/día y dosis totales entre 3–18,9mg/kg). El análisis de resultados de días de hospitalización y duración de síntomas de forma independiente no daban resultados significativos, por lo que los autores deciden unir ambas medidas en los 6 ECA, asumiendo que son equivalentes (lo que resulta discutible, como medida conjunta) y se obtiene una DMP de −0,43 días (IC del 95%: −0,81−−0,05). Este resultado pierde la significación estadística cuando solo se consideran los 4 ECA con adecuada aleatorización (DMP=−0,35 días, IC del 95%: −0,84−0,14) y los 4 ECA con adecuada exclusión de sibilancias previas (DMP=−0,29 días, IC del 95%: −0,71−0,13). A pesar de la diferencia pequeña en la duración de la hospitalización a favor del GI, el artículo extrapola un beneficio global de 51.600 días de ingreso al año en Estados Unidos26. La otra medida significativa encontrada es la mejora en la puntuación clínica a las 24h, obtenida de 3 ECA y que refleja una DMP de −1,60 (IC del 95%: −1,92−−1,28). Sin embargo, las limitaciones del estudio hacen que se deban tomar con reserva los resultados, dado que la posterior RS de la Cochrane12, que incluye ya 13 ECA (con 1.198 pacientes, considerando 10 ECA en hospitalizados y 3 ECA en urgencias) en los que se comparan corticoides sistémicos (vía oral, intramuscular o intravenoso) frente a placebo en lactantes <30 meses con BA, no encuentra diferencia en la duración de hospitalización (analizado en 7 ECA) ni en la puntuación clínica de gravedad (analizado en 8 ECA). La única diferencia significativa fue un ligero beneficio en la duración de la estancia en los casos VRS+ (DMP−0,67 días; IC del 95%: −1,11−−0,24), en contraposición a los datos procedentes de estudios in vitro. Con fines de comparación se calculó la dosis de corticoide equivalente a la prednisona (enfoque no exacto, pues no considera las diferencias farmacológicas). Esta RS ha sido descatalogada recientemente de la Cochrane.
Consistencia entre estudios: existe consistencia en una ausencia de efecto clínico significativo, a excepción del estudio de Teeratakulpisarn et al117 y el de Roosevelt et al115.
La ausencia de diferencias en la RS12 a nivel global, también se confirma en cualquiera de los subgrupos analizados (edad, antecedentes de sibilancias, etiología viral, dosis diaria de corticoides y dosis total). Así pues, existe evidencia de buena calidad (9/13 ECA con escala Jadad ≥4) que apoya la ausencia de efecto de los corticoides sistémicos para disminuir la duración del ingreso, la puntuación clínica y el porcentaje de niños que requieren ingreso hospitalario por BA. Además, la magnitud de cualquier potencial beneficio es pequeña y de relevancia clínica dudosa.
Precisión de las estimaciones: es escasa, condicionada por el tamaño muestral, pero mejora con los resultados expuestos en la RS12.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados de la baja calidad de la mayoría de los estudios, así como de la posible interacción de casos de BA y de casos con asma del lactante, fisiopatológicamente diferentes.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta, dado el pequeño número de ECA en cada subanálisis de la RS, la marcada heterogeneidad de los ECA (tamaño muestral, edad pacientes, intervenciones —tipo y dosis de corticoides— y medidas de resultado) y la dirección conflictiva del potencial beneficio. Los pacientes parecen apropiados, aunque en algunos trabajos pueden haberse incluido niños con asma (3 de los 10 ECA incluían primeros episodios).
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en el medio hospitalario, por lo que la aplicación al paciente ambulatorio de los resultados observados es dudosa. Los resultados deben interpretarse con cautela, pero todo apunta a que el tratamiento con corticoides no es beneficioso y, además, faltan datos sobre posibles efectos adversos (apenas notificados y examinados inadecuadamente).
Balance riesgo-beneficio-coste: en 6 ECA se estudian los efectos adversos, escasos y sin diferencias significativas entre grupos. Existe equilibrio entre riesgos (potenciales, aunque poco constatados por el escaso tiempo de aplicación) y beneficios (escasos, con poca relevancia clínica y no consistentes). No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: sería necesaria la realización de estudios con mejor definición de pacientes (<12 meses con primer episodio de BA y excluir posible asma del lactante), intervención (principalmente dexametasona entre 0,6–1mg/kg/día IM) y variables clínicas de interés (tiempo de ingreso y reingresos) y con mayor tamaño muestral.
RibavirinaEs el único tratamiento específico en la BA, dado que la ribavirina en un agente antivírico para la infección por VRS. Las recomendaciones iniciales de la AAP Committee on Infectious Diseases125 del año 1996 consideraban el uso de la ribavirina entre 3–7 días en aquellos niños con infección por VRS (confirmada o sospechosa) grave y/o que precisaran ventilación mecánica, así como en aquellos niños con enfermedades de base que pudieran tener mayor riesgo de complicaciones asociadas por el VRS. Si bien es a partir de 2003 cuando ya no se recomienda debido a su alto coste, eficacia dudosa y potencial efecto teratogénico en embarazadas.
Volumen de la evidencia: existen 13 ECA con calidad media-alta (8 estudios presentaron una calidad ≥4/5)126–134 y 4 estudios de cohortes (anidados en ECA en algún caso)135–138 publicados entre 1983 y 2002.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 5–41 y GC entre 9–21 pacientes). Solo 4 ECA especifican la edad de los pacientes: <12 meses133, <36 meses129 y entre 1–33 meses128,136. Todos los estudios especifican que se trate de infecciones por VRS (BA, neumonía u otras) y en 8 se concreta que sean infecciones graves (que requieran soporte respiratorio generalmente). Todos los estudios son en niños hospitalizados (en 7 de ellos ingresados en cuidados intensivos126,127,130,132,133,137,139 y en un compartiendo asistencia en domicilio129).
Intervención: ribavirina aerosolizada cuya dosis se especifica bien en dosis por kg de peso (10mg/kg140, 0,82mg/kg/h128 y 6g134) o bien como concentración (habitualmente 20mg/ml). El tiempo de aerosolización oscila entre 12, 16, 18 y 21h. La duración del tratamiento oscila entre 3 (preferente), 5–7 días, o bien se especifica que hasta extubación. En 4 estudios la aplicación de la ribavirina se realiza en pacientes en ventilación mecánica130,132,133,139.
Comparación: en los ECA con placebo (suero fisiológico o agua destilada126–130,132). En 2 ECA se compara la dosis estándar (20mg/ml durante 18h) con la dosis alta y fraccionada (60mg/ml durante 2h y 3 veces al día)139,141. En los estudios de cohorte frente a tratamiento conservador137,138 o frente a no tratamiento135,136.
Medidas principales: muy variables, por ejemplo: cambio de puntuación clínica, tiempo de hospitalización, pruebas de función pulmonar, etc. En los estudios de cohortes se valoran también los procesos respiratorios a medio-largo plazo, entre los 18 meses y los 10 años135,136,138.
Tiempo: generalmente el seguimiento es a corto plazo: durante el ingreso y hasta 7 días. Un ECA considera medidas de interés hasta un año134, siendo los estudios de cohortes los que valoran a más largo plazo, entre los 18 meses y los 10 años135,136,138.
Intensidad del efecto o fuerza de la asociación: ocho estudios no encuentran diferencias. Los 2 estudios de Rodríguez et al128,136 encuentran diferencias significativas a favor del GI, bien como mejoría en puntuación clínica y SatO2 en el ingreso128 o como menor tasa de procesos respiratorios a los 3 años136. Los 2 ECA de Hall et al126,127 encuentran diferencias significativas en la puntuación clínica, pO2 y eliminación de VRS, similar al de Groothuis et al129 y Englund et al141. El estudio de Smith et al encuentra130 diferencias en el tiempo de hospitalización y soporte respiratorio. De los 4 estudios de cohortes, solo el de Edell et al138 encuentran menor tiempo de hospitalización y menos episodios de hiperreactividad bronquial en la evolución.
No existen evidencias de que la utilización de ribavirina pueda reducir la mortalidad de nuestra población de estudio, tal como se deduce de los distintos ECA publicados, así como de las 2 RS: la inicialmente publicada en Archives of Pediatric Adolescent Medicine en 1996 por Randolph y Wang27 y la reciente publicada en Colaboración Cochrane en 2007 por Ventre et al21 (actualización de una previa publicada por los mismos autores en el año 200022).
El estudio de Randolph y Wang27 incluye un total de 8 ECA en los que se compara ribavirina nebulizada con placebo en niños con infección del tracto respiratorio inferior por VRS, de características heterogéneas y con muestras pequeñas y de calidad regular-baja. No se pudo demostrar diferencias significativas en ninguna de las medidas analizadas, bien primarias (mortalidad e insuficiencia respiratoria) o secundarias (tiempo de hospitalización, necesidad de ventilación mecánica y/o oxigenoterapia, mejoría clínica o función pulmonar). La revisión posterior de Ventre et al21 incluye 11 ECA en los que se compara ribavirina nebulizada con placebo en lactantes y niños con infección del tracto respiratorio inferior por VRS y, que ha diferencia de la anterior27, tiene mayor calidad metodológica y realiza una revisión de la literatura en múltiples bases de datos (no solo en Medline como la anterior). Se consideran medidas de efecto del proceso agudo (mortalidad, incidencia de insuficiencia respiratoria, tiempo de hospitalización, dependencia de ventilación mecánica y/o oxigenoterapia, función pulmonar) y del seguimiento (recurrencia de síntomas respiratorios y/o sibilancias, estado de oxigenación, función pulmonar). La única diferencia significativa encontrada es un menor tiempo de ventilación mecánica (DME=−1,79 días, IC del 95%: 3,37−−0,21); destacar también una cierta mejoría en el tiempo de hospitalización (DME=−1,90 días, IC del 95%: −4,59–0,90) y menor probabilidad de deterioro respiratorio (OR=0,37, IC del 95%: 0,12–1,18), sin diferencias significativas. Es preciso recordar los problemas de administración, efectos secundarios, costes económicos y teratogenicidad de la ribavirina.
Consistencia entre estudios: existe consistencia intermedia ente estudios: globalmente, los estudios se dividen casi numéricamente entre no favorables y favorables a la intervención, si bien con medidas de resultado diferentes. En los 3 ECA de mayor calidad (5/5) se obtiene en un caso algún resultado significativo a favor del GI128, pero no en los otros dos131,133. Un ejemplo de inconsistencia clara son los beneficios sobre la mecánica pulmonar: en pacientes no intubados es sorprendente la mejoría detectada a los 7 días131, hallazgos no detectados en niños intubados con esta enfermedad139.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios, aunque mejora con los resultados expuestos en la RS21, siguen siendo intervalos de confianza amplios, por lo que no pueden excluir que la intervención incremente el riesgo en algunas variables.
Estimación de sesgos: existe un riesgo de sesgos alto, derivado de la baja calidad de la mayoría de los estudios, así como de la consideración de infecciones por VRS en algunos estudios (en la mayoría de los estudios se trata de infecciones de vías respiratorias inferiores por VRS de distinta gravedad, no exclusivamente BA). El uso de agua como placebo resulta perjudicial en un GC, pues se aplica una solución aerosolizada más hipotónica que el suero fisiológico y con más riesgo de broncoespasmo (lo que puede favorecer el efecto potencialmente beneficioso de ribavirina en dichos ECA).
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado en la RS (de escaso impacto clínico), el pequeño tamaño de los ECA y la heterogeneidad de las medidas de efecto. Los pacientes están muy definidos: pacientes hospitalizados (principalmente en cuidados intensivos) con afectación grave por infecciones por VRS (si bien no exclusivamente BA). Las dosis y pautas de administración de la ribavirina están bien definidas para evaluar la intervención (mejor en los que se compara con suero fisiológico que con agua destilada).
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de los atendidos en cuidados intensivos, por afectación grave de la infección VRS. El efecto observado tiene un escaso impacto clínico, por lo que no podemos predecir la magnitud de la respuesta al tratamiento si se considera quizás su potencial utilización en pacientes con infecciones respiratorias graves por VRS y/o en pacientes de alto riesgo (prematuros, enfermedad pulmonar crónica, cardiopatía hemodinámicamente significativa, inmunodeprimidos). Un estudio prospectivo sobre 750 niños con infección de vías respiratorias inferiores por VRS incluidos en la base de datos del grupo PICNIC142 no encontró ningún beneficio significativo (en hospitalización, tiempo de ventilación mecánica, ingreso en cuidados intensivos o mortalidad) por el uso de ribavirina en prematuros, niños con cardiopatía congénita o enfermedad pulmonar crónica.
Balance riesgo-beneficio-coste: en 7 estudios se estudian los efectos adversos (en la mayoría no existen o no presentan importancia clínica). Existe un predominio de los riesgos (problemas de administración, efectos secundarios y teratogenicidad de la ribavirina) sobre los beneficios (cierta mejoría en algunas variables, no consistente entre los estudios y marginal en la mayoría de los casos), sin perder en cuenta los costes económicos de su administración (es un medicamento caro).
Estimación del impacto de futuros estudios: sería necesario la realización de estudios con mejor definición de pacientes (<12 meses con primer episodio de BA grave que requiera cuidados intensivos y excluir posible asma del lactante y otras infecciones por VRS) e intervención (dosis, intervalo, tiempo y modo de aplicación de la ribavirina aerosolizada), variables clínicas de interés homogéneas (tiempo de ingreso y ventilación mecánica, mortalidad) y mayor tamaño muestral. Sería interesante también valorar los efectos a largo plazo en un ECA multicéntrico en el que se incorporen protocolos de manejo estricto del soporte respiratorio a los pacientes (criterios de intubación, de aporte de oxigenoterapia, de admisión o alta de cuidados intensivos, etc).
AntibióticosLas GPC y estudios de revisión no recomiendan el uso de antibióticos a menos que haya preocupación por una complicación como la neumonía bacteriana secundaria u otra sobreinfección30,143. Esta conclusión se basa en trabajos que indican que existe un bajo riesgo de bacteriemia en los niños con BA y fiebre, tanto en estudios retrospectivos (0–3,7%) como prospectivos (1–2%), lo que supone un riesgo aún inferior al de los niños con fiebre sin enfermedad vírica reconocible (que oscila entre 2–7%). Cuando se confirma una infección bacteriana en niños con BA es más frecuente que sea una infección de orina, siendo infrecuente la presencia de bacteriemia y/o meningitis2. Es frecuente la asociación BA y otitis media aguda (más del 50% de los pacientes en algunas series144,145); aunque el VRS puede ser causa de otitis media aguda, no es posible diferenciar de una sobreinfección bacteriana y su tratamiento es el habitual, dado que la otitis no afecta el curso de la BA. Sí se ha demostrado que los pacientes con BA grave que requieren ventilación mecánica presentan riesgo elevado de coinfección bacteriana146,147.
Sin embargo, los niños con BA reciben con frecuencia antibioterapia por la presencia de fiebre, por ser lactantes muy pequeños y/o ante la sospecha de sobreinfección bacteriana2. Aunque existen evidencias de que la infección por VRS no predispone a la sobreinfección bacteriana148 se ha estimado que entre el 57–81% de los lactantes diagnosticados de BA reciben antibióticos149. Sin embargo, no se ha demostrado la eficacia de los antibióticos, no solo en la BA sino también en la neumonía por VRS150,151.
Volumen de la evidencia: existen 4 ECA de calidad media-baja (solo un estudio con calidad 4/5151), publicados entre 1966 y 2007.
Pacientes: el tamaño muestral es pequeño en 3 ECA (GI entre 12–72 y GC entre 9–64 pacientes); solo el estudio multicéntrico de Klein et al152 presenta un amplio tamaño muestral (234 vs. 114), pero con una baja calidad (con 65% de pérdidas en el seguimiento). Los criterios de inclusión de los pacientes son muy diferentes en edad y sintomatología. Solo un ECA concreta infecciones por VRS153, pero el resto incluyen pacientes con entidades diferentes a la BA. Todos los estudios son en niños hospitalizados.
Intervención: antibióticos diversos, bien vía oral (amoxicilina oral154, claritromicina153, cepfodopoxima o amoxicilina-clavulánico152) o intravenosa (ampicilina o penicilina151). La duración del tratamiento oscila entre 6 días151 y 3 semanas153.
Comparación: con placebo en 3 ECA151,153,154 y frente a otro antibiótico en un ECA152.
Medidas principales: se han usado diferentes variables: eficacia clínica, eficacia bacteriológica, hospitalizaciones, condensación radiológica, etc.
Tiempo: todos realizan seguimiento durante el ingreso. Dos ECA consideran variables a medio plazo (rehospitalizaciones)151,153.
Intensidad del efecto o fuerza de la asociación: 3 ECA no encuentran diferencias significativas151,152,154. El estudio de Tahan et al153 encuentra diferencias significativas en menor tiempo de hospitalización y oxigenoterapia y menor número de readmisiones, pero es un estudio con grandes limitaciones (dudoso método de aleatorización, pérdidas de un 30% y sin análisis por intención de tratar) y escasa potencia, debido al pequeño tamaño muestral.
Una reciente RS publicada en 2007 por Spurling et al7 solo considera el ECA de Field et al154; aunque se cita otro estudio (Mazumder 2006), parece referirse a una comunicación personal, pues no encontramos ninguna referencia al mismo en bases de datos. Por tanto, es una RS con limitaciones metodológicas importantes, con pequeño tamaño muestral (54 pacientes) y dudosa potencia para demostrar diferencias en la duración de síntomas y/o cultivo bacteriano en garganta.
Consistencia entre estudios: es muy escasa, debido a la heterogeneidad de los pacientes, antibióticos utilizados y variables de interés. De hecho, la RS solo considera el ECA publicado en 1966 por Field et al154, al ser el único que cumplía los criterios de inclusión.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios y no mejora con la RS7, dado que solo se considera un ECA.
Estimación de sesgos: existe un alto riesgo de sesgos, derivados del pequeño tamaño muestral y de la heterogeneidad global (tipo de antibiótico, duración, tipo de población, variables consideradas, etc) y consideración de distintas patologías respiratorias (no solo BA).
Grado de relación con la pregunta clínica: la evidencia aportada por estos estudios debe considerarse indirecta, ya que ni la población ni la intervención son apropiadas. Las medidas de efecto tienen escaso impacto clínico, pues las únicas diferencias significativas encontradas están pendientes de confirmación dadas las limitaciones del estudio del que proceden153.
Validez externa y aplicabilidad de la evidencia: los pacientes son muy heterogéneos y atendidos en el medio hospitalario. El efecto observado tiene un escaso impacto clínico. Aún así, con la información clínica disponible no está recomendada la administración sistemática de antibióticos en estos pacientes (como corresponde a una enfermedad de etiología vírica) y su indicación únicamente está justificada ante la presencia de un foco bacteriano documentado (otitis media aguda, neumonía, sinusitis, infección de orina, etc), principalmente en BA graves que precisen ventilación mecánica. Conviene plantear el potencial efecto antiinflamatorio e inmunomodulador de los macrólidos en la BA VRS+153; si bien, el efecto beneficioso de claritromicina en la BA parece de interés clínico marginal y podría relacionarse con la coexistencia de bacterias atípicas155.
Balance riesgo-beneficio-costes: se constatan los efectos adversos solo en un ECA152. Existe un predominio de riesgos (uso inapropiado de medicación antibiótica, favoreciendo la exposición innecesaria y sus consecuencias sobre resistencias bacterianas, efectos adversos y costes) sobre beneficios (posibilidad de tratar pacientes con infección bacteriana, pero son infrecuentes y no graves en su mayoría: principalmente infección de orina). No hay estudios de costes.
Estimación del impacto de futuros estudios: es poco probable que se hagan estudios aleatorizados en un futuro comparando el tratamiento con antibiótico frente a placebo en niños con BA. Solo podrían considerarse en pacientes seleccionados (BA graves que requieren ventilación mecánica o con cardiopatías congénitas cianógenas, por el mayor riesgo de coinfecciones) y/o para confirmar el aparente efecto beneficioso de la claritromicina.
Suero salino hipertónicoLa combinación en la BA de edema de la pared de las vías respiratorias, desprendimiento de restos de tejido necrótico, aumento de la producción de moco y deterioro en la eliminación de secreciones bronquiales produce una obstrucción de vías respiratorias, hiperinsuflación, atelectasia y deterioro del intercambio gaseoso. Como el edema de las vías respiratorias y el taponamiento por moco son características patológicas predominantes en la BA, puede ser beneficiosa cualquier modalidad terapéutica que pueda reducir estas alteraciones anatomopatológicas y mejorar la eliminación de las secreciones de las vías respiratorias.
Se ha observado que la solución salina hipertónica aumenta la depuración mucociliar de los pacientes normales y patológicos (asma, bronquiectasias, fibrosis quística y patologías rinosinusales). Los mecanismos de actuación del SS hipertónico son: romper los enlaces iónicos dentro del gel del moco, con lo que se consigue disminuir su viscosidad y elasticidad; provocar un flujo osmótico de agua hacia el interior de la capa de moco, con lo que se rehidrata y mejora su reología; estimular la movilidad filial mediante la liberación de prostaglandina E2; reducir el edema de la pared, al absorber agua de la mucosa y submucosa; e inducir el esputo y la tos.
Volumen de la evidencia: existen 4 ECA con calidad alta (todos presentaron una calidad ≥4/5), publicados entre 2002–2007. Tres de los ECA están elaborados por el mismo grupo de estudio (con similares ventajas y limitaciones en su análisis)156–158.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 21–47 y GC entre 20–49 pacientes). La edad es ≤24 meses156, ≤18 meses159 o ≤12 meses157,158. Aunque todos los pacientes presentaron BA solo uno define claramente los criterios159, si bien en todos se excluyeron los pacientes con un episodio anterior de sibilancias; no se concreta etiología por VRS (tasa de positividad al VRS entre 69–87%). Tres ECA son en niños hospitalizados157–159 y uno en atención primaria156.
Intervención: con SS hipertónico (SS 3%) nebulizado a dosis de 4ml (en 3 estudios)157–159 o 2ml (en un estudio)156. Salvo en el estudio de Kuzik et al159, en el resto se administra con broncodilatadores, bien 1,5mg de adrenalina157,158 o 5mg de terbutalina156. La administración es con nebulizadores de chorro con O2, salvo el estudio de Tal et al158 que es con nebulizador ultrasónico. Las dosis se repitieron preferentemente cada 8h, si bien también se consideran cada 6h159 o con dosis iniciales más frecuentes158. La duración del tratamiento es de 5 días o bien hasta el alta.
Comparación: con SS fisiológico (SS 0,9%).
Medidas principales: tiempo de hospitalización en pacientes hospitalizados157–159 y tasa de hospitalización en pacientes ambulatorios156. Como medida secundaria se considera la diferencia en la puntuación clínica de gravedad (basada en la escala de Wang43).
Tiempo: el seguimiento de las medidas de efecto es de 3 días o hasta el alta.
Intensidad del efecto o fuerza de la asociación: un ECA no encuentran diferencias159. Dos ECA encuentran diferencias significativas de puntuación clínica en los días 2 y 3 (pero no en el día uno)156,158 y una diferencia en los días de hospitalización157.
En la RS de la Colaboración Cochrane publicada en 2008 por Zhang et al23, se incluyen estos 4 ECA. El SS3% usado junto a broncodilatadores ofrece los siguientes resultados: a) La duración de la hospitalización se podría disminuir en casi un día (25,9% reducción respecto al GC), diferencia que podría tener un importante impacto económico (dada la prevalencia de la BA); b) El estado clínico (puntuación) en los 3 primeros días podría mejorar un 20% respecto al GC; ese efecto parece ser mejor en pacientes ambulatorios que en ingresados (en los que solo se alcanza una diferencia estadísticamente significativa el segundo día de ingreso). Aunque se constató un reducción del 33% en la tasa de hospitalización en el ECA con pacientes ambulatorios156, no fue estadísticamente significativo por la pequeña muestra (65 pacientes).
Consistencia entre estudios: la consistencia es importante, tanto en el diseño del los estudios como en la dirección de los resultados. La mejoría en los días de hospitalización y en la puntuación clínica en los 3 primeros días se constata también en la RS que incluye estos 4 ECA23.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios, pero correcta en los resultados expuestos en la RS23.
Estimación de sesgos: existe riesgo intermedio de sesgos por el pequeño tamaño muestral, que condiciona que no tenga el poder estadístico suficiente para encontrar diferencias en algunas medidas (ej. tasa de hospitalización). No hay análisis por intención de tratar en 3 de los 4 ECA156–158 (si bien el número de retiradas después de la aleatorización fue pequeño, por lo que existe poca probabilidad de sesgo) y ni control de las cointervenciones con broncodilatadores (en 3 ECA y en el restante159 el uso de broncodilatadores ocurre hasta en el 60% de la población).
Grado de relación con la pregunta clínica: la evidencia aportada por estos estudios puede ser considerada directa, pues la población e intervención se han definido bien y son apropiadas y las medidas de efecto (disminución del tiempo de hospitalización y sintomatología) son de interés clínico. Su resultado es consistente en los ECA individuales y en la RS.
Validez externa y aplicabilidad de la evidencia: la validez externa es correcta, tanto en BA hospitalizados como ambulatorios. La evidencia de los estudios presentados permite considerar el SS3% (usado junto a broncodilatadores) como un tratamiento efectivo y seguro en los lactantes con BA.
Balance riesgo-beneficio-coste: en todos los ECA se confirma la ausencia de efectos adversos. Aunque no se han constatado efectos adversos, no es posible descartarlos dado el pequeño tamaño muestral alcanzado. El efecto secundario teórico y conocido de la nebulización de solución salina hipertónica es el broncoespasmo agudo, que no se constata en estos ECA, posiblemente porque la administración conjunta con broncodilatadores evitaría cualquier efecto broncoconstrictor.
La relación entre riesgos (no constatado), beneficios (en días de hospitalización, mejoría clínica en los 3 primeros días y potencial disminución de la hospitalización según la RS) y costes (prácticamente nulo, salvo la adquisición del nebulizador) es francamente favorable.
Estimación del impacto de futuros estudios: sería conveniente definir en ECA de mayor tamaño muestral el papel del SS3% aislado (y su potencial efecto broncoconstrictor), así como comparar la eficacia del SS3% frente a SS3% más broncodilatadores. Son necesarios ECA grandes adicionales para evaluar la eficacia de SS3% nebulizado para prevenir la hospitalización entre los pacientes ambulatorios con BA, así como para determinar el intervalo de dosificación (cada 8h o más frecuente). Asimismo, ECA que comparen la administración con nebulizadores de chorro (generan aerosoles con diámetro más pequeño) o con nebulizadores ultrasónicos (inducen el esputo más eficientemente).
InmunoglobulinasLa inmunoglobulina frente a VRS y los anticuerpos monoclonales humanizados frente al VRS (palivizumab) se han estudiado preferentemente en la prevención de la infección aguda en lactantes de alto riesgo, pero su papel en la infección ya establecida ha sido menos explorado.
Volumen de la evidencia: existen 4 ECA de calidad media-alta, publicados entre 1987–97. Tres ECA realizados por el mismo grupo de trabajo160–162; los últimos publicados simultáneamente, uno de ellos en población sana162 y otro en población con factores de riesgo161.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 17–51 y GC entre 18–52 pacientes). En todos los casos son niños <2 años con infección por VRS (BA, neumonía, etc); en un estudio se especifica niños ≤10kg160 y en otro bien en ≤6 meses (sin patología de base) o en ≤12 meses (con patología de base)163. Los ECA con inmunoglobulina intravenosa son en niños hospitalizados160–162 y el de inmunoglobulina aerosolizada en cuidados intensivos163.
Intervención: inmunoglobulina IgG, bien intravenosa (dosis entre 1,5–2g/kg durante 12h)160–162 o en aerosol (0,1g/kg)163. La duración del tratamiento se limita a una dosis.
Comparación: placebo (albúmina en el caso de los estudios con inmunoglobulina intravenosa).
Medidas principales: días de hospitalización y de soporte respiratorio, principalmente.
Tiempo: durante el ingreso, salvo el estudio de Hemming160 que realiza seguimiento hasta 6 semanas.
Intensidad del efecto o fuerza de la asociación: no hay diferencias significativas en los ECA con inmunoglobulina intravenosa, salvo presencia de mayor título de anticuerpos neutralizantes frente VRS160, que no se correlacionó con variables de interés clínico. El ECA con inmunoglobulina aerosolizada encuentra menos apneas en el tercer día (pero no el día 1, 2, 6 o 7) y menos necesidad de presión positiva, con mínimo valor clínico163. Los efectos se valoran durante la administración del tratamiento y hospitalización, no a más largo plazo.
Consistencia entre estudios: es aceptable entres los distintos ECA en cuanto a no apoyar su utilización. En una RS de la Colaboración Cochrane publicada en 2006 por Fuller et al20 y que incluye estos 4 ECA no se pudo realizar metanálisis por la escasez de estudios, la falta de mediciones comparativas y la gran heterogeneidad de los resultados evaluados; pero no se apoya el uso en BA.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios.
Estimación de sesgos: existe riesgo moderado de sesgos, derivados del pequeño tamaño muestral y de la consideración de que los 3 ECA con inmunoglobulina intravenosa han sido financiados por la industria farmacéutica160–162.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado con inmunoglobulina intravenosa (sin interés clínico) y aerosolizada (escaso interés, basado en un único ECA). Los pacientes incluyen pacientes con patologías con VRS diferentes a BA. Las dosis y pautas de administración de la inmunoglobulina son suficientes para evaluar la intervención.
Validez externa y aplicabilidad de la evidencia: la muestra de pacientes es representativa de nuestro medio, en lactantes con infección respiratoria por VRS (entre ellas BA) moderada-grave y/o con factores de riesgo. En cuanto a la aplicabilidad de los resultados, los estudios presentados permiten no considerar su uso en estos pacientes.
Balance riesgo-beneficio-coste: se constatan los efectos adversos en 3 ECA: solo destaca, en el caso de la inmunoglobulina aerosolizada, que se observa marcado aumento de la salivación en la primera hora de la administración. El balance entre riesgos (potenciales), beneficios (no constados) y costes (elevados) es desfavorable.
Estimación del impacto de futuros estudios: es improbable que futuros estudios modifiquen la evidencia disponible, dados los resultados y que el último ECA fue publicado hace más de una década.
Tratamiento del fracaso respiratorioOxigenoterapiaEs necesario administrar oxígeno suplementario en los pacientes hipóxicos, si bien no existe consenso sobre el punto de corte crítico. En el compendio resumen de National Guideline Clearinghouse sobre BA5, las 3 GPC recomiendan la oxigenoterapia cuando la SatO2 cae por debajo de un umbral, con pequeñas diferencias: <90% (AAP)2, <91% (CCHMC)4, o ≤92% (SIGN)3. También existen pequeñas diferencias respecto a cuándo se debe retirar el suplemento de oxígeno: si SatO2 >90% con mínima dificultad respiratoria y adecuada ingesta oral (AAP)2 o si SatO2 >94% (CCHMC)4. A medida que el curso clínico mejora no es necesario la monitorización continua de la SatO22,4.
En la GPC de la AAP se considera el punto de corte de SatO2 en 90%, por debajo del cual se indicar aportar suplemento de oxígeno y por encima suspenderlo (si presenta mínima dificultad respiratoria y adecuada pauta de alimentación). Este punto de corte es inferior al publicado en otras publicaciones y cuyo potencial beneficio es disminuir la necesidad de hospitalización por ese criterio y el potencial perjuicio es proveer una inadecuada oxigenación164. Según la curva de disociación de la hemoglobina si la SatO2 es >90% implica que grandes incrementos de paO2 se asocian con pequeños aumentos en SatO2; por el contrario, si la SatO2 es <90% un pequeño descenso de la paO2 se asocia con importante descenso de la SatO2.
El mayor control de la SatO2 se ha citado como uno de los motivos de que las tasas de hospitalización en la BA se haya incrementado en los últimos años, sin cambio significativo en la mortalidad. Es necesario estandarizar los puntos de corte de la SatO2 con importancia para la hospitalización y la diferencia mínima clínicamente importante de esta medida de resultado.
Soporte respiratorioEn el manejo de la BA puede ser necesario soporte respiratorio, bien para el manejo de las apneas recurrentes o para el fracaso respiratorio. Se han utilizado distintas modalidades de soporte respiratorio en la BA (ventilación con presión positiva intermitente165–167, CPAP168,169, presión extratorácica negativa170, ventilación de alta frecuencia171 y oxigenación con membrana extracorpórea172,173), pero no se han estudiado con el diseño de ECA que permita comparar su eficacia y/o seguridad.
En aquellos pacientes con hipoxia y/o hipercapnia refractarias y secundarias a una BA grave está indicada la realización de ventilación asistida. No existen sin embargo evidencias claras sobre cuál es la modalidad ventilatoria de elección. Se ha propuesto el uso de CPAP o BiPAP como una alternativa o paso intermedio, antes de la ventilación invasiva, de forma particular en aquellos pacientes con crisis de apnea frecuentes. La CPAP contribuye a disminuir el trabajo respiratorio, prevenir atelectasias y mejorar la distribución de gases en vías aéreas con obstrucción. Cuando se requiere ventilación mecánica, la mayoría de los autores prefieren modos ventilatorios controlados por presión, con frecuencias bajas, tiempos inspiratorios cortos, espiración prolongada y picos de presión lo más bajos posible, para tratar de minimizar el riesgo de atrapamiento y prevenir el barotrauma, aun a expensas de provocar una hipercapnia (hipercapnia permisiva). Las técnicas de ventilación no invasiva han mostrado un alto porcentaje de éxito en la BA, habiéndose estudiado distintos parámetros que pueden predecir el éxito o el fracaso de la técnica174.
En aquellos casos que no responden a la ventilación mecánica convencional existe información a favor del uso de la ventilación de alta frecuencia oscilatoria (VAFO), principalmente en el caso de neumonías por VRS que desarrollan un síndrome de distrés respiratorio agudo. Finalmente, en los casos refractarios a todas las modalidades anteriores, se ha comprobado que la ECMO puede ser beneficiosa, con altas tasas de supervivencia, aunque con una morbilidad significativa175–177.
Apenas se han estudiado las distintas modalidades de soporte respiratorio en la BA con un diseño experimental. Es en el caso de la CPAP donde encontramos algunos recientes estudios al respecto.
Volumen de la evidencia: existen 4 estudios: un ECA aleatorizado con diseño cruzado178 y 3 estudios observacionales unicéntricos179–181, publicados entre 2006–08.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 6–53 y GC entre 6–68 pacientes). En todos los casos son BA <12 meses de intensidad moderada-grave (no se especifica etiología), salvo en el estudio de diseño cruzado de Martinón et al181 que incluye entre 1–24 meses. Los estudios observacionales son con ingresados en cuidados intensivos y el ECA en niños hospitalizados.
Intervención: CPAP (más manejo estándar)178,179; en 2 estudios del mismo grupo también asocia intervención con heliox (70/30)180,181. La aplicación de la CPAP era con cánula binasal179 o Infant Flow178,180,181 a dosis inicial de 5cmH2O (y aumentos hasta 8–10cmH2O). La duración del tratamiento es hasta mejoría o empeoramiento (y criterios de ventilación invasiva).
Comparación: con manejo estándar (líquidos intravenosos y suplementos de O2 mediante gafas nasales o mascarilla); en un estudio observacional de diseño cruzado se compara CPAP-heliox con CPAP-aire oxígeno181.
Medidas principales: son muy variables: puntuación clínica, FR, medidas gasométricas y tiempo de hospitalización.
Tiempo: seguimiento a corto plazo: entre 12–48h. En el estudio de diseño cruzado se estudian las variables a los 30min de aplicación de cada intervención181.
Intensidad del efecto o fuerza de la asociación: los 4 estudios encuentran diferencias significativas, pero en variables subrogadas (medidas gasométricas) y a corto plazo y que no se corresponden con mejoría en la duración del ingreso.
Consistencia entre estudios: en general es favorable a la intervención, pero limitado por la validez de los estudios y variables de interés consideradas.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios.
Estimación de sesgos: existe riesgo elevado de riesgos, derivados de las limitaciones propias de los estudios observacionales, pequeño tamaño muestral, variables primarias subrogadas y a corto plazo. En el ECA de diseño cruzado no hubo cegamiento.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, mayoritariamente basado en pequeños cambios en parámetros gasométricos (principalmente paCO2 y SatO2), sin correlación con otras medidas de mayor impacto clínico (ingreso y duración). Aunque los pacientes parecen apropiados (BA grave en <1–2 años ingresados en cuidados intensivos) y la administración de CPAP (en algunos estudios con heliox) es reproducible, los resultados proceden básicamente de estudios observacionales, con los potenciales sesgos reseñados.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos de las BA moderadas-graves que precisen soporte respiratorio en cuidados intensivos. Con la información clínica disponible no podemos predecir los casos que se pueden beneficiar del tratamiento, pero se sugiere el potencial beneficio de la aplicación conjunta de CPAP y heliox en BA grave, pudiendo evitar intubación/ventilación mecánica.
Balance riesgo-beneficio-coste: en los 3 estudios observacionales se estudian los efectos adversos y no se constatan. El balance de riesgos (método de ventilación no invasiva, sin efectos adversos constatados) y beneficios (mejoría clínica y gasométrica a corto plazo) puede ser favorable en las BA moderada-graves, especialmente por la posibilidad de evitar intubación y ventilación mecánica de estos pacientes. No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: sería deseable la realización de ECA con mayor tamaño muestral y que incluyan variables clínicas de interés (tiempo de ingreso, mortalidad) además de las variables subrogadas (clínicas y gasométricas a corto plazo). Además debe valorarse el efecto de su utilización con heliox.
HelioxEl heliox es una mezcla gaseosa (de helio y oxígeno) de menor densidad que el aire y se ha empleado con éxito en el tratamiento sintomático de múltiples enfermedades respiratorias de tipo obstructivo (inicialmente para aliviar obstrucciones de vías respiratorias superiores). Aunque están disponibles distintas mezclas, la más habitual es la proporción de 79% de helio y 21% de oxígeno. Así, cuando el nitrógeno del aire se sustituye por helio, disminuye la resistencia de las vías aéreas debido a la menor densidad de los gases inspirados y se requiere menos energía mecánica para la ventilación pulmonar. Al sustituir el nitrógeno del aire inspirado por helio, que tiene una densidad 7 veces menor, se obtiene una mezcla gaseosa con menor densidad que el aire ambiente, disminuye el número de Reynolds y el flujo es más laminar. Esto hace que disminuya la resistencia de la vía aérea y se reduzca el trabajo respiratorio del paciente. Es por ello que el heliox se utiliza principalmente en entidades médicas que impliquen una disminución en el diámetro de las vías respiratorias (y, por consiguiente, una mayor resistencia de las vías respiratorias), como asma, enfermedad pulmonar obstructiva crónica, disfunción de cuerdas vocales, crup y, también, en BA. El heliox puede mejorar el intercambio gaseoso, la ventilación pulmonar y, debido a su alto coeficiente de difusión, también la eliminación de CO2.
Volumen de la evidencia: existen 3 ECA182–184 con calidad media (2 estudios presentaron una calidad 4/5) publicados entre 1998 y 2006. Se encuentran también 2 estudios prospectivos intervencionales no aleatorizados185,186 y un estudio de casos187
Pacientes: el tamaño muestral es muy pequeño (GI entre 10–48 y GC entre 9–48 pacientes). Todos los estudios consideraron pacientes <24 meses (los 2 ECA más recientes población de menor edad: <9 meses183 y <3 meses184). En todos los estudios, salvo uno, se especifica la etiología por VRS. Todos los estudios son en niños hospitalizados en cuidados intensivos, salvo uno en urgencias186
Intervención: heliox-oxígeno a concentraciones variables en los distintos estudios (entre 50/50 y 79/21). En algún ECA se especifica que se administra en cámara de Hood durante un tiempo variables (entre 20min y 1h). En un estudio se especifica administración cada 15min187, pero no en los restantes estudios. La duración del tratamiento no se especifica.
Comparación: con aire-oxígeno.
Medidas principales: cambio de puntuación clínica, principalmente, así como otras variables heterogéneas (gasométricas, intubación endotraqueal, ingreso, etc).
Tiempo: seguimiento a corto plazo (durante el ingreso).
Intensidad del efecto o fuerza de la asociación: 3 estudios no encuentran diferencias. Dos ECA encuentran mejoría en la puntuación clínica a corto plazo182,184, de dudosa relevancia clínica. Un estudio observacional (no enmascarado y sin cegamiento) encuentra mejoría en los parámetros clínicos, pero sin mejora en los parámetros de la oxigenación185.
Consistencia entre estudios: es escasa entre los 3 estudios experimentales (2 con diseño paralelo y uno con diseño cruzado) y los 3 observacionales (2 estudios prospectivos no aleatorizados y una serie de casos). Los 2 ECA de mayor calidad (4/5) encuentran datos discordantes183,184. Los resultados discordantes de los estudios observacionales prospectivos pueden explicarse, en parte, por el hecho de que en un estudio el heliox se administra de forma continua (beneficio)185 y en otro solo se utiliza como fuente de nebulización (no beneficio)186.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de todos los estudios.
Estimación de sesgos: existe riesgo alto de sesgos, derivados de los propios sesgos de los tipos de diseños: mayor en los estudios observacionales que en los experimentales.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido al tipo y magnitud del efecto observado, basado en pequeños cambios clínicos y muy corto plazo, y discordantes. Aunque los pacientes parecen apropiados (BA grave en <2 años ingresados en cuidados intensivos) y la administración de heliox definida (aunque a variables concentraciones) los resultados significativos proceden de 2 ECA de pequeño tamaño muestral y de un estudio observacional.
Validez externa y aplicabilidad de la evidencia: los pacientes son representativos, principalmente, de las BA graves que ingresan en cuidados intensivos. Con la información clínica disponible se podría considerar su uso en pacientes seleccionados en estas circunstancias.
Balance riesgo-beneficio-coste: en 4 estudios se estudian los efectos adversos y se afirma que el heliox es muy seguro. El balance entre riesgos (medicación muy segura) y beneficios (mejoría clínica a corto plazo de dudosa relevancia clínica) es parcialmente favorable, pero muy dependiente de los costes de su aplicación (no existen estudios).
Estimación del impacto de futuros estudios: sería necesaria la realización de ECA con mejor definición de pacientes (<12 meses con primer episodio de BA grave que requiera cuidados intensivos y excluir posible asma del lactante y otras infecciones por VRS), mejor definición de la intervención (concentración de la mezcla de helio-oxígeno, dosis, intervalo, tiempo y modo de aplicación), variables clínicas de interés homogéneas (tiempo de ingreso y ventilación mecánica, mortalidad) y mayor tamaño muestral.
SurfactanteLa detección de alteraciones cualitativas y cuantitativas en el surfactante de lactantes con BA grave, constituye la base racional para la suplementación terapéutica de surfactante exógeno. El surfactante es una agente tensioactivo compuesto por proteínas y fosfolípidos que se produce en los neumocitos tipo 2, bien conocido en patología respiratoria neonatal para mejorar la estabilización alveolar al disminuir la tensión superficial. De sus 4 componentes proteicos (A, B, C, y D), 2 de ellos (A y D) tienen la capacidad de unirse a reconocidos marcadores en la superficie de bacterias y virus y facilitar su eliminación por el sistema inmune. Estas funciones también se han comprobado en el caso de la BA por VRS188,189. En este sentido, no está claro si el uso del surfactante en BA por otros virus pudiera ser diferente.
Volumen de la evidencia: existen 3 ECA con calidad media (todos presentaron una calidad 3/5), publicados entre 1998 y 2002. Dos estudios son del mismo grupo de trabajo190,191.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 9–20 y GC entre 10–20 pacientes). Son pacientes con BA grave que precisan ventilación mecánica; no se especifica edad ni etiología vírica. Los 3 ECA en niños hospitalizados en cuidados intensivos.
Intervención: surfactante (2 porcino y uno bovino). Dosis de Curosurf a 50mg/kg (2–3 dosis)190,191 y dosis de Survanta a 100mg/kg (2 dosis, a 0 y 24h)192. La duración del tratamiento es de 1–2 días, que corresponde al tiempo de aplicación de las 2 a 3 dosis.
Comparación: bien con no tratamiento190,191 o placebo192.
Medidas principales: días de ingreso en cuidados intensivos, días de ventilación mecánica y parámetros gasométricos (PaO2 y paCO2).
Tiempo: Seguimiento durante el ingreso.
Intensidad del efecto o fuerza de la asociación: los 3 ECA encuentran diferencias significativas, bien datos de mejoría clínica (menos días de ingreso en cuidados intensivos y menos días de ventilación mecánica)190–192, gasométricos (mejoría en paO2 y paCO2 a las 24 y 48h)190,191 y/o de función pulmonar (mejoría índice ventilatorio, índice de oxigenación)192.
La RS de la Colaboración Cochrane publicada en 2006 por Ventre et al24 incluye los 3 ECA comentados e identifica también algunos estudios en los que se evalúa el surfactante en niños con infecciones respiratorias inferiores, si bien no cumplen los criterios de inclusión para la RS, pues son estudios con patologías respiratorias diversas en los que una proporción de la población son VRS+193–195. Dado que en la RS el mayor efecto provenía del ECA que no incluía un protocolo para el manejo de la ventilación mecánica y otras terapias190, se realizó un análisis de sensibilidad con los 2 ECA más homogéneos en estos aspectos (que incorporan estrategias de ventilación menos agresivas y protocolizan el uso de otras terapias de soporte)191,192: a) días de UCI: en el global (3 ECA): DMP=−3,3 (−6,38−1,23); p=0,04; en el análisis de sensibilidad (2 ECA): DMP=−1,81 (−2,42−−1,19); b) días de ventilación mecánica: en el global (3 ECA): DMP=−2,6 (−5,34−0,18); p=0,07; en el análisis de sensibilidad (2 ECA): DMP=1,21 (1,67−−0,75).
Consistencia entre estudios: es importante, tanto el diseño de los estudios como la dirección de los resultados van en la misma línea. Los datos son consistentes con los resultados de una actual RS que incluye estos 3 ECA24.
Precisión de las estimaciones: es escasa, en parte por el pequeño tamaño muestral de la mayoría de los estudios, pero mejora con los resultados expuestos en la RS24.
Estimación de sesgos: el riesgo de sesgos es alto, en relación con el pequeño tamaño muestral de los ECA, la ausencia de enmascaramiento y no utilización de placebo en el GC en 2 de los ECA190,191. Además los ECA incluyen pacientes VRS+ y VRS−, lo que puede variar la respuesta deseada al surfactante.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa, pues los ECA individuales y el metanálisis constatan diferencias clínicas y gasométricas, con potencial interés clínico (2−3 días menos de ingreso en cuidados intensivos y 1−2 días menos de ventilación mecánica). Aunque los pacientes parecen apropiados (BA grave que precise ventilación mecánica), falta por definir la forma de aplicación del surfactante (en relación con la modalidad de soporte respiratorio).
Validez externa y aplicabilidad de la evidencia: la administración de surfactante en lactantes con BA grave que precisan ventilación mecánica parece una alternativa eficaz y segura, si bien los resultados provienen de 3 pequeños ECA de calidad limitada. Las evidencias existentes, aunque limitadas, sugieren un efecto beneficioso clínico y gasométrico, así como una mejoría de la función pulmonar, en las primeras 60h de su aplicación. Cabe considerar si estas pruebas científicas son suficientes para la utilización de surfactante en los pacientes con BA grave por VRS que precisan ventilación mecánica.
Balance riesgo-beneficio-coste: en todos los ECA se confirma la ausencia de efectos adversos. La relación beneficio (menor días de ingreso en cuidados intensivos y necesidad de ventilación mecánica) y riesgo (nulo) es favorable en los casos de BA grave que precisan ventilación mecánica. No existen estudios de evaluación de costes al respecto, pero es preciso tener en cuenta que las preparaciones de surfactante (porcino, bovino, sintético) son caras.
Estimación del impacto de futuros estudios: se precisan ECA con mayor poder (mayor tamaño muestral) que conteste a la cuestión de surfactante (tipo, dosis e intervalo) y modalidad ventilatoria más adecuados y que considere también variables de efecto a más largo plazo. Conviene realizar estudios de evaluación económica por el coste elevado del surfactante y el potencial beneficio de menos días de ingreso en cuidados intensivos.
MetilxantinasAproximadamente el 20% de los niños ingresados con BA padecen alguna forma de apnea. En ese caso el uso de metilxantinas (teofilina y cafeína) podría estar justificado, aunque no hay ECA al respecto. Los estudios disponibles hasta la fecha196,197, no han encontrado efectos beneficiosos tras la administración de teofilina a estos pacientes. En una revisión realizada sobre el papel de las metilxantinas en la prevención o tratamiento de las apneas asociadas a la BA, solo se encuentra limitada evidencia de un estudio retrospectivo198 y 2 casos clínicos199,200 (en un total de 10 pacientes) y en los que se percibe una favorable respuesta en la disminución de las pausas de apnea y prevención de la ventilación mecánica por apneas.
Humedad ambientalA pesar de su uso prácticamente generalizado, sorprende que existan muy pocos estudios que evalúen el papel de la nebulización/humidificación templada en el tratamiento de la BA. En ellos no se ha demostrado que la nebulización/humidificación templada sea beneficiosa, y tampoco existen pruebas de que la humidificación en sí misma tenga ningún efecto positivo para estos pacientes, entre otras razones porque son pocas las gotas de vapor que alcanzan el tracto respiratorio inferior, donde se espera actúe licuando las secreciones2. Por otra parte, no está muy claro si la humidificación es totalmente inocua en estos pacientes.
Óxido nítricoNo existen evidencias de que el óxido nítrico pueda ser beneficioso, ni como vasodilatador pulmonar, por la baja incidencia de hipertensión pulmonar en estos pacientes201, ni tampoco por sus efectos broncodilatadores202. Este tratamiento se reserva para BA graves refractarias a las modalidades convencionales de ventilación mecánica.
FisioterapiaLa fisioterapia actúa ayudando a los lactantes con BA a expulsar las secreciones y disminuir el esfuerzo respiratorio. Aunque se emplea de forma habitual en algunos países (ej. Francia), no existen evidencias directas que demuestren que la fisioterapia respiratoria sea beneficiosa en estos pacientes.
Volumen de la evidencia: existen 3 ECA con calidad media-baja, publicados entre 1985 y 2004.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 16–44 y GC entre 16–46 pacientes). Son pacientes con BA clínica, con criterios poco definidos (no se especifica edad ni etiología vírica). Dos ECA son en niños hospitalizados203,204 y uno en cuidados intensivos205.
Intervención: fisioterapia respiratoria en distintas modalidades, que se describe como percusión, drenaje y aspiración nasofaríngea203–205. El intervalo de aplicación de la fisioterapia es 2 veces al día. La duración del tratamiento no se especifica.
Comparación: bien con ausencia de tratamiento o con aspiración nasofaríngea solo.
Medidas principales: cambios en puntuación clínica y duración del ingreso.
Tiempo: seguimiento durante el ingreso.
Intensidad del efecto o fuerza de la asociación: los 3 ECA no encuentran diferencias significativas. La RS realizada en la Colaboración Cochrane en el año 2006 por Perrotta et al16 incluye los 3 ECA previos y no permite ofrecer un resultado cuantitativo procedente del metanálisis, pues los estudios originales no aportan valores combinables.
Consistencia entre estudios: hay ausencia de efecto en los 3 ECA controlados, así como en el metanálisis.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de la mayoría de los estudios. No había datos cuantitativos en la RS16 que permitieran mejorar la precisión.
Estimación de sesgos: existe un alto riesgo de sesgos en relación con el pequeño tamaño muestral de los ECA y la escasa definición de los grupos de inclusión-exclusión, así como de las diferentes intervenciones analizadas. Cabe considerar la ausencia de un placebo válido en los estudios y la selección de una variable de interés (duración del ingreso) con poca probabilidad de disminuir con la fisioterapia.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido a la calidad de los ECA, pobre definición de pacientes e intervención (distintas modalidades, pero principalmente basado en técnicas de vibración y percusión). Los resultados no son aplicables a enfoques que emplean técnicas más suaves de fisioterapia (aceleración pasiva del flujo espiratorio).
Validez externa y aplicabilidad de la evidencia: los pacientes no son representativos de BA (criterios indefinidos). Con la información clínica disponible se podría considerar que la fisioterapia no mejora la estancia hospitalaria ni la puntuación clínica de gravedad en lactantes con BA.
Balance riesgo-beneficio-costes: en todos los estudios se confirma la ausencia de efectos adversos, aunque en un estudio se afirma que un número indeterminado empeoraron momentáneamente durante la fisioterapia203. Existe un predominio de riesgos (estrés de su administración a un paciente con disnea, tiempo y personal para su administración) sobre beneficios (no diferencias en movilidad y limpieza de secreciones, ni en prevención de atelectasias). No hay estudios de costes.
Estimación del impacto de futuros estudios: se precisan ECA con mayor poder (mayor tamaño muestral), con mejor definición de la muestra (criterios de inclusión y exclusión) y de la intervención (para contestar si algún tipo de fisioterapia específico puede ser de ayuda, concretamente estudiar las técnicas de aceleración pasiva del flujo espiratorio) y con cegamiento del observador (dada la ausencia de un placebo válido para esta intervención). La selección de la variable resultado pasaría más por valorar el menor malestar posible (con puntuación clínica) y no tanto la duración del ingreso (la BA suele ofrecer un tiempo medio de ingreso de 3–4 días que resulta improbable que se modifique significativamente por la fisioterapia).
Otros tratamientosExisten otros tratamientos para los que las evidencias existentes son anecdóticas o claramente insuficientes para establecer una recomendación en el momento actual, pero en las que nuevos estudios podrían aclarar su papel, aunque parecen poco justificados. Entre ellos destacarían: ketamina206, dimetil sulfóxido207, y algunos otros ECA que se comentan a continuación.
DNAsa recombinante humanaLa DNAsa es un agente mucolítico que, al aplicarse nebulizado, actúa mejorando la eliminación de las secreciones de vías respiratorias. Ha sido demostrado que la DNAsa reduce la viscosidad del esputo, mejora la función pulmonar y reduce el número de exacerbaciones pulmonares en pacientes con enfermedad pulmonar moderada y ha sido especialmente utilizado en pacientes con fibrosis quística. Se asume un papel similar en la BA.
Volumen de la evidencia: existen 2 ECA de alta calidad, publicados ambos en 2001 y 2007.
Pacientes: Tamaño muestral aceptable (GI entre 40−111 y GC entre 35−111 pacientes). Pacientes <24 meses con BA VRS+ (en un estudio se especifica primer episodio de BA en <12 meses)208. Los 2 ECA en niños hospitalizados.
Intervención: DNAsa recombinante nebulizada 2,5mg, bien cada 12h (hasta el alta)208 o cada 24h (5 días o hasta el alta)209.
Comparación: con placebo.
Medidas principales: tiempo de hospitalización y cambios en puntuación clínica, principalmente.
Tiempo: seguimiento durante el ingreso.
Intensidad del efecto o fuerza de la asociación: La única diferencia significativa encontrada (mejoría evolución radiológica)209 es clínicamente irrelevante.
Consistencia entre estudios: es adecuada.
Precisión de las estimaciones: es correcta.
Estimación de sesgos: es bajo el riesgo de sesgos, si bien un estudio fue financiado por la industria farmacéutica208 (aunque se insiste en que el laboratorio no influyó en ningún apartado del estudio).
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse directa debido a la calidad de los ECA y adecuada definición de población e intervención.
Validez externa y aplicabilidad de la evidencia: la muestra de pacientes es representativa de nuestro medio (lactantes <24 meses ingresados por BA VRS+). En cuanto a la aplicabilidad de los resultados, los estudios presentados permiten considerar que no es útil la DNAsa recombinante nebulizada.
Balance riesgo-beneficio-coste: solo se constatan riesgos en un ECA208 y son escasos y de poca importancia. El balance entre riesgos (probables), beneficios (sin interés clínico) y costes (elevados) es desfavorable a la intervención.
Estimación del impacto de futuros estudios: es improbable que nuevos estudios cambien la evidencia actual, dado la calidad de los ECA y resultados negativos a la intervención. Solo cabe plantearse ECA en pacientes con BA más graves y/o con atelectasias.
InterferónLa producción de interferón (IFN) está disminuida durante la infección por VRS210, de ahí su potencial interés terapéutico.
Volumen de la evidencia: existen 2 ECA de baja calidad, publicados ambos en 1993211,212. También se detecta un ECA previo sobre IFNα2a vía intranasal para infección por VRS, pero en población voluntaria de 18 a 55 años, no en la infancia213.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 11 y 16 y GC entre 11 y 36 pacientes). Son pacientes <24 meses con BA VRS+hospitalizados con cierta gravedad.
Intervención: IFNα2a IM a 50.000UI/kg/día (3 días)212 o 70.000UI/kg/día (5 días)211.
Comparación: con placebo.
Medidas principales: cambios en puntuación clínica y tiempo de oxigenoterapia, principalmente. En un estudio se considera el tiempo hasta desaparición de VRS en 50% pacientes como medida secundaria212.
Tiempo: seguimiento durante el ingreso.
Intensidad del efecto o fuerza de la asociación: la única diferencia significativa encontrada (cambios de puntuación a partir del segundo día)212 es clínicamente irrelevante (y sin relación con una menor diseminación viral) como para considerar un fármaco intramuscular de estas características en el tratamiento de la BA.
Consistencia entre estudios: es suficiente entre los 2 ECA. Sin embargo, no hay más estudios publicados desde 1993.
Precisión de las estimaciones: es escasa, por el pequeño tamaño muestral de los estudios.
Estimación de sesgos: existe riesgo alto de sesgos derivados de la baja calidad y pequeño tamaño muestral.
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse indirecta debido a la calidad de los ECA, si bien existe adecuada definición de población e intervención.
Validez externa y aplicabilidad de la evidencia: la muestra de pacientes es representativa de nuestro medio (lactantes <24 meses ingresados por BA VRS+). En cuanto a la aplicabilidad de los resultados, los estudios presentados permiten considerar que no es útil el IFNα2a IM.
Balance riesgo-beneficio-coste: no se constatan efectos adversos en los 2 ECA. El balance entre riesgos (potenciales), beneficios (escasos y poco relevantes) y costes (elevados) es desfavorable a la intervención.
Estimación del impacto de futuros estudios: improbable.
FurosemidaVolumen de la evidencia: existen 2 ECA. El publicado por Van Beer et al en 1995 con calidad 3/5 (y 2 fases de intervención: en 28 pacientes con BA aguda y en 19 pacientes con sibilancias recurrentes)214 y el publicado por Bar et al en 2008 con calidad 5/5215.
Pacientes: el tamaño muestral de los estudios es pequeño (GI entre 10–16 y GC entre 10–18 pacientes). Son pacientes <18 meses con primer episodio de sibilancias en el contexto de un catarro de vías altas. Un estudio está realizado en niños hospitalizados215 y otro en urgencias214.
Intervención: furosemida nebulizada, bien 10mg en 10min (1 dosis)214 o 2mg/kg/8h (durante el ingreso)215.
Comparación: con placebo.
Medidas principales: variables, como puntuación clínica, tiempo de hospitalización, pruebas de función pulmonar, etc.
Tiempo: seguimiento durante el ingreso. Los cambios de puntuación clínica se consideran a los 30–60min.
Intensidad del efecto o fuerza de la asociación: ningún estudio encuentra diferencias significativas.
Consistencia entre estudios: es suficiente.
Precisión de las estimaciones: escasa, por el pequeño tamaño muestral de los estudios.
Estimación de sesgos: existe riesgo alto de sesgos por el pequeño tamaño muestral. El estudio de Bar et al215 es de alta calidad, pero con tamaño pequeño (calculado para demostrar una diferencia de 3 en el RDAI y puede ser pequeño para el resto de medidas).
Grado de relación con la pregunta clínica: la evidencia existente puede considerarse parcialmente directa, debido a la calidad de los ECA, con aceptable definición de población e intervención.
Validez externa y aplicabilidad de la evidencia: la muestra de pacientes es representativa de nuestro medio (lactantes <18 meses con primer episodio de sibilancias en el contexto de un catarro de vías altas). En cuanto a la aplicabilidad de los resultados, los estudios presentados permiten considerar que no es útil la furosemida nebulizada.
Balance riesgo-beneficio-coste: no se constatan efectos adversos en los 2 ECA, pero tampoco beneficios en su aplicación. No existen estudios de evaluación de costes.
Estimación del impacto de futuros estudios: debería considerar un ECA de las características del de Bar et al215, pero con mayor potencia estadística (ampliando tamaño muestral).
MontelukastUn reciente ECA multicéntrico de calidad215, realizado en lactantes <24 meses hospitalizados con primer episodio de BA moderada-grave confirma la ausencia de efecto clínico (e inmunológico) de montelukast (4mg/día granulado) durante el ingreso; incluso se aprecia una leve tendencia a una recuperación más lenta en el GI. Aunque es un estudio con pequeño tamaño muestral (23 casos en grupo de montelukast y 30 en grupo placebo) se ajusta al estimado que permitiría detectar un 30% de diferencia de la medida principal de efecto (días de hospitalización).
Vitamina ALa detección de concentraciones séricas anormalmente bajas de vitamina A en lactantes con BA por VRS y su correlación con la gravedad del proceso216–218 originaron diversos estudios sobre su suplementación terapéutica que, sin embargo, demostraron una ausencia total de beneficios219–221, e incluso una prolongación del tiempo de estancia media en los pacientes con infección por VRS221. Dado que los últimos estudios datan de 1996 es improbable que se continúe en esta línea de trabajo.
Hierbas médicas chinasEl único ECA disponible en este sentido es un estudio chino de 1993222 que obtiene que el tratamiento herbal Shuan Huang Lian mejora sintomáticamente a los pacientes con BA y disminuye su estancia media hospitalaria, basándose en las propiedades virostáticas e inductoras de IFN de estas sustancias223. Ahora bien, las diferencias estadísticamente significativas del estudio de Kong et al222 deben valorarse en base a las múltiples limitaciones del ECA (muestra pequeña y sin cálculo del tamaño muestral, criterios de inclusión y exclusión imprecisos, no se especifica método de aleatorización, no hay descripción de la variable principal de interés, simple ciego y no control de covariables) y a que el GC (antibióticos) es una práctica sin ningún fundamento con la práctica clínica habitual.
FinanciaciónFinanciado con una beca de la Fundación-Hospital Torrevieja (código de protocolo: BECA0001).
Conflicto de interesesTodos los autores implicados en la elaboración de este documento han realizado una declaración explícita de los conflictos de intereses por escrito. No constan conflictos de intereses que puedan influir en el contenido de este documento. No obstante, algunos autores (JFS, JMEB y SLLA) han declarado su participación en ponencias, congresos y proyectos patrocinados por distintas empresas de la industria farmacéutica relacionadas con el tema tratado (ALK-Abello, GSK y MSD fundamentalmente).
Jesús M, Andrés de Llano, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
María Aparicio Rodrigo, Centro de Salud Entrevías, Área 1 de Atención Primaria, SERMAS, Madrid
Ana Fe Bajo Delgado, Servicio de Pediatría, Hospital Virgen Concha Zamora.
Albert Balaguer, Servicio de Pediatría, Hospital General de Catalunya, Universitat Internacional de Catalunya, Barcelona.
Antonio Bonillo, Servicio de Pediatría, Hospital de Torrecárdenas, Almería.
José Cristóbal Buñuel Álvarez, Centro de Salud, ABS Girona-4, ICS, Gerona.
Andrés Canut Blasco, Sección Microbiología, Hospital Santiago Apóstol, Osakidetza-Servicio Vasco de Salud, Vitoria.
José María Eiros Bouza, Servicio de Microbiología, Hospital Clínico Universitario de Valladolid, Facultad de Medicina de Valladolid, Valladolid.
Jordi Fàbrega Sabaté, Servicio de Pediatría, Hospital Universitari Germans Trias i Pujol, Badalona.
José Elviro Fernández Alonso, Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
Mercedes Fernández Rodríguez, Centro de Salud EAP Potes, SERMAS, Madrid.
Santiago Lapeña López de Armentia, Servicio de Pediatría, Complejo Asistencial de León, León.
Javier López Ávila, Centro de Salud San Bernardo Oeste, Salamanca.
Cristina Molinos Norniella, Servicio de Pediatría, Hospital de Cabueñes, Gijón.
Gloria Orejón de Luna, Centro de Salud General Ricardos. Área 11 de Atención Primaria, SERMAS, Madrid.
Svetlana Todorcevic, Servicio de Pediatría, Hospital Materno Infantil de Gran Canaria, Las Palmas de Gran Canaria.
María García-Puente Sánchez, Hospital de Torrevieja, Alicante.
Beatriz Muñoz Martín, Complejo Asistencial de Zamora, Zamora.
Miembros de Grupo Revisor especificados en anexo 1 antes de la bibliografía.
AVALADO por la Asociación Española de Pediatría (AEP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), Sociedad Española de Urgencias Pediátricas (SEUP), Sociedad Española de Infectología Pediátrica (SEIP), Sociedad Española de Neumología Pediátrica (SENP), Sociedad Española de Inmunología Clínica y Alergia Pediátrica (SEICAP), Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), Sociedad Española de Neonatología (SEN) y Sociedad Española de Cardiología Pediátrica (SECPCC).