La electroencefalografía integrada por amplitud (aEEG) es una herramienta utilizada en la neuromonitorización del neonato crítico. En el paciente con asfixia perinatal, su interpretación es clave para identificar a los candidatos a hipotermia terapéutica, detectar crisis subclínicas y aportar información pronóstica. Nuestro objetivo fue analizar la concordancia en la interpretación del aEEG entre neonatólogos con distinto nivel de experiencia.
Material y métodosEstudio retrospectivo unicéntrico de los recién nacidos ≥ 35 semanas con asfixia perinatal incluidos consecutivamente durante un periodo de dos años y monitorizados con aEEG durante al menos 6 horas. El médico de guardia interpretó el aEEG respecto al trazado de base, los ciclos vigilia-sueño y las crisis. Los aEEG fueron revisados de forma ciega por dos neonatólogas con distinta experiencia. Se analizó la concordancia (coeficiente Kappa de Cohen, k) de los aEEG divididos en periodos de 0-3 horas y 3-6 horas de vida, entre ambas y la de su consenso con el médico de guardia.
ResultadosSe incluyeron 75 neonatos, 5 de ellos no se monitorizaron. Se analizaron 132 trazados con una concordancia muy buena entre las dos examinadoras en las tres características del aEEG. El k respecto al médico de guardia fue muy bueno para el trazado de base (k=0,93), moderado (k=0,52) para los ciclos vigilia-sueño y débil (k=0,32) para las crisis.
ConclusionesEste estudio apoya una mayor facilidad para interpretar adecuadamente el trazado de base frente a los ciclos vigilia-sueño o las crisis, mejorando cuando se recibe una formación dirigida en el aEEG.
Amplitude integrated electroencephalography (aEEG) is a widely tool used for neuromonitoring in the critical neonate. In the patient with perinatal asphyxia, its interpretation is key to identifying candidates for therapeutic hypothermia, detecting subclinical seizures and providing pronostic information. Our aim was to analyze the concordance in the interpretation of aEEG among neonatologists with different level of experience.
Material and methodsUnicenter retrospective study of newborns ≥35 weeks with perinatal asphyxia included consecutively over a two-year period and monitored with aEEG for at least 6h. The bedside neonatologist interpreted aEEG regarding background pattern, sleep-wake cycling, and seizures. The aEEG tracings were blindly reviewed by two neonatologists with different experience. The aEEG tracings were divided into periods of 0–3h and 3-6h of life, and the concordance (Cohen Kappa coefficient, k), between the two examiners and that of their consensus with the bedside neonatologist, was analyzed.
ResultsSeventy-five newborns were included, 5 of them were not aEEG-monitored. 132 tracings were analyzed with a very good concordance between the two examiners in the three characteristics of the aEEG. The k for the bedside neonatologist was very good for background pattern (k=0.93), moderate (k=0.52) for sleep-wake cycling, and weak (k=0.32) for seizures.
ConclusionsThis study supports that background pattern is easily interpreted compared to sleep-wake cycling or crisis, improving when targeted training on aEEG is received.
La electroencefalografía integrada por amplitud (aEEG) es una herramienta cada vez más extendida en las unidades de cuidados intensivos neonatales en la neuromonitorización del neonato crítico, complementaria al EEG convencional el cual a pesar de sus ventajas de multicanalidad presenta limitaciones para mantener la monitorización de forma prolongada y necesita de personal experimentado para su interpretación1–3.
En concreto en el paciente con asfixia perinatal, el aEEG ayuda en la identificación de los recién nacidos candidatos a hipotermia terapéutica, permite la detección de crisis subclínicas y aporta información pronóstica del desarrollo neurológico ulterior1,4,5.
Aunque se ha señalado que el aEEG es sencillo de interpretar, los estudios que analizan la concordancia entre examinadores en el análisis del aEEG son escasos, y existen limitaciones en su interpretación en manos no expertas, especialmente en el reconocimiento de las crisis6,7.
El objetivo de este estudio fue analizar la concordancia en la interpretación del aEEG entre el neonatólogo de guardia y 2 examinadores entrenados, en las 6 primeras h de vida de una cohorte prospectiva de recién nacidos con asfixia perinatal, respecto al trazado de base (TB), los ciclos vigilia-sueño (CVS) y las crisis.
Material y métodosEste estudio fue realizado dentro de un programa de atención integral al paciente con asfixia perinatal desarrollado en un hospital terciario universitario con unidad de referencia en el cuidado neurocrítico neonatal desde el año 2011. Durante el periodo de estudio la atención neonatal en esta unidad estuvo a cargo de 5 neonatólogos, uno de ellos con formación específica en el ámbito de la neurología neonatal. La curva de aprendizaje en la interpretación del aEEG del resto de los integrantes de la unidad neonatal fue la obtenida desde un año antes del estudio a partir de algunas sesiones de formación específicas de aEEG, y de la experiencia de los pacientes monitorizados y discutidos en sesiones conjuntas en la unidad.
Se incluyeron consecutivamente todos los RN ≥ 35 semanas nacidos en este hospital, entre el 1 de junio de 2011 y el 31 de mayo de 2013, con criterios de asfixia perinatal definida esta por la presencia de al menos uno de los siguientes criterios: 1) pH de cordón ≤ 7.00; 2) Apgar a los 5 min ≤ 5; 3) reanimación con intubación y/o masaje cardiaco o presión positiva después de los 5 min. Se excluyeron los nacidos extramuros y aquellos con estado moribundo al nacer.
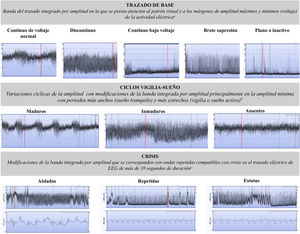
Los pacientes que cumplieron los criterios de inclusión ingresaron en la unidad y la monitorización con aEEG se inició al ingreso y se mantuvo las 6 primeras h de vida o hasta la normalización del trazado de base. La interpretación del aEEG la realizó el médico de guardia, en base a la clasificación integrada de voltaje y patrones propuesta por Hellström-Westas respecto a tres características: 1) el TB (continuo de voltaje normal [CVN], discontinuo de voltaje normal [DCN], brote supresión [BS], bajo voltaje [BV] y plano [P]); 2) los CVS (ausentes, inmaduros y maduros) y, 3) las crisis (ausentes, aisladas, repetidas y estatus)1,3 (fig. 1). La evaluación de las crisis se realizó visualizando, además del trazado integrado, la línea de EEG crudo que muestran los dos monitores utilizados en el estudio (Olympic CFM 6000 u Olympic Brainz Monitor). Los trazados se dividieron en dos tramos temporales para su clasificación: de 0 a 3 h y de 3 a 6 h de vida.
Clasificación del trazado de base, los ciclos vigilia-sueño y crisis del electroencefalograma integrado por amplitud1,5.
aContinuo de voltaje normal: banda estrecha de actividad continua con amplitud mínima por encima de 5μV máxima entre 10-50μV. Discontinuo: banda ancha de actividad discontinua con amplitud mínima variable pero <5μV y amplitud máxima >10μV. Brote-supresión: banda estrecha con amplitud entre 0-2μV sin variabilidad, y brotes con amplitud de >25μV. Bajo voltaje continuo: banda estrecha de voltaje bajo con amplitud del margen inferior <5μV y superior <10μV. Plano o inactivo: trazado isoeléctrico por debajo de 5μV.
b Ciclos vigilia-sueño maduros: variaciones sinusoidales claramente identificables con trazado entre discontinuo y continuo de al menos 20 minutos de duración; ciclos vigilia-sueño inmaduros: presencia incipiente de variaciones, pero no completamente desarrolladas con ensanchamientos y estrechamientos poco marcados; ausencia de ciclos vigilia-sueño: no variaciones cíclicas en el trazado.
c Crisis aisladas: máxima una a la hora; crisis repetidas: dos o más crisis a la hora; estatus: crisis repetidas continuas o una única, durante al menos 30 minutos de duración.
Al finalizar el reclutamiento, los aEEG fueron revisados de forma ciega por dos neonatólogas. Una de ellas (E.V.) era experta en el cuidado neurocrítico del neonato de otro hospital terciario con una experiencia de 6 años en la utilización del aEEG. La otra neonatóloga (C.B.) formaba parte del equipo neonatal de la unidad participante en el estudio, sin formación previa específica en el uso del aEEG, y recibió una formación específica de 4 h impartida por el neonatólogo con experiencia en aEEG de la unidad. Ambas clasificaron los trazados de la misma forma que hicieron los médicos de guardia. Si hubo discrepancias entre ambas, se adoptó una clasificación por consenso para ser utilizada en la comparación con el médico de guardia.
Análisis estadísticoLos datos descriptivos se muestran en porcentaje para las variables cualitativas, y como mediana y rango intercuartílico o media y desviación estándar en base a su distribución de normalidad para las variables cuantitativas. Se analizó la concordancia interobservador utilizando el coeficiente kappa de Cohen (k), entre ambos examinadores y el consenso de ambos con el médico de guardia, para cada una de las características del aEEG de forma desglosada y de forma agrupada (TB [CVN/DC =normal; BS/CBV/P =patológico], CVS [maduros/inmaduros =normal, ausentes =patológico], y crisis [ausentes =normal, aisladas/repetidas/estatus =patológico]). La fuerza de la concordancia se clasificó en pobre (k <0,20), débil (k=0,21-0,40); moderada (k=0,41-0,60); buena (k=0,61-0,80); y muy buena (k=0,81-1,00). El estudio fue aprobado por el comité de ética (N.° 1087).
ResultadosSe analizaron 132 trazados procedentes de 70 neonatos de los 75 RN incluidos; ya que en 5 niños (4 sin EHI y 1 con EHI leve) no hubo aEEG revisable. Las características de la cohorte se describen en la tabla 1.
Características de la población de estudio
| Variable | n | Resultado |
|---|---|---|
| Edad materna, mediana (IQR), años | 75 | 34 (33,35) |
| Hipertensión arterial y/o diabetes materna, n (%) | 75 | 10 (13) |
| Primiparidad, n(%) | 75 | 40 (33) |
| Edad gestacional, mediana (IQR), semanas | 75 | 40 (39,41) |
| Sexo masculino, n (%) | 75 | 33 (44) |
| Peso al nacimiento, media ±DE, gramos | 75 | 3119 ±581 |
| Presentación cefálica, n (%) | 75 | 70 (93) |
| Parto eutócico, n (%) | 75 | 22 (29) |
| Líquido meconial, n (%) | 74 | 10 (14) |
| Alteración RCTG, n (%) | 62 | 58 (94) |
| Anestesia general, n (%) | 75 | 3 (4) |
| Evento centinela, n (%) | 74 | 5 (7) |
| Reanimación avanzada, n (%) | 75 | 18 (24) |
| Apgar al minuto ≤ 5, n (%) | 75 | 30 (40) |
| Apgar a los 5min ≤ 5, n (%) | 75 | 15 (20) |
| pH de cordón, mediana (IQR) | 75 | 6,97 (6,91;6,99) |
| Déficit de bases <16mmol/L, n (%) | 75 | 34 (60) |
| Grado de EHI, n (%) | 75 | |
| No EHI | 56 (75) | |
| EHI leve | 12 (16) | |
| EHI moderada | 4 (5) | |
| EHI grave | 3 (4) |
DE: desviación estándar; EHI: encefalopatía hipóxico-isquémica perinatal; IQR: intervalo intercuartílico; n: número; RCTG: registro cardiotocográfico.
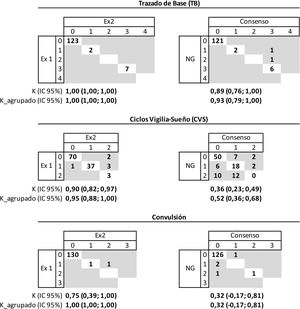
La concordancia entre las dos examinadoras fue muy buena para al TB (k=1) y para los CVS (k=0,95); en un caso las examinadoras discreparon en la presencia/ausencia de CVS maduros y, en otros 5 la discrepancia estuvo entre los CVS inmaduros que señalaba una examinadora y maduros o ausentes la otra. La concordancia fue muy buena en las crisis: solo en un caso discreparon entre crisis aislada o crisis repetidas. El acuerdo con el médico de guardia fue muy bueno (k=0,93) para el TB, moderado (k=0,52) para los CVS y débil (k=0,32) para las crisis. En 126 trazados el médico de guardia y las examinadoras estuvieron de acuerdo en no observar crisis, si bien en 3 trazados las examinadoras no apreciaron crisis al contrario de lo que opinó el médico de guardia, y al revés en otro trazado (fig. 2).
Concordancia entre los dos examinadores y su consenso con los neonatólogos de guardia respecto a las características del trazado de base, ciclos vigilia-sueño y convulsiones en el aEEG.
Trazado de base: 0 (continuo voltaje normal - CVN), 1 (discontinuo - DC), 2 (continuo de bajo voltaje - CBV), 3 (brote supresión - BS), 4 (plano o inactivo - P). Ciclos vigila sueño: 0 (ausentes), 1 (maduros), 2 (inmaduros). Convulsión: 0 (ausentes), 1 (aisladas), 2 (repetidas), 3 (estatus).
Ex1: examinador 1; Ex2: examinador 2; K: coeficiente kappa; K_agrupado: coeficiente kappa en base a la clasificación agrupada: trazado de base (CVN/DC =normal; BS/CBV/P =patológico), ciclos vigilia-sueño (maduros/inmaduros =normal, ausentes =patológico), y convulsión (ausentes =normal, aisladas/repetidas/estatus =patológico); NG: neonatólogo de guardia.
Los datos de este estudio apoyan la facilidad para clasificar correctamente el TB, pero alertan de la dificultad que existe en la interpretación de los CVS y especialmente de las crisis registradas en el aEEG.
Si bien la evolución temporal del TB en el paciente con EHI es la característica del aEEG mejor relacionada con el pronóstico, la interpretación de los CVS no es un aspecto despreciable ya que su ausencia más allá de las 72 h de vida se ha asociado con mala evolución en el neurodesarrollo4,5.
La disponibilidad del aEEG ha supuesto un punto de inflexión en el diagnóstico y manejo del tratamiento de las convulsiones, al permitir detectarlas precozmente, visualizar aquellas sin correlato clínico, que son la mayoría en el neonato, y ajustar mejor el tratamiento antiepiléptico2. Nuestro estudio concuerda con estudios previos al alertar sobre la baja concordancia para interpretarlas, y por lo tanto un área de potencial mejora6,7.
Se ha referido la necesidad y demanda de formación por parte del equipo asistencial de las unidades neonatales en las herramientas de neuromonitorización, y en concreto en la interpretación del aEEG8, y el hecho de que el segundo examinador mostrase una buena concordancia con el experto después de una formación breve, apoya que la implementación de cursos de formación estandarizados y la supervisión por profesionales con experiencia son aspectos clave para mejorar la interpretación del aEEG6,9. Así mismo, la utilización de guías o de atlas prácticos pueden ser una buena herramienta complementaria a esta formación1,10.
Por otro lado, a pesar de que se han ido extendiendo y mejorando en los últimos años los algoritmos utilizados para la detección automatizada de crisis, es necesario que enfermeras y médicos tengan experiencia en la interpretación de estos episodios para diferenciarlos de los artefactos tanto en el aEEG como en la línea cruda de EEG con los que se pueden confundir1,11,12. En estos casos, el registro simultáneo del EEG convencional multicanal en el mismo momento que el aEEG está detectando una potencial crisis podría ser de ayuda, pero desafortunadamente en la mayoría de los casos el episodio ya ha remitido cuando es posible realizar el EEG convencional.
Limitaciones de este estudio fueron ser unicentro, y el escaso número de aEEG patológicos. Esto vino definido por ser un estudio poblacional dirigido a los recién nacido con asfixia perinatal, donde la mayoría de estos no desarrollan encefalopatía hipóxico-isquémica. Posiblemente la discordancia encontrada habría sido mayor de haber existido más trazados patológicos, ya que son los más difíciles de interpretar, y además, los artefactos que pueden confundirse con crisis tienen lugar con mayor frecuencia en estos trazados hipovoltados. Por otro lado, estos resultados deben extrapolarse a unidades de características similares, ya que la existencia de algún profesional con formación específica en aEEG puede haber influido en unos resultados mejores de concordancia respecto a otros centros sin esta disponibilidad.
ConclusionesNuestro estudio establece que mediante una breve curva de aprendizaje los niveles de concordancia interobservador en personal con distinto nivel de experiencia son muy buenos para el trazado de base, siendo algo menores para la presencia de ciclos vigilia-sueño y crisis. Esto apoya la necesidad de mejorar la formación estandarizada en el aEEG para conseguir una óptima fiabilidad en su interpretación, especialmente en el reconocimiento de las crisis.
FinanciaciónEste estudio ha sido parcialmente financiado por la Gerencia Regional de Salud de Castilla y León (N.° de expediente GRS 827/A/13).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido parcialmente presentado en las siguientes reuniones: XXIV Congreso de Neonatología y Medicina Perinatal y IV Congreso de Enfermería Neonatal en Barcelona del 2 al 4 de octubre de 2013.