El objetivo del estudio fue evaluar la seguridad y la eficacia de la combinación de ledipasvir/sofosbuvir en la infección crónica por el genotipo 1 y 4 del virus de la hepatitis C (VHC) en pacientes pediátricos.
MétodosSe incluyó a pacientes de entre 6 y 18 años. La duración y la dosis de los fármacos antivirales se administraron según la edad del paciente, el estadio de fibrosis y los tratamientos previos con interferón pegilado y ribavirina. La variable principal de eficacia fue el porcentaje de pacientes con una respuesta virológica sostenida 12 semanas (RVS12) después del tratamiento.
ResultadosNueve pacientes con una mediana de edad de 14,8 años (8,48-17,91) fueron tratados con combinación de ledipasvir/sofosbuvir. Cinco pacientes habían recibido previamente tratamiento con interferón pegilado+ribavirina. Ocho pacientes tenían algún grado de fibrosis. La mediana de la carga viral previa al tratamiento fue de 6,2 log (5,9-6,8) con negativización del ARN del VHC 6 semanas después de comenzar el tratamiento en el 100% de los pacientes. Todos los pacientes mantuvieron una respuesta viral sostenida a las 12 semanas. Tres pacientes (33,3%) tuvieron algún tipo de efecto adverso (2 dolores de cabeza y un afta oral). La mediana de seguimiento posterior al tratamiento fue de 24 semanas (12-104).
ConclusionesEl tratamiento con ledipasvir/sofosbuvir en pacientes pediátricos con infección crónica por VHC de genotipo 1 y 4 es seguro y efectivo con RVS12, similar a lo reportado en adultos.
Hepatitis C virus infection is world health problem. The aim of this study was to assess the safety and efficacy of ledipasvir/sofosbuvir combination in chronic Hepatitis C Virus (HCV) genotype 1 and 4 infection in paediatric patients.
MethodsEligible patients to be treated with ledipasvir/sofosbuvir were patients from 6 to 18 years old with a chronic HCV genotype 1 or 4 infection. The duration and doses of antiviral drugs were changed depending on patient age, fibrosis stage, and PEGylated interferon+ribavirin experience status. The primary efficacy endpoint was the percentage of patients with a sustained virological response 12 weeks post-treatment.
ResultsA total of nine patients (7 males) with a median age of 14.8 years (8.48-17.91) were treated with ledipasvir/sofosbuvir combination. Five patients received previous treatment with PEGylated interferon+ribavirin during a median of 8.5 months (3-12 months). Eight patients had some degree of fibrosis (1 patient presented with F1, three patients F2, 2 patients F3, and 2 patients F4). The median pre-treatment viral load was 6.2 Log [5.9-6.8] with the HCV RNA becoming negative six weeks after starting the treatment in 100% of the patients. All patients maintained a sustained viral response at 12 weeks. Three patients (33.3%) had some type of adverse effect (2 headache and one oral thrush). The median post-treatment follow-up was 24 weeks (12-104).
ConclusionsTreatment with ledipasvir/sofosbuvir in paediatric patients with chronic HCV infection genotype 1 and 4 is safe and effective with SVR12 and similar to those reported in adults.
La infección por el virus de la hepatitis C (VHC) es un problema de salud mundial con hasta 170 millones de personas con infección crónica en todo el mundo y más de 350.000 muertes anuales por enfermedades hepáticas relacionadas con el VHC1,2. En Europa, la prevalencia estimada de la infección por el VHC en los niños es de entre el 0,2 y el 0,4%2. La transmisión de madre a hijo es la principal vía de adquisición del VHC en la infancia3,4. Entre el 4 y el 7% de los niños nacidos de madres monoinfectadas por el VHC adquieren la infección como resultado de la transmisión perinatal5. La tasa global de aclaramiento viral espontáneo en estos pacientes se encuentra entre el 24 y el 30%6. En aquellos pacientes en que se observa aclaramiento viral espontáneo, este suele presentarse antes de los 5 años de edad.
La infección crónica por VHC en niños es predominantemente asintomática o presenta síntomas leves e inespecíficos con alteraciones mínimas en las pruebas de función hepática7. Sin embargo, produce una inflamación hepática de bajo grado con fibrosis de progresión lenta, aunque se han descrito cirrosis y enfermedad hepática terminal7,8. Además, también hay descritos en la literatura pacientes con VHC crónica que han desarrollado carcinoma hepatocelular o que han requerido un trasplante de hígado durante la infancia9,10.
En adultos, el uso de antivirales de acción directa (DAA) ha cambiado el paradigma de la infección por VHC, convirtiéndola en una infección curable con regímenes de tratamiento por vía oral bien tolerados y altas tasas de respuesta viral sostenida (RVS), deteniendo la progresión de la enfermedad hepática en muchos casos11,12. Estas mejoras en el tratamiento de pacientes adultos se están comenzando lentamente a aplicar en los niños. Hasta ahora, los pacientes pediátricos han sido tratados principalmente durante 24 a 48 semanas con interferón pegilado+ribavirina (INF-Peg+RBV), un tratamiento que puede causar efectos secundarios graves13. Recientemente, han sido publicados datos sobre la combinación de ledipasvir/sofosbuvir (LPV/SOF) en niños infectados por VHC mayores de 6 años que muestran que LPV/SOF 45mg/200mg proporciona resultados comparables con los observados en adultos14. También se han publicado los resultados de seguridad y eficacia de la combinación de LPV/ SOF en adolescentes infectados por el VHC de genotipo 1 con una RVS global a las 12 semanas (RVS12) del 98%15. En pacientes mayores de 12 años con genotipo 2 o 3, la combinación de ribavirina y sofosbuvir ha demostrado ser también un tratamiento muy eficaz, con una tasa de RVS de hasta el 98% a las 12 o 24 semanas (según el genotipo)16. Por ello, en abril del 2017 la Agencia americana para el medicamento (FDA) aprobó el uso de las 2 combinaciones (sofosbuvir/ribavirina y LPV/SOF) en pacientes de más de 12 años de edad17,18.
El objetivo de nuestro estudio es reportar nuestra experiencia en la práctica clínica con la combinación LPV/SOF en pacientes pediátricos afectados por infección crónica por el genotipo 1 y 4 del VHC.
Pacientes y métodosSe trata de un estudio prospectivo, observacional, abierto y unicéntrico para evaluar la eficacia y la seguridad de la combinación LPV/SOF en pacientes pediátricos con infección crónica por el genotipo 1 o 4 del VHC. El estudio fue revisado y aprobado por el Comité de Ética de nuestro centro. El estudio se realizó siguiendo las directrices de la Declaración de Helsinki. En el momento en que iniciamos el tratamiento, la combinación LPV/SOF fue aprobada para su uso en población adulta pero no en niños. El consentimiento informado se obtuvo de cada paciente incluido en el estudio.
Criterios de inclusiónLos pacientes elegibles para ser tratados con LPV/SOF fueron pacientes de 6 a 18 años con infección crónica por el genotipo 1 o 4 del VHC, con una carga viral por encima de 10 E4 U/ml. Antes de comenzar el tratamiento, los pacientes elegibles debían presentar hemoglobina>11mg/dl y un recuento absoluto de neutrófilos> 1.500/mm3. Los pacientes se incluyeron independientemente de la presencia de fibrosis, pero se excluyó a los pacientes con cirrosis descompensada. La evaluación del estadio de fibrosis se realizó mediante pruebas elastográficas (FibroScan®, Echosens, París, Francia) y/o biopsia hepática cuando estaba disponible. Los pacientes se clasificaron en 2 grupos según si habían recibido tratamiento previo o no con INF-Peg+RBV.
Los pacientes coinfectados con virus de hepatitis B, virus de hepatitis A, virus de inmunodeficiencia humana o pacientes con historial psiquiátrico fueron excluidos. Los padres o tutores legales proporcionaron un consentimiento informado por escrito antes de iniciar los procedimientos relacionados con el estudio. Los pacientes mayores de 12 años dieron su consentimiento por escrito.
TratamientoAntes de iniciar el tratamiento, todos los pacientes fueron visitados por un hepatólogo pediátrico y un farmacólogo clínico para evaluar la posibilidad de interacciones medicamentosas. El tratamiento se inició siguiendo las directrices de tratamiento antiviral DAA de la Asociación Americana para el Estudio de Enfermedades Hepáticas (AASLD)19. Los pacientes de 12 a 18 años siguieron las siguientes recomendaciones: pacientes sin tratamiento previo infectados con el genotipo 1a, 1b o 4 del VHC con o sin cirrosis utilizaron una combinación diaria de dosis fija de ledipasvir (90mg)/sofosbuvir (400mg) durante 12 semanas; pacientes tratados previamente con INF-Peg+RBV infectados con genotipo 1a, 1b o 4 VHC sin cirrosis utilizaron una combinación de dosis fija diaria de ledipasvir (90mg)/sofosbuvir (400mg) durante 12 semanas, y pacientes tratados previamente con INF-Peg+RBV infectados con genotipo 1a, 1b o 4 VHC con cirrosis compensada utilizaron una combinación de dosis fija diaria de ledipasvir (90mg)/sofosbuvir (400mg) durante 24 semanas.
Los pacientes de 6 a 12 años siguieron las siguientes recomendaciones: pacientes sin tratamiento previo infectados con el genotipo 1a, 1b o 4 del VHC sin cirrosis utilizaron una combinación diaria de dosis fija de ledipasvir (45mg)/sofosbuvir (200mg) durante 12 semanas, y pacientes previamente tratados con INF-Peg+RBV infectados con genotipo 1a, 1b o 4 VHC con cirrosis compensada usaron una combinación de dosis fija diaria de ledipasvir (45mg)/sofosbuvir (200mg) durante 24 semanas.
Variable principalEl objetivo principal de eficacia fue una respuesta virológica sostenida, que se definió como un nivel de ARN del VHC por debajo del límite inferior de cuantificación, a las 12 semanas después del final del tratamiento.
Evaluación de eficaciaSe determinó la carga viral en suero para cada paciente en el cribado y en las semanas 2, 4, 6, 8 y 12. En pacientes tratados durante 24 semanas, se obtuvieron muestras de sangre adicionales para evaluar los niveles de ARN del VHC a las 16, 20 y 24 semanas. Después del final del tratamiento, se obtuvieron muestras de sangre a las 4, 8, 12 semanas y cada 12 semanas a partir de entonces. Los niveles de ARN del VHC en plasma se analizaron usando la prueba Roche Amp liprep/COBAS TaqMan HCV, v2.0 (Roche Molecular Systems, Inc., Branchburg, NJ, EE. UU.), que tiene un límite inferior de cuantificación de 15 U/ml.
Evaluaciones de seguridadDurante el tratamiento, se recogieron los datos de constantes vitales, examen físico completo, eventos adversos, ingesta concomitante de medicamentos y pruebas de laboratorio clínico en cada visita.
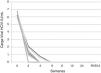
ResultadosDesde marzo del 2016 hasta julio del 2017, 9 pacientes (7 varones) fueron tratados con una combinación de LDV/SOF en nuestro centro con una edad media de 14,8 años (8,48-17,91). Las características demográficas se muestran en la tabla 1. El mecanismo de transmisión fue trasmisión vertical en 6 casos (66,6%). Un paciente adicional fue adoptado a los 3 años de edad. Aunque es muy probable que el contagio sea por transmisión vertical, no se disponía de informes médicos previos a la adopción. Un paciente con anemia de Fanconi recibió un trasplante de médula ósea de su padre infectado con el VHC (el único donante haploidéntico disponible). El paciente restante era un receptor de trasplante de riñón que se infectó durante una sesión de diálisis. Cinco pacientes con una mediana de edad de 8,2 años (3-15 años) habían recibido tratamiento con INF-Peg+RBV durante una mediana de 8,5 meses (3-12 meses). Dos de ellos no tuvieron respuesta al tratamiento, 2 mostraron una respuesta parcial y el quinto paciente presentó una recaída viral 3 meses después del final del tratamiento. Todos los pacientes presentaron efectos secundarios relacionados con el tratamiento INF-Peg+RBV (2 aplasia medular, 2 cefalea y fiebre y uno lesión en el sitio de punción). Los 9 pacientes del estudio tratados con la combinación LDV/SOF presentaban un polimorfismo genético de IL-28B distinto del CC, presentando un genotipo 1a (4 pacientes), genotipo 1b (4 pacientes) y genotipo 4 (un paciente). Al inicio del tratamiento, 8 de 9 pacientes tratados con LPV/SOF (88,8%) tenían algún grado de fibrosis (un paciente presentaba F1, 3 pacientes F2, 2 pacientes F3 y 2 pacientes F4, uno de ellos con nódulos de regeneración confirmados por biopsia). Todos los pacientes acudieron a las visitas programadas de seguimiento durante el estudio. La duración del tratamiento fue de 12 semanas en 7/9 pacientes y 24 semanas en 2 pacientes cirróticos tratados previamente con INF-Peg+RBV. La mediana de seguimiento posterior al tratamiento fue de 24 semanas (12-104) (fig. 1).
Características demográficas y virales
| P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | P9 | |
|---|---|---|---|---|---|---|---|---|---|
| Edad al inicio de tratamiento (años) | 14,85 | 17,34 | 8,48 | 9,11 | 12,31 | 17,91 | 12,08 | 15,48 | 17,31 |
| Sexo | Varón | Mujer | Varón | Varón | Varón | Varón | Mujer | Varón | Varón |
| Peso (kg) | 66,50 | 75,50 | 26,00 | 21,00 | 54,00 | 85,00 | 40,00 | 53,00 | 75,00 |
| Raza | Caucásica | Caucásica | Caucásica | Caucásica | Caucásica | Caucásica | Afroamericana | Caucásica | Caucásica |
| Genotipo | 1b | 1b | 1b | 4 | 1b | 1a | 1a | 1a | 1a |
| IL 28B | CT | CT | TT | CT | CT | TT | CT | CT | CT |
| HCV RNA (log 10 U/ml) pretratamiento | 6,20 | 6,23 | 6,01 | 6,20 | 6,80 | 6,10 | 5,91 | 6,50 | 6,62 |
| Negativización VHC (semanas) | 4 | 4 | 4 | 6 | 2 | 4 | 4 | 6 | 4 |
| Fibrosis | F0 | F1 | F2 | F4 | F2 | F3 | F3 | F4 | F2 |
| Método determinación fibrosis | Biopsia | Biopsia | Elastografía | Biopsia | Elastografía | Elastografía | Elastografía | Elastografía | Elastografía |
| INF-PEG+RVB previo | Sí | Sí | No | Sí | Sí | No | No | Sí | No |
| Enfermedades concomitantes | No | No | Cirugía Fontan | No | No | T. médula ósea (anemia Fanconi) | Trasplante riñón (lupus) | No | No |
| AST pretratamiento | 45,00 | 42,00 | 81,00 | 206,00 | 60,00 | 108,00 | 99,00 | 62,00 | 85,00 |
| ALT pretratamiento | 21,00 | 27,00 | 37,00 | 52,00 | 31,00 | 35,00 | 32,00 | 25,00 | 35,00 |
| Vía transmisión | Vertical | Vertical | Desconocida | Vertical | Vertical | Transfusión | Aguja contaminada | Vertical | Vertical |
Tratamiento con antivirales de acción directa. En la primera columna se especifica el número de paciente. Con asterisco (*), los pacientes tratados previamente con interferón-ribavirina. La segunda columna determina el grado de fibrosis pretratamiento según la escala Metavir. Tercera columna: dosis y duración de tratamiento. Las líneas especifican el seguimiento posterior a la finalización de tratamiento.
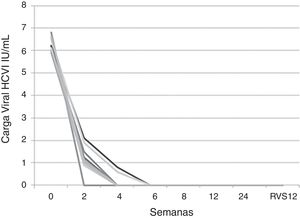
La mediana de la carga viral previa al tratamiento fue de 6,2 log (5,9-6,8) con negativización del ARN del VHC a las 4 semanas después de comenzar el tratamiento en el 77,7% (7/9) de los pacientes. Los 2 pacientes restantes mostraron carga viral negativa a las 6 semanas después del inicio del tratamiento (2/9, 22,2%). Todos los pacientes mantuvieron una RVS 12 semanas después del final del tratamiento, independientemente de su polimorfismo genético IL28B, el estado previo del tratamiento INF-Peg+RBV y el estadio de fibrosis previo al tratamiento (fig. 2).
SeguridadTres pacientes (33,3%) tuvieron algún tipo de efecto adverso. Dos pacientes tuvieron cefalea leve (22,2%) y un paciente tuvo aftas orales recurrentes (11,1%). Ningún paciente presentó alteraciones del hemograma o de la función renal durante el tratamiento. Ningún paciente presentó eventos adversos graves que requirieran la retirada del medicamento.
DiscusiónEl VHC es responsable de una gran carga de enfermedad en todo el mundo. Aunque la transmisión del VHC en los países desarrollados está casi restringida a la transmisión perinatal4, en otras partes del mundo la transmisión parenteral sigue siendo un problema con altas tasas de infección por el VHC20. Hasta hace pocos meses, el estándar de tratamiento para los niños con infección crónica por hepatitis C era usar 24-48 semanas de INF-Peg subcutáneo y RBV por vía oral13. Aunque este tratamiento podía ser efectivo en algunos casos, conllevaba una cantidad significativa de efectos secundarios21. Gracias a los avances para comprender la estructura molecular y el ciclo vital del VHC, se han podido desarrollar nuevos fármacos conocidos comúnmente como antivirales de acción directa3. Desde 2013, los regímenes de DAA han sido aprobados para su uso en adultos con infección crónica por el VHC con excelente eficacia (SVR12> 90%) y perfil de seguridad8. La introducción de estos DAA en el tratamiento de pacientes adultos ha cambiado por completo el paradigma de la infección crónica por VHC y la ha convertido en una infección de elevada tasa de curación con tratamiento oral sin efectos secundarios importantes11,12,22.
Desafortunadamente, los regímenes DAA para tratar a niños con infección crónica por VHC solo están disponibles en España como uso compasivo, estando ya aprobados para su uso en pediatría en otros países17,18.
Algunos problemas son evidentes en el campo del tratamiento del VHC en niños. En primer lugar, hay una escasez de estudios de farmacocinética, eficacia y seguridad en la población pediátrica. Además, a pesar de las pautas bien establecidas para el tratamiento del VHC en adultos, no hay consenso sobre qué pacientes con VHC deben tratarse y cuándo deben hacerlo. Además, el coste derivado de tratamiento con DAA, que es muy significativo incluso en los países desarrollados, no puede pasarse por alto. Sin embargo, tras los resultados de los últimos estudios en edad pediátrica15,16 que ponen de manifiesto su seguridad y efectividad en esta población, los tratamientos con DAA deberían convertirse en el tratamiento de elección en la población pediátrica en el futuro cercano en España. Teniendo en cuenta los excelentes resultados obtenidos con DAA en pacientes adultos y los resultados de estudios preliminares realizados en pacientes pediátricos, es muy difícil justificar el uso continuado de INF-Peg+RVB en niños.
En nuestro estudio, 9 pacientes pediátricos con infección crónica por VHC genotipo 1 y 4 fueron tratados con LPV/SOF durante 12 o 24 semanas, dependiendo de su estado INF-Peg+RBV y su estadio de fibrosis. La tasa general de RVS a las 12 semanas fue del 100%. Esta elevada eficacia del tratamiento también fue seguida por una negativización muy rápida de la carga viral del VHC con un ARN del VHC indetectable en la semana 4 en el 77% de los pacientes y en la semana 6 en el 100% de los pacientes. Algunos autores han indicado que en pacientes sin tratamiento previo con fibrosis leve y carga viral baja (< 6 millones de U /ml) los regímenes LPV/SVOF de 8 semanas pueden mostrar RVS similar a los regímenes de 12 semanas23. Parece interesante resaltar que en nuestra serie pacientes con cirrosis compensada y experiencia de tratamiento INF-Peg+RBV son los pacientes que negativizaron la carga viral más tarde (en la semana 6), apoyando la idea de que los tratamientos más cortos podrían estudiarse en el futuro para pacientes seleccionados.
El estudio presenta principalmente 2 limitaciones: 1) serie pequeña: a pesar del hecho de que el número de pacientes en nuestro estudio es pequeño, es razonable suponer que los regímenes DAA pueden ser al menos tan efectivos en niños como en la población adulta; y 2) corto periodo de seguimiento: sería importante valorar la evolución de los pacientes con mayores grados de fibrosis con periodos de seguimiento más largos tras el aclaramiento viral. Igual que los resultados publicados en adultos, no se observaron diferencias en términos de eficacia o efectos secundarios según el genotipo (1 o 4), el polimorfismo IL28B o el estado de tratamiento INF-Peg+RBV. A pesar de que en el estudio se han recogido los polimorfismos genéticos de IL28B, no se ha descrito en la literatura ninguna relación entre dichos polimorfismos con la respuesta terapéutica a los DAA, a diferencia de lo que sucedía con IFN-RBV. Por este motivo, los autores no consideran necesario solicitar el polimorfismo de IL28B a un paciente pediátrico antes de iniciar tratamiento con DAA.
Además, es importante destacar que presentamos un estudio de práctica clínica, en el que se incluyó a un paciente trasplantado de riñón, un paciente trasplantado de médula ósea y un paciente sometido a cirugía cardíaca. Se realizó una estrecha vigilancia, especialmente en los niveles de tacrolimús en el paciente de trasplante de riñón. Se ha publicado previamente que era seguro y eficaz utilizar la combinación LDP/SOF en la enfermedad renal en etapa terminal o en pacientes con trasplante renal con infección por HCV24. En nuestro paciente, no se observaron alteraciones en los niveles de tacrolimús o disfunción renal durante el tratamiento, presentando una negativización de la carga viral en la semana 4.
En términos de eventos adversos, todos fueron leves y muy similares a los informados en los estudios de adultos12. Ningún niño suspendió el estudio debido a los efectos secundarios y ninguno tuvo un evento adverso grave o potencialmente mortal relacionado con el medicamento estudiado.
Para concluir, el tratamiento con LPV/SOF en pacientes pediátricos con infección crónica por el VHC, genotipos 1 y 4, es seguro y efectivo con RVS12, dato similar al obtenido en estudios de pacientes adultos. La dosis utilizada en adultos parece ser efectiva y bien tolerada en adolescentes. Sin embargo, se necesitan más estudios que recluten un mayor número de pacientes para extender el uso de los regímenes DAA a la población pediátrica por un beneficio de coste efectividad en curar la infección y sus complicaciones de forma precoz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación del trabajo previa: Comunicación oral en el XXIV Congreso de la SEGHNP, 25-27 de mayo del 2017, San Sebastián.