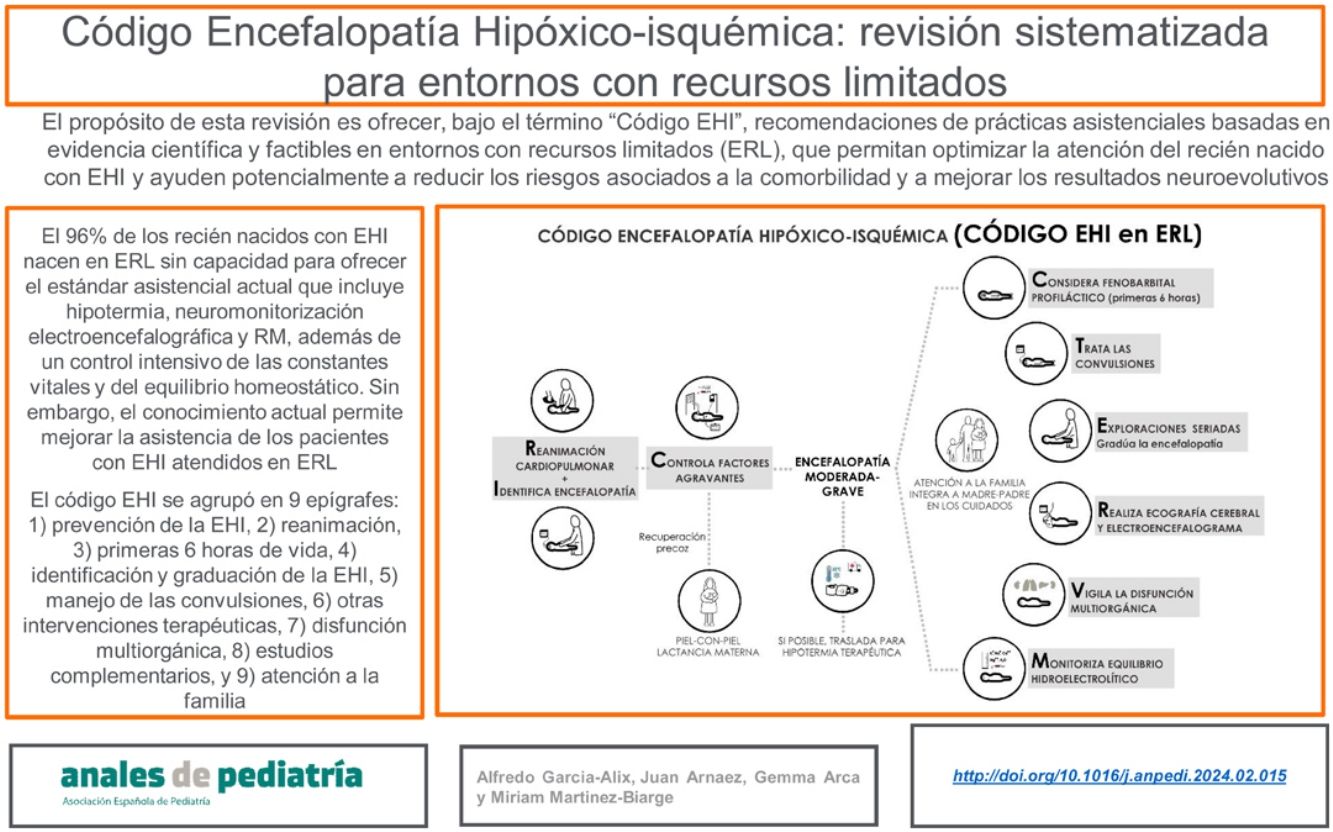
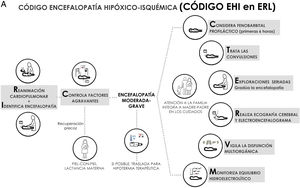
Se estima que el 96% de los recién nacidos (RN) con encefalopatía hipóxico-isquémica (EHI) nacen en entornos con recursos limitados (ERL) sin capacidad para ofrecer el estándar asistencial vigente desde hace cerca de 15 años en los países con altos recursos y que incluye hipotermia terapéutica, neuromonitorización continua electroencefalográfica y resonancia magnética, además de un control intensivo de las constantes vitales y del equilibrio homeostático. Esta situación no parece estar cambiando; sin embargo y aún con estas limitaciones, el conocimiento actualmente disponible permite mejorar la asistencia de los pacientes con EHI atendidos en ERL. El propósito de esta revisión sistematizada es ofrecer, bajo el término «código EHI», recomendaciones de prácticas asistenciales basadas en evidencia científica y factibles en ERL, que permitan optimizar la atención del RN con EHI y ayuden potencialmente a reducir los riesgos asociados a la comorbilidad y a mejorar los resultados neuroevolutivos. El contenido del código EHI se agrupó en nueve epígrafes: 1) prevención de la EHI, 2) reanimación, 3) primeras seis horas de vida, 4) identificación y graduación de la EHI, 5) manejo de las convulsiones, 6) otras intervenciones terapéuticas, 7) disfunción multiorgánica, 8) estudios complementarios, y 9) atención a la familia.
It is estimated that 96% of infants with hypoxic-ischaemic encephalopathy (HIE) are born in resource-limited settings with no capacity to provide the standard of care that has been established for nearly 15 years in high-resource countries, which includes therapeutic hypothermia, continuous electroencephalographic monitoring and magnetic resonance imaging in addition to close vital signs and haemodynamic monitoring. This situation does not seem to be changing; however, even with these limitations, currently available knowledge can help improve the care of HIE patients in resource-limited settings. The purpose of this systematic review was to provide, under the term «HIE Code», evidence-based recommendations for feasible care practices to optimise the care of infants with HIE and potentially help reduce the risks associated with comorbidity and improve neurodevelopmental outcomes. The content of the HIE code was grouped under 9 headings: 1) prevention of HIE, 2) resuscitation, 3) first 6hours post birth, 4) identification and grading of encephalopathy, 5) seizure management, 6) other therapeutic interventions, 7) multiple organ dysfunction, 8) diagnostic tests and 9) family care.
La encefalopatía hipóxico-isquémica (EHI) es la principal causa de daño cerebral adquirido y discapacidad en el recién nacido (RN) a término o casi término. Conlleva una enorme carga para la salud en términos de «años de vida perdidos» y «años vividos con discapacidad», además de un alto impacto emocional y económico en las familias y la sociedad1.
Se ha estimado que, en el año 2010, 1,15 millones de neonatos en el mundo (8,5‰ RN vivos) presentaron EHI, aconteciendo el 96% en países de renta media o baja (pRMB)2. Mientras que en países con rentas altas (pRA) la incidencia es inferior a 2‰ RN vivos, en los pRMB se calcula > 8‰.
El abordaje integral estándar del RN con EHI en los pRA incluye: hipotermia terapéutica (HT), neuromonitorización continua electroencefalográfica y realización de resonancia magnética (RM)3,4. Sin embargo, más de 15 años después de la implementación de este estándar asistencial, la realidad en los pRMB es muy diferente. Además, mientras que algunos ensayos clínicos y revisiones sistemáticas han observado un efecto neuroprotector de la HT utilizando equipos de bajo coste en pRMB5,6, otros no han encontrado una reducción de la mortalidad7,8, pudiendo ser perjudicial cuando se aplica en estos países9.
Diversas razones pueden estar tras la aparente falta de efecto consistente de la HT en pRMB, entre otras, carencias en: una cobertura sanitaria universal, la atención prenatal y al parto complicado, la calidad de los cuidados intensivos neonatales con escasez de personal médico o de enfermería, una alta proporción de nacidos sin posibilidad de transporte seguro a un hospital con recursos y deficiencias en la formación y experiencia de los profesionales, así como la ineficacia de los dispositivos de enfriamiento de baja tecnología. Además, es posible que algunas características poblacionales, como las tasas de infección y de retraso del crecimiento intrauterino, también desempeñen un papel2,7.
La brecha en la atención de los pacientes con EHI se ha ido acentuando entre regiones del mundo, dependiendo de la renta y también entre áreas en un mismo país, según los recursos disponibles. Esta situación está conduciendo al desaliento de muchos profesionales que trabajan en entornos con recursos limitados (ERL), quienes perciben que poco puede hacerse en esta entidad que para ellos sigue «huérfana de terapia». Sin embargo, se está infravalorando que, aún con las limitaciones de no disponer de HT ni de neuromonitorización, el conocimiento que existe permite mejorar la asistencia de los pacientes con EHI atendidos en ERL.
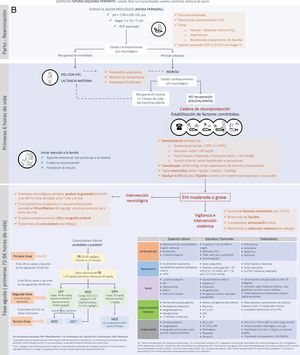
Nosotros preferimos hablar de ERL más que de pRMB, pues es bien conocido que puede existir una marcada heterogeneidad de recursos según el centro hospitalario6. El propósito de esta publicación es ofrecer recomendaciones de prácticas asistenciales, bajo el término «código EHI», que eviten aumentar el daño neurológico y ayuden potencialmente a mejorar los resultados neuroevolutivos en el RN con EHI atendido en ERL, sin disponibilidad de HT, neuromonitorización o RM, pero con Unidades de Cuidados Intensivos Neonatales (UCIN) (fig. 1). Hablamos de código EHI debido a que la EHI es una patología «tiempo-dependiente» en la que el retraso diagnóstico o terapéutico influyen negativamente en su evolución y pronóstico, y en la que «activar un código» requiere sistemas de coordinación entre niveles asistenciales de diferente complejidad, así como la consolidación de procedimientos consensuados entre todos los profesionales sanitarios implicados en el proceso asistencial.
Material y métodosSe realizó una revisión sistematizada de la literatura en español, francés o inglés (PubMed y EMBASE) con los siguientes términos Medical Subject Headings (MESH) hasta el 31 de octubre de 2023: («Hypoxic-Ischemic Encephalopathy» OR «Neonatal Encephalopathy» OR «seizures» OR «Brain Magnetic Resonance Imaging» OR «Brain Ultrasound» OR «Electroencephalography») AND («Pediatrics» OR «Infant, Newborn» AND «low- and -middle income countries» OR «resource-limited»). La identificación y selección de los estudios se efectuó por dos de los investigadores (AGA y JA). La naturaleza de los estudios y la ausencia de ensayo clínico aleatorizado (ECA) no posibilitaron hacer un metaanálisis, por lo que se realizó un análisis descriptivo de los datos contextuales seguido de un proceso de discusión entre los autores. Si, por el contrario, existía algún ECA o revisión sistemática (metaanálisis) se formularon recomendaciones acordes al nivel de evidencia.
El contenido del código EHI se agrupó en nueve epígrafes: 1) prevención de la EHI, 2) reanimación, 3) primeras seis horas de vida, 4) identificación y graduación de la encefalopatía, 5) convulsiones, 6) intervenciones terapéuticas, 7) disfunción multiorgánica, 8) estudios complementarios y 9) atención a la familia.
Definiciones operativasAsfixia perinatal: cualquier RN con alteración del registro cardiotocográfico, parto distócico o evento centinela que al nacimiento requiere reanimación cardiopulmonar (RCP) avanzada y/o presenta una prueba de Apgar ≤ 5 a los cinco minutos y/o pH cordón ≤ 7,00 o un déficit de bases> 16 mmol/L.
EHI perinatal: disfunción neurológica (encefalopatía) presente desde las primeras horas siguientes al parto, atribuible a una agresión hipóxico-isquémica alrededor del parto con base en los antecedentes de asfixia perinatal.
ResultadosPrevención de la encefalopatía hipóxico-isquémicaAunque hay factores anteparto que pueden predisponer o contribuir a episodios adversos intraparto, su presencia por sí solos no basta para causar EHI, considerándose el periodo intraparto como el momento de mayor riesgo y el principal origen de la EHI10. La atención obstétrica tiene como objetivo identificar y rescatar al feto en riesgo de agresión hipóxico-isquémica mediante el reconocimiento de signos sugestivos de hipoxia fetal. Las altas tasas de EHI en pRMB seguramente están condicionadas por los factores sociales que impactan en la salud materna y por las circunstancias y lugar del parto. Un mejor cuidado prenatal a cargo de matronas comunitarias entrenadas, junto con el fortalecimiento de los sistemas hospitalarios y extra-hospitalarios de atención al parto, podrían reducir las tasas de mortalidad perinatal y la incidencia de EHI11.
Reanimación cardiopulmonarEl objetivo de la reanimación del RN con asfixia perinatal es restablecer lo antes posible la oxigenación tisular y el flujo sanguíneo cerebral (FSC) y, además, evitar situaciones o acciones sobre el cerebro y otros órganos que puedan agravar la agresión hipóxico-isquémica. En los pRMB se estima que el 15% de los RN requieren reanimación básica (estimulación, posicionamiento cefálico, desobstrucción de la vía aérea y ventilación con bolsa y mascarilla con aire ambiente), la cual reduce la mortalidad intraparto un 40%, la mortalidad neonatal relacionada con el parto un 30% y la mortalidad neonatal precoz un 38%12.
La competencia en la reanimación neonatal a través de programas de formación es crucial para garantizar la seguridad y efectividad de esta intervención y reducir la morbimortalidad, especialmente elevada en ERL, secundaria a la asfixia perinatal12.
El International Liaison Committee on Resuscitation (ILCOR) publica periódicamente directrices de consenso que constituyen la base de las tres principales guías de acción y programas educativos en reanimación neonatal utilizados en el mundo: el Programa de Reanimación Neonatal (PRN), el Soporte Vital Neonatal (SVN) y el Helping Babies Breathe (HBB) diseñado específicamente para ERL. En la tabla 1 se resumen los aspectos esenciales de las recomendaciones actuales y referimos al documento del ILCOR (2020)13, las Guías del Consejo Europeo de Resucitación (2021)14, o de la Academia Americana de Pediatría (2023)15, y en lengua española al posicionamiento específico del Grupo de Reanimación Neonatal de la Sociedad Española de Neonatología (GRN-SENeo)16, y para la reanimación básica en ERL a la 2.ª edición del HBB (2016).
Recomendaciones para la reanimación cardiopulmonar neonatal (estas recomendaciones no sustituyen a las guías locales de RCP neonatal que tienen en cuenta los recursos disponibles en cada momento)13–16
| 1. Al menos un profesional sanitario (personal médico, de enfermería o matrona) con competencia en la reanimación neonatal debe estar presente en cada parto. |
| 2. La Tª del lugar de la RCP no debe superar los 23°C para evitar la hipertermia materna y neonatal. |
| 3. El programa HBB, está diseñado específicamente para ERL sin monitorización transcutánea de la SatO2, ni equipos avanzados de termorregulación, ni gases humidificados y calientes. Este programa permite capacitar profesionales con distintos niveles de formación, desde médicos a matronas y parteras comunitarias. |
| 4. Iniciar la RCP con aire ambiente (FiO2 0,21) caliente y humidificado y considerar la administración de oxígeno en concentraciones crecientes según la pulsioximetría (mano derecha); la respuesta clínica (color de la piel y mucosas) está sujeta a importantes sesgos y solo debe ser utilizada en ausencia de pulsioximetría. |
| 5. Evitar la hipo e hiperoxia. Las recomendaciones actuales siguen las gráficas de Dawson (2010); la SatO2 del RN sano se incrementa progresivamente después del nacimiento: 60-65% al minuto, 65-70% a los 2min, 70-75% a los 3min, 75-80% a los 4min, 80-85% a los 5min y 85-95% a los 10min manteniendo FC> 100 lpm. Estudios realizados con pinzamiento tardío de cordón parecen indicar que la saturación de O2 se incrementa más rápidamente. |
| 6. La relación compresiones/ventilación es 3:1, se debe utilizar O2 al 100%, y reducir paulatinamente la concentración en cuanto se recupera la FC. Esta se debe evaluar con ECG y si no es posible, utilizar auscultación y pulsioximetría. |
| 7. Ante un RN arreactivo nacido con líquido meconial, es preferible iniciar las maniobras de RCP sin explorar la vía aérea con el laringoscopio y sin aspirar las secreciones traqueales. Muy raramente, será necesaria la intubación y succión intratraqueal para eliminar la posible obstrucción. |
| 8. Si el RN no recupera la FC por encima de 60 lpm con ventilación y masaje, administrar adrenalina a dosis 0,01-0,03 mg/kg por vía intravascular (vena umbilical); repetir la dosis cada 3-5 minutos si es necesario. Utilizar la dosis de 0,05-1,00 mg/kg vía intratraqueal, hasta que el acceso intravascular esté disponible. |
| 9. Evitar expansores de volumen (cristaloides o concentrado de hematíes), excepto en situaciones evidentes de hipovolemia que no responden a la RCP. |
| 10. Evitar la utilización de bicarbonato salvo en situaciones de RCP prolongada sin respuesta. |
| 11. Si bien en el RN a término o casi a término se recomienda el pinzamiento tardío de cordón (≥ 30 s), si se requieren maniobras de RCP no demorar el inicio de estas por el pinzamiento tardíoa. |
| 12. Si se tiene la posibilidad de trasladar al paciente a un centro con HT, estaría indicado apagar el calor de la cuna de reanimación una vez recuperada la FC, vigilando estrechamente la Ta central (rectal) o en su defecto la axilar cada 15 minutos evitando Ta <33°C o> 36,5°C. |
| 13. Se debe considerar la interrupción de las maniobras de RCP a partir de los 10min, especialmente después de los 20min de RCP. |
ECG: electrocardiograma; ERL: entornos con recursos limitados; FC: frecuencia cardiaca; FiO2: fracción inspirada de oxígeno; HBB: Helping Babies Breathe; HT: hipotermia terapéutica; O2: oxígeno; min: minuto; RCP: reanimación cardiopulmonar; RN: recién nacido; SatO2: saturación de oxígeno; s: segundos; Ta: temperatura.
Un ECA que comparó el pinzamiento tardío del cordón umbilical frente al ordeño del cordón en RN (35 a 42 semanas de gestación) no vigorosos al nacer (tono reducido, color pálido o falta de respiración en los primeros 15 segundos después del nacimiento) observó que el ordeño del cordón asoció una hemoglobina más alta, menos probabilidad de Apgar anormal al minuto, menor necesidad de apoyo cardiorrespiratorio en el parto, así como una menor frecuencia de EHI moderada o grave y de necesidad de HT. Estos datos deben ser contrastados en otros estudios antes de incorporar esta intervención.
El control de los factores comórbidos que pueden agravar las lesiones cerebrales hipóxico-isquémicas es un pilar en la atención al RN con EHI y adquiere gran relevancia en ERL. Las recomendaciones que se describen en este apartado están dirigidas al periodo inmediato después del parto en un RN con asfixia perinatal, pero son extensibles a los primeros días de vida en el RN con EHI. En esta vigilancia serán fundamentales el control de la temperatura y de la glucemia (Tabla S1), así como de otros aspectos que se recogen en la tabla 2.
Recomendaciones para el control de factores comórbidos en el recién nacido con asfixia/EHI durante las primeras seis horas de vida
| A. La temperatura |
| 1. Tratar la hipertermia materna con antipiréticos o medidas físicas y considerar la presencia de infección obstétrica, particularmente en entornos sin anestesia epidural. |
| 2. En las siguientes seis horas al nacimiento de un RN con asfixia perinatal, registrar cada 30 minutos la Ta mientras se considera la presencia o no de EHI. |
| 3. Idealmente, monitorizar con sensor continuo o bien de forma intermitente la Ta central (catéter introducido 5cm rectal), o si no es posible la Ta periférica, durante las primeras 72 hdv y especialmente en las primeras 24 hdv. |
| 4. En caso de hipertermia (Ta central> 37°C) al ingreso, apagar fuentes externas de calor y si es necesario, aplicar medidas físicas de reducción de la Ta. |
| 5. En caso de hipotermia (Ta central <36°C) espontánea al ingreso, evitar el sobre-enfriamiento (Ta central <33°C), y dejar que esta vuelva progresiva y lentamente (< 0,5°C a la hora) a la normotermia, sin calentar activamente al RN. |
| B. La glucemia |
| 1. En el RN con asfixia que recupera la normalidad neurológica, la cardiorrespiratoria y la lactoacidosis, es necesario controlar la glucemia en las primeras 6 hdv para evitar la hipoglucemia (< 46 mg/dL) e iniciar la lactancia materna. |
| 2. En el RN con EHI, se debe controlar la glucemia durante las primeras 72 hdv, prestando particular atención a las primeras 24 horas:• Evitar la hipoglucemia. Iniciar una infusión intravenosa de glucosa a 6-8 mg/kg/minuto y mantenerla durante las primeras horas.• Si persiste la hipoglucemia a pesar de la infusión intravenosa, incrementar aportes en 2 mg/kg/minuto. Control de glucemia cada 30-60 minutos hasta alcanzar valores alrededor de 50 mg/dL con control posterior cada 4-6 horas.• Si ocurre hiperglucemia (> 150 mg/dL), disminuir los aportes administrados por infusión intravenosa. Evitar la administración de insulina salvo que haya valores elevados persistentes que no responden al descenso de los aportes. |
| C. Otros factores |
| 1. Evitar la hipocarbia grave (pCO2 <20 mmHg) y la moderada sostenida (pCO2 20-25 mmHg). |
| 2. Evitar la hipo e hiperoxia (evitar SatO2 <92% o> 98%). |
| 3. Evitar la hipotensión (TAM <40 mmHg) y los cambios bruscos en la TA. Existe una estrecha relación entre la hemodinámica sistémica y la cerebral, y una pérdida de autorregulación del FSC en el RN con EHI. |
| 4. Evitar las expansiones de volumen y el bicarbonato. |
| 5. Normalizar las alteraciones electrolíticas. |
EHI: encefalopatía hipóxico-isquémica; FSC: flujo sanguíneo cerebral; hdv: horas de vida; pCO2: presión parcial de dióxido de carbono; RN: recién nacido; SatO2: saturación de oxígeno; Ta: temperatura; TA: tensión arterial; TAM: tensión arterial media.
La identificación y graduación de la gravedad clínica de la EHI es una acción capital en la atención del RN con asfixia perinatal (Tabla 3 y S2).
Identificación y graduación de la gravedad de la encefalopatía
| A. Valor de identificar y graduar la gravedad de la encefalopatía |
| 1. Identificar a los pacientes candidatos a ser trasladados a un centro con HT. |
| 2. Anticipar la potencial gravedad de la disfunción multiorgánica que pueden presentar en las horas y días siguientes. |
| 3. Establecer la profundidad y duración de la monitorización y vigilancia. |
| 4. Establecer una adecuada aproximación al pronóstico. |
| 5. Anticipar la probabilidad de daño en los estudios de neuroimagen. |
| 6. Establecer grupos de riesgo neuroevolutivo y optimizar los recursos en el seguimiento. |
| B. Recomendaciones |
| 1. Realizar exámenes neurológicos y graduar la gravedad de la EHI en las primeras 6 horas, a las 48 h, entre las 72-96 h, a los 7 días y antes del alta utilizando una de las escalas específicas disponibles. |
| 2. Existen escalas puntuadas que reflejan mejor el espectro completo de la gravedad de la EHI, como la de Thompson, NICHD, SIBEN y la de García-Alix. Esta última incorpora definiciones estandarizadas de cómo realizar y puntuar las maniobras (Tabla S2) |
| 3. Entrenamiento en la valoración de la gravedad de la encefalopatía con los recursos disponibles:3.1 Plastificar la escala, la cual ha de contener definiciones operativas claras, y situarla cerca del RN con el fin de hacerla fácilmente accesible.3.2 Filmar al paciente (con consentimiento de los padres) y discutir las observaciones intragrupo y con un compañero entrenado.3.3 Elaborar material educativo del examen neurológico a realizar, así como ejemplos clínicos de la presencia y gravedad de la EHI. Realizar cursos de actualización y entrenamiento periódicos.3.4 Disponer de un especialista entrenado en neurología neonatal. |
EHI: encefalopatía hipóxico-isquémica; HT: hipotermia terapéutica; NICHD: National Institute of Child Health and Human Development; RN: recién nacido; SIBEN: Sociedad Iberoamericana de Neonatología.
La gravedad de la EHI en las primeras seis horas posnatales es el sine qua non para incluir estos pacientes en programas de HT. En la era pre-HT, la discapacidad asociada a la EHI leve era muy baja, intermedia en la moderada y muy elevada en la EHI grave (prácticamente todos fallecían en el periodo neonatal o presentaban discapacidad grave a los 18-24 meses)17–19. Resultados similares han sido apreciados en los ECA que testaron la eficacia de la HT20–22. Mientras que la graduación de la gravedad de la EHI en las primeras seis horas tiene una capacidad moderada para predecir los resultados a largo plazo (Tabla S3), la evaluación de la gravedad a las 48-96 horas y a los siete días ofrece una mejor aproximación al pronóstico19,23–25, lo que refleja el carácter dinámico (mejoría o empeoramiento) de la EHI18,19,23,24. Cuando la encefalopatía no mejora en las primeras 72 horas, la probabilidad de muerte o discapacidad es mucho más alta que cuando lo hace en las primeras 24horas posnatales. En ERL, la graduación de la gravedad clínica de la EHI y su perfil temporal, bien con escalas categóricas o con escalas puntuadas19,26, puede ser la aproximación más eficiente para establecer grupos de riesgo neuroevolutivo. Si el entrenamiento es insuficiente, es conveniente solicitar el apoyo por expertos locales o por telemedicina27.
ConvulsionesLa EHI es la causa más importante de convulsiones neonatales (CN) independientemente de la renta y recursos del país28. En los pRA, un 50-85% de RN con EHI moderada y grave presentan convulsiones clínicas, independientemente de si reciben o no HT22,23,29, mientras que en los ERL lo hace cerca del 80% de los pacientes con EHI moderada y más del 80% de aquellos con EHI grave5,9.
El inicio de las convulsiones en la EHI suele ocurrir después de las seis horas de vida, comenzando entre las seis y las 24 horas en la mitad de los pacientes y no es infrecuente que aparezcan después de las 12 horas29–31. Estos datos señalan que cuando se observan fenómenos sospechosos de convulsiones antes de las seis horas ha de considerarse que el fenómeno no responda a verdaderas convulsiones o bien traduzca una agresión hipóxico-isquémica prenatal u otra etiología.
El reconocimiento exclusivamente clínico (sin electroencefalograma integrado por amplitud [EEG]) de las CN en la EHI subestima la verdadera carga epiléptica (número y duración acumulada de las convulsiones durante un periodo definido) ya que la mayoría de las CN son subclínicas y hasta un 23% presentan un estado epiléptico electrográfico durante los primeros días29,31. Por otra parte, incluso los clínicos expertos tienen dificultades para distinguir mediante la observación entre convulsiones y fenómenos motores no epilépticos, y por tanto, existe un riesgo de sobrediagnóstico de las CN. En consecuencia, la Liga Internacional contra la Epilepsia (ILAE) ha subrayado la importancia del EEG para la identificación certera de las CN32.
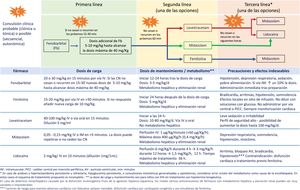
La carga epiléptica en el RN con EHI moderada-grave tratado o no con HT es alta, depende de la gravedad de la EHI y alcanza su máxima expresión alrededor de las 24 horas de vida29,30. La carga epiléptica es un importante factor predictivo de lesiones en la neuroimagen y de trastorno del neurodesarrollo, siendo su asociación con la evolución adversa independiente de la gravedad de la EHI y del tratamiento o no con HT33,34. Por ello, resulta imperativo tratar las CN rápida y eficazmente (fig. 2, Tabla 4 y S4). En los algoritmos de tratamiento debe tenerse cautela en aquellas convulsiones refractarias y ampliar el diagnóstico diferencial a otras etiologías distintas o concurrentes con la hipoxia-isquemia (fig. 2).
Recomendaciones en el manejo y tratamiento de las convulsiones en el recién nacido con EHI en entornos con recursos limitadosa
| 1. Iniciar sin demora el tratamiento antiepiléptico con fenobarbital ante la presencia de convulsiones clínicas de tipo clónica o tónica focal. |
| 2. Considerar el tratamiento antiepiléptico con fenobarbital si las convulsiones son clínicas secuenciales, autonómicas o mioclónicas generalizadas. |
| 3. En ausencia de monitorización, tratar activamente con antiepilépticos hasta la desaparición completa de las crisis clínicas. Dado que no es posible tener certeza de la desaparición de las convulsiones eléctricas, se debe mantener un alto índice de sospecha. |
| 4. No iniciar tratamiento en aquellos pacientes con automatismos motores o episodios de extensión tónica generalizada sensible a estímulos («posturing»). |
| 5. Se recomienda implementar en cada centro un esquema de tratamiento de acuerdo con los recursos disponibles, eligiendo entre las posibilidades que se ofrecen en la figura 2. |
| 6. Iniciar la retirada progresiva de anticonvulsivantes tras un periodo libre de convulsiones de 72 h. El objetivo, si es posible, es discontinuar completamente el tratamiento antes del alta. |
| 7. Cuando el RN ha requerido más de un fármaco anticonvulsivante, se recomienda ir reduciendo el número de fármacos anticonvulsivos, primero los de tercera línea y tras 48-72 h sin convulsiones, interrumpir los de segunda línea, dejando para el final la retirada de fenobarbital (primera línea). |
| 8. Es aconsejable realizar un registro de EEG convencional tras la retirada de cada fármaco anticonvulsivo. |
EEG: electroencefalograma convencional; EHI: encefalopatía hipóxico-isquémica; h: horas; RN: recién nacido.
Se recomienda leer la tablas S4 y S5 para completar la información sobre las convulsiones neonatales.
Como muchas Unidades Neonatales en ERL tienen un acceso limitado al EEG continuo o a la electroencefalografía integrada por amplitud (aEEG), el tratamiento de las CN descansa en su reconocimiento clínico, por lo que es necesario entrenar a los profesionales en ello. La Brighton Collaboration ha propuesto un esquema terapéutico con cinco niveles de certeza diagnóstica, que ayudan, cuando no se dispone de monitorización electroencefalográfica, a decidir el tratamiento y a evitar el sobretratamiento35 (Tabla S5).
Por otro lado, la exposición continuada a anticonvulsivantes puede tener efectos nocivos a largo plazo en el cerebro en desarrollo y, por su acción sedante, pueden retrasar el establecimiento de la alimentación oral y dificultar la vinculación de los padres con su RN. Por ello, los anticonvulsivantes deben indicarse solo mientras sean necesarios.
La duración del tratamiento anticonvulsivo, una vez conseguido el cese de las convulsiones, tiene un consenso limitado32,36. Sin embargo, hay evidencia creciente de que las CN en la EHI son infrecuentes después del cuarto al quinto día de vida y que una vez que estas son controladas, es infrecuente que se repitan29,31.
Intervenciones terapéuticasNo se recomienda la aplicación de la HT durante 72 horas utilizando medidas pasivas o activas no servocontroladas. Estas se reservan para periodos muy cortos y con un control estrecho de la temperatura, como es la inducción de la hipotermia previa al traslado a un centro receptor con HT servocontrolada7,8.
Excepto para la HT, los estudios disponibles sobre intervenciones neuroprotectoras son escasos, y la mayoría abordan más su factibilidad que su eficacia. Desde la introducción de la HT, la gran mayoría de estas intervenciones han sido testadas como coadyuvantes a la HT, lo que limita conocer cómo se comportarían como monoterapia en ERL. La única intervención que ha mostrado beneficios en ERL fue la administración profiláctica de fenobarbital (Tabla S6).
Disfunción multiorgánicaLa disfunción multiorgánica es frecuente y su extensión y gravedad están relacionadas con la de la EHI, así como con la muerte neonatal37. Asimismo, puede originar una importante morbilidad y agravar el daño cerebral hipóxico-isquémico. Los estudios de control y los tratamientos propuestos en la tabla 5 no están basados en la evidencia, pues son pocos los que comparan intervenciones diagnósticas o terapéuticas. No obstante, el soporte sistémico no debe ser descuidado. El conocimiento de la relación estrecha que existe entre la hemodinámica sistémica y la cerebral ha impulsado la monitorización no invasiva de la saturación regional de oxígeno y los estudios de ecocardiografía funcional. Disponer de un ecógrafo abre la posibilidad a conocer y dirigir las opciones terapéuticas más precisas.
Resumen del espectro clínico, estudios de control y tratamiento de la disfunción multiorgánica
| Espectro clínico | Estudios/controles | Tratamiento | |
|---|---|---|---|
| Cardiovascular | • Hipotensión (↓ contractilidad o ↓ gasto cardiaco)• Bradicardia• ↓diuresis/oliguria | • Troponina T y/o CK-MB en sangre• Alteración ECG• TAM, SatO2 pre y posductal• Ecocardiografía | • Dobutaminaa• Adrenalina• Dopamina• Milrinonab |
| Respiratorio | • Insuficiencia respiratoria, necesidad de soporte respiratorio o de O2• HTPP | • Gases sanguíneos• Objetivo: anión gap [Na+ - (Cl-+CO3H−)]−<15 mEq/L; pH> 7,3; pCO2 37,5-52,5 mmHg | • Evitar hipoxia o hiperoxia• Evitar hipocarbia• Si HTPP: milrinona; sildenafiloc |
| Renale | • ↓diuresis/oliguria• DRA• Hiponatremia• SIADH• Disfunción tubular | • Diuresis/balance hídrico• Cistatina Cd• Creatinina• Ecografía renal• Ionograma urinario, densidad/osmolaridad | • Iniciar aportes con solución glucosada al 10%: 50 mL/kg/día• Aumentar según balances hídricos, valor glucémico, función renal y cardiaca• Si IRA refractaria al tratamiento médico: diálisis peritoneal |
| GastrointestinalHepáticof | • Retraso del vaciado gástrico• Peristaltismo deficiente• Sangrado gástrico• Hipoglucemia• ↑ AST/ALT (>100 UI/L) | • Restos y pH gástrico (tira Merck)• Glucemia• ALT y AST• LDH• TP | • Dieta absoluta o alimentación no nutritiva (calostro o LM 1-3 mL/kg cada 3 horas)• Considerar administrar vit K o PFC |
| Coagulopatía | • Trombocitopenia• Coagulopatía• Sangrado activo (sobre todo pulmón y gastrointestinal) | • ALT y AST• TP, TTPa, INR• Fibrinógeno• Plaquetas• Dímero D | • PFC si TP o TTPA o INR>1,5 del rango normal• Crioprecipitado si fibrinógeno <1,5 g/L• Transfusión CH si HB <7-8 g/dL en neonato estable• Transfusión de plaquetas si <50.000/mL |
AST: aspartato transaminasa; ALT: alanina transaminasa; CH: concentrado de hematíes; CID: coagulación intravascular diseminada; Cl: cloro; CK-MB: isoenzima MB de la creatinquinasa; Co3H: bicarbonato; DRA: daño renal agudo; ECG: electrocardiograma; HTPP: hipertensión pulmonar persistente; INR: índice que indica el tiempo que tarda en coagularse la sangre (international normalized ratio); LDH: lactato deshidrogenasa; LM: lactancia materna; pCO2: presión parcial de dióxido de carbono; PFC: plasma fresco congelado; SatO2: saturación de oxígeno; SIADH: secreción inadecuada de hormona antidiurética; TAM: tensión arterial media; TP: tiempo protrombina; TTPA: tiempo parcial de tromboplastina activada; vit: vitamina.
La dobutamina podría ser el fármaco de elección por su efecto α a dosis bajas sin aumentar las resistencias vasculares. Asimismo, la adrenalina es una buena opción por su acción sobre los receptores α y β2 y la reducción de la resistencia vascular pulmonar, de especial indicación en HTPP en que se necesita aumentar la resistencia vascular periférica.
La disminución en el filtrado glomerular se detecta más fácilmente mediante la determinación de cistatina C sérica que mediante la concentración de creatinina.
Precaución con medicamentos nefrotóxicos, como los aminoglucósidos, antiinflamatorios no esteroideos y la administración de vancomicina. La cefotaxima puede sustituir a la gentamicina al tener una cobertura similar, pero sin nefrotoxicidad. Si existe daño renal agudo, considerar reducir la dosis de antiepiléticos con excreción renal (fenobarbital, hidantoína, midazolam, lidocaína).
La administración de líquidos ha de controlarse cuidadosamente. Dado que estos RN pueden presentar retraso en el inicio de la diuresis, daño renal agudo y en ocasiones secreción inadecuada de hormona antidiurética (SIADH), están en riesgo de tener sobrecarga de líquidos e hiponatremia. El 15-40% de los neonatos con EHI no enfriados presentan una función renal patológica y más de un 30% muestran hiponatremia.
En más del 50% de los RN con EHI aparecen otras alteraciones electrolíticas20,22,38. Las más comunes por orden son: hipocalcemia, hiperpotasemia, hipopotasemia, hiponatremia e hipomagnesemia22. Se recomienda monitorizar los electrolitos séricos cada 12-24 horas (Tabla 6 y S7).
Recomendaciones para el manejo de líquidos, electrolitos y nutrición en el RN con EHI
| 1. En el RN con EHI, el tipo de manejo hidroelectrolítico puede ser perjudicial y agravar el daño cerebral. |
| 2. La sobrecarga hídrica y la hiponatremia pueden favorecer el desarrollo de edema cerebral. Se recomienda una restricción leve de líquidos (55-60 mL/kg/día) hasta que se haya establecido una diuresis igual a 1 mL/kg/hora.3 |
| 3. El aporte restringido de líquidos durante las primeras 72 horas, debe permitir mantener un balance hídrico neutro o mínimamente positivo, un adecuado suministro de glucosa (4-8 mg/kg/minuto), niveles de Na+ sérico entre 135 y 145 mEq/L y una diuresis> 1 mL/kg/h. |
| 4. En caso de hiponatremia, establecer la causa es crucial para decidir el manejo más apropiado. Considerar en el diferencial: excesivos aportes (hiponatremia dilucional), daño renal agudo, secreción inadecuada de hormona antidiurética y/o síndrome pierde sal. |
| 5. Si se instaura una restricción excesiva de líquidos, esta puede causar deshidratación e hipotensión, disminuyendo la perfusión cerebral y provocar más daño cerebral o reducir la diuresis y empeorar la función renal. |
| 6. Ante un desequilibrio en algún electrolito se recomienda una terapia inmediata seguida por un mantenimiento con el fin de mantener los niveles dentro del rango normal (el nivel de magnesio es preferible que esté en el rango normal alto). |
| 7. En el RN con EHI moderada iniciar alimentación trófica no nutritiva (10-20 mL/kg/d) con leche materna y aumentar progresivamente los volúmenes prestando atención a signos de intolerancia como residuos gástricos abundantes, biliosos o teñidos de sangre. |
EHI: encefalopatía hipóxico-isquémica; Na+: sodio; RN: recién nacido.
Con referencia a la nutrición en el RN con EHI, los ECA que testaron la eficacia de la HT mantenían a los pacientes con dieta absoluta durante las primeras 72 horas por la posibilidad de daño intestinal por isquemia-reperfusión38. Sin embargo, la incidencia de trastornos intestinales graves es muy baja, y la alimentación trófica y progresiva no parece conllevar un aumento de las complicaciones intestinales (Tabla 6 y S7).
El uso de antibioterapia rutinario en el paciente con asfixia o EHI perinatal no está justificado, si bien debe tenerse un alto índice de sospecha y monitorizar estrechamente los parámetros infecciosos en sangre y líquido cefalorraquídeo (LCR), especialmente si hay antecedentes de corioamnionitis, fiebre, aumento de los reactantes de fase aguda, o si la evolución de la disfunción neurológica no es la esperable.
Estudios complementariosDos estudios complementarios de amplia disponibilidad como el EEG convencional y la ultrasonografía craneal (USC) pueden ser de particular valor para mejorar la capacidad pronóstica en los ERL (Tabla S8).
Electroencefalograma convencionalPreviamente a la incorporación de la monitorización continua electroencefalográfica, la alteración grave del trazado de fondo en el electroencefalograma durante los primeros días de vida mostró una fuerte correlación con la gravedad de la EHI, con los hallazgos en la RM y con la evolución adversa39–41. Esta evaluación neurofisiológica clásica durante al menos 15 minutos puede realizarse a pie de cuna, utilizando un número limitado de electrodos y su interpretación es relativamente sencilla42.
Ultrasonografía cranealLa USC es una evaluación no invasiva, realizada a la cabecera del paciente que puede ser repetida para visualizar la evolución temporal de las alteraciones detectadas. Los equipos modernos con escala de grises y transductores de frecuencia variable han mejorado la sensibilidad y especificidad del diagnóstico lesional por USC. Además, la disponibilidad y precio de ecógrafos portátiles ha condicionado que la USC sea cada vez más factible en los ERL. La realización e interpretación de esta evaluación por neonatólogos entrenados ha mejorado su disponibilidad y abaratado los costes43.
En la EHI, los hallazgos en la USC entre las 24 y 72 horas se correlacionan bien con los hallazgos postmorten44 y con los de la RM durante la primera semana; y son predictivos de evolución adversa45. La observación secuencial de la evolución de la lesión permite definir el patrón y la gravedad de las lesiones. En el RN con EHI que no recibe HT, la medición del índice de resistencia en la arteria cerebral anterior es un buen indicador pronóstico.
Atención centrada en la familia durante la fase aguda de la encefalopatíaEste pilar, como parte de la atención integral al RN con EHI, ha recibido escaso interés hasta la incorporación de la HT. El nacimiento y hospitalización del RN con EHI es una experiencia estresante y traumática para la familia. La tecnología que rodea al RN, el miedo a su muerte y la incertidumbre sobre el pronóstico, son factores que provocan sentimientos de culpa, tristeza y desesperanza en los padres. Asimismo, la separación, la dificultad para sostener al RN en sus brazos y participar de su cuidado, han sido identificados como elementos que perturban el establecimiento del vínculo y dificultan el desarrollo del rol materno-paterno, e impactan negativamente en el bienestar emocional de la familia (Tabla S9).
ConclusionesAun cuando la HT no esté disponible en ERL, la evidencia señala otras medidas terapéuticas que sí son accesibles en ERL, tienen valor neuroprotector y podrían mejorar el pronóstico de estos pacientes. Es más, los resultados de los estudios de cohortes posHT han mostrado resultados significativamente mejores que los hallados en los ECA, sugiriendo que la optimización de los cuidados intensivos puede ser responsable de una buena proporción de la mejoría atribuida a la HT46.
Este documento proporciona por primera vez un código para la EHI, una patología «tiempo-dependiente», en ERL sin disponibilidad de HT, pero con cuidados intensivos neonatales. Aunque todavía quedan cuestiones por resolver y son necesarios más estudios en ERL, la implementación de estas recomendaciones podría disminuir la morbimortalidad asociada a la EHI y lograr un uso más eficiente de los recursos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.