El Comité Asesor de Vacunas (CAV) de la Asociación Española de Pediatría actualiza anualmente el calendario de vacunaciones teniendo en cuenta, tanto aspectos epidemiológicos como de efectividad y eficiencia de las vacunas.
El presente calendario incluye grados de recomendación. Se han considerado como vacunas sistemáticas aquellas que el CAV estima que todos los niños deberían recibir, como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que es deseable que los niños reciban, pero que pueden ser priorizadas en función de los recursos para su financiación pública y dirigidas a grupos de riesgo aquellas con indicación preferente para personas en situaciones epidemiológicas de riesgo. El CAV considera como objetivo prioritario la consecución de un calendario de vacunaciones único.
El CAV se reafirma en la recomendación de incluir la vacunación frente a neumococo en el calendario de vacunación sistemática. La vacunación universal frente a varicela en el segundo año de vida es una estrategia efectiva y por tanto un objetivo deseable. La vacunación frente a rotavirus, dada la morbilidad y la elevada carga sanitaria, es recomendable en todos los lactantes.
El CAV se adhiere a las recomendaciones del Consejo Interterritorial del Sistema Nacional de Salud en referencia a la vacunación sistemática frente a VPH de todas las niñas de 11 a 14 años e insiste en la necesidad de vacunar frente a la gripe y hepatitis A a todos los pacientes que presentan factores de riesgo para dichas enfermedades. Finalmente se insiste en la necesidad de actualizar las vacunaciones incompletas con las pautas de vacunación acelerada.
The Vaccine Advisory Committee of the Spanish Association of Paediatrics updates annually, the immunization schedule, taking into account epidemiological data, as well as evidence of the effectiveness and efficiency of vaccines.
This vaccination schedule includes grades of recommendation. The committee has graded as universal vaccines those that all children should receive, as recommended those with a profile of universal vaccination in childhood and which are desirable that all children receive, but that can be prioritized based on resources for its public funding and for risk groups those targeting groups of people in situations of epidemiological risk. The Committee considers as a priority to achieve a common immunization schedule.
The Committee reaffirms the recommendation to include pneumococcal vaccination in the routine vaccination schedule. Vaccination against varicella in the second year of life is an effective strategy and therefore a desirable goal. Vaccination against rotavirus is recommended for all infants given the morbidity and high burden on the health care system.
The Committee adheres to the recommendations of the Interterritorial Council of the National Health Care System in reference to routine vaccination against HPV for all girls aged 11 to 14 years and stresses the need to vaccinate against influenza and hepatitis A all patients with risk factors for these diseases. Finally, it stresses the need to update incomplete immunization schedules using accelerated immunization schedules.
Se considera una función primordial del Comité Asesor de Vacunas (CAV) de la Asociación Española de Pediatría actualizar, cada año, el calendario de vacunaciones, teniendo en cuenta la evidencia disponible sobre la efectividad y la eficiencia de las vacunas infantiles, así como la epidemiología de las enfermedades inmunoprevenibles en nuestro país. Las recomendaciones van dirigidas a pediatras, médicos de familia, personal de enfermería, familiares de los niños y en general, a todos aquellos interesados en una información actualizada sobre la vacunación en la edad pediátrica.
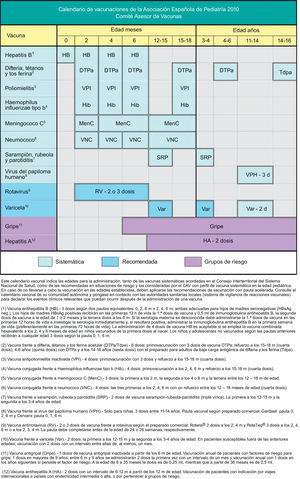
Teniendo en cuenta que en España los calendarios oficiales de vacunación son sufragados en su totalidad por los servicios públicos de salud, el presente calendario incluye grados de recomendación para las diferentes vacunas con el objeto de establecer niveles de prioridad en la financiación pública de las mismas, teniendo en cuenta no solo su efectividad y seguridad, sino la carga de enfermedad en nuestro medio y, cuando sea posible, criterios de eficiencia. Este mismo criterio pretende orientar al pediatra sobre las recomendaciones dirigidas a los padres sobre vacunas contempladas en este calendario, pero no incluidas en los calendarios oficiales. En la figura 1 se muestra el calendario de vacunaciones recomendado por el CAV para 2010 clasificando las vacunas en sistemáticas, recomendadas y las dirigidas a grupos de riesgo. Se han considerado como vacunas sistemáticas aquellas que el CAV estima que todos los niños en España deberían recibir de forma universal; como recomendadas las que presentan un perfil de vacuna sistemática en la edad pediátrica y que el CAV considera deseable que todos los niños reciban, pero que por razones de costeefectividad su prioridad se establece en función de las posibilidades económicas de su financiación pública; y dirigidas a grupos de riesgo aquellas que se consideran de indicación prioritaria para personas en situaciones epidemiológicas o personales que incrementen el riesgo de padecer las enfermedades para las que van dirigidas o de presentar formas más graves si las padecen.
El CAV considera un objetivo prioritario la consecución de un calendario de vacunaciones único, de forma que se mantenga el principio de equidad en la prevención de la salud y el principio de racionalidad que facilite el cumplimento de las inmunizaciones en los niños que cambien de comunidad autónoma como lugar de residencia. En la actualidad, no hay diferencias epidemiológicas en las enfermedades inmunoprevenibles entre las diferentes comunidades autónomas, con la posible excepción de la hepatitis A en Ceuta y Melilla, que justifiquen calendarios vacunales distintos. El CAV estima que es necesario un esfuerzo colectivo de todos los agentes sanitarios y políticos implicados en la toma de decisiones en el diseño del calendario de vacunaciones para los niños españoles y ofrece su colaboración para la consecución de este objetivo.
También se hace hincapié en la necesidad de que las inmunizaciones sistemáticas alcancen a todos los niños, eliminando las disparidades étnicas, sociales y económicas. Se considera un objetivo primordial poner al día el calendario de vacunación en todos los niños inmigrantes o en aquellos niños cuyo calendario de vacunación esté incompleto, no solo para lograr su protección individual ante las enfermedades inmunoprevenibles, sino también para evitar bolsas de población susceptible. Los contactos esporádicos que algunos niños tienen con los servicios de salud (urgencias, ingreso hospitalario, pediatra, médico de cabecera o enfermera) deben ser aprovechados para la actualización de su calendario de vacunación.
Vacunación frente a difteria, tétanos, tos ferina, poliomielitis, Haemophilus influenzae tipo b y hepatitis BEl CAV mantiene su recomendación de utilizar vacunas combinadas para la protección frente a estas enfermedades. El empleo de vacunas combinadas reduce el número de inyecciones a los niños, simplifica notablemente la distribución, el almacenamiento y la administración de las vacunas del calendario de vacunaciones y aumenta el grado de cumplimiento del mismo1.
Se mantiene la recomendación de utilizar estas vacunas combinadas hexavalentes (DTPa-VPI-HB-Hib) o pentavalentes (DTPa-VPI-Hib) para la primovacunación a los 2–4–6 meses y la pentavalente para la dosis de refuerzo a los 15–18 meses. A los 4–6 años se aplicará, como dosis de refuerzo, la vacuna DTPa y a los 14–16 años se recomienda una dosis de refuerzo con Tdpa. La persistencia de casos de tos ferina en lactantes pequeños contagiados sobre todo a partir de adultos jóvenes afectados, hace muy recomendable que la vacunación de adolescentes se realice con la vacuna Tdpa (con baja carga antigénica para difteria y tos ferina), en lugar de la Td que se está administrando actualmente1,2.
La vacunación frente a Haemophilus influenzae tipo b (Hib), indicada en menores de 5 años, puede administrarse en mayores de esta edad si existe un riesgo elevado para infección por este germen. La referida indicación, no incluida en la ficha técnica, se basa en estudios que demuestran buena inmunogenicidad en individuos mayores de 5 años y adultos con leucemia, VIH, asplenia anatómica o funcional que podrían beneficiarse de la protección frente a Hib. En estos casos está indicada la administración de una dosis de vacuna monovalente. En otras fuentes se cita, en base a datos limitados, la recomendación de la administración de 2 dosis separadas por 1 o 2 meses en niños mayores de 5 años con infección por VIH o déficit de IgG22,3.
La vacunación frente a hepatitis B (HB) requiere 3 dosis, que pueden administrarse según pautas equivalentes: 0–2–6 meses o 0–2–6 meses, ambas adecuadas para hijos de madres seronegativas (HBAg negativo). La vacunación con 4 dosis de vacuna anti-HB es aceptable si se utiliza la vacuna hexavalente a los 2–4–6 meses de vida para aquellas comunidades autónomas donde se vacuna frente a HB al nacimiento. Opcionalmente se puede utilizar una combinación de vacuna hexavalente y pentavalente en función de la vacunación frente a HB en el RN1,2.
Vacunación frente a meningococo CRespecto a las vacunas frente a meningococo C, el CAV mantiene la recomendación de primovacunación con 2 dosis en el primer año (a los 2 y a los 4 o 6 meses de edad) y una dosis de refuerzo en el segundo año, preferentemente entre los 12–18 meses1.
Vacunación frente a sarampión, rubeola y parotiditisPara la vacunación frente a sarampión, rubeola y parotiditis se administrarán 2 dosis, la primera a los 12–15 meses y la segunda a los 3–4 años de edad. En inmigrantes que en su país de origen hayan recibido una dosis de sarampión (presentación monocomponente), deberán administrarse 2 dosis de vacuna triple vírica (sarampión, rubeola y parotiditis).
Vacunación frente a hepatitis AEl CAV recomienda la vacunación frente a hepatitis A (HA) a los niños a partir de los 12 meses y adolescentes con un elevado riesgo de infección: viajeros a países con endemicidad intermedia o alta para la infección por el virus de la HA (especialmente si son niños emigrantes que visitan sus países de origen), residentes en instituciones cerradas y receptores de hemoderivados de forma reiterativa. Está especialmente indicada en niños y adolescentes con mayor riesgo de hepatitis fulminante en caso de infección por el virus de la HA: pacientes en espera de trasplante hepático o con cualquier hepatopatía crónica y en aquellos pacientes con serología positiva para el virus de hepatitis C. La pauta de vacunación es de 2 dosis a partir de los 12 meses de edad, con un intervalo de 6–12 meses entre dosis.
Vacunación frente a neumococoEl CAV se ratifica en la recomendación de incluir la vacunación frente a neumococo en todas las comunidades y ciudades autónomas de nuestro país1. Durante los últimos años, se han hecho evidentes algunos cambios en la epidemiología de la enfermedad neumocócica invasora (ENI), probablemente por causas multifactoriales, como el uso de la vacuna antineumocócica conjugada heptavalente (VNC7) Prevenar®, la presión selectiva de los antibióticos y las propias características de las diferentes cepas de neumococo. Algunos de estos cambios se habían iniciado ya varias décadas antes4.
Además de cambios en la incidencia de la ENI, se han producido variaciones en la prevalencia de los serotipos neumocócicos desde la introducción de la VNC7 que, de forma genérica, pueden resumirse como una disminución de los serotipos vacunales y un aumento de los serotipos no vacunales, tanto en niños4–6 como en adultos4,7,8. Antes de la introducción de la VNC7, los serotipos contenidos en esta vacuna representaban el 78 y el 81% de los aislamientos de sangre y del oído medio, respectivamente9. En el año 2003, sin embargo, el Ministerio de Sanidad estimó que los serotipos vacunales eran la causa de solo el 54% de la ENI en España10.
Los serotipos neumocócicos cuya prevalencia ha experimentado un ascenso más acentuado han sido el 1, 19A, 5 y el 7F5,7,11–14. La expansión de los serotipos 1, 5 y 19A obedece, probablemente, a diferentes causas. El serotipo 1 presenta brotes en ciclos de larga duración y su incidencia ha venido incrementándose en nuestro país desde 1995 hasta la actualidad4,6,7. El serotipo 5 varía de unas regiones a otras, toda vez que causa brotes u ondas epidémicas de duración variable15,16. El ascenso del 19A comenzó a principios de la década de los 90 del siglo anterior, pero el mayor incremento se ha producido a partir del año 20004. En algunas áreas de nuestro país, el 19A representa entre el 20–30% de todos los casos de ENI13,17. En Madrid, el serotipo 19A fue el responsable, en el periodo 2007–2008, del 22% de las meningitis neumocócicas18. Según datos del Laboratorio Nacional de Referencia de Neumococos, el 19A supuso un 19% de todos los aislados neumocócicos en ENI en el año 200819.
Debido a que algunos serotipos neumocócicos producen, de forma preferente, algunas formas concretas de ENI15,20, el cambio de los mismos se ha acompañado también de una variación de los cuadros clínicos. La más importante ha sido el fuerte ascenso del número de empiemas y de neumonías bacteriémicas que, en España, como ha sucedido en otros países, se inició antes de la introducción de la VNC721,22. Este incremento se ha producido prácticamente en toda la geografía española5,12,14,18,23, aumentando en algunas regiones hasta el 320% con respecto al periodo prevacunal5. El serotipo implicado con más frecuencia ha sido el 15,12,14,18,23, seguido del 19A, el 3 y el 7F18,23. Los serotipos 1 y 5, con fuerte tropismo por el pulmón, causan también una proporción considerable (27 y 29% en Madrid, respectivamente) de neumonías bacteriémicas sin empiema18, tienen una gran capacidad invasora15,20 y son habitualmente sensibles a los antibióticos, ya que raramente colonizan la nasofaringe15,20. El serotipo 7F tiene, también, una capacidad invasora y una letalidad elevadas24,25, mientras que el 3, más frecuente en adultos que en niños, puede producir infecciones graves20 y neumonías necrotizantes26.
Una gran proporción de las resistencias – especialmente las de alto nivel – del neumococo se asocian a los serotipos 6B, 6A, 9V, 14, 19F, 19A y 23F, todos ellos eficientes colonizadores nasofaríngeos y expuestos a la presión selectiva de los antibióticos27,28. La disminución de la colonización nasofaríngea por las cepas vacunales tras la vacunación27–30 es, probablemente, el mecanismo primordial por el que estas vacunas disminuyen las resistencias27,28,31,32. En nuestro país, en el momento actual, el serotipo 19 A es el que se asocia con más frecuencia a resistencias y multirresistencias (resistencia a 3 o más antibióticos). El incremento de resistencias a este serotipo en España se debe a ciertos clones multirresistentes que se han expandido por la presión selectiva de los antibióticos17,28,33,34 aunque la vacunación con la VNC7 y las propias características de este serotipo, con gran capacidad colonizadora en nasofaringe, han jugado también un papel relevante en este fenómeno20,35.
A la luz de estos hechos epidemiológicos, se prevé un papel significativo para las nuevas vacunas neumocócicas conjugadas, la decavalente (VNC10) Synflorix®Glaxo-SmithKline y la tridecavalente (VNC13) Prevenar 13®Pfizer, en el control de la ENI en España. Ambas vacunas han sido aprobadas por la Agencia Europea del Medicamento (EMA), basándose en los niveles de Ac frente al polisacárido capsular y en los títulos de actividad opsonofagocítica que la OMS ha definido como parámetros indirectos de protección36,37.
Synflorix® fue aprobada por la EMA con indicación para la prevención de la ENI y de la otitis media aguda (OMA) por neumococo en niños de 6 semanas a 2 años de edad. Esta vacuna contiene polisacáridos para los mismos serotipos neumocócicos que la VNC7 (4, 6B, 9V, 14, 18C, 19F y 23F) más los serotipos 1, 5 y 7F. Como proteína de conjugación utiliza la proteína D (una forma no lipídica recombinante de la proteína D altamente conservada de H. influenzae no tipable) en todos los serotipos neumocócicos, excepto en el 18C y el 19F, que están conjugados con el toxoide tetánico y el toxoide diftérico, respectivamente. Estudios de no inferioridad inmunológica han demostrado que la VNC10 no es inferior a la VNC7 para los serotipos comunes, si se aplican los criterios inmunológicos establecidos por la OMS. Además, para los serotipos que esta vacuna amplía, la respuesta inmunológica inducida cumple los parámetros establecidos de protección y la dosis de refuerzo genera una adecuada memoria inmunológica para todos los serotipos que contiene38. La VNC10 puede coadministrarse con otras vacunas del calendario de vacunaciones, ya que no se producen interferencias significativas en la inmunogenicidad39–41, ni mayor reactogenicidad42.
Prevenar 13® contiene polisacáridos para 13 serotipos neumocócicos conjugados con el toxoide diftérico CRM197: los 7 serotipos de la VNC7 más los serotipos 1, 3, 5, 6A, 7F y 19A. Ha sido aprobada por la EMA e indicada para la prevención de la ENI, neumonía y OMA causadas por neumococo en niños de entre 6 semanas y 5 años de edad. La VNC13 cumple los criterios de no inferioridad inmunológica frente a la VNC7 para los serotipos comunes, así como los parámetros de protección frente a los 6 serotipos que amplía, considerando los criterios inmunológicos establecidos por la OMS. La dosis de refuerzo induce una adecuada memoria inmunológica43,44. Cuando se coadministra con otras vacunas del calendario sistemático no se producen interferencias inmunológicas significativas ni se incrementa la reactogenicidad45–48.
Si los marcadores indirectos de protección de las nuevas vacunas conjugadas ante los serotipos no contenidos en la VNC7 se correlacionan con la efectividad esperada, estas vacunas jugarán un papel importante en el control de la ENI al disminuir la carga global de enfermedad en nuestro país. Específicamente, la prevención de las infecciones por los serotipos 1 y 5 se traducirá en una disminución de las neumonías bacteriémicas y las que cursan con empiema. La repercusión sobre el 19A también puede disminuir la carga de ENI en forma de empiemas19 y meningitis17,18, así como las tasas de resistencias de neumococo a los antibióticos.
Mucho más difícil es cuantificar la repercusión de las nuevas vacunas en la carga de enfermedad no invasora. Los marcadores indirectos de protección no están tan bien definidos en la neumonía49 y la OMA50 como en la ENI y por otra parte, no existen en España datos sobre la distribución de serotipos neumocócicos en la OMA. Los serotipos 3 y 19A son patógenos relevantes en la OMA, tanto en Europa y los EEUU como en Latinoamérica51 y su aislamiento ha aumentado en los países donde se utiliza la VNC752,53. Es esperable que la VNC13 amplíe la efectividad frente a OMA observada con la VNC7, al incluir serotipos implicados en la etiología de la misma, como el 19A. Desde otra perspectiva, una vacuna 11-valente experimental, predecesora de la VNC10 y que utiliza el mismo carrier (la proteína D de H. influenzae no tipable), redujo la incidencia de cualquier tipo OMA en un 33,6% de los niños vacunados y concretamente para la OMA producida por H. influenzae no tipable la reducción fue del 35%54. Aunque es coherente extrapolar a la VNC10 esta potencialidad observada en la prevención de la OMA, su eficacia debe ser confirmada con la formulación final de esta vacuna en los ensayos clínicos actualmente en curso.
También es complejo predecir el papel de las nuevas vacunas en la prevención de neumonías neumocócicas no bacteriémicas. Entre un 10–40% de las neumonías de los niños son de etiología neumocócica55–57, pero hay pocos estudios que hayan determinado los serotipos implicados, aunque posiblemente son similares a los que causan las neumonías bacteriémicas. En este caso, las nuevas vacunas proporcionarán muy probablemente un aumento significativo de la efectividad, ya constatada con la VNC758, frente a esta forma de enfermedad neumocócica.
El impacto de las nuevas vacunas en la prevención de la OMA y la neumonía es un determinante primordial de su eficiencia en el ámbito de la salud pública, ya que por su elevada incidencia, cualquier reducción porcentual supone un elevado ahorro económico a la sociedad, una disminución del consumo de antibióticos y de las visitas ambulatorias y una menor selección de las resistencias bacterianas.
Un tema a abordar si, como es deseable, se introduce la vacunación universal frente a neumococo en todas las comunidades y ciudades autónomas de España, es qué pauta de vacunación utilizar. El esquema de 3 dosis de primovacunación en el primer año de vida más una dosis de refuerzo en el segundo año (esquema 3+1) viene avalado por la experiencia de la VNC7 en los EEUU y otros países59,60 que han logrado reducciones de la ENI, gracias no solo al efecto directo, sino también al efecto indirecto en las personas no vacunadas (inmunidad de grupo)59,61,62. Gran parte del efecto de inmunidad de grupo de la VNC7 y de su capacidad para reducir la selección de cepas resistentes a antibióticos reside en su eficacia para disminuir la colonización nasofaríngea por las cepas vacunales28,29, que se produce, sobre todo, tras la dosis de refuerzo del segundo año de vida29,63. Por ello, ningún esquema vacunal debería prescindir de la dosis de refuerzo en el segundo año.
En el momento actual hay una experiencia cada vez mayor con la pauta de 2 dosis de primovacunación en el primer año de vida y una dosis de refuerzo en el segundo (esquema 2+1). Tras 2 dosis de la VNC7 la mayoría de los sujetos alcanzan títulos protectores de Ac anticapsulares, excepto frente a los serotipos 6B y 23F, para los que un 20–40% de los niños no adquieren niveles de protección. Estos niños podrían ser susceptibles a la infección por estos serotipos, en tanto no reciban la dosis de refuerzo64. Si se utilizan esquemas 2+1, la dosis de refuerzo debe administrarse entre los 11 y 15 meses de edad. Semejante esquema de vacunación solo se debería aplicar en poblaciones en las que la vacunación antineumocócica fuera universal, de forma que los niños potencialmente susceptibles a los serotipos 6B y 23F estarían protegidos por la inmunidad de grupo. En la práctica individual, en un escenario sin vacunación universal, la pauta 2+1 no es aceptable por las razones expuestas.
Con la disponibilidad de las nuevas vacunas conjugadas, puede ser necesario realizar la transición a las mismas en niños que aún no han completado la vacunación con la VNC7. La ficha técnica de la VNC10 establece que en la serie de primovacunación no puede haber intercambiabilidad con otras vacunas antineumocócicas. En lo referente a la dosis de refuerzo, un estudio ha demostrado que después de una serie de primovacunación con la VNC7, una dosis de refuerzo con la VNC10 induce niveles protectores de Ac por ELISA y opsonofagocítica frente a los 7 serotipos comunes en el 97 y 95%, respectivamente38. En el caso de la VNC7 y VNC13, ambas con el mismo carrier proteico, la intercambiabilidad es posible, de manera que los niños que hayan iniciado la vacunación con la VNC7 pueden cambiar, en cualquier momento, a la VNC13.
Con el esquema de vacunación 3+1, utilizado hasta ahora en nuestro país, las pautas de vacunación son similares en ambas vacunas, con la salvedad de que la VNC10 solo está aprobada, por el momento, hasta los 24 meses de edad, mientras que la VNC13 lo está hasta los 5 años. En los niños de 6 semanas a 6 meses de edad se recomiendan para ambas vacunas 3 dosis, separadas por un intervalo mínimo de 1 mes. Debe administrarse una dosis de refuerzo entre los 12–18 meses de edad (preferiblemente entre los 12–15 meses). En los niños de entre 7–11 meses de vida, no vacunados previamente, la pauta consiste en 2 dosis separadas por un intervalo mínimo de 1 mes y una tercera dosis de refuerzo en el segundo año de vida, separada, al menos, 2 meses de la última dosis de primovacunación. En los niños de 12–23 meses de edad la vacunación se llevará a cabo con 2 dosis separadas por un intervalo de, al menos, 2 meses entre ambas. En niños de 2–5 años de edad solo se contempla la vacunación con una dosis de la VNC13.
Vacunación frente a varicelaEl CAV recomienda la vacunación frente a la varicela para todos los niños, con una primera dosis de la vacuna entre los 12–15 meses y una segunda dosis a los 3–4 años de edad. La estrategia alternativa de vacunación sistemática de niños susceptibles a los 10–14 años de edad permite evitar formas graves de la enfermedad, más frecuentes entre los adolescentes y los adultos, pero no evita la mayoría de los casos de varicela, ni la mayoría de las complicaciones y hospitalizaciones debidas a la enfermedad.
El seguimiento activo de diferentes regiones de los EEUU, donde se instauró la vacunación universal en 1995, ha demostrado que en el periodo comprendido entre este año y el año 2000, con coberturas que en el último año habían alcanzado entre el 73% y el 84% de los niños, el número de casos de varicela disminuyó entre un 70–85%63. Esta disminución tuvo lugar, sobre todo, entre los niños de 1–4 años, pero también en otras edades, incluso en los adultos65. El efecto beneficioso de la vacuna en aquel país continúa hasta la actualidad, produciéndose una reducción acusada del número de casos de varicela66 y de todas las complicaciones asociadas a esta enfermedad. Las hospitalizaciones por varicela también han experimentado un descenso y lo mismo ha sucedido con la mortalidad asociada a esta enfermedad que, entre 1994–2000 cayó un 66%67,68. Además, algunas enfermedades, como las infecciones invasoras por estreptococo del grupo A, que en los niños van casi exclusivamente ligadas a la varicela, prácticamente han desaparecido69. Es importante enfatizar que la efectividad de la vacunación universal se ha extendido también a las personas no vacunadas, lo que demuestra que induce inmunidad de grupo65.
No obstante, en este mismo país, se han producido brotes de varicela en niños vacunados, fundamentalmente en colegios, incluso en áreas con coberturas vacunales superiores al 90%70–73. La pérdida progresiva de inmunidad en los niños vacunados es un hecho evidente74–78. Se ha estimado que a los 10 años de la vacunación, la efectividad de la vacuna puede ser tan baja como el 72%75 y que uno de cada 5 niños vacunados será susceptible a varicela79. Se postula la hipótesis de que la ausencia de casos de varicela en poblaciones con tasas elevadas de vacunación pueda dar lugar a una disminución del «efecto de refuerzo natural» y a una disminución progresiva de la inmunidad de la población. También hay alguna evidencia de que un pequeño porcentaje de niños puede no desarrollar respuestas protectoras adecuadas tras la vacunación80, pasando a formar parte del grupo de personas susceptibles, cuyo número aumenta con el tiempo.
En los primeros brotes de varicela en niños vacunados, la mayoría de los que padecieron la enfermedad tuvieron formas leves de la misma, con escasos o nulos síntomas sistémicos, de forma que la efectividad de la vacuna frente a formas floridas o graves de la enfermedad continuó siendo superior al 95%. Sin embargo, actualmente no solo hay un aumento del número de casos de la enfermedad en niños vacunados, sino casos más graves y con mayor expresividad clínica, que incluso pueden necesitar hospitalización, a medida que aumenta el tiempo desde la vacunación76–79.
En el año 2006, el Advisory Committee on Immunization Practices y la American Academy of Pediatrics, recomendaron una pauta de vacunación con 2 dosis de vacuna de la varicela, la primera entre los 12–15 meses de edad y la segunda a los 4–6 años81. Dos dosis de esta vacuna proporcionan niveles más altos, más duraderos y más parecidos a los de la infección natural que los que confiere una sola dosis80,82. Además, el seguimiento de cohortes con una o 2 dosis de vacuna de varicela ha demostrado que la incidencia de la enfermedad es significativamente menor en los niños que reciben 2 dosis80. Una segunda dosis, por tanto, podría evitar los casos de varicela debidos a la pérdida de inmunidad, así como los de niños con fallos primarios de vacunación.
Algunos modelos matemáticos estiman que con una dosis de vacuna y coberturas de vacunación del 90%, durante los 5 años siguientes a la introducción de la vacuna, se produciría una disminución muy acusada de los casos de varicela («periodo epidémico de luna de miel») en todas las edades. Sin embargo, posteriormente tendría lugar un nuevo incremento de casos, la mitad de ellos en personas mayores de 19 años, en las que la enfermedad es, por lo general, más grave83. Una segunda dosis de vacuna, además de evitar los casos de varicela en los niños vacunados, podría también impedir muchos de los casos de adultos jóvenes.
Según los mismos modelos83, la cobertura de vacunación que se alcanza en una comunidad no solo determina el número de casos de varicela, sino la distribución de estos casos en las diferentes edades. Cuanto menor es la cobertura, menor es el impacto sobre la carga de enfermedad, pero además, mayor es el desplazamiento de los casos hacia los adultos jóvenes. Por el contrario, coberturas del 90% o mayores consiguen una gran reducción de los casos totales de varicela.
En espera de la unificación del calendario de vacunación contra la varicela, el CAV aboga por el cumplimiento de las recomendaciones que el Consejo Interterritorial del Sistema Nacional de Salud aprobó en 2005, que aconsejan vacunar a los niños entre 10–14 años (incluidas ambas edades) que no refieran haber pasado la enfermedad, ni haber sido vacunados con anterioridad. El CAV también insiste en vacunar de la varicela a todos los contactos susceptibles de pacientes inmunodeprimidos.
Sin embargo, a la luz de los datos epidemiológicos de los países en los que se ha introducido la vacunación universal frente a varicela, el CAV considera que la estrategia de vacunación universal con una primera dosis a los 12–15 meses y una segunda a los 3–4 años es la más efectiva, no solo para evitar el mayor número de casos y sus complicaciones en niños, sino también para asegurar coberturas vacunales superiores al 90%, capaces de prevenir los casos de varicela en los adultos. La vacunación de adolescentes se asocia tradicionalmente a bajas coberturas y podría acentuar el desplazamiento de la enfermedad a edades adultas.
Es importante recalcar que, dada la capacidad del virus varicela-zóster para mantener latencia, es difícil predecir cómo se comportarán las infecciones por este virus a medida que disminuya la circulación del virus salvaje que actúa como un «refuerzo natural» frente a la enfermedad. Por ello, el CAV estima que será necesario hacer un seguimiento a largo plazo, para realizar las modificaciones oportunas en la estrategia de vacunación frente a la varicela.
Vacuna frente a rotavirusEl rotavirus es la principal causa de gastroenteritis en la infancia. Se acompaña de una alta morbilidad en todos los países y de elevada mortalidad en los países con bajo nivel de ingresos. A pesar de los progresos en las medidas de salud pública (higiene de manos, depuración de las aguas, mejoría del nivel socioeconómico, etc.) la incidencia de la enfermedad ha disminuido poco82,83.
La mejor estrategia preventiva para la enfermedad es la vacunación universal. El objetivo fundamental de la vacunación contra el rotavirus es proteger contra las formas graves de gastroenteritis aguda, previniendo muertes, hospitalizaciones, pérdidas de jornadas de trabajo en los padres, etc., reduciendo la carga de la enfermedad y la utilización de recursos (costes)84,85.
En 2008, el CAV ya recomendó la vacunación sistemática frente al rotavirus1. También los CDC incluyen la vacunación frente a rotavirus como vacuna sistemática en sus recomendaciones84. Recientemente han sido publicados diversos trabajos que muestran la importancia de la enfermedad producida por rotavirus en España86–88 y en Europa89, así como algunos aspectos económicos que conlleva90.
Disponemos en nuestro país de 2 vacunas frente al rotavirus aprobadas por la EMA y comercializadas durante los años 2006–2007, cuyos ensayos clínicos han demostrado su eficacia, inmunogenicidad, seguridad y escasa reactogenicidad85,91–93. Estas vacunas son Rotarix®, GlaxoSmithKline y RotaTeq®, Sanofi Pasteur MSD.
Rotarix® es una vacuna monovalente de virus atenuados, obtenida de una cepa de virus de origen humano, que se replica muy bien en el intestino. Se administra de forma oral a partir de las 6–12 semanas de edad, en 2 dosis separadas por un intervalo mínimo de 4 semanas, debiéndose completar la pauta de administración antes de las 24 semanas de edad (6 meses).
RotaTeq® es una vacuna pentavalente de cepas bovinohumanas reordenadas, cuya pauta de administración difiere de la anterior, ya que consta de 3 dosis orales a partir de las 6–12 semanas de vida, con un intervalo mínimo de separación de 4 semanas y cuya edad máxima recomendada para la última dosis es la de 26 semanas (6 meses y medio).
En el año 2009, el ACIP destaca en sus recomendaciones la ampliación de la edad máxima de administración de ambas vacunas hasta los 8 meses de edad83, dada la ausencia de problemas de seguridad observados y con el objetivo de mejorar la cobertura de vacunación. No obstante, en España las fichas técnicas mantienen la limitación de edad máxima de administración antes comentada.
Ninguna de las 2 vacunas necesita reconstitución. Rotarix® se suministra con un líquido transparente e incoloro y aplicador oral precargado. RotaTeq® se presenta en forma de líquido blanquecino opaco.
Coadministradas con el resto de las vacunas de calendario confieren una elevada protección para prevenir episodios de cualquier intensidad de gastroenteritis aguda por rotavirus, con disminución global de la incidencia de la enfermedad, de la tasa de hospitalización y de consultas médicas ambulatorias y de visitas a los servicios de urgencias84,90–94. La vacunación debe completarse siempre con la misma marca comercial con la que se inicie, ya que no hay datos sobre la eficacia y la seguridad de la intercambiabilidad de los 2 preparados disponibles.
Tras amplios ensayos clínicos no se han demostrado diferencias significativas en la incidencia de invaginación intestinal en los niños vacunados con cualquiera de las 2 vacunas, cuando se comparan con placebo91–95. Tampoco se han observado efectos adversos clínicamente relevantes.
Las 2 vacunas se han utilizado en niños prematuros96,97. Las condiciones para su administración en estos niños son: que tengan una edad gestacional mayor de 25 semanas, se encuentren estables hemodinámicamente, tengan cumplidas 6 semanas cronológicas de vida y hayan sido dados de alta del servicio de neonatología o del hospital. Con las 2 vacunas se han llevado a cabo ensayos clínicos sobre eficacia, inmunogenicidad, seguridad y reactogenicidad con excelentes resultados, sin encontrar diferencias significativas con respecto a los RN a término, tanto en la eficacia vacunal como en su seguridad e inmunogenicidad96,97.
Rotarix® y RotaTeq® se vienen utilizando en varios países de nuestro entorno y se encuentran incluidas en algunos calendarios de vacunación. En los EEUU, tras la inclusión de la vacunación universal frente a rotavirus, se ha observado una disminución del 64% en el número de aislamientos de rotavirus en la temporada 2007–2008 con respecto a la época prevacunal98. En Europa, tanto la Sociedad de Gastroenterología, Hepatología y Nutrición como la Sociedad Europea de Infectología Pediátrica han recomendado99 la vacunación frente a rotavirus de forma universal en todos los niños europeos sanos.
La OMS recientemente ha actualizado su posición sobre la vacunación frente a rotavirus a nivel mundial100, recomendando la introducción de la vacuna en todos los programas nacionales. En nuestro país no está incluida en el calendario del Consejo Interterterritorial del Sistema Nacional de Salud. Tampoco se contempla la financiación selectiva, dada la ausencia de grupos de riesgo específicos para esta enfermedad101.
Dada la morbilidad y la elevada carga sanitaria que representa esta enfermedad, el CAV considera recomendable la vacunación frente a rotavirus de todos los lactantes. No obstante, como quiera que la infección por rotavirus no ocasiona mortalidad en nuestro medio, la inclusión de esta vacuna en los calendarios sistemáticos debe integrarse en el marco de las estrategias preventivas frente a otras enfermedades más graves, que requieren mayor prioridad de financiación pública.
Vacunas frente al VPHEl CAV se adhiere a las recomendaciones del Consejo Interterritorial del Sistema Nacional de Salud en referencia a la vacunación sistemática frente a VPH de todas las niñas de 11–14 años, como forma de prevención del cáncer cervical y de otras lesiones precancerosas del tracto genital en la mujer. Además, el CAV recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada comunidad autónoma para la vacunación sistemática.
El CAV reitera el adecuado perfil de seguridad de las 2 vacunas contra el papilomavirus actualmente disponibles. Los estudios de seguimiento, después de la utilización de estas vacunas a gran escala, han demostrado que los acontecimientos graves son extraordinariamente raros102. En EEUU, con más de 23 millones de dosis administradas, los efectos secundarios más frecuentes por cada 100.000 dosis han sido los siguientes: síncope vasovagal 8,2; reacciones locales 7,5; mareos 6,8; nauseas 5; cefalea 4,1; reacciones de hipersensibilidad 3,1; urticaria 2,6. La incidencia de síndrome de Guillain-Barré no ha sido superior a la de la población general, ni tampoco se han observado otras alteraciones neurológicas que puedan ser atribuidas a la vacunación. La incidencia de fenómenos tromboembólicos ha sido de 0,2/100.000 dosis, pero algunos de ellos podrían estar relacionados con la toma de anticonceptivos orales, ya que la población de las mujeres que se vacunan y la de las que toma anticonceptivos se solapan103. Incluso algunos efectos secundarios, como el síncope vasovagal, más que a la vacuna «per se», suele deberse al propio acto de la administración mediante inyección intramuscular. Este efecto secundario ha sido descrito en niños y adolescentes que reciben otras vacunas104 y en Australia ocurrió en 26 de 720 niñas de 12–17 años que recibieron la vacuna tetravalente de papilomavirus, como consecuencia de una respuesta psicógena en masa105. Un estudio reciente no ha encontrado una diferencia significativa en la incidencia de síncope, de efectos graves o de aparición de nuevas enfermedades entre las niñas que recibieron la vacuna tetravalente de papilomavirus y las que recibieron placebo106.
Otro dato importante del perfil de seguridad de una vacuna es conocer la consecuencia de la vacunación inadvertida en mujeres gestantes. Un estudio prospectivo realizado en Francia, Canadá y los Estados Unidos ha demostrado que la frecuencia de abortos espontáneos o malformaciones fetales no es mayor en mujeres vacunadas que en las no vacunadas107.
Por último, es importante recordar que algunas enfermedades autoinmunes tienden a aparecer con mayor frecuencia en edades en las que coincide la administración de la vacunación frente a VPH, por lo que puede atribuirse erróneamente una relación causal a lo que no es más que una mera asociación temporal108.
Vacunación antigripalGripe estacionalLa vacunación frente a la gripe estacional es una estrategia especialmente efectiva cuando se dirige a los grupos de población considerados de riesgo, que son los que incluyen individuos que por su condición o patología de base pueden presentar formas graves, complicaciones y mayor mortalidad cuando adquieren dicha enfermedad109,110. Muchos niños y adolescentes pertenecientes a estos grupos de riesgo no reciben, por distintas razones, dicha vacunación. El CAV considera que es prioritaria la implicación de todos los profesionales sanitarios para trasmitir a los padres y a los propios pacientes pertenecientes a los grupos de riesgo, la conveniencia de la vacunación anual frente a la gripe estacional. En relación con la infancia y a la adolescencia, el CAV recomienda la vacunación de110:
- 1.
Niños mayores de 6 meses y adolescentes pertenecientes a grupos de riesgos por presentar alguna de las siguientes patologías de base o condiciones:
- •
Enfermedad respiratoria crónica (incluyendo asma).
- •
Enfermedad cardiovascular crónica.
- •
Enfermedad metabólica crónica (diabetes…).
- •
Enfermedad renal o hepática crónica.
- •
Individuos con inmunodepresión o inmunodeficiencia (congénita o adquirida).
- •
Asplenia funcional o anatómica.
- •
Enfermedad neuromuscular crónica.
- •
Enfermedades hematológicas moderadas y graves.
- •
Niños y adolescentes (de 6 meses a 18 años) en tratamiento continuado con ácido acetilsalicílico.
- •
Síndrome de Down.
- •
- 2.
Niños mayores de 6 meses y adolescentes que sean contactos domiciliarios (convivientes) de pacientes (niños o adultos) pertenecientes a grupos de riesgo.
También deben vacunarse frente a la gripe estacional los adultos que sean contactos domiciliarios (convivientes o cuidadores) de niños, adolescentes y adultos que pertenecen a los grupos de riesgo. Es especialmente importante la vacunación del entorno familiar cuando existan lactantes menores de 6 meses de edad con factores de riesgo, ya que estos no pueden recibir la vacuna111.
Gripe pandémica H1N1 2009El CAV hace hincapié en la vacunación de las personas incluidas en los grupos de riesgo definidos por el Ministerio de Sanidad y Política Social112, así como en la seguridad de las nuevas vacunas contra este virus. Los CDC113 y la OMS114 avalan la seguridad de las nuevas vacunas, y diferentes registros en los EEUU115 y estudios en otros países116,117 han demostrado que su perfil de seguridad es similar al de las vacunas de la gripe estacional. Aunque los efectos secundarios parecen ser más frecuentes en las vacunas adyuvadas frente a la gripe pandémica que en las vacunas de gripe estacional, los efectos secundarios graves aparecen con la misma frecuencia en ambas vacunas. Incluso es posible que la mayor frecuencia de efectos secundarios con las vacunas de la gripe pandémica esté valorada al alza, ya que puede existir una mayor exigencia en la notificación. Es importante enfatizar que, tras la vacunación con las vacunas frente a la gripe pandémica, no se ha detectado un aumento de la frecuencia de síndrome de Guillain-Barré u otras enfermedades desmielinizantes115.
Dos de las vacunas frente a la gripe pandémica disponibles en nuestro medio llevan adyuvantes, una el MF59 y otra el AS03, que son emulsiones de aceite en agua a base de escualeno, con capacidad de favorecer la presentación del antígeno por parte de las células dendríticas y así potenciar su efecto inmunogénico118. Estos adyuvantes han sido utilizados en otras vacunas y en diferentes vacunas antigripales. En estas últimas inducen una respuesta inmunológica notablemente superior a las vacunas que no llevan adyuvante118–120. Las vacunas antigripales con adyuvantes provocan con mayor frecuencia efectos secundarios locales (dolor, induración y eritema) en el lugar de la inyección y también sistémicos (mialgias, cefalea, cansancio y malestar) que las vacunas sin adyuvantes121, pero no difieren en cuanto a la frecuencia de efectos graves, enfermedades desmielinizantes o enfermedades autoinmunes de nueva aparición120,121.
Estas evidencias sugieren que los adyuvantes utilizados en estas vacunas son seguros y parece probable que en el futuro sean cada vez más utilizados en las vacunas antigripales y en otras diferentes para potenciar su inmunogenicidad.
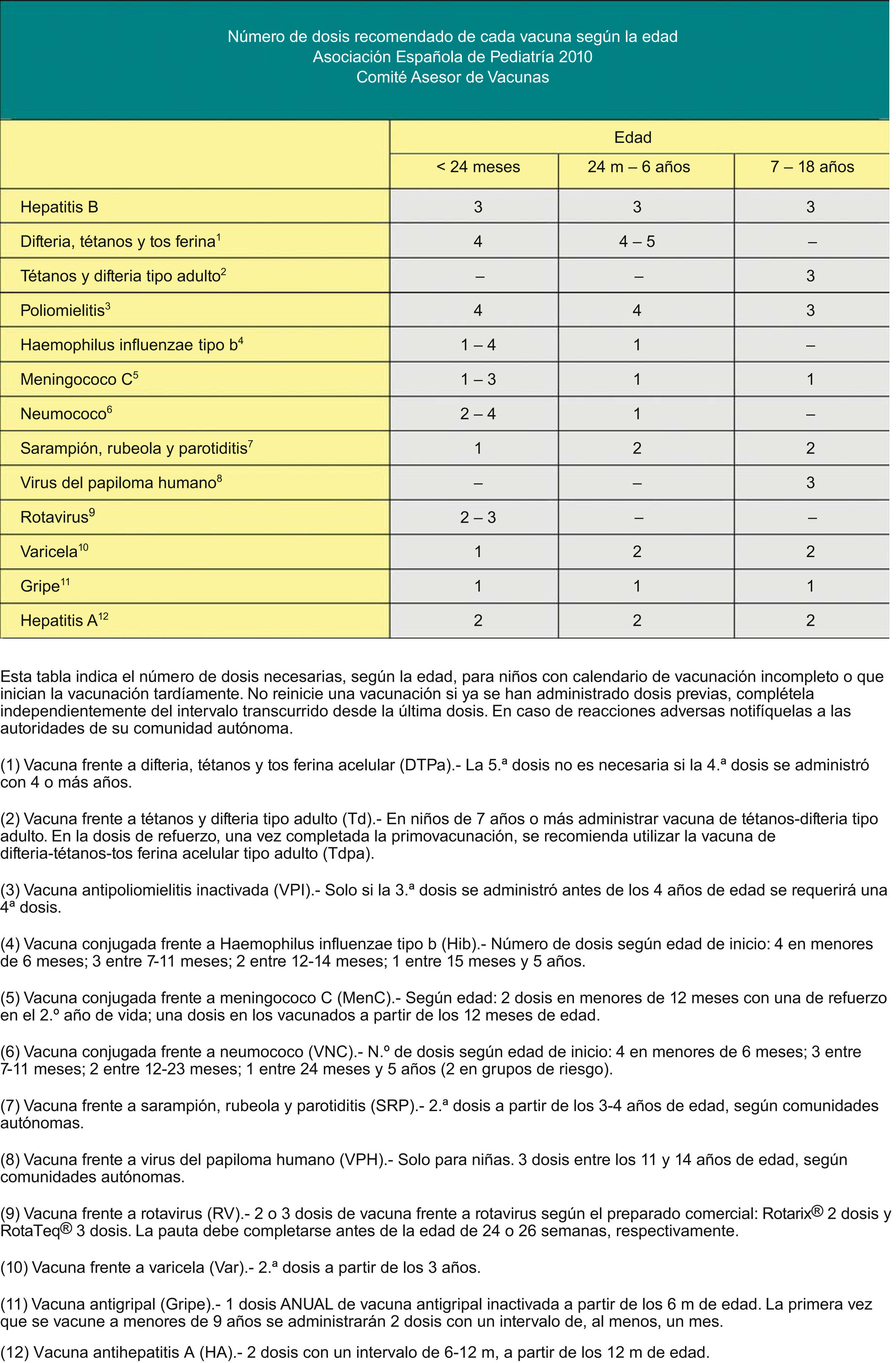
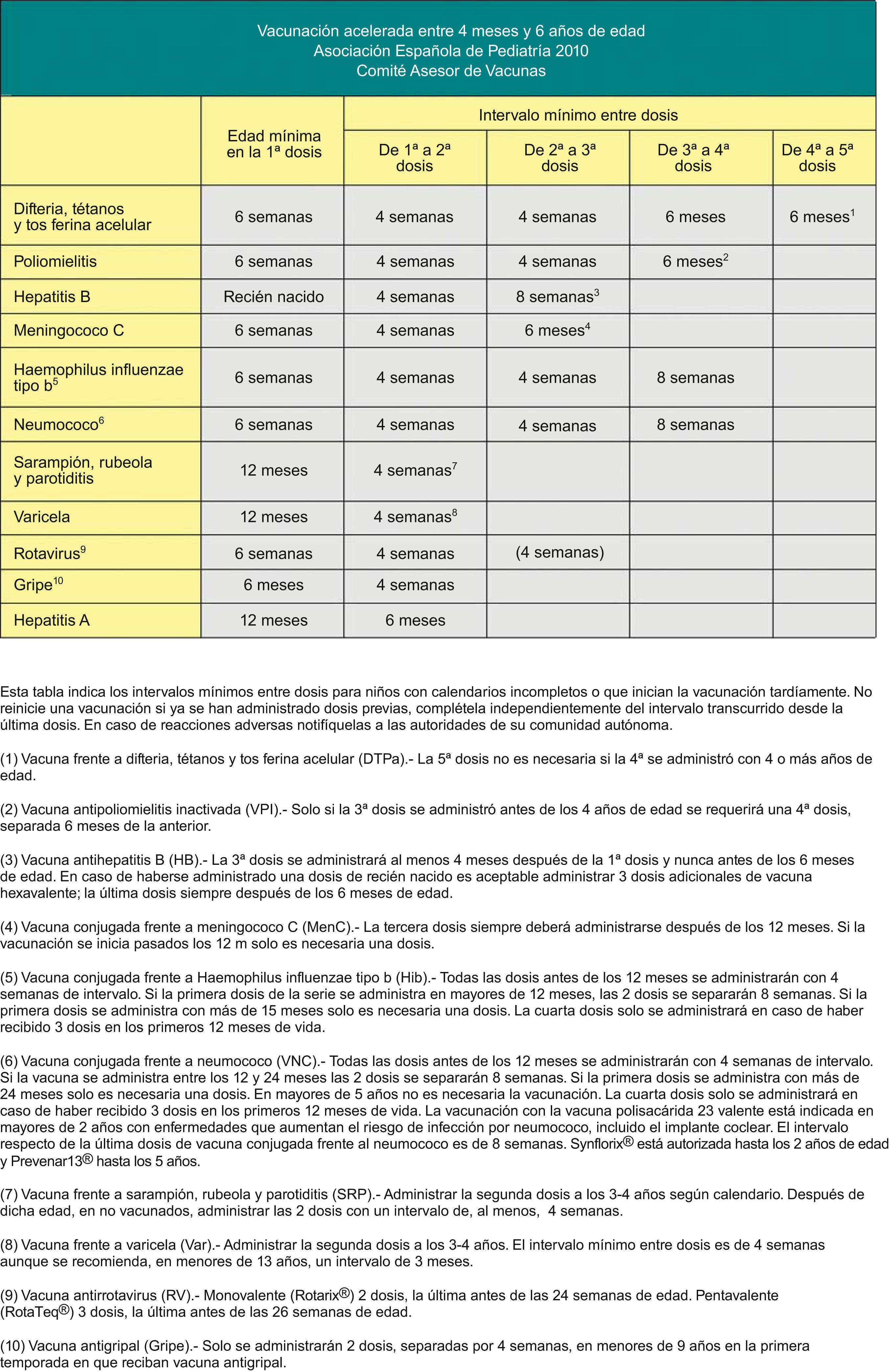
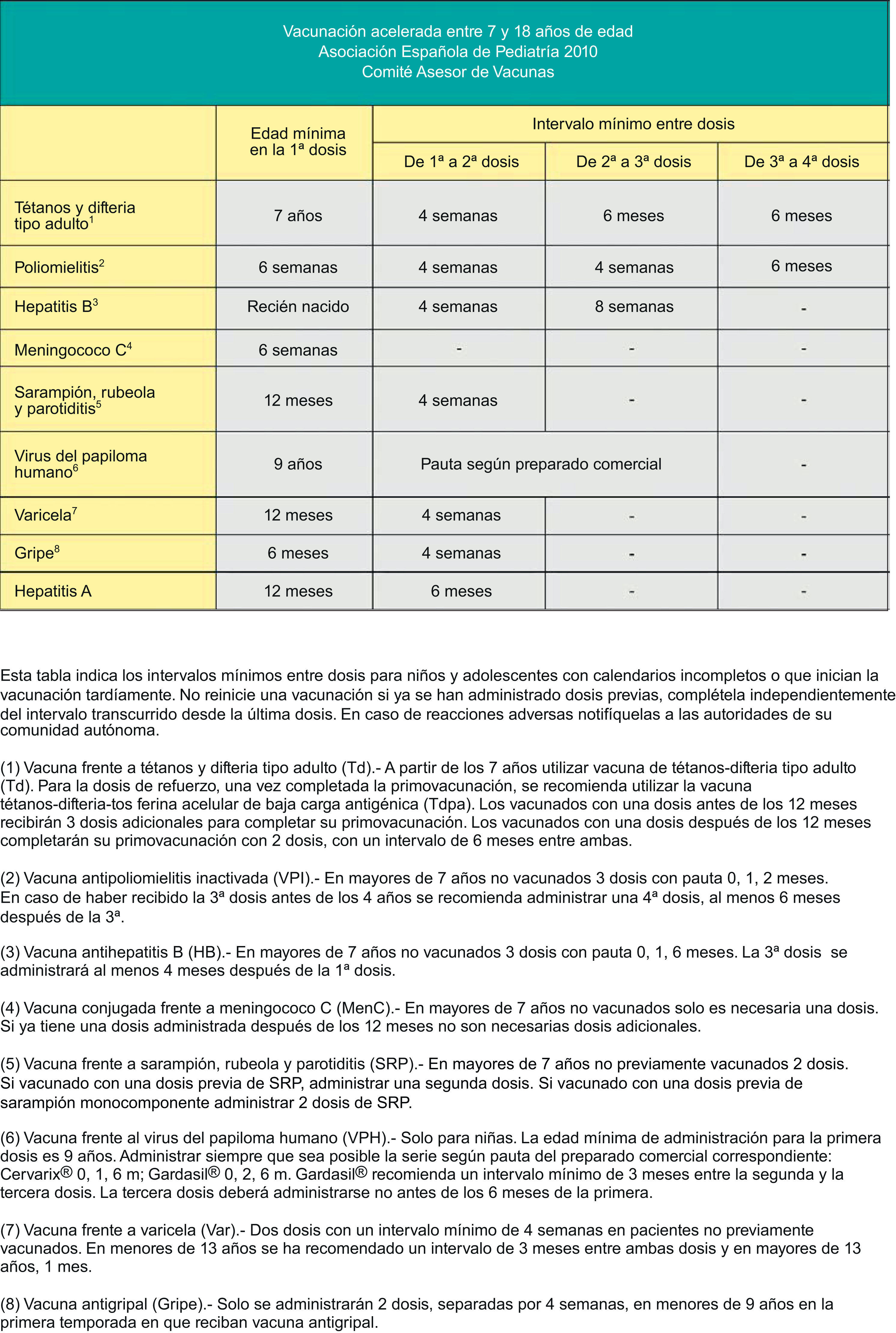
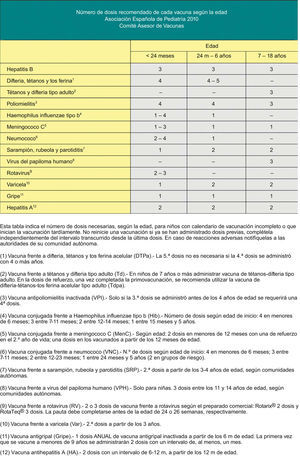
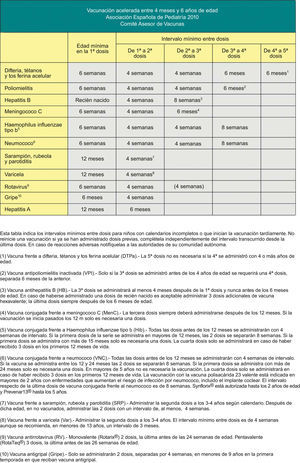
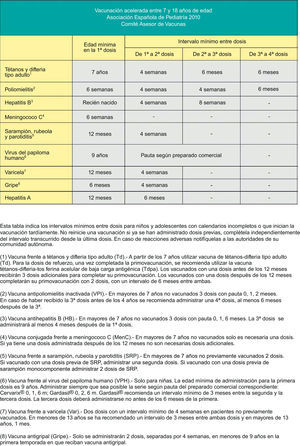
Calendario de vacunación acelerada para niños y adolescentes con vacunación incompleta.En muchas ocasiones es necesario vacunar a pacientes que no han recibido vacunas previamente o que no han seguido un calendario de vacunaciones de forma regular, lo han iniciado tardíamente, lo han interrumpido o han sido vacunados en sus países de origen con una pauta diferente a la indicada en España. En todos estos pacientes se debe realizar una adaptación al calendario de vacunación de nuestro país. Con esta finalidad se han elaborado unas tablas que contienen orientaciones para establecer una pauta de vacunación acelerada para niños y adolescentes con vacunación incompleta (figs. 2, 3 y 4).
El objetivo de estos calendarios acelerados es que sean un instrumento de ayuda para los pediatras en su práctica diaria. Se basan en recomendaciones de diversas sociedades científicas y de expertos122,123 y para interpretarlos deben tenerse en cuenta las siguientes premisas124,125:
- •
Edad del paciente y en función de ella, el número de dosis necesarias para estar correctamente vacunado (fig. 2). Las dosis administradas previamente, si las hubiese, deben considerarse válidas siempre que respeten la edad mínima y el intervalo entre las dosis. No se reiniciará una pauta de vacunación si el paciente ha recibido dosis previas válidas. Para actualizar el calendario se establecerán las dosis necesarias en función de la edad y se restarán las que ya hubiese recibido; el resultado serán las dosis necesarias para poner al día el calendario de vacunas.
- •
Se considerarán válidas las dosis que estén correctamente registradas o identificadas. En los casos en los que no hubiese ninguna prueba documentada de las vacunas administradas y por interrogatorio no se pudiese establecer fehacientemente que vacunas ha recibido un individuo, podrá optarse por administrar todas las vacunas adecuadas a la edad, como si se tratase de un paciente no vacunado.
- •
Debe respetarse el intervalo mínimo entre dosis para obtener una adecuada respuesta inmunológica y considerar la vacunación como válida. La aplicación de estos intervalos permite completar cuanto antes el calendario de vacunación (pauta acelerada) y alcanzar rápidamente un estado de inmunización adecuado. A partir de ese momento será preferible no utilizar los intervalos mínimos para continuar la vacunación, respetando los intervalos habituales recomendados.
- •
Se administrarán simultáneamente todas las vacunas posibles en lugares anatómicos distintos. Se utilizarán preferentemente vacunas combinadas (para disminuir el número de inyecciones). En caso de que, por distintos motivos, no se puedan administrar todas las vacunas simultáneamente (reticencia del paciente, sus padres o tutores, número elevado de dosis pendientes o no disponibilidad de algún preparado comercial) y se considere que el paciente volverá a la consulta por tener un domicilio estable, se administrarán primero las vacunas que inmunicen frente a la patología de mayor riesgo con relación a la edad del niño y a la epidemiología de su entorno y las que lo inmunicen frente a enfermedades para las que no hubiese recibido ninguna dosis previa de vacuna.
En las figuras 3 y 4 se muestran los intervalos mínimos y el número de dosis necesarias de las vacunas recomendadas por el CAV para niños entre 4 meses y 6 años y para niños y adolescentes entre los 7–18 años de edad, respectivamente. Es necesario, para una correcta comprensión de la tabla, leer el pie de tabla, ya que la información allí expresada aclara algunos aspectos que hacen referencia a situaciones específicas.
Los autores declaran no tener ningún conflicto de intereses.