Tras la finalización y análisis de resultados del estudio CIVIC, la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC) plantea la necesidad de revisar sus recomendaciones para la prevención del VRS en niños con cardiopatías congénitas. Para considerar tanto la valoración de las nuevas evidencias disponibles como la experiencia preventiva acumulada por los cardiólogos infantiles, se propone efectuar dicha actualización mediante un método estructurado de consenso profesional.
ObjetivosDesarrollar un consenso clínico español sobre la prevención de la infección por virus respiratorio sincitial, bajo el auspicio de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas.
MétodosConsenso Delphi modificado en 2 rondas. El estudio se efectuó en 4 fases: 1) constitución de un comité científico, impulsor del proyecto y responsable de la revisión bibliográfica y de la formulación de las recomendaciones a debate; 2) constitución de un panel experto multicéntrico con 75 representantes de la especialidad; 3) encuesta postal en 2 rondas con procesamiento intermedio de opiniones e informe a los panelistas, y 4) discusión de resultados en sesión presencial del comité científico.
ResultadosCincuenta y cinco expertos consultados completaron las 2 rondas de evaluación del cuestionario. En la primera ronda se lograron consensuar 44 de las 70 cuestiones analizadas. Tras la interacción del panel, se aumentó el consenso hasta un total de 54 ítems de la encuesta (el 77% de los contenidos propuestos). En las 16 cuestiones restantes no se consiguió un consenso suficientemente unánime, bien por disparidad de opiniones entre los profesionales, bien por falta de criterio establecido en la mayoría de los expertos.
ConclusionesSe presenta y actualiza una lista de recomendaciones profilácticas frente al virus respiratorio sincitial, cualificadas según el grado de acuerdo profesional en que se sustentan, que pueden considerarse vigentes hasta la aparición de nueva información científica que justifique su revisión.
Following the results of the CIVIC study, the SECPCC proposes to revise its recommendations for the prevention of RSV, taking into account the new evidence, as well as the preventive experience of paediatric cardiologists. For this purpose a structured method of professional consensus has been chosen.
ObjectivesTo develop a Spanish clinical consensus on preventing infection by RSV under the auspices of the Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas.
MethodsDelphi Consensus modified in two rounds. The study was conducted in four phases: 1) constitution of a Scientific Committee for bibliographic review and submission of the recommendations for discussion, 2) constitution of an Expert Panel with 75 representatives in the speciality, 3) postal survey organised in two rounds and intermediate processing of opinions, and issuing of a report to the panellists, and 4) discussion of the results in a face-to-face meeting of the Scientific Committee.
ResultsConsensus was reached on 54 of the 70 preventive recommendations analysed. With respect to the 16 remaining issues, no consensus was reached, due to differences in professional opinion and the absence of established criteria among the majority of the experts.
ConclusionsA set of recommendations for RSV prophylaxis in cardiology was developed and updated, rated in accordance with the degree of professional consensus on which they were based. These can be considered valid until such time as new scientific information emerges that warrants a further review.
Las infecciones respiratorias infantiles graves por el virus respiratorio sincitial (VRS) son una importante causa de morbimortalidad evitable para la población pediátrica afectada por cardiopatías congénitas. Frente a estas infecciones, está bien establecida la utilidad profiláctica de ciertas medidas higiénicas básicas, dirigidas a limitar la exposición y transmisión del virus entre la población en riesgo, y la efectividad de la inmunoprofilaxis intramuscular con anticuerpos monoclonales humanizados (palivizumab) en períodos epidémicos para prevenir la infección aguda en niños de alto riesgo y disminuir el porcentaje de hospitalizaciones e ingresos en UCI.
En el ámbito específico de la Cardiología Pediátrica hay varias fuentes internacionales de recomendaciones preventivas anti-VRS, básicamente concordantes en sus aspectos principales, entre las que se encuentran las de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC). Tras la reciente finalización del estudio epidemiológico de inCidencia de Infecciones de Vías respiratorias que causan Ingreso hospitalario en pacientes con Cardiopatía congénita (CIVIC), de especial valor clinicoepidemiológico local, la SECPCC plantea la actualización de sus recomendaciones y toma en consideración tanto las últimas evidencias disponibles como el criterio profesional de los cardiólogos expertos en este ámbito clínico, a fin de reducir la posible variabilidad de práctica clínica en nuestro país.
Con el presente estudio se pretende, por tanto, desarrollar un nuevo consenso cardiológico multicéntrico sobre las recomendaciones preventivas para la infección por VRS y el uso clínico del palivizumab en España. Para eso, bajo el impulso y supervisión institucional de la SECPCC, se ha sometido a la valoración de un grupo multicéntrico de cardiólogos pediátricos expertos una amplia serie de cuestiones (criterios profesionales y recomendaciones clínicas), objeto de distinto grado de debate profesional.
Las conclusiones del presente estudio complementan al consenso multiprofesional sobre la prevención de las infecciones respiratorias graves por VRS1 desarrollado en fecha reciente entre la Sociedad Española de Neonatología, la Sociedad Española de Neumología Pediátrica, la SECPCC y la Sociedad Española de Hematología y Oncología Pediátrica, y analizan de forma específica ciertos aspectos de interés clave sobre el problema en el ámbito de la Cardiología Pediátrica.
Los expertos participantes en este proyecto han valorado, contrastado y consensuado sus opiniones profesionales respecto a una amplia serie de consideraciones clinicoepidemiológicas y de recomendaciones preventivas sobre la infección por VRS, sometidas a determinado nivel de controversia profesional. Durante este proceso se les ha pedido tomar en consideración tanto las evidencias científicas conocidas, como su propia experiencia personal en el tratamiento clinicoepidemiológico de estos pacientes, en los diversos aspectos considerados relevantes por cada experto (percepción del impacto sociosanitario de la enfermedad, viabilidad práctica de las recomendaciones en la población habitualmente atendida, riesgo iatrogénico asumido, percepción de prioridad para cada recomendación, en términos de beneficio-riesgo, efectividad en reducción del uso de los servicios sanitarios y de los costes indirectos para el paciente y su familia, etc.).
En el desarrollo del estudio se ha empleado el método Delphi modificado2, una técnica estructurada de consenso profesional, variante del procedimiento original desarrollado por Dalkey et al en Rand Corporation3,4, que mantiene sus principales ventajas frente a otras alternativas técnicas (como las conferencias de consenso, los grupos nominales o las reuniones no estructuradas) y resuelve algunos de sus principales inconvenientes5.
La técnica permite conocer y aproximar la opinión de grupos muy heterogéneos sobre una cuestión de interés, y preserva el anonimato de los panelistas, a quienes se garantiza disponer de un tiempo suficiente para la reflexión individual y de un mecanismo controlado de interacción con otros participantes, que minimiza el posible sesgo de influencia. Para participar no se requieren especiales capacidades de escritura, de oratoria, ni de convicción. Por otra parte, se evita la necesidad de desplazamientos y no precisan de excesivos recursos estructurales. A diferencia del procedimiento original, los canales de comunicación electrónica acortan muy significativamente el tiempo de trabajo de campo de estos proyectos.
Por el contrario, algunos inconvenientes del método Delphi modificado son el tiempo preparatorio requerido para elaborar el cuestionario estructurado que se someterá a debate, la limitada oportunidad de realizar aclaraciones a las ideas y la necesidad de que los participantes tengan un alto interés (para lograr las más altas tasas de respuesta posibles). Por otra parte, el método no es inmune a la posibilidad de influencia del coordinador (en la elección del panel de expertos y en la discusión de los resultados). Para controlar estos riesgos, un equipo investigador multicéntrico de distinta procedencia e intereses ha planificado y codirigido el presente trabajo; este equipo ha seguido procedimientos sistematizados y objetivables de selección de panelistas6 y de análisis estadístico e interpretación de resultados7,8.
Material y métodosDiseñoEl método Delphi modificado solicita la opinión individual y anónima de cada experto sobre el tema a debate mediante la respuesta a una encuesta estructurada escrita vehiculada por correo. La repetición individual de una segunda ronda de encuesta sobre las cuestiones no consensuadas en el primer intento, previa información a los participantes de los resultados obtenidos por el grupo en el primer cuestionario (y de sus posibles comentarios libres), permite la reconsideración y aproximación de posturas divergentes, con lo que se logra el máximo consenso posible en el grupo. El grado de dispersión en las respuestas se analiza estadísticamente para determinar en qué cuestiones se ha logrado el consenso del panel experto, bien sea en el acuerdo o bien en el desacuerdo con los temas propuestos en la encuesta.
El estudio se efectuó en 4 fases: 1) constitución de un comité científico del proyecto, responsable de la revisión bibliográfica y de la formulación de los ítems de encuesta (criterios profesionales y recomendaciones clínicas sometidas a debate); 2) constitución de un panel experto con especialistas en Cardiología implicados con especial interés y experiencia en la prevención de infecciones por VRS; 3) encuesta postal en 2 rondas con procesamiento intermedio de opiniones e informe a los panelistas, y 4) recopilación, análisis de resultados y discusión de conclusiones en sesión presencial del comité científico.
Elaboración de cuestionarioEl comité científico cardiológico impulsor del proyecto, con la colaboración de un asesor metodológico independiente, trabajó en la elaboración del cuestionario a partir de la libre propuesta inicial de un número indeterminado de ítems de encuesta por cada uno de sus miembros. Cada ítem es una aseveración (afirmativa o negativa) que recoge un criterio profesional o una recomendación clínica sobre la profilaxis de la infección VRS en el ámbito cardiológico, en cualquier aspecto de interés o controversia (repercusión clínica del problema, eficacia de las medidas higiénicas, indicaciones de palivizumab, recomendaciones de uso, etc.).
Para desarrollar esta tarea se encargó a cada experto del comité la reevaluación y actualización independiente de un apartado específico del documento preexistente de recomendaciones preventivas anti-VRS de la SECPCC, y la aportación expresa de la bibliografía considerada para formular sus criterios personales.
Cada miembro efectuó para eso una revisión sistemática normalizada9 de la literatura médica en su apartado temático, en la base de datos electrónica Medline y actualizada a fecha de abril de 2008, así como una revisión manual de las referencias bibliográficas de los artículos obtenidos para localizar otros que pudieran resultar de interés. Se facilitó asesoría técnica en este proceso a quienes lo requirieron. No hubo restricciones de idioma, aunque se excluyeron los artículos que no tenían disponible el resumen en Medline.
Para evaluar y categorizar la calidad de las pruebas científicas recopiladas se indicó al Comité el empleo común de las recomendaciones del Centre for Evidence-Based Medicine de Oxford10. Se considera nivel 1 cuando las pruebas científicas proceden de múltiples ensayos clínicos aleatorizados. En el nivel 2 las pruebas científicas proceden de estudios de cohortes, investigación de resultados o ensayos clínicos controlados de baja calidad. Finalmente, en el nivel 3 las pruebas proceden de estudios de casos y controles.
El listado preliminar de ítems recibidos de cada miembro del Comité se sometió a un proceso de revisión y agrupación temática por parte de 2 consultores externos. Obtenido un primer borrador del cuestionario, se hizo circular en repetidas ocasiones a través de correo electrónico entre los miembros del Comité, hasta lograr una versión definitiva unánimemente satisfactoria. De forma simultánea, se recopiló la colección de separatas de los originales bibliográficos referenciados por los expertos, que se recogen entre las citas bibliográficas del estudio en orden alfabético (ya que en su mayor parte incluían información útil para varios de los diferentes apartados del consenso: epidemiología, medidas higiénicas, indicaciones de palivizumab y otras recomendaciones, lo que dificultó su ordenación temática), para ponerlos a disposición de los panelistas al recabar su participación en el consenso11–57.
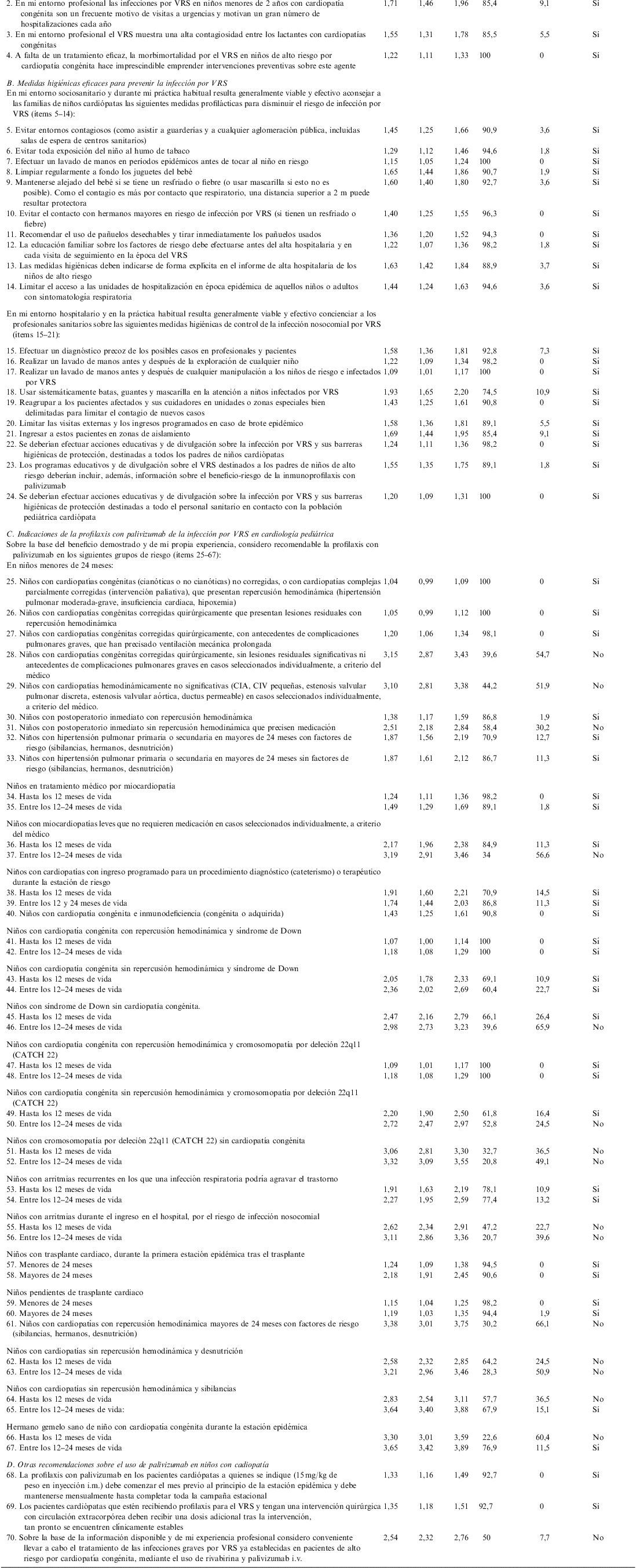
La versión final del cuestionario incluyó 70 ítems (tabla 1), agrupados en las siguientes áreas temáticas: epidemiología y repercusión de las infecciones infantiles por VRS en cardiología pediátrica (4 ítems), medidas higiénicas eficaces para prevenir la infección por VRS (20 ítems), indicaciones de la profilaxis con palivizumab de la infección por VRS en Cardiología Pediátrica (43 ítems), otras recomendaciones sobre el uso de palivizumab en niños con cardiopatía (3 ítems).
| Media | LI-IC | LS-IC | Porcentaje de panelistas a favor | Porcentaje de panelistas en contra | Consenso | |
| A. Epidemiología y repercusión de las infecciones infantiles por VRS en Cardiología Pediátrica | ||||||
| 1. En mi entorno profesional el VRS es una causa principal de infecciones de la vía aérea inferior (especialmente bronquiolitis y neumonía) durante el período epidémico, en los niños menores de 2 años afectados de cardiopatías congénitas | 1,36 | 1,17 | 1,55 | 94,5 | 3,6 | Sí |
| 2. En mi entorno profesional las infecciones por VRS en niños menores de 2 años con cardiopatía congénita son un frecuente motivo de visitas a urgencias y motivan un gran número de hospitalizaciones cada año | 1,71 | 1,46 | 1,96 | 85,4 | 9,1 | Sí |
| 3. En mi entorno profesional el VRS muestra una alta contagiosidad entre los lactantes con cardiopatías congénitas | 1,55 | 1,31 | 1,78 | 85,5 | 5,5 | Sí |
| 4. A falta de un tratamiento eficaz, la morbimortalidad por el VRS en niños de alto riesgo por cardiopatía congénita hace imprescindible emprender intervenciones preventivas sobre este agente | 1,22 | 1,11 | 1,33 | 100 | 0 | Sí |
| B. Medidas higiénicas eficaces para prevenir la infección por VRS | ||||||
| En mi entorno sociosanitario y durante mi práctica habitual resulta generalmente viable y efectivo aconsejar a las familias de niños cardiópatas las siguientes medidas profilácticas para disminuir el riesgo de infección por VRS (ítems 5–14): | ||||||
| 5. Evitar entornos contagiosos (como asistir a guarderías y a cualquier aglomeración pública, incluidas salas de espera de centros sanitarios) | 1,45 | 1,25 | 1,66 | 90,9 | 3,6 | Sí |
| 6. Evitar toda exposición del niño al humo de tabaco | 1,29 | 1,12 | 1,46 | 94,6 | 1,8 | Sí |
| 7. Efectuar un lavado de manos en períodos epidémicos antes de tocar al niño en riesgo | 1,15 | 1,05 | 1,24 | 100 | 0 | Sí |
| 8. Limpiar regularmente a fondo los juguetes del bebé | 1,65 | 1,44 | 1,86 | 90,7 | 1,9 | Sí |
| 9. Mantenerse alejado del bebé si se tiene un resfriado o fiebre (o usar mascarilla si esto no es posible). Como el contagio es más por contacto que respiratorio, una distancia superior a 2 m puede resultar protectora | 1,60 | 1,40 | 1,80 | 92,7 | 3,6 | Sí |
| 10. Evitar el contacto con hermanos mayores en riesgo de infección por VRS (si tienen un resfriado o fiebre) | 1,40 | 1,25 | 1,55 | 96,3 | 0 | Sí |
| 11. Recomendar el uso de pañuelos desechables y tirar inmediatamente los pañuelos usados | 1,36 | 1,20 | 1,52 | 94,3 | 0 | Sí |
| 12. La educación familiar sobre los factores de riesgo debe efectuarse antes del alta hospitalaria y en cada visita de seguimiento en la época del VRS | 1,22 | 1,07 | 1,36 | 98,2 | 1,8 | Sí |
| 13. Las medidas higiénicas deben indicarse de forma explícita en el informe de alta hospitalaria de los niños de alto riesgo | 1,63 | 1,42 | 1,84 | 88,9 | 3,7 | Sí |
| 14. Limitar el acceso a las unidades de hospitalización en época epidémica de aquellos niños o adultos con sintomatología respiratoria | 1,44 | 1,24 | 1,63 | 94,6 | 3,6 | Sí |
| En mi entorno hospitalario y en la práctica habitual resulta generalmente viable y efectivo concienciar a los profesionales sanitarios sobre las siguientes medidas higiénicas de control de la infección nosocomial por VRS (ítems 15–21): | ||||||
| 15. Efectuar un diagnóstico precoz de los posibles casos en profesionales y pacientes | 1,58 | 1,36 | 1,81 | 92,8 | 7,3 | Sí |
| 16. Realizar un lavado de manos antes y después de la exploración de cualquier niño | 1,22 | 1,09 | 1,34 | 98,2 | 0 | Sí |
| 17. Realizar un lavado de manos antes y después de cualquier manipulación a los niños de riesgo e infectados por VRS | 1,09 | 1,01 | 1,17 | 100 | 0 | Sí |
| 18. Usar sistemáticamente batas, guantes y mascarilla en la atención a niños infectados por VRS | 1,93 | 1,65 | 2,20 | 74,5 | 10,9 | Sí |
| 19. Reagrupar a los pacientes afectados y sus cuidadores en unidades o zonas especiales bien delimitadas para limitar el contagio de nuevos casos | 1,43 | 1,25 | 1,61 | 90,8 | 0 | Sí |
| 20. Limitar las visitas externas y los ingresos programados en caso de brote epidémico | 1,58 | 1,36 | 1,81 | 89,1 | 5,5 | Sí |
| 21. Ingresar a estos pacientes en zonas de aislamiento | 1,69 | 1,44 | 1,95 | 85,4 | 9,1 | Sí |
| 22. Se deberían efectuar acciones educativas y de divulgación sobre la infección por VRS y sus barreras higiénicas de protección, destinadas a todos los padres de niños cardiópatas | 1,24 | 1,11 | 1,36 | 98,2 | 0 | Sí |
| 23. Los programas educativos y de divulgación sobre el VRS destinados a los padres de niños de alto riesgo deberían incluir, además, información sobre el beneficio-riesgo de la inmunoprofilaxis con palivizumab | 1,55 | 1,35 | 1,75 | 89,1 | 1,8 | Sí |
| 24. Se deberían efectuar acciones educativas y de divulgación sobre la infección por VRS y sus barreras higiénicas de protección destinadas a todo el personal sanitario en contacto con la población pediátrica cardiópata | 1,20 | 1,09 | 1,31 | 100 | 0 | Sí |
| C. Indicaciones de la profilaxis con palivizumab de la infección por VRS en cardiología pediátrica | ||||||
| Sobre la base del beneficio demostrado y de mi propia experiencia, considero recomendable la profilaxis con palivizumab en los siguientes grupos de riesgo (ítems 25–67): | ||||||
| En niños menores de 24 meses: | ||||||
| 25. Niños con cardiopatías congénitas (cianóticas o no cianóticas) no corregidas, o con cardiopatías complejas parcialmente corregidas (intervención paliativa), que presentan repercusión hemodinámica (hipertensión pulmonar moderada-grave, insuficiencia cardiaca, hipoxemia) | 1,04 | 0,99 | 1,09 | 100 | 0 | Sí |
| 26. Niños con cardiopatías congénitas corregidas quirúrgicamente que presentan lesiones residuales con repercusión hemodinámica | 1,05 | 0,99 | 1,12 | 100 | 0 | Sí |
| 27. Niños con cardiopatías congénitas corregidas quirúrgicamente, con antecedentes de complicaciones pulmonares graves, que han precisado ventilación mecánica prolongada | 1,20 | 1,06 | 1,34 | 98,1 | 0 | Sí |
| 28. Niños con cardiopatías congénitas corregidas quirúrgicamente, sin lesiones residuales significativas ni antecedentes de complicaciones pulmonares graves en casos seleccionados individualmente, a criterio del médico | 3,15 | 2,87 | 3,43 | 39,6 | 54,7 | No |
| 29. Niños con cardiopatías hemodinámicamente no significativas (CIA, CIV pequeñas, estenosis valvular pulmonar discreta, estenosis valvular aórtica, ductus permeable) en casos seleccionados individualmente, a criterio del médico. | 3,10 | 2,81 | 3,38 | 44,2 | 51,9 | No |
| 30. Niños con postoperatorio inmediato con repercusión hemodinámica | 1,38 | 1,17 | 1,59 | 86,8 | 1,9 | Sí |
| 31. Niños con postoperatorio inmediato sin repercusión hemodinámica que precisen medicación | 2,51 | 2,18 | 2,84 | 58,4 | 30,2 | No |
| 32. Niños con hipertensión pulmonar primaria o secundaria en mayores de 24 meses con factores de riesgo (sibilancias, hermanos, desnutrición) | 1,87 | 1,56 | 2,19 | 70,9 | 12,7 | Sí |
| 33. Niños con hipertensión pulmonar primaria o secundaria en mayores de 24 meses sin factores de riesgo (sibilancias, hermanos, desnutrición) | 1,87 | 1,61 | 2,12 | 86,7 | 11,3 | Sí |
| Niños en tratamiento médico por miocardiopatía | ||||||
| 34. Hasta los 12 meses de vida | 1,24 | 1,11 | 1,36 | 98,2 | 0 | Sí |
| 35. Entre los 12–24 meses de vida | 1,49 | 1,29 | 1,69 | 89,1 | 1,8 | Sí |
| Niños con miocardiopatías leves que no requieren medicación en casos seleccionados individualmente, a criterio del médico | ||||||
| 36. Hasta los 12 meses de vida | 2,17 | 1,96 | 2,38 | 84,9 | 11,3 | Sí |
| 37. Entre los 12–24 meses de vida | 3,19 | 2,91 | 3,46 | 34 | 56,6 | No |
| Niños con cardiopatías con ingreso programado para un procedimiento diagnóstico (cateterismo) o terapéutico durante la estación de riesgo | ||||||
| 38. Hasta los 12 meses de vida | 1,91 | 1,60 | 2,21 | 70,9 | 14,5 | Sí |
| 39. Entre los 12 y 24 meses de vida | 1,74 | 1,44 | 2,03 | 86,8 | 11,3 | Sí |
| 40. Niños con cardiopatía congénita e inmunodeficiencia (congénita o adquirida) | 1,43 | 1,25 | 1,61 | 90,8 | 0 | Sí |
| Niños con cardiopatía congénita con repercusión hemodinámica y síndrome de Down | ||||||
| 41. Hasta los 12 meses de vida | 1,07 | 1,00 | 1,14 | 100 | 0 | Sí |
| 42. Entre los 12–24 meses de vida | 1,18 | 1,08 | 1,29 | 100 | 0 | Sí |
| Niños con cardiopatía congénita sin repercusión hemodinámica y síndrome de Down | ||||||
| 43. Hasta los 12 meses de vida | 2,05 | 1,78 | 2,33 | 69,1 | 10,9 | Sí |
| 44. Entre los 12–24 meses de vida | 2,36 | 2,02 | 2,69 | 60,4 | 22,7 | Sí |
| Niños con síndrome de Down sin cardiopatía congénita. | ||||||
| 45. Hasta los 12 meses de vida | 2,47 | 2,16 | 2,79 | 66,1 | 26,4 | Sí |
| 46. Entre los 12–24 meses de vida | 2,98 | 2,73 | 3,23 | 39,6 | 65,9 | No |
| Niños con cardiopatía congénita con repercusión hemodinámica y cromosomopatía por deleción 22q11 (CATCH 22) | ||||||
| 47. Hasta los 12 meses de vida | 1,09 | 1,01 | 1,17 | 100 | 0 | Sí |
| 48. Entre los 12–24 meses de vida | 1,18 | 1,08 | 1,29 | 100 | 0 | Sí |
| Niños con cardiopatía congénita sin repercusión hemodinámica y cromosomopatía por deleción 22q11 (CATCH 22) | ||||||
| 49. Hasta los 12 meses de vida | 2,20 | 1,90 | 2,50 | 61,8 | 16,4 | Sí |
| 50. Entre los 12–24 meses de vida | 2,72 | 2,47 | 2,97 | 52,8 | 24,5 | No |
| Niños con cromosomopatía por deleción 22q11 (CATCH 22) sin cardiopatía congénita | ||||||
| 51. Hasta los 12 meses de vida | 3,06 | 2,81 | 3,30 | 32,7 | 36,5 | No |
| 52. Entre los 12–24 meses de vida | 3,32 | 3,09 | 3,55 | 20,8 | 49,1 | No |
| Niños con arritmias recurrentes en los que una infección respiratoria podría agravar el trastorno | ||||||
| 53. Hasta los 12 meses de vida | 1,91 | 1,63 | 2,19 | 78,1 | 10,9 | Sí |
| 54. Entre los 12–24 meses de vida | 2,27 | 1,95 | 2,59 | 77,4 | 13,2 | Sí |
| Niños con arritmias durante el ingreso en el hospital, por el riesgo de infección nosocomial | ||||||
| 55. Hasta los 12 meses de vida | 2,62 | 2,34 | 2,91 | 47,2 | 22,7 | No |
| 56. Entre los 12–24 meses de vida | 3,11 | 2,86 | 3,36 | 20,7 | 39,6 | No |
| Niños con trasplante cardiaco, durante la primera estación epidémica tras el trasplante | ||||||
| 57. Menores de 24 meses | 1,24 | 1,09 | 1,38 | 94,5 | 0 | Sí |
| 58. Mayores de 24 meses | 2,18 | 1,91 | 2,45 | 90,6 | 0 | Sí |
| Niños pendientes de trasplante cardiaco | ||||||
| 59. Menores de 24 meses | 1,15 | 1,04 | 1,25 | 98,2 | 0 | Sí |
| 60. Mayores de 24 meses | 1,19 | 1,03 | 1,35 | 94,4 | 1,9 | Sí |
| 61. Niños con cardiopatías con repercusión hemodinámica mayores de 24 meses con factores de riesgo (sibilancias, hermanos, desnutrición) | 3,38 | 3,01 | 3,75 | 30,2 | 66,1 | No |
| Niños con cardiopatías sin repercusión hemodinámica y desnutrición | ||||||
| 62. Hasta los 12 meses de vida | 2,58 | 2,32 | 2,85 | 64,2 | 24,5 | No |
| 63. Entre los 12–24 meses de vida | 3,21 | 2,96 | 3,46 | 28,3 | 50,9 | No |
| Niños con cardiopatías sin repercusión hemodinámica y sibilancias | ||||||
| 64. Hasta los 12 meses de vida | 2,83 | 2,54 | 3,11 | 57,7 | 36,5 | No |
| 65. Entre los 12–24 meses de vida: | 3,64 | 3,40 | 3,88 | 67,9 | 15,1 | Sí |
| Hermano gemelo sano de niño con cardiopatía congénita durante la estación epidémica | ||||||
| 66. Hasta los 12 meses de vida | 3,30 | 3,01 | 3,59 | 22,6 | 60,4 | No |
| 67. Entre los 12–24 meses de vida | 3,65 | 3,42 | 3,89 | 76,9 | 11,5 | Sí |
| D. Otras recomendaciones sobre el uso de palivizumab en niños con cadiopatía | ||||||
| 68. La profilaxis con palivizumab en los pacientes cardiópatas a quienes se indique (15mg/kg de peso en inyección i.m.) debe comenzar el mes previo al principio de la estación epidémica y debe mantenerse mensualmente hasta completar toda la campaña estacional | 1,33 | 1,16 | 1,49 | 92,7 | 0 | Sí |
| 69. Los pacientes cardiópatas que estén recibiendo profilaxis para el VRS y tengan una intervención quirúrgica con circulación extracorpórea deben recibir una dosis adicional tras la intervención, tan pronto se encuentren clínicamente estables | 1,35 | 1,18 | 1,51 | 92,7 | 0 | Sí |
| 70. Sobre la base de la información disponible y de mi experiencia profesional considero conveniente llevar a cabo el tratamiento de las infecciones graves por VRS ya establecidas en pacientes de alto riesgo por cardiopatía congénita, mediante el uso de rivabirina y palivizumab i.v. | 2,54 | 2,32 | 2,76 | 50 | 7,7 | No |
CIA: comunicación interauricular; CIV: comunicación interventricular; LI-IC: límite inferior del intervalo de confianza del 95% del promedio; LS-IC: límite superior del intervalo de confianza del 95% del promedio; VRS: virus respiratorio sincitial.
Ítems no consensuados: 28,29,31,37,46,50,51,52,55,56,61,62,63,64,66 y 70.
Se propuso un solo tipo de escala valorativa para todas las cuestiones, ordinal de tipo Likert con 5 categorías de respuesta detalladas mediante un cuantificador lingüístico y un descriptor numérico para cada opción: 1=total acuerdo con el ítem, 2=más bien de acuerdo, 3=ni de acuerdo ni en desacuerdo (no tengo un criterio definido), 4=más bien en desacuerdo, 5=total desacuerdo con el ítem. En cada cuestión se ofreció la posibilidad de añadir observaciones libres a los panelistas y un apartado final para recoger, si lo deseaban, nuevas propuestas de ítems. Si las cuestiones no se contestaban por considerarse el panelista no cualificado en la materia, se analizaron como casos perdidos a efectos estadísticos.
Selección del panel expertoEl Comité Científico seleccionó a los expertos para formar parte del panel, en representación del colectivo profesional de la cardiología pediátrica con especial interés y reconocido criterio en el ámbito de la infección por VRS. Para su identificación se empleó una estrategia en «bola de nieve» a partir de los contactos personales de los miembros del Comité, quienes propusieron, a su vez, nuevos candidatos de su entorno profesional, de reconocido prestigio en este ámbito6. Tras este proceso, finalmente se invitó mediante carta y aceptaron participar 75 profesionales procedentes de todas las comunidades autónomas.
El trabajo de campo del proyecto se desarrolló durante 6 semanas, en los meses de julio y septiembre del año 2008, y se empleó el correo electrónico como vía de distribución y recogida de formularios.
Análisis e interpretación de resultadosSe analizaron las respuestas de la primera ronda del cuestionario mediante el cálculo de los valores promedio de puntuaciones de cada ítem y su correspondiente intervalo de confianza (IC) del 95%. Se consideraron consensuados por el panel los ítems en los que el límite superior del IC del 95% resultó inferior a 3 (acuerdo del panel con la afirmación) y en los que el límite inferior del IC del 95% resultó superior a 3 (desacuerdo con la afirmación). Los ítems restantes en los que el IC del 95% incluyó el valor 3 se seleccionaron para proponerse a reconsideración del panel en la segunda ronda Delphi.
Se informó a los panelistas de los resultados preliminares y de la distribución de respuestas en la primera ronda de cada ítem no consensuado mediante los correspondientes gráficos de barras (con el porcentaje de respondedores a cada categoría de respuesta). Asimismo, se distribuyeron los comentarios libres y aclaraciones aportados por los panelistas de forma anónima.
Tras la segunda ronda de encuesta se aplicaron idénticos criterios para discriminar los ítems definitivamente consensuados de aquéllos en los que no fue posible lograr consenso del panel. A efectos comparativos, cuanto más extremo resulte el promedio de puntuaciones de un ítem (más próximo a 1 o a 5), más manifiesto se considera el consenso logrado, bien en el acuerdo o en el desacuerdo, respectivamente, sobre la propuesta expresada. Cuanto más estrecho resulte el IC, mayor unanimidad existe en las opiniones del grupo. Los ítems en los que no se logró un consenso tras completar el proceso descrito se analizaron descriptivamente para distinguir aquéllos en los que existían opiniones marcadamente diferentes entre los panelistas de aquéllos en los que una mayoría del grupo expresó no tener un criterio definitivo al respecto (voto=3).
Aunque esta metodología de análisis está ampliamente difundida en estudios previos2,8, se verificó el consenso resultante bajo otros criterios estadísticos alternativos más exigentes empleados por otros autores en estudios con similares escalas de evaluación58–60, a saber: coeficiente de variación menor de 0,3; promedio de las puntuaciones inferior a 2,5 o superior a 3,5; suma de los porcentajes de los valores extremos (1+2 o 4+5) superior al 70% de la respuestas (respectivamente para el acuerdo y el desacuerdo), y mediana distinta al punto central (3).
ResultadosDe los 75 expertos consultados, 55 completaron las 2 rondas de evaluación y no propusieron nuevos ítems. En la primera ronda se consensuaron 44 de las 70 cuestiones analizadas según los criterios de evaluación preestablecidos (todos ellos en términos de acuerdo grupal con las cuestiones planteadas). De los 26 ítems restantes propuestos a la reconsideración de los expertos en la segunda ronda se lograron consensuar 10 más (8 de ellos en acuerdo grupal con el ítem planteado y 2 en términos de desacuerdo grupal unánime con el ítem planteado).
Globalmente considerado, el panel logró un consenso suficiente en el 77% de los contenidos propuestos. En 16 ítems (el 23% del cuestionario) no se consiguió suficiente unanimidad de criterio en el panel, bien por disparidad de opinión profesional, bien por falta de criterio establecido en una mayoría de los expertos. En la tabla 1 se detallan los resultados globales con sus estadísticos correspondientes, y se indica en cada caso la distribución de opiniones de los panelistas (porcentaje que se manifiesta de acuerdo o en desacuerdo con cada ítem).
DiscusiónEn términos generales, el criterio profesional de los distintos especialistas sobre la prevención de las infecciones graves por el VRS es bastante uniforme, como resulta esperable a la luz de la evidencia disponible sobre buena parte de los temas sometidos a la consideración del panel, que ha logrado el consenso pretendido en más de tres cuartas partes de los ítems propuestos.
Así, respecto a la epidemiología y repercusión de las infecciones respiratorias infantiles por VRS los expertos muestran un alto grado de consenso sobre la responsabilidad etiológica del VRS como causa común en su medio de infección de la vía respiratoria baja en niños con cardiopatía congénita y como determinante de numerosas consultas urgentes y hospitalizaciones en este grupo poblacional. Por su alta contagiosidad y su potencial morbimortalidad en este contexto clínico, la totalidad de los panelistas percibe como prioritaria la necesidad de emprender intervenciones preventivas sobre este agente.
Todas las recomendaciones higiénicas generales para prevenir la infección por VRS habitualmente recomendadas a las familias y a los cuidadores de la población en riesgo resultan consensuadas sin excepción por los profesionales encuestados. Con independencia del entorno sociodemográfico de procedencia, los expertos consideran todas ellas, no sólo efectivas, sino viables en sus distintos lugares de desempeño profesional. El nivel de acuerdo es máximo (plena unanimidad) sobre la necesidad de lavarse las manos en períodos epidémicos antes de tocar al niño, de evitar el contacto con hermanos mayores en riesgo de haber contraído la infección y sobre el uso de pañuelos desechables.
En la misma línea, los panelistas muestran su acuerdo generalizado con la viabilidad y efectividad de concienciar a los profesionales sanitarios sobre todas las medidas higiénicas planteadas para el control de la infección nosocomial por VRS. De nuevo, el consenso es unánime respecto a la necesidad de lavado de manos del profesional, previo y posterior a la manipulación del niño en riesgo (y de cualquier niño) y a la necesidad de abordar acciones educativas específicas sobre prevención del VRS con las familias de niños en riesgo y con el personal sanitario que los atiende.
En cuanto a las recomendaciones de inmunoprofilaxis con palivizumab por debajo de los 24 meses de vida, el panel logra un consenso unánime respecto a las indicaciones convencionales de uso del fármaco en los niños con cardiopatías congénitas no corregidas, cirugía paliativa o con lesiones residuales poscorrección que producen repercusión hemodinámica, en los niños corregidos quirúrgicamente con antecedentes de complicaciones pulmonares graves y en todo postoperatorio inmediato con repercusión hemodinámica. Asimismo, se consideran candidatos a la profilaxis los niños, aun mayores de 24 meses, que presentan hipertensión pulmonar primaria o secundaria, con o sin factores de riesgo para la infección.
Por el contrario, en ausencia de lesiones residuales poscorrección o de antecedentes de complicación pulmonar grave, en los niños con cardiopatías hemodinámicamente irrelevantes Comunicación Interauricular [CIA], Comunicación Interventricular [CIV], pequeñas, estenosis valvular pulmonar discreta, estenosis valvular aórtica, ductus permeable) o en el postoperatorio inmediato sin repercusión hemodinámica (aunque se precise medicación), el panel no logra consensuar la recomendación de uso de palivizumab, ni aun para casos individualmente seleccionados a criterio del médico, aunque un porcentaje significativo de los encuestados (entre el 39,6–58,4% según recomendación) se manifestaron de acuerdo con estas indicaciones.
Los niños con miocardiopatías que requieren tratamiento se consideran candidatos a la inmunoprofilaxis durante los 2 primeros años de vida. En los casos leves que no precisan medicación, esta indicación sólo se mantiene para el primer año de vida. También se considera apropiado el uso preventivo de palivizumab para los niños cardiópatas con ingreso programado para un procedimiento diagnóstico (cateterismo) o terapéutico durante la estación de riesgo, durante los primeros 2 años de vida, y para los niños con inmunodeficiencia (congénita o adquirida) comórbida con la cardiopatía congénita.
El panel experto considera que todos los niños con síndrome de Down y cardiopatía congénita con repercusión hemodinámica deben recibir profilaxis con palivizumab en la temporada epidémica de sus 2 primeros años de vida. La recomendación debe extenderse a los casos en los que no exista repercusión hemodinámica, a pesar de que un significativo número de cardiólogos (un quinto de los encuestados) expresa no tener criterio o experiencia personal al respecto, y no se manifiesta de acuerdo ni en desacuerdo con esta opción. Con menor unanimidad, en ausencia de cardiopatía también se puede aceptar el consenso mayoritario del panel sobre la vacunación sistemática del niño con síndrome de Down durante su primer año de vida.
En el caso de la cromosomopatía por deleción 22q11, la indicación se establece para los 2 primeros años de vida en caso de cardiopatía hemodinámicamente relevante. En ausencia de tal repercusión, se alcanza mayoría suficiente para el consenso estadístico a favor de la profilaxis durante el primer año de vida. No obstante, más de la mitad del panel experto (52,8%) está de acuerdo con su uso en estos niños después de 12 meses, mientras que un alto porcentaje (22,6%) se abstiene de expresarse en uno u otro sentido por falta de criterio o experiencia personal. En ausencia de cardiopatía, la indicación preventiva de palivizumab es una opción mantenida por un 32,7% de los panelistas para los menores de 12 meses), mientras que crece hasta el 30% la fracción de panelistas que se abstienen de opinar por inexperiencia. Futuros estudios que aporten nuevas evidencias sobre este subgrupo poblacional pueden ayudar a definir el criterio profesional y a reducir la heterogeneidad actual de las opiniones expertas.
Las arritmias también son motivo de indicación de profilaxis con palivizumab (durante los primeros 24 meses) en los casos recurrentes, en los que se considera que una infección respiratoria podría agravar el trastorno. Por el contrario, no se logra consenso profesional sobre el hecho de que una arritmia episódica durante un ingreso hospitalario se pueda considerar un factor de riesgo específico para adquirir una infección nosocomial y pueda justificar la prescripción.
Los niños con trasplante cardiaco durante la primera estación epidémica tras el trasplante y los que están a la espera de este se consideran beneficiarios claros de la inmunoprofilaxis, con independencia de su edad (mayor o menor de 24 meses).
Por encima de los 24 meses de vida, se considera mayoritariamente (66,9%) inapropiada la indicación de palivizumab en los niños con cardiopatía congénita, incluso si esta produce repercusión hemodinámica y están presentes factores de riesgo concomitantes (sibilancias, hermanos, desnutrición); sin embargo, no se trata de un criterio suficientemente unánime como para considerarlo consensuado.
Tampoco durante los 2 primeros años de vida la presencia individual de los factores de riesgo mencionados se considera un motivo suficiente para usar palivizumab, si la cardiopatía es hemodinámicamente irrelevante. Sin embargo, aunque no se alcanza un consenso, más de la mitad de los panelistas consideran apropiada esta indicación profiláctica en los primeros 12 meses de vida si el niño presenta desnutrición (64,2%) o sibilancias (57,7%). Durante el segundo año de vida, por el contrario, es mayoritario el rechazo de los expertos a esta práctica preventiva.
Por último, existe un consenso manifiesto sobre que la profilaxis con palivizumab en los pacientes cardiópatas a quienes se indique debe comenzar el mes previo al principio de la estación epidémica y mantenerse mensualmente hasta completar toda la campaña estacional. Asimismo, se acepta generalizadamente que los pacientes cardiópatas que estén recibiendo profilaxis para el VRS y tengan una intervención quirúrgica con circulación extracorpórea deben recibir una dosis adicional tras la intervención, tan pronto se encuentren clínicamente estables.
En conclusión, los expertos en Cardiología Pediátrica muestran un alto grado de consenso en su criterio profesional sobre la mayoría de los contenidos sometidos a su consideración. Los criterios profesionales que han resultado consensuados en este proyecto pueden considerarse justificación suficiente de recomendaciones clínicas avaladas por un criterio profesional unánime de los expertos españoles, y su aplicación debería considerarse para reducir la variabilidad injustificada de prácticas preventivas frente al VRS preventivas en la práctica cardiológica habitual.
En cuanto a los ítems no consensuados en este proyecto, han permitido evidenciar algunos aspectos de la práctica en los que existe mayor disparidad de opinión entre los profesionales. Por tratarse de un consenso basado en el criterio de clínicos expertos, estos ítems deben considerarse como escenarios clínicos de posible uso selectivo de palivizumab. Los pacientes que se encuentren en estas situaciones deben ser objeto de una evaluación individualizada por parte de los facultativos que los atiendan, quienes disponen de la información clave para integrar todas las circunstancias clinicoepidemiológicas concurrentes en cada caso, antes de tomar la decisión clínica más apropiada para la seguridad de cada paciente.
Las recomendaciones para la práctica clínica cardiológica pediátrica derivadas de este estudio, que se proponen en el anexo I, deben considerarse vigentes en la fecha de elaboración de este consenso y hasta la aparición de nuevos datos científicos que justifiquen su futura revisión.
Comité científicoC. Medrano López
Presidente del Grupo de trabajo de infecciones de la SECPCC y coordinador del estudio CIVIC
Hospital General Universitario Gregorio Marañón, Madrid
L. García-Guereta
Secretario del Grupo de trabajo de infecciones de la SECPCC y coordinador del estudio CIVIC
Hospital Universitario La Paz, Madrid
L. Fernández Pineda
Secretario de la SECPCC
Hospital Ramón y Cajal, Madrid
P. Malo Concepción
Hospital Universitario La Fe, Valencia
E. Maroto Álvaro
Hospital General Universitario Gregorio Marañón, Madrid
J. Santos de Soto
Hospital Universitario Virgen del Rocío, Sevilla
J. Lirio Casero
Hospital Universitario Niño Jesús, Madrid
P. Suárez Cabrera
Hospital Universitario Materno-Infantil de Canarias, Las Palmas de Gran Canaria
Grupo CIVIC de la Sociedad Española de Cardiología Pediátrica y Cardiopatías CongénitasAntúnez, Marisa
Ardura, Julio
Ballesteros, Fernando
Baños, Antonio
Betrian, Pedro
Briales, Carlos
Carretero, Juan
Casaldaliga, Jaume
Castro, Francisco José
Castro, Susana
Centeno, Fernando
Coll, Elena
Collell, Rosa
Coserría, Félix
Cuenca, Victorio
De la Fuente, María Ángeles
Del Alcázar, Ricardo
Díez, Juan José
Erdozain, Gabriel
Escobar, María Clara
Escudero, Fuensanta
Espin, Juana
Expósito, Juan Francisco
Fernández, Ana
Fernández-Santamaría, Inmaculada
Galdeano, José Miguel
García, Fernando
Garrido, Eugenio
García de la Calzada, Dolores
García, Jesús
Gómez, Elena
Granados, Miguel Ángel
Grueso, Josefina
Guía, José Manuel
Herrero, Javier
Jiménez, María Soledad
Insa, Beatriz
Leiva, María del Carmen
López-Abel, Bernardo
Lozano, José Antonio
Luis, María Teresa
Marimón, Cristina
Martínez, María Isabel
Más, Asumpta
Mendoza, Alberto
Milán del Bosch, Paloma
Moyá, Amparo
Navalón, Miguel
Olivera, Carmen
Ortega, María Ángeles
Ortigado, Alfonso
Pastor, Esteban
Perín, Francesca
Picazo, Beatriz
Pozuelo, María
Prada, Fredy
Puigdevall, Angels
Quero, María Teresa
Reguillo, Ana María
Riano, Bibiana
Rodríguez, Adela
Rodríguez, María del Mar
Ruiz, Eladio
Rueda, Fernando
Sánchez, Ana
Sánchez, Carmen
Sarquella, Georgia
Soriano, Dolors
Suárez, Joaquín
Suárez, Pedro
Tejero, María Ángeles
Teodoro, Silvia
Usano, Ana
Viadero, María Teresa
Vicente, Mariano
La SECPCC ha recibido una ayuda económica de Abbott Laboratories S. A. destinada a sufragar la implementación de los cuestionarios electrónicos y a la gestión de datos del estudio, que se han efectuado como tarea bajo contrato por una Oficina de Coordinación del Grupo Luzán 5 S.A. (Madrid). El patrocinador no ha participado en ninguna tarea del diseño, trabajo de campo, análisis de datos, ni en la redacción del presente artículo.
La SECPCC ha realizado anteriormente, con la colaboración de Abbott Laboratories, S.A., el estudio CIVIC relacionado con las infecciones respiratorias en niños con cardiopatías congénitas menores de 24 meses. Los firmantes, excepto los indicados con (*), han participado en el estudio CIVIC en los últimos 5 años.
A los panelistas encuestados, miembros de la SECPCC, por su participación como expertos en la encuesta Delphi.
Recomendaciones de la profilaxis con palivizumab de la infección por VRS en cardiología pediátrica en los siguientes grupos de niños con cardiopatías menores de 24 meses en el periodo de riesgo de la infección:
Niños con cardiopatías congénitas significativas11 Cardiopatías hemodinámicamente no significativas: Comunicación interauricular pequeña, Comunicación interventricular muscular o perimembranosa pequeña, estenosis valvular pulmonar leve o moderada, estenosis o insuficiencia valvular aórtica leve, ductus arterioso permeable pequeño. Repercusión hemodinámica: clínica de insuficiencia cardíaca, desnutrición (percentil de peso <3 para la edad y sexo), hipoxemia (desaturación, necesidad de O2 suplementario) y/o que precisa medicación cardiológica.
Niños con cardiopatías congénitas complejas parcialmente corregidas (intervención paliativa) que presenten repercusión hemodinamica
Niños con cardiopatías congénitas corregidas que presentan lesiones residuales con repercusión hemodinámica.
Niños con cardiopatías congénitas corregidas, con antecedentes de complicaciones pulmonares graves y/o que han precisado ventilación mecánica prolongada.
Niños con cardiopatías congénitas corregidas sin lesiones residuales, pero que en el postoperatorio inmediato continúen con repercusión hemodinámica33 Postoperatorio inmediato: si tras 1 mes post intervención continúan con datos de repercusión. Reevaluar criterios mensualmente.
Niños con hipertensión pulmonar primaria o secundaria moderada o severa.
Niños en tratamiento médico por miocardiopatía.
Niños con arritmias severas, recurrentes, que tienen o han tenido repercusión hemodinámica y que precisan medicación crónica en los que una infección respiratoria podría desencadenar o agravar el trastorno.
Niños con trasplante cardiaco
Niños en lista de trasplante cardiaco
En menores de 12 meses
o Inmunodeficiencia (congénita o adquirida).Niños con cardiopatía congénita intervenida con o sin defectos residuales y sin repercusión hemodinámica (ej.: cleft mitral con insuficiencia leve)
Niños con cardiopatía congénita leve no operados y sin repercusión hemodinámica (ej.: ductus arterioso silente, CIA pequeña, CIV restrictiva).
En representación del Grupo CIVIC de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC).
Cardiopatías hemodinámicamente no significativas: Comunicación interauricular pequeña, Comunicación interventricular muscular o perimembranosa pequeña, estenosis valvular pulmonar leve o moderada, estenosis o insuficiencia valvular aórtica leve, ductus arterioso permeable pequeño.
Repercusión hemodinámica: clínica de insuficiencia cardíaca, desnutrición (percentil de peso <3 para la edad y sexo), hipoxemia (desaturación, necesidad de O2 suplementario) y/o que precisa medicación cardiológica.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas