Los biomarcadores que faciliten el diagnóstico rápido de las infecciones bacterianas graves (IBG), establezcan su pronóstico, monitoricen su evolución y ayuden a decidir el momento más precoz para retirar antibióticos sin riesgo de recidiva, supondrían una gran ayuda en la clínica. Cerca de 200 moléculas han sido propuestas como marcadores potenciales, aunque solo un 20% han llegado a ser valoradas en estudios apropiados. Las últimas investigaciones se centran en los campos de la genómica y la metabolómica, comenzando a barajarse la aplicación de soluciones basadas en la nanotecnología para prevenir, detectar y tratar IBG1. Mientras esperamos los resultados de estos trabajos, necesitamos optimizar el uso de los marcadores más utilizados en clínica, la proteína C reactiva (PCR), la procalcitonina (PCT) y la interleucina 6 (IL-6).
Estudios como el publicado en este número de Anales de Pediatría por Parada et al.2, para valorar el impacto de la PCT en el manejo del lactante febril hospitalizado, resultan muy necesarios. Como los autores establecen, el carácter retrospectivo, el escaso número de pacientes con IBG, siendo un 75% infecciones urinarias, y la administración de antibióticos a pacientes sin IBG, debilitan las conclusiones. No obstante, sus hallazgos alertan de la importancia de analizar el valor (o su ausencia) que los marcadores añaden a la práctica clínica. Como contraste, Milcent et al.3 en un reciente estudio multicéntrico con 2.047 lactantes febriles, encontraron que la PCT (punto de corte: 0,3ng/ml; área bajo curva: 0,91; IC 95%: 0,83-0,99) era superior a la PCR (punto de corte: 2mg/dl; área bajo curva: 0,75; IC 95%: 0,65-0,89) para detectar infección bacteriana invasiva y ambos marcadores eran similares para detectar IBG. Sus resultados sugieren que estos marcadores pueden mejorar la práctica clínica en lactantes febriles. Intentaremos analizar las limitaciones y las fortalezas de los marcadores para entender los resultados contradictorios de muchos estudios publicados, y tratar de sacarles el máximo rendimiento4.
El diagnóstico y tratamiento precoz de las IBG condiciona su pronóstico. La primera limitación de la PCR, PCT e IL-6 es que se elevan ante cualquier respuesta inflamatoria, tanto si la causa es una infección, como si es un traumatismo, un shock grave o una situación de necrosis tisular (postoperatorios complejos, grandes quemaduras,…). Por ello, cuando tengamos un resultado elevado, debemos de decidir si hay alguna causa no infecciosa que justifique esa elevación o si, por el contrario, debemos iniciar tratamiento antibiótico, inmediatamente. Si el resultado es bajo, es poco probable que haya IBG, aunque resulta clave, tener en cuenta la cinética de estos marcadores, para evitar solicitarlos en momentos en que un valor bajo no tiene trascendencia bien porque es demasiado pronto para que se comiencen a elevar o bien porque es demasiado tarde para que mantengan la elevación. La IL-6 asciende en las primeras 2-3h tras la agresión, la PCT entre las 6 y las 12h, y la PCR entre las 24 y 48h. Por tanto, para realizar un diagnóstico precoz y decidir un tratamiento antibiótico inmediato, la IL-6 sería el marcador ideal, seguido de la PCT. La IL-6 desciende, en ocasiones, muy rápido, por lo que podría darnos un falso negativo si la petición es tardía y la PCR resulta más útil si el cuadro lleva al menos 24h de evolución.
Los puntos de corte se establecen dependiendo del nivel de sensibilidad y especificidad que queramos dar a la prueba. Debemos de individualizar a nuestros pacientes y utilizar el marcador como una ayuda más en la decisión, estableciendo si queremos priorizar la sensibilidad, como ocurre en los pacientes inmunodeprimidos en los que preferimos, iniciar antibiótico que correr el riesgo de tratar tardíamente. El valor normal de la PCT en la población sana que descarta la presencia de inflamación es menor a 0,1ng/ml. Sin embargo, en los estudios publicados se establecen puntos de corte entre 0,2-0,5ng/ml para las IBG en pacientes previamente sanos, entre 1-2ng/ml para las IBG en pacientes de cuidados intensivos, y entre 2-5ng/ml para pacientes postoperados. Al resto de marcadores inflamatorios les ocurre lo mismo. Los puntos de corte también cambian dependiendo de la información que queramos obtener del marcador, con diferentes valores para intentar predecir el riesgo de mortalidad o indicar la retirada de antibióticos.
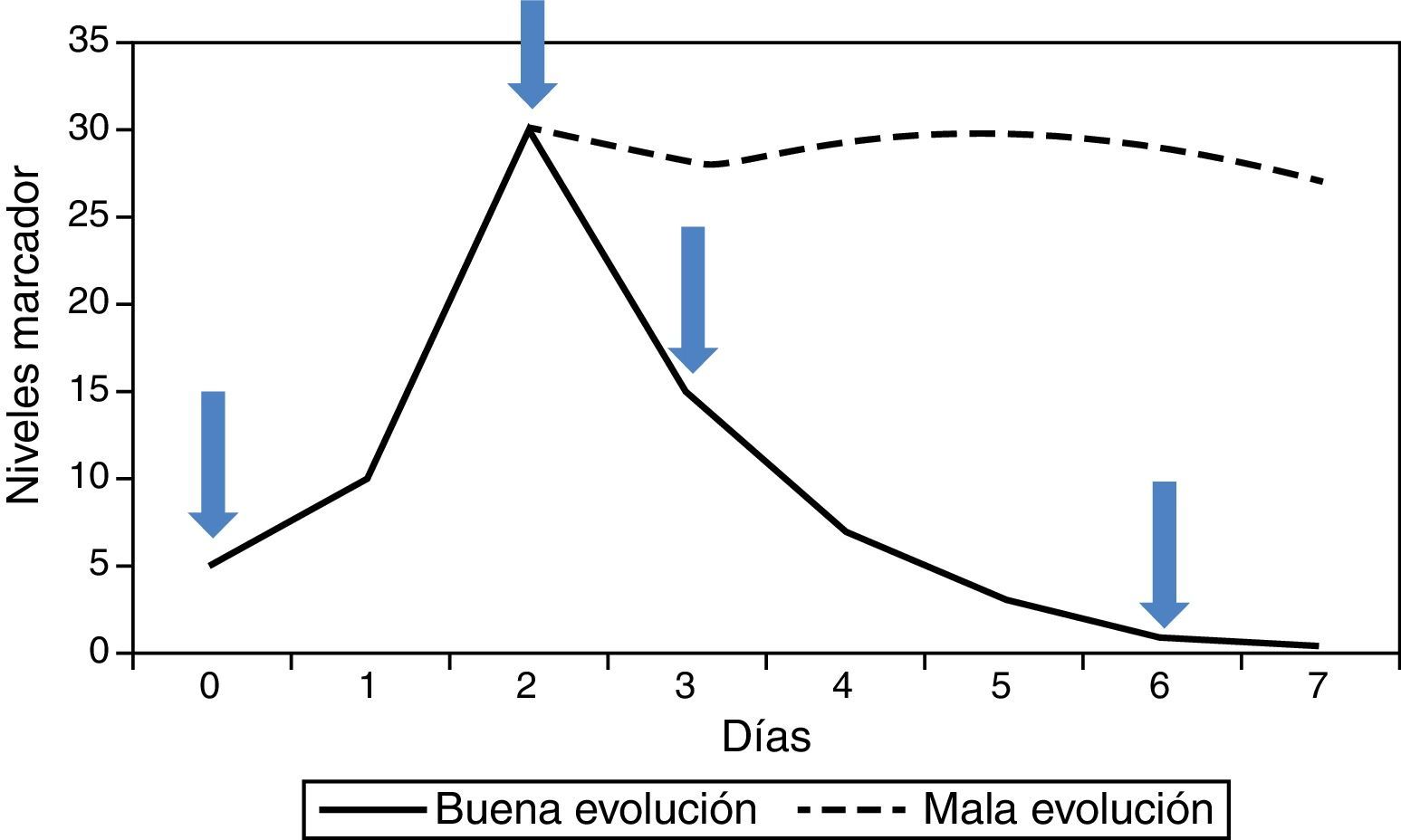
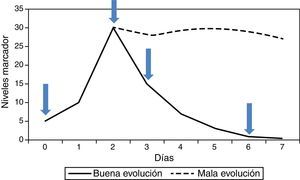
En el paciente hospitalizado, más que un valor aislado, es la cinética de los valores sucesivos lo que más puede aportar. Generalmente hay 4 valores útiles (fig. 1): 1) Primer valor del marcador (será el que ayude a confirmar o descartar la sospecha diagnóstica); 2) Valor máximo (marca el punto de peor evolución de la enfermedad); 3) Valor en descenso (confirma la buena respuesta al tratamiento), y 4) Valor por debajo del cual valoramos retirar los antibióticos (final del proceso). La PCT ha sido el más estudiado para monitorizar esta evolución, ya que su cinética resulta apropiada. Se comienza a elevar bastante rápido (6-12h), alcanza su valor máximo en 24-48h, y si la evolución es favorable, comienza su descenso a partir de ese momento, reduciendo a la mitad su valor previo cada 24h. La PCR también es útil, aunque su cinética más lenta hace que ascienda y descienda unas 24h más tarde. La IL-6 suele descender muy rápidamente, por lo que no resulta útil para monitorizar la evolución de los pacientes, ni para ser usada como criterio de retirada del tratamiento antibiótico. En caso de que el cuadro evolucione de forma desfavorable, los niveles del marcador no descienden, sino que se mantienen elevados en el tiempo (fig. 1), indicando una posible necesidad de cambio terapéutico, concretamente en el tratamiento antibiótico, en espera de los hemocultivos, si se trata de un cuadro infeccioso.
En los últimos años se han publicado diversos trabajos en los que se utilizan marcadores como guía de retirada de tratamiento antibiótico. La PCT ha sido objeto de varios ensayos y metaanálisis. Los niveles propuestos para suspender el antibiótico estarían por debajo de 0,25ng/ml o entre 0,25-0,50ng/ml, siempre que fueran inferiores al 80% del valor máximo alcanzado5. La PCR, también puede resultar apropiada para este cometido.
Se están investigando otros marcadores que pueden aportar información a decisiones relacionadas con el pronóstico y el ingreso de los pacientes. El uso de paneles de biomarcadores ha sido descrito como una solución para aprovechar las ventajas y reducir las limitaciones de un marcador aislado. Sin embargo, se hace necesario un mayor rigor metodológico en los estudios clínicos con marcadores para demostrar el coste/efectividad de dichas combinaciones.
En resumen, Parada et al.2 han puesto de manifiesto la necesidad de valorar el impacto de la introducción de biomarcadores en la práctica clínica. Aspectos como la formación adecuada del personal médico, antes de introducir una prueba diagnóstica, la selección adecuada de los pacientes a los que se hará la petición, la interpretación de los resultados en el contexto clínico de cada paciente y la concienciación de que todas las pruebas tienen un coste, deben de ser tenidos muy en cuenta. No deberíamos solicitar un marcador de forma rutinaria sin haber pensado previamente, tras una valoración clínica exhaustiva, que actitud tomaremos en función del resultado que recibamos. La petición de muchas pruebas de laboratorio no es sinónimo de mejor práctica clínica, sino más bien todo lo contrario.
Conflicto de interesesEl autor ha recibido financiación de las compañías Brahms y Thermofisher por impartir conferencias en congresos sobre temas relacionados con biomarcadores y sepsis.