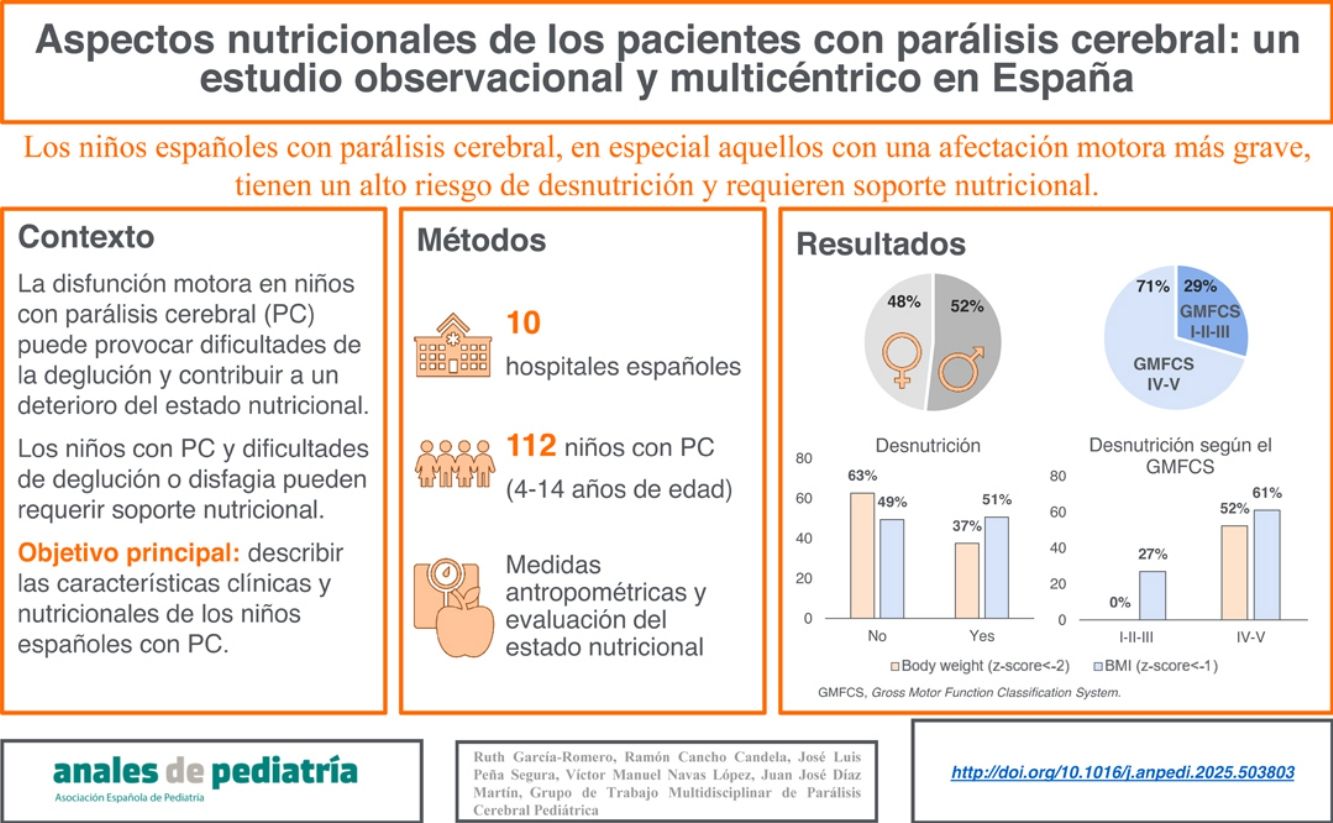
La parálisis cerebral (PC) abarca un grupo de trastornos motores que pueden resultar en dificultades para tragar, afectando la ingesta de alimentos y contribuyendo a un deterioro del estado nutricional. El objetivo del estudio fue describir las características clínicas y nutricionales de los niños españoles con PC.
MétodosEstudio observacional multicéntrico realizado en niños de 4 a 14 años diagnosticados de PC. Se recopilaron datos sociodemográficos y clínicos, así como medidas antropométricas, modalidad escolar, nutrición recibida en la escuela, apoyo nutricional y comorbilidades gastrointestinales de todos los pacientes.
ResultadosSe incluyó un total de 112 pacientes con una edad media de 9,2 años. Un 70,5% presentaba un grado IV-V en el Sistema de Clasificación de la Función Motora Gruesa (GMFCS). En comparación con aquellos con GMFCS I-II-III, los niños con grados IV-V del GMFCS mostraron una puntuación z media significativamente menor en peso, talla, relación peso/talla, índice de masa corporal y circunferencia del brazo, y un área del brazo significativamente menor. Una proporción mayor de pacientes con GMFCS IV-V asistió a escuelas de educación especial en comparación con pacientes con GMFCS I-II-III (68,4% vs. 12,1%, p<0,0001). Una mayor proporción de niños con GMFCS IV-V presentó disfagia (62,0% vs. 15,2%, p<0,0001), estreñimiento (51,9% vs. 27,3%, p=0,0218) y reflujo gastroesofágico (31,6% vs. 3,0%, p=0,0005) en comparación con niños con GMFCS I-II-III.
ConclusionesNuestro estudio muestra que los niños españoles con PC, especialmente aquellos con mayor deterioro motor severo, están en riesgo de desnutrición, presentan comorbilidades gastrointestinales y requieren apoyo nutricional.
Cerebral palsy (CP) encompasses a group of motor disorders that can result in swallowing difficulties, affecting food intake and contributing to poor nutritional status. The goal of the study was to describe the clinical and nutritional characteristics of Spanish children with CP.
MethodsMulticenter observational study conducted in children aged 4 to 14 years with a diagnosis of CP. For every patient, we collected data on sociodemographic and clinical characteristics as well as anthropometric measurements, schooling modality, nutrition received at school, nutritional support and gastrointestinal comorbidities.
ResultsThe sample included a total of 112 patients with a mean age of 9.2 years old. The majority (70.5%) had been classified as Gross Motor Function Classification System (GMFCS) level IV or V. Compared to children classified as GMFCS level I, II or III, the group of children with GMFCS level IV/V had significantly lower mean z scores in body weight, height, weight-to-height ratio, body mass index and upper arm circumference and a significant lower mean arm area. A higher proportion of patients with GMFCS level IV/V attended special education schools compared to patients classified as level I to III (68.4% vs 12.1%; P<.0001). A higher proportion of children classified as level IV/V compared to children classified as levels I to III presented dysphagia (62.0% vs 15.2%; P<.0001), constipation (51.9% vs 27.3%, P=.0218) and gastroesophageal reflux (31.6% vs 3.0%; P=.0005).
ConclusionsOur study shows that Spanish children with CP, especially those with severe motor impairment, are at risk of malnutrition, present gastrointestinal comorbidities and require nutritional support.
La parálisis cerebral (PC) abarca un grupo heterogéneo de trastornos motores y de la postura caracterizados por alteraciones del tono muscular, la postura y el movimiento que causan limitaciones en la actividad y atribuidos a alteraciones no progresivas ocurridas durante el desarrollo cerebral del feto o el niño pequeño1,2. Con frecuencia, los trastornos motores en la PC se acompañan de alteraciones sensoriales, perceptivas o cognitivas, trastornos de la comunicación o de la conducta, epilepsia y problemas musculoesqueléticos secundarios1. Aunque el trastorno motor es persistente, las manifestaciones clínicas pueden cambiar durante la evolución de la enfermedad2,3. La prevalencia global de PC en los países de renta alta es de aproximadamente 2 por cada 1000 recién nacidos vivos, estimándose prevalencias superiores en países de renta media y baja3.
El diagnóstico de la PC es fundamentalmente clínico y se basa en la exploración neurológica y la evaluación motora, la exploración de los principales factores de riesgo asociados a la PC y los hallazgos de neuroimagen y de la resonancia magnética cerebral4,5. La gravedad de la PC puede clasificarse mediante el Gross Motor Function Classification System (GMFCS, sistema de clasificación de la función motora gruesa), que establece el nivel de función o discapacidad motora6. En niños con PC, especialmente aquellos con grados altos del GMFCS, la disfunción motora se asocia a un riesgo alto de dificultades en la deglución7, afectando a la ingesta de alimentos8,9 y contribuyendo a un deterioro del estado nutricional. La disfunción motora puede promover el desarrollo de disfagia10, presente en casi todos los niños con PC grave11, y puede afectar a la seguridad y la eficacia de la deglución y causar deterioro del estado nutricional, así como infecciones del tracto respiratorio debido a la aspiración bronquial recurrente11,12. En consecuencia, la prevalencia de la desnutrición es alta en la población pediátrica con PC (aproximadamente 40%), y aún mayor en aquellos con disfunción motora grave7,9. Como resultado, los niños con PC pueden tener una densidad mineral ósea y masa muscular disminuidas, que a su vez conllevan un deterioro funcional7. Los niños con dificultades de deglución o disfagia pueden necesitar soporte nutricional para superar la desnutrición13. En este sentido, estudios anteriores han demostrado que el soporte nutricional puede lograr un aumento de peso y mejorar el estado nutricional de estos pacientes14,15.
Aunque la evaluación y la intervención nutricionales en estos pacientes pueden suponer un reto, deben formar parte de su manejo. En este contexto, las guías de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) recomiendan la evaluación rutinaria de las medidas antropométricas, la composición corporal y parámetros analíticos para detectar signos de desnutrición16.
A pesar de estas recomendaciones, los datos sobre el estado nutricional de los niños con PC en España son escasos y la mayoría de los datos publicados se centran en regiones concretas17,18. Por lo tanto, el objetivo principal de nuestro estudio fue obtener una perspectiva más amplia de la situación actual de los niños con PC en España en diferentes regiones mediante la recogida y el análisis de datos sobre sus características clínicas y nutricionales. Asimismo, se identificaron y analizaron las comorbilidades presentes en estos pacientes y el soporte nutricional que habían recibido.
MétodosDiseño del estudioEstudio observacional multicéntrico realizado en pacientes pediátricos con PC atendidos en 10 hospitales españoles. Se invitó a participar a los posibles candidatos cuando visitaron el centro. En esa misma visita, los investigadores informaron a los padres sobre el estudio y, tras obtener el consentimiento informado, examinaron a los pacientes en el momento o programaron una visita para el estudio en una fecha posterior. Todos los datos necesarios para los análisis se recogieron en una sola visita.
El presente estudio (número: 0114-N-19) se adhirió a los principios de la Declaración de Helsinki y fue aprobado por el Comité de Ética de la Investigación Provincial de Málaga del Hospital Regional Universitario de Málaga.
ParticipantesSe incluyeron niños de 4 a 14 años con diagnóstico de PC, independientemente del grado del GMFCS, que dieron su consentimiento por escrito (a través de su tutor legal) para participar en el estudio. En el caso de los pacientes de 13 a 14 años con cognición normal, se obtuvo su consentimiento informado por escrito. Se excluyó a los pacientes sin diagnóstico establecido de PC. Los pacientes se clasificaron de acuerdo con el GMFCS6, que va desde el grado I (el más leve) hasta el grado V (el más grave).
Variables de estudioPara cada paciente, se recogieron datos sociodemográficos (edad, sexo), clínicos (edad gestacional, gestación múltiple, edad al diagnóstico, tiempo de evolución desde el diagnóstico) y antropométricos (peso al nacer, peso actual, talla, talla estimada según la longitud de la tibia, relación peso/talla, índice de masa corporal [IMC], circunferencia del brazo y pliegue tricipital). Las mediciones antropométricas se obtuvieron mediante técnicas estandarizadas, como el uso de cinta métrica para las mediciones de perímetros y longitudes segmentarias, plicómetros para los pliegues subcutáneos y básculas para el peso corporal.
La desnutrición se evaluó por medio del índice de Waterlow de peso para la talla y los valores antropométricos. Se utilizó la clasificación de Waterlow para evaluar el estado nutricional en términos de la emaciación (wasting) y el grado de reducción en la talla (stunting), definidos en base al peso actual del paciente en relación con la mediana de peso en la población de referencia para la talla del paciente19, y clasificando al paciente en una de las siguientes categorías: obesidad, peso normal y desnutrición leve, moderada o grave. La desnutrición también se definió en base a las puntuaciones estándar de los valores antropométricos como una puntuación z de −2 o inferior.
También se recogieron datos concernientes a la modalidad escolar (especial, con adaptación curricular, ordinaria), el número de comidas y el tipo de nutrición proporcionada en la escuela (comida casera, comida casera con adecuación de textura, gastrostomía), el método de alimentación (oral, gastrostomía, mixto), la necesidad de suplementación con productos de nutrición enteral, suplementos nutricionales orales (SNO) o ambos, y las comorbilidades gastrointestinales (disfagia, estreñimiento, reflujo gastroesofágico). Se utilizó la escala Eating and Drinking Ability Classification System (EDACS) para evaluar la capacidad para comer y beber de los niños con PC20. En esta escala, la capacidad de comer y beber se clasifica en cinco niveles (I a IV) de acuerdo con la gravedad de las alteraciones en términos de seguridad y eficacia. La escala EDACS se ha traducido y validado al español y se ha aplicado en un estudio previo realizado en una cohorte de niños españoles con PC17.
Cálculo del tamaño muestralEn base a datos publicados por Fernández-Jaén y Calleja-Pérez21, para un nivel de confianza (1−α) del 95% y una precisión del 10%, estimando una prevalencia de desnutrición en pacientes con PC del 45%, calculamos que el tamaño muestral mínimo necesario sería de 103 pacientes.
Análisis estadísticoSe calcularon medidas de tendencia central (media, mediana) y de dispersión (desviación estándar [DE], rango intercuartílico [RIC]) para expresar los datos cuantitativos. Los datos categóricos se describieron en términos de frecuencias absolutas y relativas. Los parámetros antropométricos se expresaron como puntuaciones z, utilizando como referencia los datos de crecimiento publicados por Sánchez González et al.22. El área del brazo se calculó en función de la circunferencia del brazo. Clasificamos a los pacientes en dos subgrupos según la gravedad de la PC, como se ha descrito anteriormente: GMFCS grados I-III y GMFCS grados IV-V23,24. La normalidad de las variables se evaluó por medio de las pruebas de Shapiro-Wilk y de Kolmogorov-Smirnov. Para las variables continuas, se utilizó la prueba t de Student o el análisis de varianza para comparar subgrupos si los datos seguían una distribución normal o, en caso contrario, las pruebas U de Mann-Whitney o de Kruskal-Wallis. Para las variables cualitativas, se utilizó la prueba exacta de Fisher o la prueba chi-cuadrado. Todos los análisis se realizaron con los datos disponibles, sin utilizar ninguna técnica de sustitución de datos faltantes. El análisis estadístico se realizó con el software SAS, versión 9.4 (SAS Institute Inc., Cary, Carolina del Norte, EE. UU.). Se utilizó un nivel de significación de p<0,05 para todas las pruebas.
ResultadosCaracterísticas de los pacientesEn el estudio participaron un total de 112 pacientes con una edad media de 9,2 años (DE: 2,9) atendidos en 10 hospitales españoles (tabla 1). Según la escala GMFCS, 33 pacientes se clasificaron como GMFCS grados I-II-III y 79 pacientes como GMFCS grados IV-V.
Pacientes y características de la enfermedad en el momento de la visita del estudio
| Características | |
| Edad actual (años) | |
| Media (DE) | 9,2 (2,9) |
| Mediana (RIC) | 9 (7-11) |
| Sexo, n (%) | |
| Varón | 58 (51,8) |
| Mujer | 54 (48,2) |
| Edad gestacional (semanas) | |
| Media (DE) | 35,2 (5,4) |
| Mediana (RIC) | 38 (30-40) |
| Grupo de edad gestacional, n (%) | |
| <28 semanas | 17 (15,2) |
| 28-<32 semanas | 15 (13,4) |
| 32-<37 semanas | 18 (16,1) |
| ≥37 semanas | 62 (55,4) |
| Peso al nacer (g) | |
| Media (DE) | 2363,8 (1004,8) |
| Mediana (RIC) | 2600 (1240-3150) |
| Gestación múltiple, n (%) | 15 (13,4) |
| Edad al diagnóstico (años) | |
| Media (DE) | 1,6 (2,1) |
| Mediana (RIC) | 1 (0-2,5) |
| Tiempo de evolución desde el diagnóstico (años) | |
| Media (DE) | 7,6 (3,2) |
| Mediana (RIC) | 7,3 (5,3-10,1) |
| Etiología de la parálisis cerebral, n (%) | |
| Prenatala | 24 (21,4) |
| Perinatala | 82 (73,2) |
| Posnatal | 7 (6,3) |
| Semiología del trastorno motor, n (%) | |
| Espástica | 70 (62,5) |
| Discinética/atáxica | 3 (2,7) |
| Mixta (espástica-discinética) | 39 (34,8) |
| Topografía, n (%) | |
| Monoparesia | 1 (0,9) |
| Hemiparesia | 16 (14,3) |
| Diparesia | 13 (11,6) |
| Triparesia | 6 (5,4) |
| Tetraparesia | 76 (67,9) |
| Grado GMFCS, n (%) | |
| I | 10 (8,9) |
| II | 16 (14,3) |
| III | 7 (6,3) |
| IV | 28 (25,0) |
| V | 51 (45,5) |
| Índice Waterlow de peso para la talla, n (%) | |
| Obesidad (>110) | 12 (19,7) |
| Normal (90-110) | 17 (27,9) |
| Desnutrición leve (80-90) | 15 (24,6) |
| Desnutrición moderada (70-80) | 12 (19,7) |
| Desnutrición grave (<70) | 5 (8,2) |
DE: desviación estándar; GMFCS: Gross Motor Function Classification System; RIC: rango intercuartil.
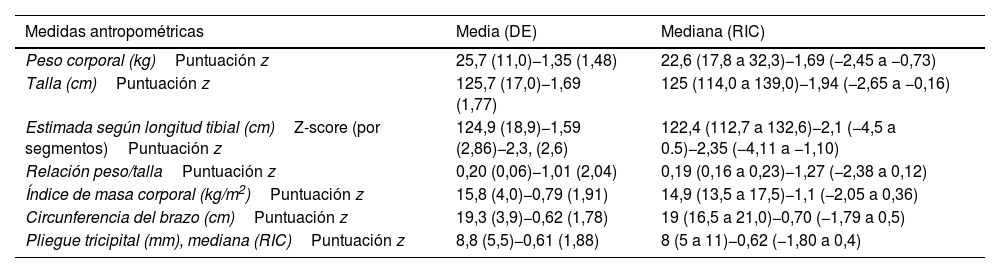
En la muestra total, en el momento de la visita del estudio, el peso medio de los pacientes fue de 25,7kg (DE=11,0) y la talla media de 125,7cm (DE=17,0) (tabla 2).
Medidas antropométricas de los pacientes en la visita de estudio
| Medidas antropométricas | Media (DE) | Mediana (RIC) |
|---|---|---|
| Peso corporal (kg)Puntuación z | 25,7 (11,0)−1,35 (1,48) | 22,6 (17,8 a 32,3)−1,69 (−2,45 a −0,73) |
| Talla (cm)Puntuación z | 125,7 (17,0)−1,69 (1,77) | 125 (114,0 a 139,0)−1,94 (−2,65 a −0,16) |
| Estimada según longitud tibial (cm)Z-score (por segmentos)Puntuación z | 124,9 (18,9)−1,59 (2,86)−2,3, (2,6) | 122,4 (112,7 a 132,6)−2,1 (−4,5 a 0.5)−2,35 (−4,11 a −1,10) |
| Relación peso/tallaPuntuación z | 0,20 (0,06)−1,01 (2,04) | 0,19 (0,16 a 0,23)−1,27 (−2,38 a 0,12) |
| Índice de masa corporal (kg/m2)Puntuación z | 15,8 (4,0)−0,79 (1,91) | 14,9 (13,5 a 17,5)−1,1 (−2,05 a 0,36) |
| Circunferencia del brazo (cm)Puntuación z | 19,3 (3,9)−0,62 (1,78) | 19 (16,5 a 21,0)−0,70 (−1,79 a 0,5) |
| Pliegue tricipital (mm), mediana (RIC)Puntuación z | 8,8 (5,5)−0,61 (1,88) | 8 (5 a 11)−0,62 (−1,80 a 0,4) |
DE: desviación estándar; RIC: rango intercuartil.
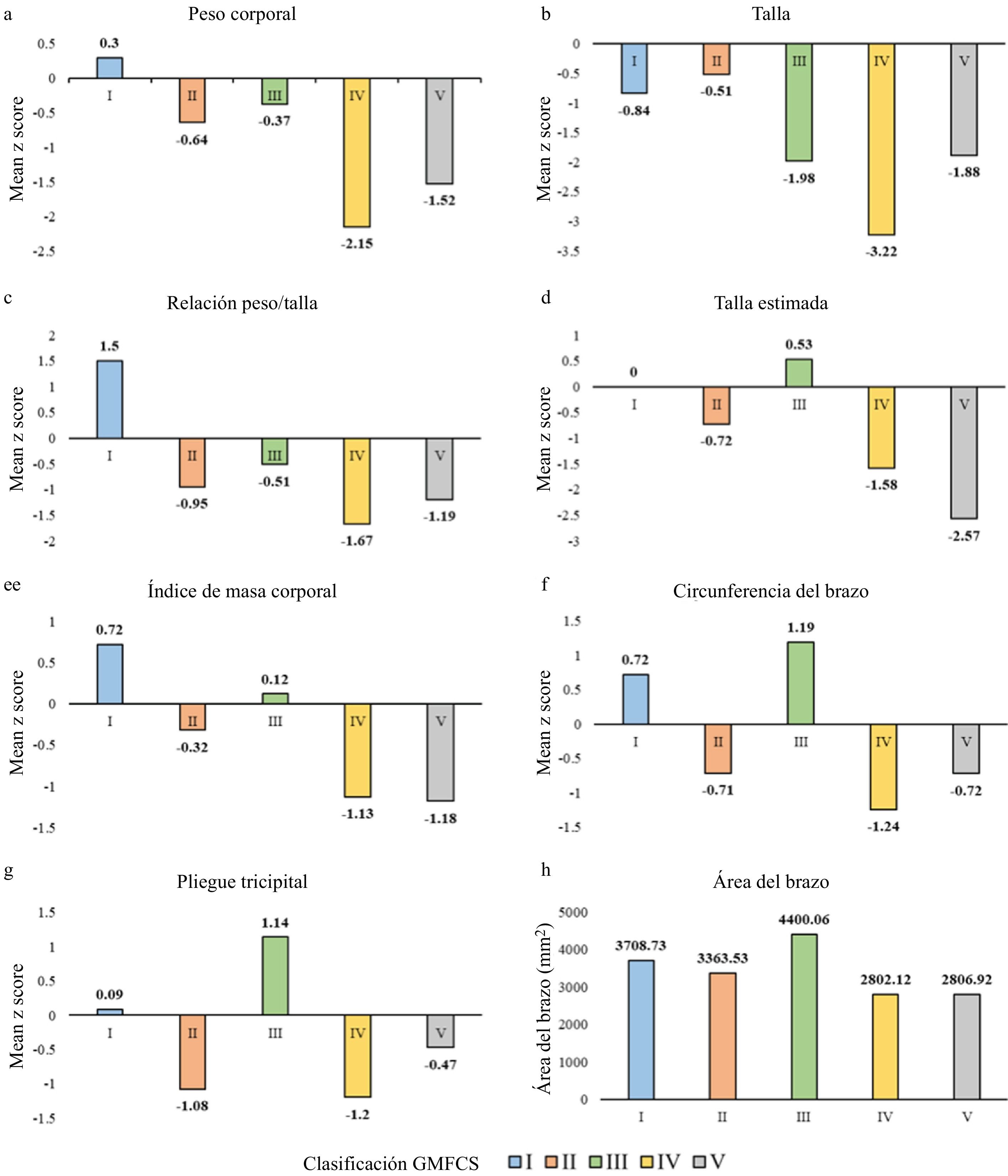
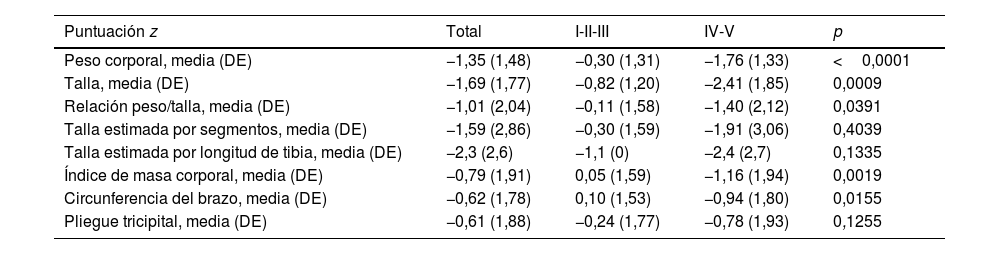
Los valores medios de las puntuaciones z obtenidos para cada uno de los parámetros antropométricos según el grado del GMFCS se muestran en la figura 1 (a-g). En general, las puntuaciones z de los pacientes con GMFCS grados IV-V fueron significativamente menores en todas las medidas antropométricas (p<0,05), con excepción de la talla estimada según la longitud tibial y el pliegue tricipital (tabla 3).
Media de la puntuación z de las medidas antropométricas por grupo GMFCS
| Puntuación z | Total | I-II-III | IV-V | p |
|---|---|---|---|---|
| Peso corporal, media (DE) | −1,35 (1,48) | −0,30 (1,31) | −1,76 (1,33) | <0,0001 |
| Talla, media (DE) | −1,69 (1,77) | −0,82 (1,20) | −2,41 (1,85) | 0,0009 |
| Relación peso/talla, media (DE) | −1,01 (2,04) | −0,11 (1,58) | −1,40 (2,12) | 0,0391 |
| Talla estimada por segmentos, media (DE) | −1,59 (2,86) | −0,30 (1,59) | −1,91 (3,06) | 0,4039 |
| Talla estimada por longitud de tibia, media (DE) | −2,3 (2,6) | −1,1 (0) | −2,4 (2,7) | 0,1335 |
| Índice de masa corporal, media (DE) | −0,79 (1,91) | 0,05 (1,59) | −1,16 (1,94) | 0,0019 |
| Circunferencia del brazo, media (DE) | −0,62 (1,78) | 0,10 (1,53) | −0,94 (1,80) | 0,0155 |
| Pliegue tricipital, media (DE) | −0,61 (1,88) | −0,24 (1,77) | −0,78 (1,93) | 0,1255 |
DE: desviación estándar; GMFCS: Gross Motor Function Classification System.
Además, la media del área del brazo en el total de la muestra fue de 3072,44mm2 (DE=1328,21), con una media significativamente mayor en pacientes con GMFCS grados I-II-III (3688,01 [DE=1541,26]) en comparación con pacientes con GMFCS grados IV-V (2805,15 [DE=1134,77]) (p=0,0007) (fig. 1h).
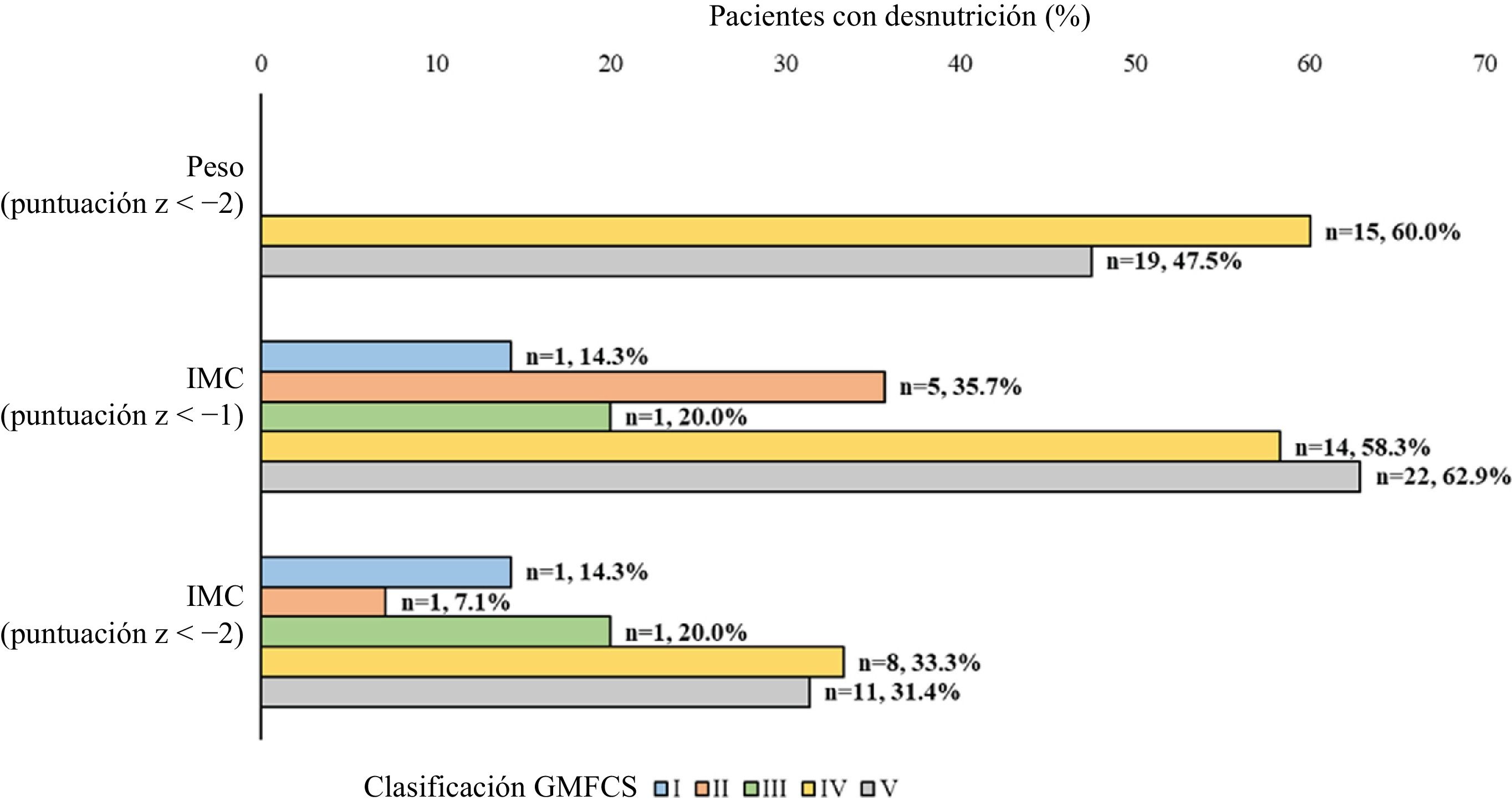
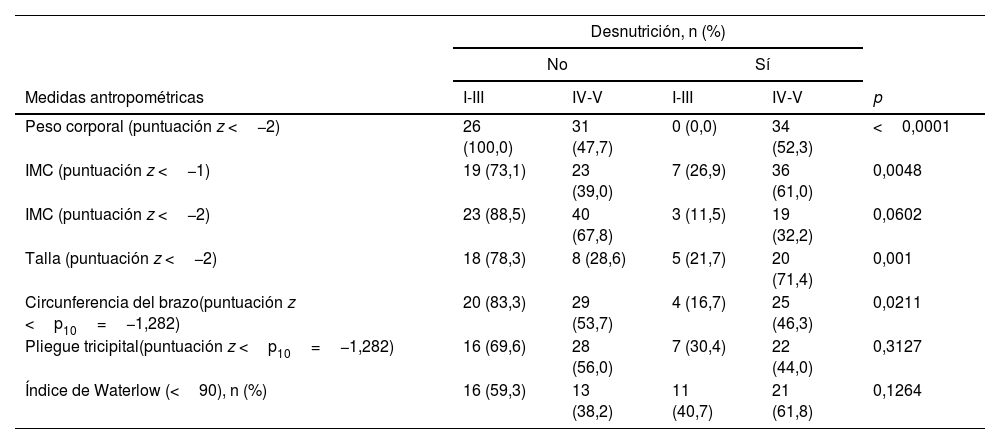
Estado nutricionalEl análisis del estado nutricional en base a las características antropométricas mostró que, aproximadamente, entre el 26% y el 52% de los pacientes presentaban desnutrición (tabla 3). Además, de acuerdo con el peso corporal, el IMC (z score <–1), la talla y la circunferencia del brazo, había una proporción significativamente mayor de pacientes desnutridos en el grupo con grado IV-V del GMFCS en comparación con el grupo con grado I-II-III (fig. 2, tabla 4). Definiendo la desnutrición como un índice de Waterlow inferior a 80, se encontró una proporción mayor de pacientes desnutridos en el grupo con GMFCS grados IV-V (n=13; 38,2%) en comparación con el grupo con GMFCS grados I-II-III (n=4; 14,8%) (p=0,0502).
Desnutrición en los pacientes estudiados en base a distintas medidas antropométricas y el GMFCS
| Desnutrición, n (%) | |||||
|---|---|---|---|---|---|
| No | Sí | ||||
| Medidas antropométricas | I-III | IV-V | I-III | IV-V | p |
| Peso corporal (puntuación z <−2) | 26 (100,0) | 31 (47,7) | 0 (0,0) | 34 (52,3) | <0,0001 |
| IMC (puntuación z <−1) | 19 (73,1) | 23 (39,0) | 7 (26,9) | 36 (61,0) | 0,0048 |
| IMC (puntuación z <−2) | 23 (88,5) | 40 (67,8) | 3 (11,5) | 19 (32,2) | 0,0602 |
| Talla (puntuación z <−2) | 18 (78,3) | 8 (28,6) | 5 (21,7) | 20 (71,4) | 0,001 |
| Circunferencia del brazo(puntuación z <p10=−1,282) | 20 (83,3) | 29 (53,7) | 4 (16,7) | 25 (46,3) | 0,0211 |
| Pliegue tricipital(puntuación z <p10=−1,282) | 16 (69,6) | 28 (56,0) | 7 (30,4) | 22 (44,0) | 0,3127 |
| Índice de Waterlow (<90), n (%) | 16 (59,3) | 13 (38,2) | 11 (40,7) | 21 (61,8) | 0,1264 |
GMFCS, Gross Motor Function Classification System; IMC, índice de masa corporal; p10: percentil 10.
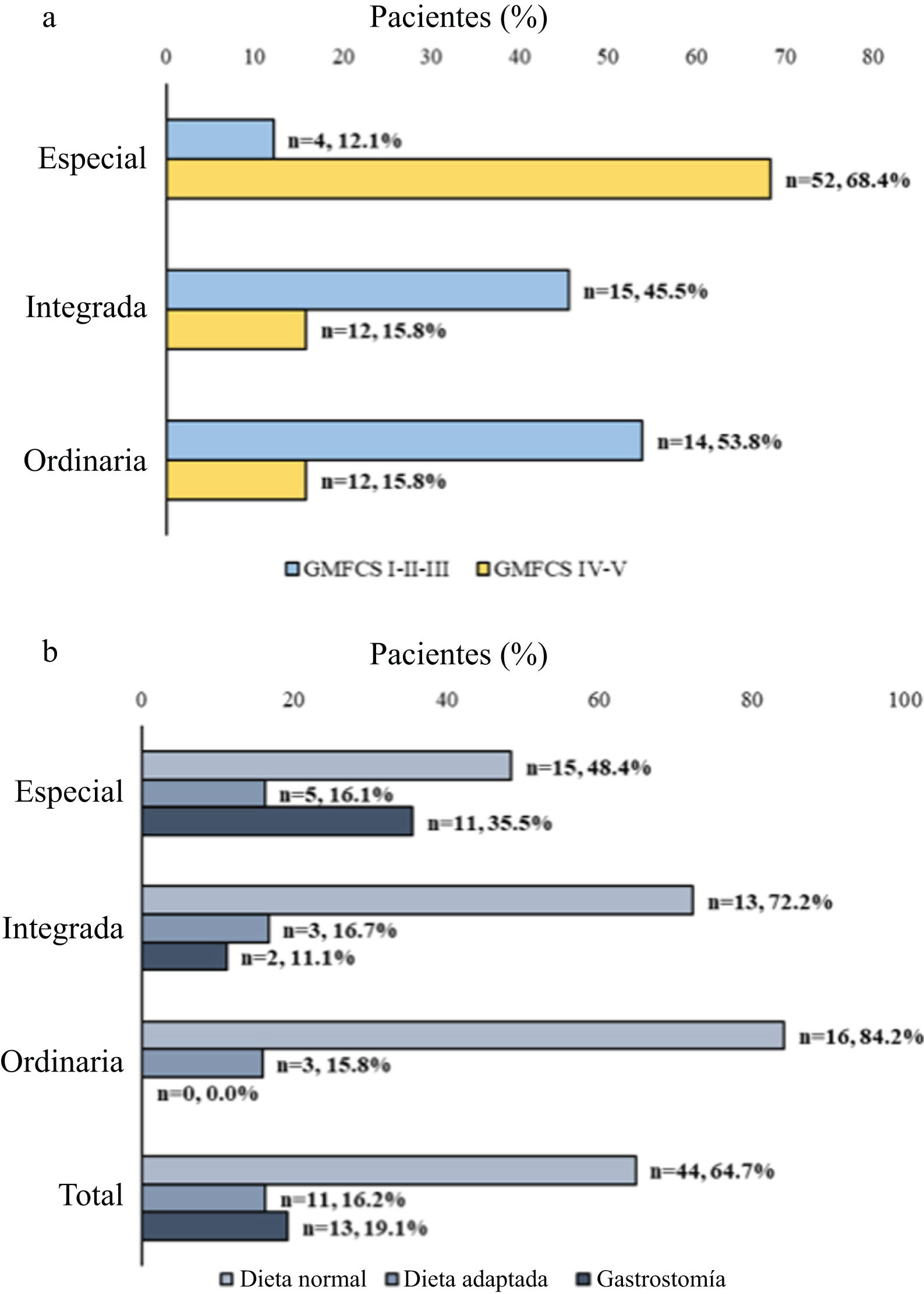
Cincuenta y seis pacientes (51,4%) asistían a escuelas de educación especial, mientras que 27 (24,8%) asistían a escuelas de integración y 26 (23,9%) a centros ordinarios. La proporción de niños en modalidad de educación especial fue mayor en el grupo con GMFCS grados IV-V en comparación con el grupo con GMFCS grados I-II-III (68,4% vs. 12,1%; p<0,0001) (fig. suplementaria 1a).
Ochenta pacientes (73,4%) tomaban al menos una comida en el centro escolar, mientras que 30 (27,6%) realizaban al menos dos comidas, con mayor frecuencia la comida del mediodía (n=51, 46,8%) y el almuerzo (n=50, 45,9%), seguidas del desayuno (n=12; 11,0%).
En cuanto al abordaje nutricional, la mayoría de los pacientes recibían nutrición oral normal (n=44; 64,7%), 11 (16,2%) nutrición oral adaptada y 13 (19,1%) nutrición enteral por gastrostomía (fig. suplementaria 1b).
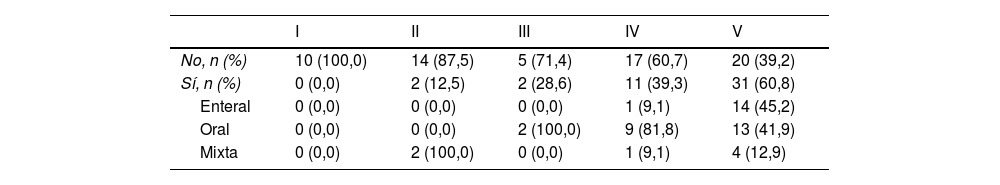
Modalidad de alimentación y soporte nutricionalLa mayoría de los pacientes bajo estudio (n=87; 77,7%) recibían nutrición oral, mientras que 17 (15,2%) se alimentaban por sonda de gastrostomía y 8 (7,1%) recibían nutrición mixta. Además, 46 pacientes (41,1%) requerían soporte nutricional, la mayoría de ellos (n=42; 91,3%) clasificados como grados IV-V del GMFCS (p<0,001). En este grupo, la ruta más frecuente de administración del soporte nutricional fue la oral en pacientes con grado IV del GMFCS (81,8%) y la enteral en pacientes con grado V (45,2%) (tabla 5).
Apoyo nutricional según el grado del GMFCS
| I | II | III | IV | V | |
|---|---|---|---|---|---|
| No, n (%) | 10 (100,0) | 14 (87,5) | 5 (71,4) | 17 (60,7) | 20 (39,2) |
| Sí, n (%) | 0 (0,0) | 2 (12,5) | 2 (28,6) | 11 (39,3) | 31 (60,8) |
| Enteral | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (9,1) | 14 (45,2) |
| Oral | 0 (0,0) | 0 (0,0) | 2 (100,0) | 9 (81,8) | 13 (41,9) |
| Mixta | 0 (0,0) | 2 (100,0) | 0 (0,0) | 1 (9,1) | 4 (12,9) |
GMFCS: Gross Motor Function Classification System.
El análisis de las comorbilidades mostró que 54 pacientes (48,2%) tenían disfagia, 50 (44,6%) estreñimiento y 26 (23,2%) reflujo gastroesofágico. Además, 30 pacientes (26,8%) presentaban solo una de estas comorbilidades gastrointestinales, mientras que 26 (23,2%) tenían dos y 16 (14,3%) tenían tres comorbilidades gastrointestinales concomitantes.
El análisis según la clasificación GMFCS reveló que una proporción significativamente mayor de pacientes con grado IV-V en comparación con el grupo con grado I-II-III tenía disfagia (62,0% vs. 15,2%; p=0,0001), estreñimiento (51,9% vs. 27,3%; p=0,0218) y reflujo gastroesofágico (31,6% vs. 3,0%; p=0,0005).
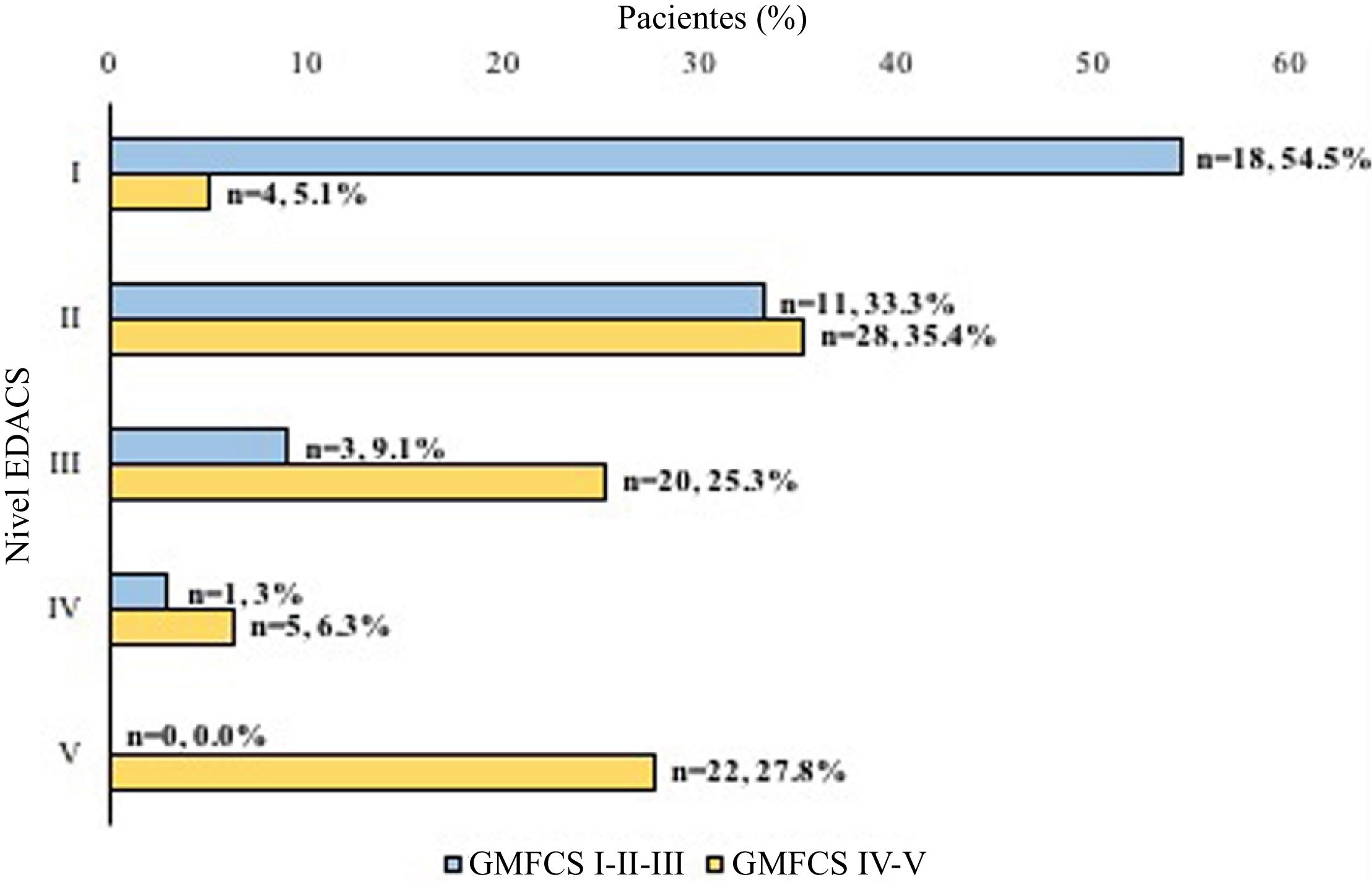
Según la puntuación en la escala EDACS, la mitad de los pacientes (n=51; 50%) mostraban limitaciones en la seguridad y la eficacia al comer y beber (EDACS≥III). Clasificamos a los pacientes de manera más pormenorizada en subgrupos según el GMFCS y la EDACS, y observamos una proporción significativamente mayor de pacientes con dificultades para comer y beber en el grupo con disfunción motora más grave según el GMFCS (p<0,0001) (fig. 3).
DiscusiónLos niños con PC presentan discapacidad motora que puede producir dificultades en la ingesta, las cuales, a su vez, pueden repercutir en su estado nutricional y requerir soporte nutricional. En este contexto, realizamos un estudio para analizar las características clínicas y el estado nutricional de los niños con PC en España.
Hasta donde sabemos, este es el primer estudio multicéntrico realizado en España que describe distintos aspectos nutricionales en niños con PC. Los resultados de nuestro estudio muestran que aproximadamente el 70% de los niños con PC atendidos en unidades de neurología pediátrica españolas que también recibieron atención especializada en gastroenterología y nutrición presentaban afectación motora grave (GMFCS grado IV-V). En general, las medidas en estos pacientes fueron significativamente más bajas para todos los parámetros antropométricos en comparación con los pacientes con GMFCS grados I-II-III, como se ha descrito anteriormente en la literatura24–27.
En cuanto a su estado nutricional, el 28% de los pacientes presentaban desnutrición moderada o grave según el índice de Waterlow, mientras que hasta el 52% presentaba desnutrición según otras mediciones antropométricas. La proporción de pacientes con desnutrición fue significativamente mayor en niños con GMFCS grados IV-V en comparación con niños con GMFCS grados I-II-III. Estudios previos en este campo han arrojado resultados similares. En un estudio español en estudiantes con discapacidades neurológicas (58% con PC), Costa et al. encontraron que aproximadamente el 64% tenía afectación motora de grado IV-V en el GMFCS y, globalmente, el 56% tenía desnutrición según la puntuación z del peso para la edad18. Aunque estos resultados son similares a los de nuestro estudio, el de estos autores se llevó a cabo en un solo colegio y no todos los niños tenían diagnóstico de PC, por lo que es posible que los datos no sean directamente comparables. De manera similar, en otro estudio unicéntrico realizado en España, Martínez de Zabarte Fernández et al. observaron que aproximadamente el 28% de los niños con PC presentaban desnutrición de moderada a grave según el índice de peso de Waterlow, con una prevalencia mayor (74%) en aquellos con GMFCS grados IV-V28. En otros entornos también se han obtenido resultados similares. Por ejemplo, Ruiz Brunner et al. describieron una prevalencia de desnutrición de alrededor del 58%, con desnutrición de moderada a grave en el 54% de los pacientes, que era más frecuente en niños con GMFCS grados IV-V que en aquellos con GMFCS grados I-II-III23. En cambio, otros autores han registrado una prevalencia más baja de desnutrición (22-34%)29,30. A este respecto, cabe señalar que las guías de la ESPGHAN recomiendan que la detección de la desnutrición infantil se base en mediciones antropométricas16. No obstante, Bell et al. observaron que la versión pediátrica del Subjective Global Nutrition Assessment (SGNA, Evaluación Nutricional Global Subjetiva) identificó a más niños como potencialmente desnutridos en comparación con parámetros antropométricos como el IMC, la talla o el peso31. Aunque nuestros hallazgos en lo concerniente a la desnutrición fueron similares a los descritos por otros autores18,23,31, es posible que la prevalencia de la desnutrición se haya infravalorado en nuestro estudio.
Del total de la muestra estudiada, el 41% de los pacientes necesitaban apoyo nutricional, en su mayoría pacientes con afectación motora grave (GMFCS grados IV-V). El soporte nutricional fue oral en la mayoría de los pacientes que lo requirieron, aunque el 45% de los niños con GMFCS grado V precisaron de soporte nutricional enteral. El soporte nutricional en estos pacientes debe ser personalizado, teniendo en cuenta su estado nutricional global y sus requerimientos energéticos, así como la presencia de comorbilidades gastrointestinales y signos de alerta nutricionales32,33. En consecuencia, se recomienda un abordaje multidisciplinar.
En nuestra cohorte, casi la mitad de los pacientes presentaban comorbilidades gastrointestinales, que según la literatura previa son frecuentes en niños con PC34. La comorbilidad gastrointestinal más frecuente en nuestro estudio fue la disfagia, presente en el 48% de los pacientes, con una prevalencia mayor en el grupo GMFCS grados IV-V, en consonancia con la literatura previa29. La mitad de los pacientes en nuestra cohorte presentaban limitaciones para comer y beber (EDACS≥III), de los cuales el 92% fueron clasificados como GMFCS grados IV-V. De manera similar, en un estudio publicado recientemente, García Ron et al. evaluaron el estado nutricional de 44 pacientes españoles con PC, y observaron que el 39% de los pacientes presentaban un grado IV-V de afección motora según el GMFCS y el 43% tenían un nivel de II o superior en la escala EDACS17. Nuestro estudio encontró una proporción mayor de pacientes con limitaciones en la capacidad de comer y beber en ambos grupos GMFCS (70% y 80%, respectivamente); no obstante, hay que tener en cuenta que el estudio de García Ron et al. se llevó a cabo en un solo centro. A pesar de las diferencias observadas, los datos demuestran que la mayoría de los niños españoles con PC tienen dificultades para comer y beber, así como desnutrición en mayor o menor medida.
En general, los resultados sobre el estado nutricional de los pacientes obtenidos en el estudio concuerdan con el hecho de que los pacientes con grados más altos del GMFCS también se clasificaron con niveles más altos en la EDACS. En estos pacientes, la gravedad de la afectación motora causaría el deterioro de las capacidades de comer y beber y por lo tanto una reducción en la ingesta que resultaría en un estado de desnutrición, lo que explica la necesidad más frecuente de soporte nutricional, que se administraba por ruta enteral en una proporción mayor de pacientes en el grupo con GMFCS grado V. Por lo tanto, los facultativos deben ser conscientes de esta situación y evaluar de forma rutinaria a los niños con PC para detectar posibles indicios de desnutrición o comorbilidades como la disfagia. Además, podría ser útil promover un abordaje multidisciplinar.
Nuestro estudio presenta limitaciones. No se puede descartar el sesgo de selección, ya que la inclusión de los pacientes no fue aleatoria. Por consiguiente, existe la posibilidad de que los niños con GMFCS grados IV-V estuvieran sobrerrepresentados en la muestra. Esto se debería a que este tipo de pacientes es más común en las consultas especializadas. No obstante, hay que tener en cuenta que participaron más de 100 pacientes de 10 centros diferentes. Por lo tanto, consideramos que los resultados son representativos de la situación actual de los niños con PC que reciben atención gastroenterológica y nutricional en España y de la práctica clínica habitual, y que reflejan el estado nutricional de los niños con PC y la atención que reciben. Otra de las limitaciones es que no se realizó seguimiento, ya que todos los datos se recogieron en una única visita. En cualquier caso, el estudio aporta información relevante sobre la prevalencia actual de la desnutrición en esta población en función del grado de discapacidad motora, así como otros desenlaces de interés concernientes a los síntomas y comorbilidades en estos pacientes que podrían ser útiles para generar nuevas hipótesis. Sería conveniente realizar estudios longitudinales para evaluar la evolución del estado nutricional de los pacientes que reciben soporte nutricional.
En conclusión, nuestro estudio pone de relieve la prevalencia de desnutrición y las comorbilidades gastrointestinales en la población pediátrica con PC en España, incluso en casos de afectación leve según el GMFCS. Hasta ahora, los datos eran escasos o se centraban en zonas geográficas concretas, mientras que este trabajo ofrece una perspectiva más amplia que abarca diferentes regiones del país. Los resultados de nuestro estudio señalan la necesidad de una vigilancia más estrecha del estado nutricional y las comorbilidades gastrointestinales, incluyendo la disfagia, por parte de los especialistas involucrados en el manejo de estos pacientes, como los neurólogos o gastroenterólogos. Esto subraya la importancia de dedicar más recursos sanitarios a abordar estos problemas asociados a la PC.
FinanciaciónEl presente trabajo fue financiado por Danone Nutricia.
Conflicto de interesesRuth García-Romero, Ramón Cancho Candela y José Luis Peña Segura han recibido honorarios como ponentes en reuniones científicas patrocinadas por Danone Nutricia.
Víctor Manuel Navas López ha recibido honorarios como consultor, becas de investigación, regalías y otros pagos de Danone Nutricia.
Alejandro Rodríguez Martínez y Juan José Díaz Martín han recibido financiación para asistir a reuniones científicas y honorarios como ponentes y consultores en Advisory Boards de Danone Nutricia. El resto de los autores no tienen conflictos de intereses que declarar.
Los autores expresan su agradecimiento a Outcomes’10 por su asistencia en la redacción médica, financiada por Danone Nutricia.
Xenia Alonso Curco; Neurología Pediátrica, Hospital Sant Joan de Deu, Barcelona, España
Gema Arriola; Neurología Pediátrica, Hospital Universitario de Guadalajara, Guadalajara, España
Estibaliz Barredo Valderrama; Neurología Pediátrica, Hospital General Universitario Gregorio Marañón, Madrid, España
Bárbara Blanco Martínez; Neurología Pediátrica, Hospital Universitario Virgen del Rocío, Sevilla, España
Andrés Bodas Pinedo; Gastroenterología Pediátrica, Hospital Clínico San Carlos, Madrid, España
Gonzalo Galicia Poblet; Gastroenterología Pediátrica, Hospital Universitario de Guadalajara, Guadalajara, España
Ainhoa García Ribes; Neurología Pediátrica, Hospital Universitario de Cruces, Bizkaia. Universidad de Alcalá, Madrid, España
Adrián García Ron; Neurología Pediátrica, Hospital Clínico San Carlos, Madrid, España
Ignacio Málaga Diéguez; Neurología Pediátrica, Hospital Universitario Central de Asturias, Oviedo, España
Alejandro Rodríguez Martínez; Gastroenterología Pediátrica, Hospital Universitario Virgen del Rocío, Sevilla, España
Cesar Ruiz García; Neurología Pediátrica, Hospital Regional Universitario de Málaga, Malaga, España
Mariela de los Santos; Gastroenterología Pediátrica, Hospital Sant Joan de Deu, Barcelona, España
Mar Tolín Hernani; Gastroenterología Pediátrica, Hospital General Universitario Gregorio Marañón, Madrid, España
Carlos Tutau Gomez; Gastroenterología Pediátrica, Hospital Universitario de Cruces, Bizkaia, España
Ana María Vegas Álvarez; Gastroenterología Pediátrica, Hospital Universitario Río Hortega, Valladolid, España