La parálisis cerebral (PC) es la causa más frecuente de discapacidad motora en la edad pediátrica. El objetivo es estudiar la situación nutricional de los pacientes con PC controlados en una unidad de referencia, así como la relación entre la afectación neurológica y la nutricional.
Material y métodosEstudio transversal, observacional, descriptivo y analítico en el que se han incluido pacientes con PC con gradosIII-IV-V (GMFCS) procedentes del área de influencia de un hospital pediátrico de referencia, con edades de 4-15años. Se ha realizado: encuesta (con recogida de datos generales, medicaciones y hábitos nutricionales), estudio antropométrico y bioimpedanciometría (BIA).
ResultadosEl estudio incluyó 69 pacientes (reclutamiento 84,15%). Edad media 10,46±0,43años, el 50,7% mujeres. Distribución según GMFCS: gradoIII (36,2%), gradoIV (29%), gradoV (34,8%). Según el peso para la talla: desnutrición moderada el 21,8% (gradoV: 33,3%), desnutrición grave el 5,8% (gradoV: 12,6%), sobrepeso/obesidad el 23,2% (gradoIII: 24%; gradoIV: 35%). Nivel adecuado de masa magra para su talla: gradoIII (36%), gradoIV (55%), gradoV (16,7%). Exceso de grasa: gradoIII (36%), gradoIV (40%), gradoV (29,2%). Comparación de masa grasa: BIA 6,89±0,64kg versus antropometría 5,56±4,43kg.
ConclusionesEn PC grado GMFCSV es frecuente el déficit de peso asociado a disminución de masa magra para su talla. Los pacientes con PC grados GMFCSIII-IV presentan una prevalencia llamativa de sobrepeso/obesidad. La antropometría es una herramienta útil para la valoración nutricional en niños con PC, aunque los niveles de grasa tienden a infravalorarse.
Cerebral palsy (CP) is the most frequent cause of motor disability in the paediatric age. The aim of this article is the study of the nutritional status of patients with CP followed-up in a reference hospital, as well as the relationship between neurological and nutritional state.
Material and methodsA cross-sectional, observational, descriptive and analytical study was conducted on a sample consisting of 4-15years old patients with CP with Gross Motor Function Classification System (GMFCS) gradesIII-IV-V, from a specialised paediatric hospital reference area. An interview (collection of general data, medications and nutritional habits), anthropometric study and bioimpedance (BIA) measurements were carried out.
ResultsThe study included 69 patients (recruitment 84.15%), with a mean age of 10.46±0.43years, and 50.7% females. The distribution according to GMFCS scale was: gradeIII (36.2%), gradeIV (29%), and gradeV (34.8%). According to weight for height: moderate malnutrition 21.8% (gradeV: 33.3%), severe malnutrition 5.8% (gradeV: 12.6%), overweight/obesity 23.2% (gradeIII: 24%, gradeIV: 35%). Adequate level of lean mass for height: gradeIII (36%), gradeIV (55%), and gradeV (16.7%). Fat excess: gradeIII (36%), gradeIV (40%), and gradeV (29.2%). Fat mass comparison: BIA 6.89±0.64kg versus anthropometry 5.56±4.43kg.
ConclusionsIn CP grade GMFCSV, the weight deficit associated with a decrease in lean body mass is common. Patients with CP grades GMFCSIII-IV have a significant prevalence of overweight/obesity. Anthropometry is a useful tool for nutritional assessment in children with CP, although fat levels could be underestimated.
La parálisis cerebral (PC) es la causa más frecuente de discapacidad motora en la edad pediátrica y la tercera causa de trastornos del neurodesarrollo tras la discapacidad intelectual y los trastornos del espectro autista. El concepto PC se refiere a secuelas motoras que pueden ir acompañadas o no de otros trastornos, sin tener implicaciones etiológicas o necesidad de estar relacionadas con eventos adversos o antecedentes determinados.
El estudio europeo Surveillance of Cerebral Palsy in Europe1 estableció la prevalencia de PC en 2-3/1.000 recién nacidos vivos. Este estudio recomienda la edad mínima para el diagnóstico de PC en 3años y la edad óptima en 5años.
Los problemas de alimentación en niños con PC son frecuentes, aunque generalmente los niños con mayor deterioro neurológico son los que presentan más alteraciones nutricionales y de la ingesta2,3. La prevalencia de desnutrición oscila ampliamente entre el 19 y el 50,9% según la serie revisada4,5.
Una nutrición adecuada pretende obtener un crecimiento óptimo, evitando la malnutrición y la aparición de enfermedades carenciales, además de instaurar hábitos saludables ayudando a prevenir la aparición de enfermedades de base nutricional6. Un adecuado estado nutricional permite desarrollar mejor las funciones motoras, las capacidades de cognición, de comunicación y de interacción social, y por lo tanto el desarrollo neuropsicológico globalmente7,8.
La ingesta y la dieta deben ser seguras y eficientes, permitiendo en la medida de lo posible el disfrute con la alimentación. Todo esto requiere una monitorización continua, completa, coordinada y cercana basada en un enfoque multidisciplinar: neuropediatría, gastroenterología, nutricionista/dietista, enfermería, logopedia y rehabilitación6,9.
Los objetivos de este trabajo son: estudiar el estado nutricional de los pacientes con PC de predominio espástico y analizar el grado de compromiso nutricional según las diferencias en la afectación clínica.
Material y métodosSe ha realizado un estudio transversal, observacional, descriptivo y analítico. La población a estudio han sido pacientes de entre 4 y 15años afectos de PC moderada-grave con espasticidad procedentes de la unidad de neuropediatría de un hospital de referencia.
Se incluyeron los pacientes clasificados en nivelesIII-IV-V del Sistema de la Clasificación de la Función Motora Gruesa (Gross Motor Function Classification System [GMFCS]) de Palisano et al.10, modificada en concordancia con la Clasificación Internacional del Funcionamiento (CIF) de la OMS, que divide a los pacientes en grupos en función de su grado de afectación motora.
Se excluyeron los pacientes que no desearon participar en el estudio por decisión propia o de sus tutores, los que no estaban en el rango de edad del estudio o que no cumplían los criterios diagnósticos de PC.
El estudio fue aprobado antes de su desarrollo por el comité de ética regional (CEICA; PI16/039). Todos los pacientes y/o sus tutores firmaron un consentimiento informado.
Tras comprobar que se cumplían los criterios mencionados para ser seleccionados se contactó con ellos o sus tutores para concertar una visita en consulta, donde se realizó una entrevista clínica para recoger variables relacionadas con el estado clínico, la antropometría y los hábitos nutricionales.
Para el estudio antropométrico se tomó la talla calculada mediante la fórmula de estimación de Stevenson11 a partir de la altura de rodilla (AR): talla=AR×2,69+24,2cm. El resto de variables fueron: peso, perímetro de brazo (PB), pliegues subcutáneos (bicipital, tricipital [PST], subescapular, suprailíaco). Para recoger estos datos se emplearon cinta métrica (perímetros y talla por segmentos), plicómetro de Holtain® (pliegues subcutáneos), báscula (peso) y caliper (altura de rodilla). Se ha empleado la fórmula de Siri para estimar la composición corporal.
Se estimaron las puntuaciones estándar (Z-score) para los valores antropométricos empleando el Estudio de Crecimiento de Carrascosa et al. (2010)12, siguiendo las recomendaciones de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) de 2017 de emplear los estándares poblacionales de referencia. Se calculó el índice de masa corporal (IMC) y el peso para la talla (índice de Waterlow [W]) para catalogar el estado nutricional del paciente en función del peso: W=peso actual/peso ideal (p50) para la talla ×100.
Se valoró la composición corporal de los pacientes con bioimpedanciometría (BIA) mediante un bioimpedanciómetro modelo Akern BIA-101 Anniversary. Mediante este método se obtienen datos referentes a agua total (extra e intracelular), masa grasa, masa celular (masa total de células vivas, funcionantes y metabólicamente activas) y masa libre de grasa (masa magra y masa ósea)13,14. Para ello se aplica una corriente alterna imperceptible mediante electrodos adheridos a la piel a una o más frecuencias, detectándose la resistencia (oposición al paso de corriente eléctrica) y la reactancia (demora en la conducción causada por las membranas celulares, las interfaces tisulares y las sustancias no iónicas)13.
Se realizó la BIA tras ayuno de un mínimo de 4h, sin realización de ejercicio físico al menos 12h antes y en máximo reposo. Las determinaciones se realizaron en decúbito supino y una separación entre las extremidades superiores de 20-30° e inferiores a 45°. Los dos electrodos señal se colocaron en la línea media de muñeca y tobillo con el paciente desnudo sobre una camilla de material no conductor, y los electrodos detectores a 4-5cm de los electrodos señal en las líneas metacarpofalángicas y metatarsofalángicas, respectivamente; siempre homolaterales (hemicuerpo).
Para poder valorar adecuadamente la masa magra, sin que influya el bajo peso de los pacientes, se calculó el porcentaje ideal de masa magra para su talla. Para ello, sobre el peso ideal para su talla (según el Estudio de Crecimiento de Carrascosa 2010), se han calculado los kilogramos de masa magra ideales (según estándares de Fomon15 y Haschke16) y, por último, se han dividido los kilogramos de masa magra del paciente sobre ese magro ideal.
Para clasificar el nivel de masa grasa se siguieron los siguientes criterios basados en las categorías sugeridas por Lohman y Going17: déficit (<10% en varones y <15% en mujeres), normal (11-25% en varones y 16-30% en mujeres) y exceso (>25% en varones y >30% en mujeres).
Para el análisis estadístico se empleó el programa SPSS Statics V21.0. Se ha realizado un estudio descriptivo, expresando los resultados en media ±desviación estándar/IC95% (variables cuantitativas) o frecuencias (variables cualitativas). Se comprobó la normalidad de la muestra (test de Kolmogorov-Smirnov y Saphiro-Wilk). Posteriormente se ha realizado un contraste de hipótesis empleando múltiples estadísticos: test chi-cuadrado y test de Fisher (variables cualitativas), t de Student (muestras paramétricas, variables cuantitativa y cualitativa dicotómica), U de Mann Whitney (muestras no paramétricas, variables cuantitativa y cualitativa dicotómica), ANOVA y comparación de Bonferroni (muestras paramétricas, variables cuantitativa y cualitativa no dicotómica), Kruskal-Wallis (muestras no paramétricas, variables cuantitativa y cualitativa no dicotómica).
ResultadosEl número de pacientes que cumplieron los criterios de inclusión fueron 82, aunque 13 rechazaron participar o resultaron ilocalizables, por lo que la muestra final fue de 69 pacientes, con un reclutamiento final del 84,2%. El 50,7% (n=35) eran mujeres. Al catalogar a los pacientes en los diferentes grados de la escala GMFCS la distribución fue: gradoIII 36,2% (n=25), gradoIV 29,0% (n=20), gradoV 34,8% (n=24). La edad media era de 10,46±0,4años (gradoIII 10,83±0,7años, gradoIV 10,89±0,8años, gradoV 9,73±0,7años; p=0,380).
El tipo de PC según el patrón clínico predominante fue: espástica 75,4% (n=52), mixta 17,4% (n=12) y distónica 7,2% (n=5), aunque todos los pacientes presentaban espasticidad (100%). La extensión de la paresia era: tetraparesia (59,4%; n=41), triparesia 21,7% (n=15), diparesia 18,9% (n=13). El 73,9% (n=51) recibían toxina botulínica regularmente, sin diferencias entre grupos.
La vía de alimentación de los pacientes era: exclusivamente oral el 87% (n=60), vía enteral exclusiva el 10,1% (n=7) y de forma mixta el 2,9% (n=2). Un 13% (n=9) de los pacientes de la muestra eran portadores de gastrostomía, todos gradoV.
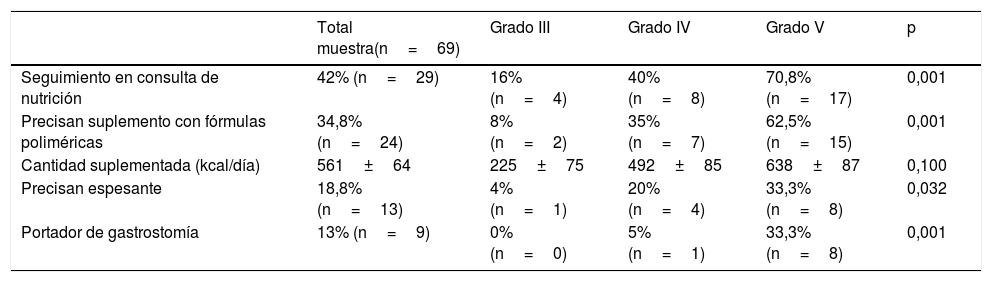
En la tabla 1 se muestran los datos sobre el empleo de suplementos y soporte nutricional en el total de la muestra, donde puede observarse que según aumenta el grado de afectación neurológica se incrementa el empleo de fórmulas poliméricas y espesantes.
Frecuencia de seguimiento en consulta especializada de nutrición y de empleo de suplementos nutricionales por grupos de afectación clínica según escala GMFCS
| Total muestra(n=69) | Grado III | Grado IV | Grado V | p | |
|---|---|---|---|---|---|
| Seguimiento en consulta de nutrición | 42% (n=29) | 16% (n=4) | 40% (n=8) | 70,8% (n=17) | 0,001 |
| Precisan suplemento con fórmulas poliméricas | 34,8% (n=24) | 8% (n=2) | 35% (n=7) | 62,5% (n=15) | 0,001 |
| Cantidad suplementada (kcal/día) | 561±64 | 225±75 | 492±85 | 638±87 | 0,100 |
| Precisan espesante | 18,8% (n=13) | 4% (n=1) | 20% (n=4) | 33,3% (n=8) | 0,032 |
| Portador de gastrostomía | 13% (n=9) | 0% (n=0) | 5% (n=1) | 33,3% (n=8) | 0,001 |
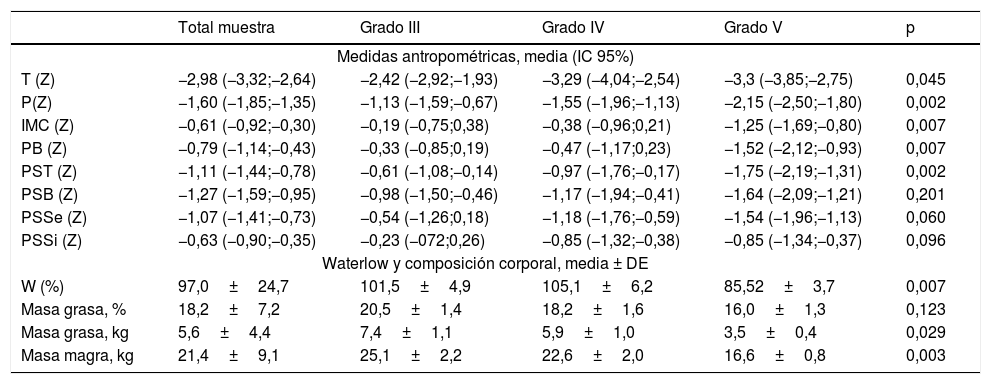
En la tabla 2 se muestran los datos antropométricos y de composición corporal calculada mediante antropometría. Se observa una mayor alteración en los Z-score antropométricos en los pacientes con más afectación motora, especialmente llamativa en las variables de mayor interés para la valoración nutricional en los pacientes con PC: IMC, PB, PST, W.
Valores antropométricos y de composición corporal (mediante medidas antropométricas) por grupos de GMFCS
| Total muestra | Grado III | Grado IV | Grado V | p | |
|---|---|---|---|---|---|
| Medidas antropométricas, media (IC 95%) | |||||
| T (Z) | −2,98 (−3,32;−2,64) | −2,42 (−2,92;−1,93) | −3,29 (−4,04;−2,54) | −3,3 (−3,85;−2,75) | 0,045 |
| P(Z) | −1,60 (−1,85;−1,35) | −1,13 (−1,59;−0,67) | −1,55 (−1,96;−1,13) | −2,15 (−2,50;−1,80) | 0,002 |
| IMC (Z) | −0,61 (−0,92;−0,30) | −0,19 (−0,75;0,38) | −0,38 (−0,96;0,21) | −1,25 (−1,69;−0,80) | 0,007 |
| PB (Z) | −0,79 (−1,14;−0,43) | −0,33 (−0,85;0,19) | −0,47 (−1,17;0,23) | −1,52 (−2,12;−0,93) | 0,007 |
| PST (Z) | −1,11 (−1,44;−0,78) | −0,61 (−1,08;−0,14) | −0,97 (−1,76;−0,17) | −1,75 (−2,19;−1,31) | 0,002 |
| PSB (Z) | −1,27 (−1,59;−0,95) | −0,98 (−1,50;−0,46) | −1,17 (−1,94;−0,41) | −1,64 (−2,09;−1,21) | 0,201 |
| PSSe (Z) | −1,07 (−1,41;−0,73) | −0,54 (−1,26;0,18) | −1,18 (−1,76;−0,59) | −1,54 (−1,96;−1,13) | 0,060 |
| PSSi (Z) | −0,63 (−0,90;−0,35) | −0,23 (−072;0,26) | −0,85 (−1,32;−0,38) | −0,85 (−1,34;−0,37) | 0,096 |
| Waterlow y composición corporal, media ± DE | |||||
| W (%) | 97,0±24,7 | 101,5±4,9 | 105,1±6,2 | 85,52±3,7 | 0,007 |
| Masa grasa, % | 18,2±7,2 | 20,5±1,4 | 18,2±1,6 | 16,0±1,3 | 0,123 |
| Masa grasa, kg | 5,6±4,4 | 7,4±1,1 | 5,9±1,0 | 3,5±0,4 | 0,029 |
| Masa magra, kg | 21,4±9,1 | 25,1±2,2 | 22,6±2,0 | 16,6±0,8 | 0,003 |
IMC: índice masa corporal; P: peso; PB: perímetro braquial; PSB: pliegue subcutáneo bicipital; PSSe: pliegue subcutáneo subescapular; PSSi: pliegue subcutáneo suprailíaco; PST: pliegue subcutáneo tricipital; T: talla; W: peso para la talla (índice Waterlow).
La longitud de tibia y la altura de rodilla no fueron valorables en un paciente al haber sufrido intervención quirúrgica ósea bilateral, por lo que se realizó el tallaje por segmentos.
No se encontraron diferencias al comparar peso, talla e IMC entre sexos.
Al clasificar la muestra según W puede observarse, tal y como se muestra en la tabla 3, que la mayor parte de casos con desnutrición moderada y grave se encuentran en el gradoV mientras que los casos de sobrepeso/obesidad pertenecen de forma predominante a los gruposIII-IV.
Situación nutricional de los pacientes estudiados en función de su grado GMFCS
| Grado PC | Total muestra(n=69) | Grado III | Grado IV | Grado V |
|---|---|---|---|---|
| Sobrepeso/obesidad: W>110% | 23,2% (n=16) | 24% (n=6) | 35% (n=7) | 12,5%(n=3) |
| Normal: W 90-110% | 33,3% (n=23) | 48% (n=12) | 30% (n=6) | 20,8% (n=5) |
| Desnutrición leve: W 80-90% | 15,9% (n=11) | 8% (n=2) | 20% (n=4) | 20,8% (n=5) |
| Desnutrición moderada: W 70-79% | 21,8% (n=15) | 16% (n=4) | 15% (n=3) | 33,3% (n=8) |
| Desnutrición grave: W<70% | 5,8% (n=4) | 4% (n=1) | 0% (n=0) | 12,6% (n=3) |
W: peso para la talla (índice de Waterlow).
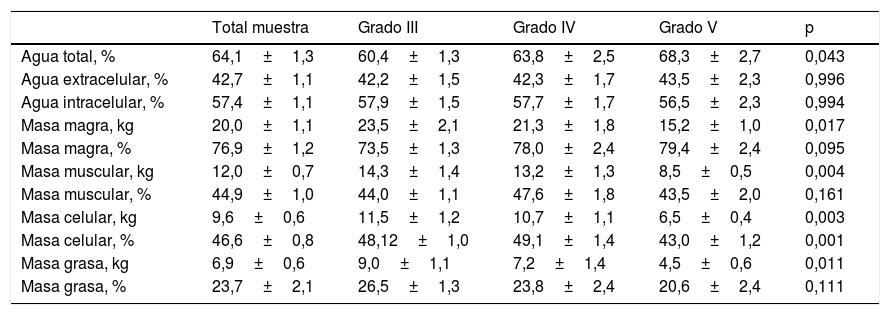
En la tabla 4 se muestran los datos de composición corporal obtenidos mediante BIA. Se observa disminución significativa de la masa celular en el grupoV con respecto a los otros grupos. También se observa disminución de masa magra, muscular y grasa, pero únicamente en cuanto a cantidad y no a porcentaje de composición corporal.
Composición corporal calculada mediante bioimpedanciometría (BIA) según grupos GMFCS
| Total muestra | Grado III | Grado IV | Grado V | p | |
|---|---|---|---|---|---|
| Agua total, % | 64,1±1,3 | 60,4±1,3 | 63,8±2,5 | 68,3±2,7 | 0,043 |
| Agua extracelular, % | 42,7±1,1 | 42,2±1,5 | 42,3±1,7 | 43,5±2,3 | 0,996 |
| Agua intracelular, % | 57,4±1,1 | 57,9±1,5 | 57,7±1,7 | 56,5±2,3 | 0,994 |
| Masa magra, kg | 20,0±1,1 | 23,5±2,1 | 21,3±1,8 | 15,2±1,0 | 0,017 |
| Masa magra, % | 76,9±1,2 | 73,5±1,3 | 78,0±2,4 | 79,4±2,4 | 0,095 |
| Masa muscular, kg | 12,0±0,7 | 14,3±1,4 | 13,2±1,3 | 8,5±0,5 | 0,004 |
| Masa muscular, % | 44,9±1,0 | 44,0±1,1 | 47,6±1,8 | 43,5±2,0 | 0,161 |
| Masa celular, kg | 9,6±0,6 | 11,5±1,2 | 10,7±1,1 | 6,5±0,4 | 0,003 |
| Masa celular, % | 46,6±0,8 | 48,12±1,0 | 49,1±1,4 | 43,0±1,2 | 0,001 |
| Masa grasa, kg | 6,9±0,6 | 9,0±1,1 | 7,2±1,4 | 4,5±0,6 | 0,011 |
| Masa grasa, % | 23,7±2,1 | 26,5±1,3 | 23,8±2,4 | 20,6±2,4 | 0,111 |
El 14,5% (n=10) de los pacientes tenían déficit de grasa según el estudio bioimpedanciométrico, el 50,7% (n=35) un porcentaje normal y el 34,8% (n=24) exceso. Según los niveles de GMFCS (p=0,104):
- •
III: 0% (n=0) tienen defecto de grasa, 64% (n=16) cantidad normal y 36% (n=9) exceso.
- •
IV: defecto 20% (n=4), normal 40% (n=8), exceso 40% (n=8).
- •
V: defecto 25% (n=6), normal 50% (n=12), exceso 25% (n=6).
La cantidad de masa grasa en varones era: 11,8% déficit (<10%), 41,2% normal (11-25%), 47% exceso (>25%). La cantidad de masa grasa en mujeres era: 17,1% déficit (<15%), 60% normal (16-30%), 22,9% exceso (>30%). No se encontró relación entre sexo y normalidad/exceso/defecto de grasa en la composición corporal según BIA.
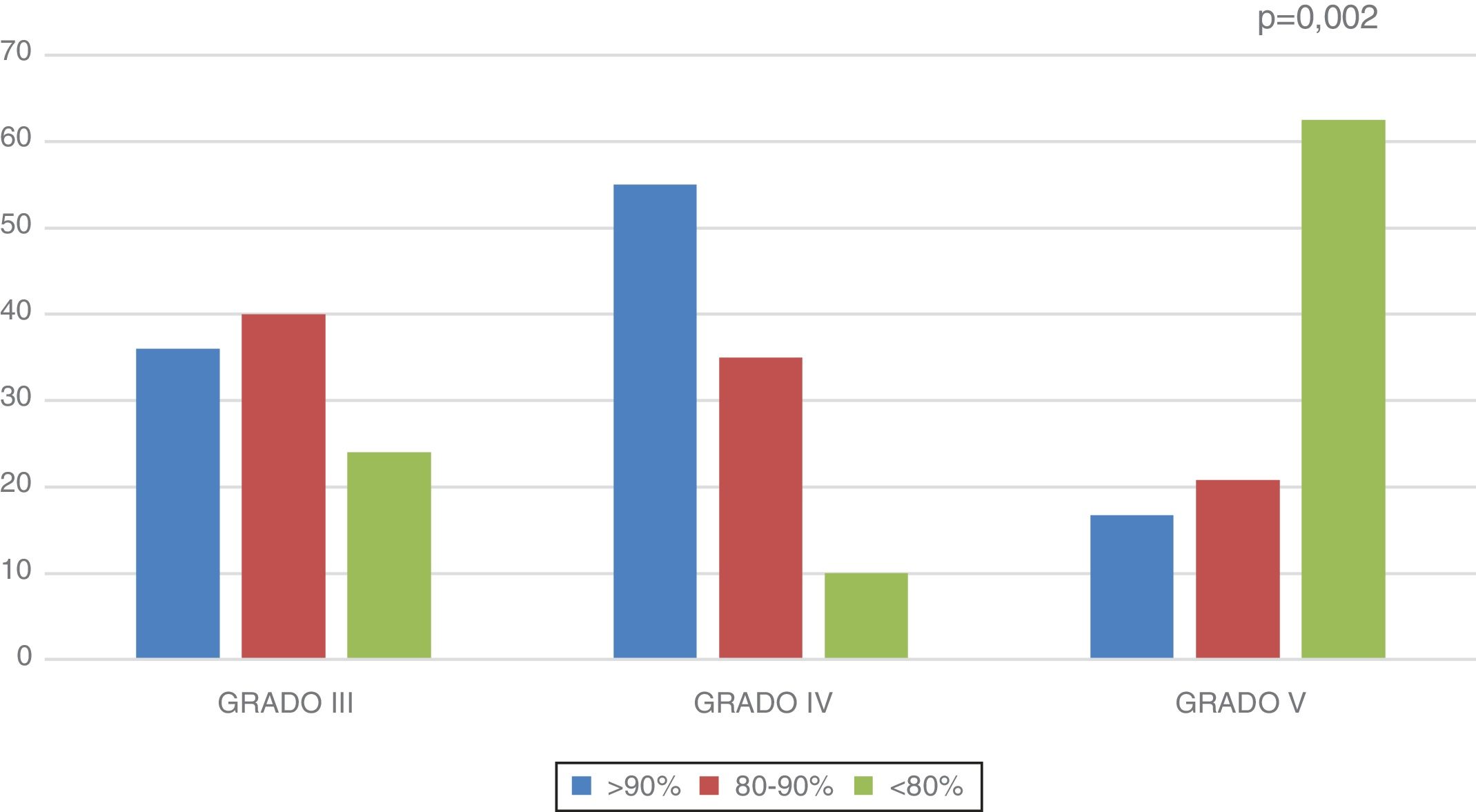
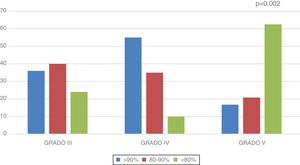
El porcentaje medio de masa magra respecto al ideal para su talla fue 88,77±2,4% en el total de la muestra. Este es mayor en los gradoIII (88,93±3,5%) y gradoIV (98,31±5,7%) y menor en gradoV (80,66±2,8%) (p=0,012). En la figura 1 se muestra la distribución por grupos del porcentaje de masa magra con respecto al ideal.
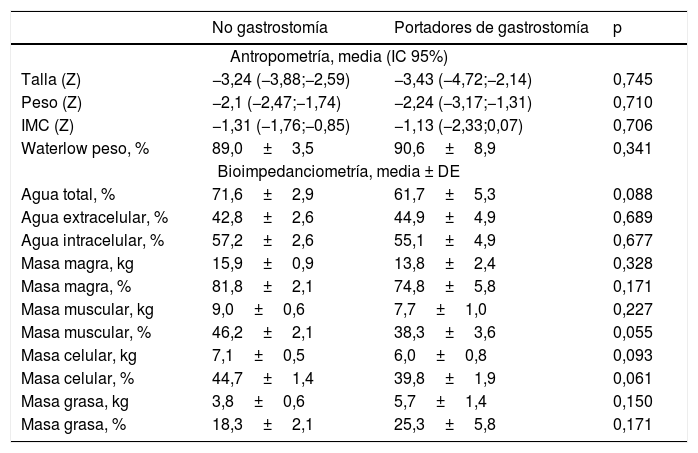
Entre los pacientes gradoV (n=24), un 33,3% (n=8) llevaban gastrostomía. La edad media de los pacientes con gastrostomía era de 9,73±3,3años (sin diferencias entre pacientes con/sin gastrostomía), siendo el 50% mujeres. El tiempo transcurrido desde la colocación de la gastrostomía y el estudio era de 43,89±8,5meses. En la tabla 5 se muestra la comparativa de resultados de composición corporal y marcadores nutricionales entre pacientes con/sin gastrostomía, donde parece que los pacientes con gastrostomía presentan niveles menores de masa muscular y celular.
Estudio antropométrico y de composición corporal mediante bioimpedanciometría (BIA) de los pacientes GMFCS V con/sin sonda nasogástrica
| No gastrostomía | Portadores de gastrostomía | p | |
|---|---|---|---|
| Antropometría, media (IC 95%) | |||
| Talla (Z) | −3,24 (−3,88;−2,59) | −3,43 (−4,72;−2,14) | 0,745 |
| Peso (Z) | −2,1 (−2,47;−1,74) | −2,24 (−3,17;−1,31) | 0,710 |
| IMC (Z) | −1,31 (−1,76;−0,85) | −1,13 (−2,33;0,07) | 0,706 |
| Waterlow peso, % | 89,0±3,5 | 90,6±8,9 | 0,341 |
| Bioimpedanciometría, media ± DE | |||
| Agua total, % | 71,6±2,9 | 61,7±5,3 | 0,088 |
| Agua extracelular, % | 42,8±2,6 | 44,9±4,9 | 0,689 |
| Agua intracelular, % | 57,2±2,6 | 55,1±4,9 | 0,677 |
| Masa magra, kg | 15,9±0,9 | 13,8±2,4 | 0,328 |
| Masa magra, % | 81,8±2,1 | 74,8±5,8 | 0,171 |
| Masa muscular, kg | 9,0±0,6 | 7,7±1,0 | 0,227 |
| Masa muscular, % | 46,2±2,1 | 38,3±3,6 | 0,055 |
| Masa celular, kg | 7,1±0,5 | 6,0±0,8 | 0,093 |
| Masa celular, % | 44,7±1,4 | 39,8±1,9 | 0,061 |
| Masa grasa, kg | 3,8±0,6 | 5,7±1,4 | 0,150 |
| Masa grasa, % | 18,3±2,1 | 25,3±5,8 | 0,171 |
IMC: índice de masa corporal.
Para mantener una adecuada situación nutricional en los pacientes con PC debe realizarse una evaluación periódica y rutinaria del estado nutricional que permita detectar situaciones de desnutrición o de riesgo precozmente5. Sin embargo, menos de la mitad de los pacientes estudiados siguen controles habituales por un especialista en nutrición.
Debido a su accesibilidad, la antropometría es el método más habitual para valorar la evolución nutricional, siendo talla, peso, PST y PB los parámetros más recomendados para el seguimiento de los pacientes con PC4,5,18,19.
Con respecto a la talla, se observó una alteración directamente proporcional a la gravedad de la PC. Esto era esperable, ya que el patrón de crecimiento y de composición corporal en pacientes con PC es diferente a la población estándar para su misma edad y sexo20. Como en este estudio, el déficit de crecimiento suele ser mayor cuanto más grave sea la afectación neurológica y nutricional21. Para el tallaje de los pacientes gradosIII-V suelen encontrarse dificultades al presentar escoliosis, espasticidad y otras alteraciones de la postura corporal. Por ello es recomendable emplear medidas segmentales que mediante fórmulas estiman la talla8,22, siendo la altura de rodilla la que parece presentar menor error técnico y coeficiente de variación intraobservador e interobservador19,23.
Para valorar el peso es aconsejable relacionarlo con la altura mediante IMC y/o W. El W ha detectado mayor porcentaje de pacientes con desnutrición en el grado GMFCSV. Sin embargo, los gradosIII-IV presentan alta prevalencia de sobrepeso/obesidad con exceso de masa grasa. Este exceso de peso es relativamente frecuente en los gruposIII-IV sin problemas con la ingesta, en relación con la afectación de su movilidad y deambulación20.
Existen unas tablas de peso, talla e IMC publicadas por Day et al.21 en 2007 que son específicas para niños con PC según grado de afectación motora4. Estas son únicamente descriptivas y no están estandarizadas, ya que hay múltiples factores en el estudio que afectan a las variables antropométricas, como una alta tasa de malnutrición, de modo que no representan un patrón de crecimiento ideal. Por esto la ESPGHAN recomienda no emplear estas tablas de forma rutinaria para la detección de problemas nutricionales en niños con PC, sino que lo más correcto es seguir los estándares poblacionales de referencia19.
Además del peso, de la talla y de sus relaciones, la ESPGHAN recomienda realizar mediciones sistemáticas de pliegues subcutáneos (especialmente PST) y PB para monitorizar la situación nutricional19. En la muestra, los pacientes con afectación neurológica más grave presentan valores más bajos de PST y PB. En la literatura existe controversia, ya que algunos trabajos presentan una tendencia similar, mientras que otros no encuentran ninguna relación entre el grado de afectación neurológica y las variaciones en los pliegues y perímetros20,24, por lo que deberían realizarse más estudios para confirmar estos hallazgos.
Además de situar las medidas antropométricas según su Z-score, es importante conocer cómo se distribuye la masa del paciente según su composición corporal. Esto puede realizarse mediante fórmulas a partir de los pliegues cutáneos, aunque pueden no ser muy precisas en los niños con PC19. Existen otros métodos para estudiar la composición corporal, siendo fundamental a nivel clínico la BIA19. La BIA es un método seguro, fiable, indoloro y rápido para estudiar la composición corporal que permite mayor precisión y menor variabilidad interobservador e intraobservador corporal20,25.
En el análisis de la BIA se ha encontrado un nivel total (kg) de masa muscular, masa magra y masa grasa menor en los pacientes con mayor grado GMFCS. Resultados similares se han descrito previamente, observando que mayor afectación neurológica asocia menor peso corporal, menor crecimiento y menor masa magra4.
En cuanto al porcentaje de masa magra, este es superior en los pacientes gradoV; sin embargo, al ajustar la masa magra para su talla se ha encontrado un déficit mayor en este grupo. Por esto es importante valorar los datos obtenidos relacionándolos con su edad, talla y sexo. Resulta llamativo que la masa magra para la talla es mayor en los pacientes gradoIV que en los gradoIII. Esto puede deberse a que un 40% de los pacientes gradoIV siguen controles en la unidad de nutrición y solo el 16% de los gradoIII. Otros trabajos han encontrado estos cambios positivos en la composición corporal cuando se inicia seguimiento nutricional habitual26, de forma que la ESPGHAN recomienda realizar controles nutricionales en los pacientes con PC cada 1-3meses19.
Otro dato aportado por la BIA es la masa celular, considerada un buen marcador para estudiar la situación nutricional14. Como en la muestra, Sung et al.27 hallaron en 2017 en una serie de 146 pacientes una disminución de masa celular en aquellos con mayor afectación neurológica, especialmente gradoV. En relación con el compartimento graso, un estudio de Kuperminc et al.20 en 2008 analizó el porcentaje de masa grasa normal en pacientes con gradosIII-V, encontrando porcentajes de grasa menores que los hallados en todos los grupos.
En comparación con la BIA, la antropometría infravalora la masa grasa y sobreestima el magro. Se estima que la antropometría genera un error sistemático de aproximadamente 1,3kg al medir masa grasa, similar al del presente trabajo20. Esto puede deberse a que la reducción de los pliegues cutáneos periféricos no indican necesariamente reducción de los depósitos grasos, ya que los niños con PC acumulan grasa preferentemente de manera central19,28.
Cuando la alimentación oral no logra un adecuado aporte de nutrientes, genera disconfort o situaciones de riesgo, puede colocarse una gastrostomía3,19. La tasa de pacientes con gastrostomía concuerda con el 10-33% de otras series7. Al comparar la situación nutricional entre pacientes con/sin gastrostomía, otros estudios concluyen que aquellos con gastrostomía presentan mejores datos nutricionales especialmente en peso, IMC, masa grasa y masa magra2,21. Sin embargo, en esta muestra los pacientes con gastrostomía presentan únicamente mejorW, con aumento de masa grasa sin lograr aumento de magro. Esto podría deberse a una mayor afectación neurológica en los pacientes con gastrostomía, o a que mediante gastrostomía tiende a aumentarse de forma notable la cantidad de grasa en la dieta2.
La principal limitación del estudio es no disponer de una muestra mayor especialmente en la división por grupos, aunque la muestra refleja la población de un hospital de referencia con suficiente volumen y los resultados obtenidos son suficientemente significativos. Por otro lado, podría ser interesante ampliar este estudio con otros que permitieran contrastar la situación nutricional con afectación real en la calidad de vida.
A modo de conclusión, puede decirse que los pacientes con PC y afectación neurológica más grave presentan más frecuentemente desnutrición, mientras que en las formas menos graves un tercio de los casos asocian sobrepeso u obesidad. Aunque la antropometría es una herramienta accesible y muy útil para la valoración nutricional, la BIA puede ser un buen complemento para la monitorización no invasiva de la composición corporal, ya que la antropometría clásica infravalora la masa grasa y sobreestima la masa magra. Al ajustar la masa magra para la talla se ha encontrado un déficit mayor en los pacientes gradoV, de ahí que sea interesante valorar los datos obtenidos relacionándolos con la edad, la talla y el sexo. Por todo esto, es importante la realización de valoraciones sistemáticas e individualizadas en los pacientes con PC para asegurar un buen manejo nutricional y una mejora de su estado de salud, calidad de vida y desarrollo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a Ana Moráis su contribución al desarrollo del concepto del magro ajustado a la talla.