La leucemia mieloblástica aguda (LMA) constituye la segunda hemopatía maligna en la población pediátrica y una de las principales causas de mortalidad por cáncer infantil. La supervivencia se sitúa alrededor del 60% sin haber mejorado en las últimas décadas, por lo que son necesarios nuevos enfoques terapéuticos. El efecto antileucémico ejercido por los linfocitos y las células natural killer (NK) del sistema inmunológico está bien establecido en el trasplante de células madre hematopoyéticas pero también como estrategia de inmunoterapia adoptiva tras la quimioterapia de consolidación.
Pacientes y métodosDe manera retrospectiva, se analizan las características clínicas de los pacientes diagnosticados de LMA en nuestro centro durante el período 1996-2014. Además en 10 leucemias agudas, 5 linfoides y 5 mieloides, se analizaron la intensidad media de fluorescencia de HLA-I, MICA-B, ULBP1-4, ligandos para los receptores de las células NK.
ResultadosUn total de 67 pacientes formaron parte de este análisis. La supervivencia libre de eventos con una mediana de seguimiento de 25 meses fue del 62% (IC del 95%, 55-67). Las LMA con menor supervivencia fueron las secundarias, las no M3 y las carentes de marcadores citogenéticos favorables. La probabilidad de recaída fue del 38% (IC del 95%, 31-45). La expresión de HLA-I y ULBP-4 fue significativamente menor en los blastos mieloides que en los linfoides.
ConclusionesNuestros resultados clínicos son similares a los descritos en la literatura. No se ha modificado significativamente la supervivencia en las últimas décadas y la probabilidad de recaída sigue siendo elevada. Los blastos mieloides podrían ser más susceptibles a las células NK al expresar menos HLA-I, por lo que estrategias de terapia celular podrían ser eficaces tal y como reportan otros grupos.
Acute myeloid leukaemia (AML) is the second haematological malignancy in the paediatric population, and one of the leading causes of childhood cancer mortality. Survival is currently around 60%, with no improvement in last decades, suggesting that new therapeutic approaches are needed. The anti-leukaemia effect mediated by the lymphocytes and natural killer (NK) cells of the immune system has been established in haematopoietic stem cell transplantation, and also as adoptive immunotherapy after consolidation chemotherapy schemes.
Patients and methodsA retrospective study was conducted on the clinical characteristics of patients diagnosed and treated for AML in our centre during 1996-2014. The mean fluorescence intensities of HLA-I, MICA/B and ULBP1-4, ligands for NK cell receptors, were also analysed in ten new diagnosed leukaemia cases, five myeloid and five lymphoid.
ResultsA total of 67 patients were used in this analysis. With a median follow up of 25 months, the event-free survival was 62% (95% CI: 55-67). Secondary AML, non-M3 phenotype, and the absence of favourable cytogenetic markers had a lower survival. The probability of relapse was 38% (95% CI: 31-45). The expression of HLA-I and ULBP-4 was significantly lower in myeloid than in lymphoid blast cells.
ConclusionsOur clinical results are similar to those described in the literature. Survival did not significantly change in recent decades, and the likelihood of relapse remains high. Myeloid blasts might be more susceptible to the cytotoxicity of NK cells through their lower expression of HLA-I. NK therapy strategies in minimal disease situation could be effective, as reported by other groups.
La leucemia mieloblástica aguda (LMA) constituye el 20% de todas las leucemias agudas infantiles1. Se diagnostican cerca de 60 casos al año en nuestro país. Los esquemas de tratamiento actualmente vigentes se basan en la administración de poliquimioterapia, combinando altas dosis de citarabina con antracíclicos e inhibidores de topoisomerasa2. Además, los pacientes con mala respuesta al tratamiento de inducción; los considerados al inicio de alto riesgo, bien por tratarse de una LMA secundaria o por sus características citogenéticas, y los pacientes clasificados de riesgo intermedio con donante familiar idéntico, son subsidiarios de recibir en primera remisión completa un trasplante alogénico de progenitores hematopoyéticos (TPH)3,4.
La supervivencia de los pacientes con LMA ha mejorado sustancialmente en los últimos 40 años, fundamentalmente debido a la mejoría en el tratamiento de soporte. Sin embargo se ha estancado en el 60% en las últimas décadas. Conocemos cada vez más la heterogeneidad genética de la LMA y su importancia en el pronóstico5,6. Existen alteraciones citogenéticas con pronóstico favorable como las t(8;21)(q22;q22), inv(16)(p13.1q22) o t(16;16)(p13.1;q22), t(15;17)(q22;q12), cuya presencia se traduce en una supervivencia del 80% solo con quimioterapia; mientras que las alteraciones desfavorables como 5q, t(6;9)(p23;q34), monosomía 7 y los cariotipos complejos, son refractarios a la quimioterapia e incluso con TPH alcanzan una supervivencia no superior al 40%6–8.
Hasta el momento el potencial de estas alteraciones genéticas como dianas terapéuticas no ha impactado de manera significativa en la supervivencia9,10. Recientemente, y de manera complementaria a los fenómenos genéticos y epigenéticos, se está desarrollando un enfoque inmunobiológico en la LMA11,12. Los datos que sustentan este acercamiento inmunológico residen en varias observaciones: a) el papel tan importante del TPH3,13; b) el éxito de la inmunoterapia adoptiva con linfocitos del donante postrasplante para revertir la enfermedad mínima residual y/o quimerismo mixto hematopoyético14,15; y c) la experiencia clínica y preclínica favorable con algunos anticuerpos como gemtuzumab (anti-CD33) y anticuerpos biespecíficos de linfocitos T (CD33/CD3, AMG 330)16,17.
En este sentido, el grupo de Perugia liderado por el Dr. Velardi ha puesto de relieve el efecto antileucemia del TPH de donante haploidéntico en pacientes adultos con LMA a través de los linfocitos natural killer (NK) del donante18,19. Posteriormente, el grupo de St Jude confirmó estos datos en LMA pediátrica y ha sido pionero en desarrollar un esquema de terapia celular con NK como tratamiento de consolidación en pacientes con LMA de riesgo bajo e intermedio20. Conocemos cómo la actividad antileucemia de las células NK está regulada por el reconocimiento a través de receptores inhibidores y activadores de sus ligandos en las células blásticas21. Estos ligandos son las moléculas human leucocyte antigen class I (HLA-I), para los receptores inhibidores, y major histocompatibility complex (MHC) class i–related chain A/B (MICA/B), y UL16-binding proteins 1-4 (ULBP 1-4), para los receptores activadores22.
En este trabajo revisamos de manera retrospectiva nuestra experiencia en el manejo de la LMA pediátrica y describimos en 10 leucemias agudas (5 mieloides y 5 linfoides) la expresión de los ligandos de los receptores de las células NK en las células blásticas, comparando dicha expresión en ambos tipos de leucemia aguda, con el objetivo de aportar nuevos datos que persigan incorporar la inmunoterapia adoptiva con células NK en los protocolos convencionales de quimioterapia.
Pacientes y métodoPacientesDe manera retrospectiva, se recogen los datos epidemiológicos, las características morfológicas según la clasificación French-American-British (FAB)23 o la clasificación inmunológica propuesta por el grupo europeo (EGIL)24, las alteraciones citogenéticas, el tratamiento y la evolución de los pacientes diagnosticados de LMA en el período comprendido entre 1996 y 2014, en la unidad de Hemato-Oncología Infantil del Hospital Universitario La Paz de Madrid, España (tabla 1). Los pacientes fueron tratados consecutivamente según las sucesivas versiones del protocolo de la Sociedad Española de Hemato-Oncología Pediátrica (SHOP-96, SHOP-2001, SHOP-2007). Quedaron excluidos del análisis los pacientes con LMA y con síndrome de Down. Para los estudios biológicos, se obtuvo consentimiento informado de todos los responsables de los pacientes y se obtuvo aprobación para este estudio por parte del Comité de Ética del Hospital La Paz.
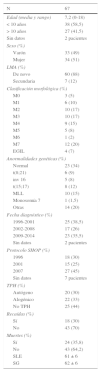
Características de los pacientes pediátricos diagnosticados de LMA durante el período 1996-2014 en nuestra unidad
| N | 67 |
|---|---|
| Edad (media y rango) | 7,2 (0-18) |
| < 10 años | 38 (58,5) |
| > 10 años | 27 (41,5) |
| Sin datos | 2 pacientes |
| Sexo (%) | |
| Varón | 33 (49) |
| Mujer | 34 (51) |
| LMA (%) | |
| De novo | 60 (88) |
| Secundaria | 7 (12) |
| Clasificación morfológica (%) | |
| M0 | 3 (5) |
| M1 | 6 (10) |
| M2 | 10 (17) |
| M3 | 10 (17) |
| M4 | 9 (15) |
| M5 | 5 (8) |
| M6 | 1 (2) |
| M7 | 12 (20) |
| EGIL | 4 (7) |
| Anormalidades genéticas (%) | |
| Normal | 23 (34) |
| t(8;21) | 6 (9) |
| inv 16 | 5 (8) |
| t(15;17) | 8 (12) |
| MLL | 10 (15) |
| Monosomía 7 | 1 (1,5) |
| Otras | 14 (20) |
| Fecha diagnóstico (%) | |
| 1996-2001 | 25 (38,5) |
| 2002-2008 | 17 (26) |
| 2009-2014 | 23 (35,5) |
| Sin datos | 2 pacientes |
| Protocolo SHOP (%) | |
| 1996 | 18 (30) |
| 2001 | 15 (25) |
| 2007 | 27 (45) |
| Sin datos | 7 pacientes |
| TPH (%) | |
| Autógeno | 20 (30) |
| Alogénico | 22 (33) |
| No TPH | 25 (44) |
| Recaídas (%) | |
| Sí | 18 (30) |
| No | 43 (70) |
| Muertes (%) | |
| Sí | 24 (35,8) |
| No | 43 (64,2) |
| SLE | 61 ± 6 |
| SG | 62 ± 6 |
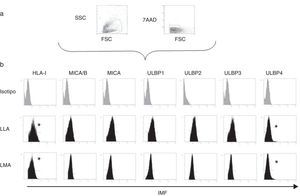
En 10 muestras de aspirado de médula ósea obtenidas en el momento del diagnóstico y correspondientes a 5 pacientes con LMA y 5 pacientes con leucemia linfoblástica aguda y mediante citometría de flujo multiparamétrica, utilizando el citómetro Becton Dickinson FACS CANTO II, se determinó la intensidad media de fluorescencia (IMF) de HLA-I, constituyen los ligandos de los receptores inhibidores KIR de las células NK, ligando para los receptores inhibidores de las células NK, y MICA-B, ULBP-1, ULBP-2, ULBP-3 y ULBP-4, ligandos del receptor activador NKG2D de las células NK, en las células leucémicas seleccionadas previamente mediante tamaño y complejidad. Se utilizaron los siguientes anticuerpos: HLA-I-PE (clon G46-2.6) de Beckton Dickinson; y MICA-PE (clon 159227), MICB-PE (clon 236511), ULBP-1-PE (clon 170818), ULBP-2/5/6-APC (clon 165903), ULBP3-PE (clon 166510), ULBP4-PE (clon 709116) de R&D Sytems. El nivel de expresión se definió como la ratio de la intensidad media de fluorescencia de los valores obtenidos con los anticuerpos específicos divididos por los valores obtenidos mediante la autofluorescencia de las células.
Análisis estadísticoLos datos se expresaron en media ± desviación estándar, salvo que se indicara otra unidad de medida. Los cálculos estadísticos fueron realizados utilizando el paquete estadístico SPSS 12.0 para Windows (Statistical Package for the Social Sciences). La supervivencia libre de eventos (SLE), definidos como recaída o muerte, es la principal variable del estudio y se calculó con el método de Kaplan-Meier, y la prueba log rank test, con el intervalo de confianza del 95%. También se calculó la probabilidad de recaída y de muerte no relacionada con la enfermedad (muerte tóxica) por este mismo método. Se utilizó el test no paramétrico U de Mann-Whitney para buscar diferencias estadísticas entre las variables no paramétricas. Se consideró una diferencia estadísticamente significativa cuando la p<0,05.
ResultadosCaracterísticas de los pacientesEntre 1996 y 2014, un total de 67 pacientes (33 niños y 34 niñas) con una media de edad de 7,2 años (rango 0-18) fueron diagnosticados de LMA y recibieron tratamiento en nuestra unidad según los protocolos SHOP-96 (30%), SHOP-2001 (25%), o SHOP-2007 (45%). Las características epidemiológicas de los pacientes con LMA incluidas en las diferentes versiones del protocolo SHOP fueron homogéneas.
En 60 pacientes (88%) el diagnóstico fue LMA de novo, mientras que 7 pacientes (12%) presentaron LMA secundaria o relacionada con síndromes mielodisplásicos. La clasificación morfológica y las alteraciones citogenéticas se muestran en la tabla 1. Un 66% de los pacientes presentaba alteraciones citogenéticas, mientras que un 34% presentaba una citogenética normal. Hasta un tercio de los pacientes (29%) presentaba alteraciones citogenéticas consideradas de buen pronóstico como son t(8;21), inv16 y la t(15;17), un 20% presentaba alteraciones citogenéticas sin factor pronóstico conocido y un 16,5% de los pacientes presentaba alteraciones citogenéticas desfavorables, reordenamiento del gen MLL y monosomía del 7.
Un total de 25 pacientes (44%) se trató solo con quimioterapia. Un total de 20 pacientes (30%) recibieron un TPH autólogo (el último el 30 de abril del 2012) y un total de 22 pacientes (33%) recibieron un TPH alogénico (7 de un donante familiar HLA idéntico, 7 de un donante no familiar HLA idéntico, 4 de sangre de cordón umbilical y 4 de un donante haploidéntico).
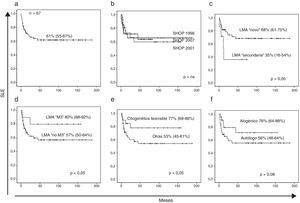
En el momento de redactar este documento, 24 pacientes habían fallecido, 13 de ellos por enfermedad y 11 por complicaciones relacionadas con el tratamiento (infecciosas en 9 pacientes y hemorrágicas en 2 pacientes). Con una mediana de seguimiento de 26 meses, la SLE de los pacientes con LMA de nuestra serie fue del 61% (IC del 95%, 55-67%) (fig. 1 a) y la supervivencia global del 62% (IC del 95%, 56-68%). La probabilidad de recaída fue del 38% (IC del 95%,31-45%) y la probabilidad de muerte no relacionada con la LMA fue del 19% (IC del 95%, 14-23%) (fig. 2 a y b).
a) Supervivencia libre de evento (muerte y recaída). b) Supervivencia libre de evento según los diferentes protocolos SHOP. c) Supervivencia libre de evento en LMA «de novo» y secundarias. d) Supervivencia libre de evento en las LMA M3 respecto al resto. e) Supervivencia libre de eventos en las LMA con traslocaciones favorables: t(8;21), inv(16), t(15;17) respecto al resto. f) Supervivencia libre de eventos en los pacientes que recibieron un TPH alogénico respecto a los que no lo recibieron.
En el análisis univariante para la SLE no encontramos diferencias entre el sexo, edad o versión de protocolo SHOP (fig. 1 b). Se observan diferencias significativas en la SLE entre LMA de novo vs. secundarias (68%, IC del 95% 61-75 vs. 35%, IC del 95% 16-54), LMA M3 vs. distinta de M3 (80%, IC del 95% 68-92 vs. 57%, IC del 95% 50-64) y presencia vs. ausencia de alteraciones citogenéticas favorables (77%, IC del 95% 68-86 vs. 53%, IC del 95% 45-61) (fig. 1 c-e). La probabilidad de recaída en los grupos con citogenética favorable no es significativamente inferior (29 vs. 42%, p=0,07). No se observan diferencias significativas entre la probabilidad de recaída o muerte tóxica entre las diferentes versiones de protocolo de tratamiento SHOP (tabla 2).
Probabilidad de recaía y muerte tóxica en las diferentes versiones del protocolo SHOP en nuestra serie
| % | SHOP 1996 | SHOP 2001 | SHOP 2007 | p |
|---|---|---|---|---|
| Recaída | 22% (IC del 95%, 11-33) | 32% (IC del 95%, 19-45) | 45% (IC del 95%, 33-57) | 0,6 (ns) |
| Muerte tóxica | 33% (IC del 95%, 23-43) | 14% (IC del 95%, 6-22) | 8% (IC del 95%, 6-14) | 0,2 (ns) |
ns: no significativa.
El número de TPH alogénicos ha aumentado significativamente en el protocolo SHOP-2007 con respecto a los previos (SHOP-2007 53% vs. SHOP-2001 25%, y SHOP-1996 26%). Por el contrario, el número de TPH autólogos han disminuido en el protocolo actual (SHOP-2007 15% vs. SHOP-2001 58% y SHOP-1996 46%). En cuanto al impacto del TPH en la SLE, se observa una tendencia favorable pero no estadísticamente significativa (76%, IC del 95% 64-88% vs. 56%, IC del 95% 48-64%; p=0,08) (fig. 1 f).
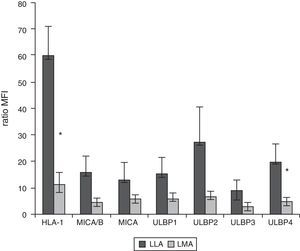
Expresión de HLA-I y ligandos de NKG2D en blastos leucémicos en pacientes pediátricosMediante citometría de flujo multiparamétrica se determinó la expresión de los ligandos HLA-I y MICA/B y ULBP-1, ULPB-2, ULPB-3 y ULBP-4 en 10 muestras de blastos leucémicos analizados según el tamaño y la complejidad (tabla 3). Observamos cómo en los blastos mieloides la intensidad media de fluorescencia es significativamente menor en HLA- I (11±3 vs. 60±10, p<0,05) y en ULBP-4 (5±2 vs. 20±7, p<0,05) que en los blastos linfoides. Las diferencias en MICA/B, ULBP-1, ULBP-2 y ULBP-3 no fueron significativas (figs. 3 y 4).
Ratio de la intensidad media de fluorescencia (IMF) de los blastos mieloides y linfoides. El experimento es el resultado del análisis de 10 leucemias agudas, 5 mieloblásticas y 5 linfoblásticas
| HLA-I | MICA/B | MICA | ULBP1 | ULBP2 | ULBP3 | ULBP4 | |
|---|---|---|---|---|---|---|---|
| LLA | 60±10 | 16±6 | 13±6 | 15±6 | 27±13 | 9±4 | 20±7 |
| LMA | 11±3 | 4±1 | 6±2 | 6±2 | 7±2 | 3±1 | 5±2 |
Se muestran la media ± desviación estándar. En cursiva y negrita se expresan las diferencias estadísticamente significativas.
a) Esquema de selección de los blastos leucémicas en función del tamaño, complejidad, expresión de CD45 y viabilidad. b) Intensidad media de fluorescencia de los ligandos para los receptores inhibidores y activatorios en los blastos mieloides y linfoides. Se muestra el ejemplo de un paciente de cada grupo.
*: diferencia estadísticamente significativa.
Intensidad media de fluorescencia de los ligandos para los receptores inhibidores y activatorios en los blastos mieloides y linfoides. Se muestra la media y la desviación estándar de 10 leucemias agudas infantiles, 5 LMA y 5 leucemias agudas linfoblásticas.
*Diferencia estadísticamente significativa.
Los resultados de nuestra serie retrospectiva son similares a la experiencia descrita en pacientes pediátricos con LMA tanto a nivel nacional como internacional. El registro español de tumores infantiles (RETI) comunica en su último informe que comprende el período 1980-2013, una supervivencia global a 5 años del 54% en los años 1995-1999, el 59% en 2000-2004 y el 62% durante 2005-2007. El grupo europeo NOPHO describe recientemente en su protocolo NOPHO-AML2004, una SLE a 5 años del 55%25; el grupo del hospital de St Jude de Memphis, EE. UU., en su protocolo AML-02 incluye 230 pacientes durante el período 2000-2008 y describe una SLE a 5 años del 63%26. Según nuestros datos la supervivencia libre de enfermedad en la LMA infantil no se ha modificado sustancialmente en las 3 últimas versiones del protocolo SHOP y se mantiene estancada desde hace más de 2 décadas, aún en valores subóptimos. Además, en consonancia con lo conocido, las LMA secundarias (relacionadas con el tratamiento o síndromes mielodisplásicos) presentan una supervivencia muy inferior a las LMA de novo27. Por otro lado, la heterogeneidad de la LMA se ejemplifica en el caso de la LMA promielocítica (FAB M3) que presenta una SLE muy superior al resto de las LMA (80% vs. 57%, p<0,05), poniendo de manifiesto el impacto favorable del ácido transretinoico sobre la supervivencia, y la necesidad de hallar una diana molecular para el resto de las LMA28.
En nuestra serie también resultan determinantes las alteraciones citogenéticas en el pronóstico. Así, la presencia en un tercio de nuestros pacientes de alteraciones consideradas favorables como t(8;21), inv16, t(15;17) se tradujo en mayor supervivencia, posiblemente debido a una menor probabilidad de recaída, pese a no alcanzar significación estadística debido al pequeño tamaño muestral. El TPH alogénico ha ido aumentando como estrategia terapéutica en los últimos protocolos y disminuyendo el TPH autógeno. Las mejoras en los estudios citogenéticos, identificando alteraciones de alto riesgo pudieron influir en este hallazgo. El TPH alogénico muestra una tendencia favorable sobre la SLE, tal y como describen otras series3,29. Un mayor tamaño muestral nos podría haber permitido detectar diferencias significativas en nuestros pacientes.
Las causas de muerte en los pacientes de nuestra serie fueron la recaída y las relacionadas con el tratamiento: infecciones y hemorragias. En los sucesivos protocolos, la mortalidad de causa tóxica tiende a disminuir, mientras que la recaída sigue siendo un evento importante que no se ha modificado30. El reducido tamaño muestral de nuestro estudio no nos permite identificar factores pronósticos para la probabilidad de recaída. Consideramos que un 38% de recaídas es todavía una cifra muy elevada. Incluso en el grupo de pacientes con citogenética favorable la probabilidad de recaída se aproxima al 30%. Por ello consideramos que todos los pacientes son subsidiarios de nuevos procedimientos terapéuticos.
En adición a este estudio retrospectivo, nuestro trabajo aporta los resultados preliminares sobre la expresión de los ligandos de los receptores inhibidores y activadores en los blastos leucémicos mieloides y linfoides con la intención de explicar la mayor susceptibilidad de la LMA a la citotoxicidad de los linfocitos NK descrita por otros grupos internacionales31. En consonancia con esta evidencia, la intensidad media de fluorescencia de HLA-I, ligando de los receptores inhibidores KIR, es significativamente menor en los blastos mieloides que en los linfoides, lo que sugiere una mayor sensibilidad a la citotoxicidad NK a través de sus receptores inhibidores. Con respecto a la expresión de los ligandos MICA/B y ULBP, solo encontramos diferencias significativas en la expresión de ULBP-4, lo que podría poner de manifiesto la menor importancia de la vía activadora con respecto a la inhibidora, tal y cómo reflejan otros autores32. En esta misma línea se ha descrito cómo la disminución de la expresión de los ligandos para los receptores activadores en los pacientes con LMA supone un mecanismo de escape al control del sistema inmunitario33. Recientemente, se está explorando la terapia celular con linfocitos NK haploidénticos como tratamiento de consolidación en pacientes pediátricos con LMA de riesgo bajo e intermedio que no tienen indicación de TPH20,34. Los resultados son muy prometedores, con un 0% de toxicidad y un 100% de supervivencia libre de recaída tras una mediana de seguimiento superior a 3 años34. La biotecnología nos permite actualmente aislar células NK a partir de aféresis de donantes sanos. Además, actualmente en nuestro país se están investigando 2 nuevos productos celulares, las células NK estimuladas con IL-15 a partir de aféresis de donante haploidéntico (NK-IL-15) y las células NK activadas y expandidas (NKAE) a partir de sangre periférica del paciente (NKAE autólogas) o de donante haploidéntico (NKAE haploidénticas). Hasta el momento no se han comunicado toxicidades importantes (> 2 según NCI 3.0) en pacientes con enfermedad avanzada35, por lo que sería factible incorporar esta estrategia de terapia celular en un estudio prospectivo multicéntrico nacional, especialmente para los pacientes en remisión que no son candidatos a un TPH alogénico.
Como conclusión, actualmente la SLE en la LMA continúa estando en valores subóptimos y la recaída constituye un problema importante. Es necesario investigar en procedimientos diagnósticos, terapéuticos y de seguimiento que mejoren la supervivencia actual. En este sentido, la terapia celular con células NK podría constituir un procedimiento a desarrollar dado el componente inmunológico tan importante de la LMA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido financiado en parte por el fondo de investigación sanitaria (FIS), PI12/01622, y la fundación Cris contra el cáncer (http://www.criscancer.org/es/index.php).