La arteritis de Takayasu (AT) es una vasculitis granulomatosa de grandes vasos infrecuente en niños. Suele comenzar con cefalea, fiebre, dolor abdominal o hipertensión arterial (HTA). Es excepcional su comienzo como insuficiencia cardiaca, describiéndose solo en el 18% de los casos pediátricos. Recientemente se ha implicado en su patogenia a la IL-61, hallándose elevada en sangre y pared arterial.
Para el diagnóstico son imprescindibles las alteraciones angiográficas junto con uno de los 5 criterios diagnósticos EULAR/PRINTO/PRES2 (tabla 1). Aunque la angio-TC es la prueba de elección, pues permite visualizar el flujo y la extensión de los vasos colaterales, no proporciona información sobre la pared arterial. De ahí la necesidad de realizar angio-RM que permite valorar la afectación de la pared, y se correlaciona con la clínica y marcadores inflamatorios. La PET-TC no está indicada de rutina, pero podría resultar útil en pacientes con marcadores inflamatorios negativos2.
Criterios de clasificación para la arteritis de Takayasu de EULAR/PRINTO/PRES
| Alteraciones angiográficas (convencional, TC o RM) de la aorta o sus ramas principales y arterias pulmonares mostrando aneurismas/dilatación, estrechamiento, oclusión o engrosamiento de la pared arterial no debido a displasia fibromuscular o causas similares (criterio obligatorio) más uno de los siguientes 5 criterios: |
| 1. Déficit de pulso o claudicación: pérdida/disminución/asimetría de los pulsos arteriales periféricos o claudicación (dolor muscular focal inducido por actividad física) |
| 2. Discrepancia en tensión arterial: discrepancia de >10mmHg en la presión sistólica de cualquiera de los 4 miembros |
| 3. Soplos: soplos audibles o thrills palpables sobre grandes arterias |
| 4. Hipertensión: presión arterial sistólica/diastólica >percentil 95 para la altura |
| 5. Reactantes de fase aguda: VSG>20mm en la primera hora o PCR de cualquier valor superior a la normalidad (según laboratorio local) |
El tratamiento se realiza en 2 fases: inducción y mantenimiento. Si existe repercusión hemodinámica, la inducción consiste en pulsos de corticoides intravenosos seguidos de una pauta oral, junto con inmunosupresores (ciclofosfamida o metotrexato)3. Para el mantenimiento se han empleado metotrexato, micofenolato mofetilo o azatioprina3. En los últimos años se plantean otras alternativas terapéuticas en casos refractarios2,4–6.
Presentamos un caso de AT que comenzó como insuficiencia cardiaca y que, finalmente, precisó un fármaco biológico anti-IL6.
Niña de 11 años que presentaba cuadro de 10 días de vómitos y dolor abdominal, asociando astenia las últimas semanas. En la exploración presentaba palidez cutáneo-mucosa con frialdad acra, dificultad respiratoria, hipoventilación y crepitantes bibasales, ritmo de galope (FC 140lpm), SatO2 90% y hepatomegalia. Los pulsos radial y braquial izquierdos estaban ausentes, con TA en miembro superior izquierdo 80/50 (<p50) y derecho 140/100 (>p99). Analíticamente destacaba Hb 9,9g/dl, plaquetas 636.000/mm3 y PCR 20mg/l. En la radiografía de tórax se objetivó cardiomegalia con signos de edema agudo de pulmón y electrocardiográficamente crecimiento de aurículas e hipertrofia ventricular izquierda.
Ingresó en la UCIP con diagnóstico de insuficiencia cardiaca aguda, realizándose ecocardiografía que mostró disfunción sistólica grave (FEV1 20%) e insuficiencia mitral leve. Se inició soporte hemodinámico con milrinona, diuréticos y levosimendán, y respiratorio con BIPAP con buena respuesta.
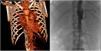
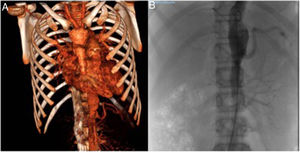
En ecografía abdominal se evidenciaron datos de aortitis por lo que, con la sospecha de AT, se completó estudio con angio-TC (fig. 1A), objetivando engrosamiento de la subclavia izquierda con estenosis significativa y estenosis en salida de la arteria vertebral izquierda con vascularización colateral, así como segmentos de engrosamiento de la pared de aorta torácica/abdominal y estenosis de arterias renales derechas. Mediante angio-RM se confirmó que la afectación de subclavia y vertebral eran agudas, mientras que la de aorta y sus ramas crónicas. Con diagnóstico de AT tipo V se inició tratamiento con bolos de metilprednisolona 30mg/kg/3 días (seguido de prednisona 2mg/kg/día) y ciclofosfamida intravenosa 500mg/m2/cada 3 semanas, normalizando parámetros analíticos a partir de la segunda dosis. Mantuvo TA>p99 a pesar de la combinación de 6 fármacos por lo que, tras realizar arteriografía (fig. 1B), precisó angioplastia de arteria renal derecha que permitió la retirada de 4 fármacos con buen control de TA. Dos meses más tarde se observó elevación de PCR 46mg/l, VSG 77mm/h y niveles séricos de IL-6 (29,4pg/ml), por lo que tras 5 dosis de ciclofosfamida se inició tratamiento con anti-IL-6 (tocilizumab iv 8mg/kg/cada 2 semanas). Se comprobó buena respuesta tras 2 dosis, con normalización analítica y descenso de niveles de IL-6 (3,5pg/ml). Tras 12 meses se encuentra asintomática, con FEV1 70%, y sin tratamiento antihipertensivo, por lo que tras comprobar estabilidad radiológica se ha espaciado tocilizumab a cada 3 semanas.
Además del control de HTA, que suele ser complicado y puede requerir en ocasiones técnicas invasivas como la angioplastia renal4, será necesario un seguimiento estrecho de otros factores de riesgo cardiovascular como la hipercolesterolemia y la hipercoagulabilidad. Nuestra paciente precisó rosuvastatina y AAS.
El reto en la AT es diferenciar la fase activa de la fase crónica, ya que no existen marcadores específicos de actividad. PCR y VSG presentan una baja sensibilidad y especificidad, de ahí que se estén evaluando nuevos biomarcadores como metaloproteinasas de matriz extracelular (MMP), molécula de citoadhesión vascular (VCAM), la inversión del CD4/CD8 y la pentraxina-35. No obstante, se ha encontrado una buena correlación entre los niveles de IL-6 y la actividad de la enfermedad, de ahí la posibilidad de usar esta citoquina como diana terapéutica1,5,6.
Aunque el tratamiento convencional sigue vigente, se han publicado series de casos que demuestran la efectividad de fármacos biológicos como anti-TNF-α (infliximab/adalimumab) o anti-IL6 (tocilizumab)4–6. Se describe un tiempo medio hasta la resolución sintomática de 3 meses, sin efectos secundarios graves y permitiendo reducir la dosis de corticoides.