Los anticuerpos antitransglutaminasa (ATG) poseen alta especificidad para el diagnóstico de enfermedad celíaca (EC). Sin embargo, se han descrito anticuerpos ATG positivos en pacientes no celíacos.
ObjetivoValorar la presencia de anticuerpos ATG positivos no relacionados con la ingesta de gluten.
Pacientes y métodosRevisión retrospectiva de historias clínicas y seguimiento de pacientes con sospecha de EC y con un comportamiento serológico atípico, es decir, anticuerpos ATG positivos a pesar de una dieta sin gluten y disminución de anticuerpos ATG tomando gluten.
ResultadosSe incluyeron 9 casos. De ellos, 5 casos tenían afectación histológica Marsh 3 en la biopsia inicial y diagnóstico de EC (grupo A). Se retiró el gluten de la dieta y se retiraron las proteínas de leche de vaca (PLV) por la afectación nutricional. Al reintroducir las PLV aumentaron los ATG y al retirarlas se volvieron a normalizar. Los otros 4 pacientes presentaban una biopsia inicial normal (grupo B): en estos no se retiró el gluten, pero sí las PLV por sospecha de alergia no IgE mediada. Los síntomas desaparecieron y se normalizaron los ATG al retirar las PLV manteniendo dieta con gluten. Todos presentan el haplotipo de susceptibilidad para EC.
ConclusionesEn algunos celíacos, la reintroducción de PLV en la dieta tras un período de exclusión induce un aumento de los anticuerpos ATG IgA. Si se han descartado transgresiones con gluten, las PLV pueden causar esta respuesta inmune. Hemos observado también esta respuesta en pacientes con alergia no IgE, mediada por las PLV, portadores del haplotipo de susceptibilidad HLA DQ2/DQ8.
Anti-tissue transglutaminase antibodies (tTG) have high specificity for coeliac disease (CD). However, positive anti-tTG antibodies have been described in non-coeliac patients.
Aim To assess positive anti-tTG antibodies not related to gluten intake.
Patients and methodsRetrospective review and follow up conducted on patients with suspected CD (increase anti-tTG levels and gastrointestinal symptoms) but with atypical serology results, positive anti-tTG with gluten free diet and a decrease in anti-tTG levels despite gluten intake.
ResultsA total of 9 cases were reviewed in which 5 cases had Marsh 3 involvement in the initial biopsy, and were diagnosed with CD (Group A). They began a gluten free diet and also a cow's milk protein (CMP) free diet because of their nutritional status. When CMP was re-introduced, anti-tTG increased, and returned to normal after the CMP was withdrawn again. The other 4 patients had a normal initial biopsy (Group B). Gluten was not removed from their diet, but they started a CMP free diet because a non IgE mediated CMP allergy was suspected. Symptoms disappeared, and anti-tTG was normal after CMP free diet with gluten intake. All the patients had susceptibility haplotype HLA DQ2/DQ8.
ConclusionsCMP ingestion after an exclusion diet can induce an increase in anti-tTG in some coeliac subjects. CMP can produce this immune response if there were no gluten transgressions. This response has also been observed in non-IgE mediated CMP allergy patients with the susceptibility haplotype HLA DQ2/DQ8.
Los anticuerpos antitransglutaminasa (ATG) poseen una alta especificidad para el diagnóstico de enfermedad celíaca (EC)1,2. De hecho, gracias a la mejora diagnóstica de estos marcadores serológicos, y de acuerdo con los nuevos criterios diagnósticos de la ESPGHAN 2012, se puede llegar a omitir la realización de una biopsia intestinal para llegar al diagnóstico de EC en determinadas circunstancias3.
No obstante, a pesar de esta alta especificidad de los ATG para la EC, encontramos datos en la literatura sobre la presencia de anticuerpos ATG positivos en pacientes no celíacos. No se conocen del todo los mecanismos patogénicos por los que se producen estos anticuerpos, pero el comportamiento parece ser diferente en sujetos celíacos y no celíacos. Un posible mecanismo basado en el modelo «hapten-carrier» indica que la combinación de la gliadina con la enzima transglutaminasa de la mucosa intestinal formaría agregados de macromoléculas que, tras ser procesados por los linfocitos B, sintetizarían anticuerpos ATG. Estos linfocitos B formadores de anticuerpos específicos frente a la transglutaminasa están presentes probablemente en todas las personas, pero dependen del estímulo de los linfocitos Th para empezar a secretar anticuerpos4. También se ha propuesto como hipótesis una regulación «al alza» de la enzima transglutaminasa en zonas de inflamación, la cual sería capaz de generar nuevos epítopos antigénicos por reacción cruzada o desaminación de proteínas endógenas o exógenas como virus, bacterias o proteínas de la dieta5.
Se han descrito ATG elevados de manera transitoria en algunas enfermedades autoinmunes, así como en pacientes con enfermedad inflamatoria intestinal6. Di Tola et al.7 encuentran una aumento de anticuerpos ATG en más del 50% de los pacientes evaluados con enfermedad inflamatoria intestinal: en todos ellos los anticuerpos antiendomisio (EMA) son negativos y las cifras de ATG presentan títulos bajos en comparación con los pacientes celíacos; además, están relacionados con el grado de actividad de la enfermedad.
Por otro lado, determinados agentes infecciosos pueden desempeñar un papel en la producción de anticuerpos frente a la tranglutaminasa. Ferrara et al.8 muestran en un estudio prospectivo como se producen anticuerpos ATG temporalmente en el transcurso de enfermedades infecciosas (virus Epstein-Barr, virus coxsackie) tanto en pacientes celíacos como en no celíacos. Estos anticuerpos ATG representarían un fenómeno inmunológico desencadenado por la sobreexpresión de autoantígenos o por una infección viral. Ninguno de los pacientes con ATG positivos de este estudio tenían EMA positivos, lo que refuerza la idea de que los mecanismos inmunológicos que generan los anticuerpos ATG son diferentes en pacientes celíacos y no celíacos.
Finalmente, se ha descrito que algunas proteínas de la dieta, como las proteínas de leche de vaca (PLV), pueden provocar síntomas gastrointestinales en algunos pacientes con EC. Las proteínas bovinas son capaces de inducir una respuesta inflamatoria en la mucosa de pacientes celíacos. Esta sensibilidad a la caseína en estos pacientes con EC parece estar mediada por la respuesta inmune innata9. Estos síntomas no se pueden relacionar con la presencia de proteínas del gluten en la leche de vaca, pues no se ha detectado gluten en la leche de vacas alimentadas con trigo10. Esta respuesta, más bien, parece deberse a epítopos que comparten las gliadinas y las caseínas bovinas, reconocidas por los anticuerpos IgA antigliadina11,12. Además, también se le ha atribuido a la caseína la capacidad de actuar como trigger en otros trastornos autoinmunes13.
El objetivo de este estudio es valorar la presencia de anticuerpos ATG positivos no relacionados con la ingesta de gluten en un grupo de pacientes controlados por sospecha de EC.
Pacientes y métodosSe ha realizado un estudio observacional retrospectivo de todos los pacientes controlados en consultas externas de nuestro centro por sospecha clínica de EC durante el período 2002-2010, pero que posteriormente habían presentado un comportamiento serológico atípico, es decir, cambios en los niveles de ATG no relacionados con la ingesta de gluten.
Los criterios de inclusión fueron haber presentado al inicio del seguimiento elevación de ATG o IgA antigliadina y haberse realizado biopsia intestinal. Se excluyeron los casos en los que se demostró una etilogía infecciosa del aumento de los ATG, y aquellos en los que no se había realizado estudio genético. En el grupo A, se incluyó a los pacientes que habían presentado afectación histológica en la biopsia intestinal, en los que se realizó el diagnóstico de EC según los criterios diagnósticos EPSGHAN 1990. En este grupo, se definió como comportamiento serológico atípico la elevación de los anticuerpos ATG a pesar de una dieta exenta de gluten. En el grupo B, se incluyó a los pacientes en los que la biopsia intestinal fue normal y en los que por sospecha clínica de alergia no IgE mediada por las PLV, se realizó una dieta de eliminación diagnóstica de las PLV. El diagnóstico fue clínico, con mejoría tras exclusión de las PLV y recaída tras provocación; el RAST frente a la leche de vaca resultó negativo en todos los casos en los que se solicitó. En este grupo, se consideró un comportamiento serológico atípico a la disminución de los anticuerpos ATG al retirar las PLV de la dieta, a pesar de no excluir el gluten.
La determinación de anticuerpos ATG de clase IgA fue llevada a cabo de manera automatizada mediante fluoroenzimoinmunoanálisis (EliA CeliKey Phadia-thermofisher, <7 U negativo; >10 U positivo). Hemos considerado un grado de positividad alto (++) cuando los valores eran superiores a 10 veces el límite de normalidad (>100 U) y un grado de positividad bajo (+) cuando los valores eran positivos pero menores de 10 veces el límite de normalidad (>7 U pero >100 U). Se determinaron anticuerpos antigliadina (AAG) de clase IgA, mediante ELISA propio casero. Los valores de referencia, expresados en unidades arbitrarias (UA) son <0,3 UA en niños y <0,6 UA en adultos (Ribes-Koninckx C, 1984).
Se realizó la determinación de anticuerpos frente a péptidos desamidados de gliadina de manera automatizada mediante fluoroenzimoinmunoanálisis (EliA AGP Phadia-thermofisher, <7 U negativo; >10 U positivo). Se detectaron anticuerpos EMA de clase IgA mediante inmunofluorescencia indirecta utilizando como sustrato secciones de esófago de mono (Biosystems). En cada análisis se incluyó un control positivo y negativo. Se utilizó una dilución 1:5 de los sueros, que fueron incubados durante 30 min en cámara húmeda oscura; posteriormente se incubó con anti-human IgA conjugado con FITC (Dako) en dilución 1:20 durante 30 min. Tras su montaje, se procedió a su lectura a ciegas en microscopio de fluorescencia (Motic Trinocular BA400 con Motic bloque de filtros para FITC FLUO 3).
Se realizó el tipaje HLA mediante técnica de PCR para la detección de alelos DRB1/DQA1/DQB1.
La lesión histológica fue valorada de acuerdo con la clasificación de Marsh-Oberhuber14. Para la detección de depósitos subepiteliales de ATG-IgA, se realizaron secciones de 5μ de biopsias intestinales, congeladas en fresco y adheridas a portas «SuperFrost», que fueron incubadas (15min, cámara de humedad, temperatura ambiente) secuencialmente con: Ac-monoclonal de ratón anti-TG2 (dilución 1:200), Ac-de conejo antiinmunoglobulina de ratón conjugado con TRITC (1:120) y Ac-policlonal de conejo anti-IgA-humana conjugado con FICT (1:40). Se realizó lectura a ciegas con microscopio de fluorescencia y un software (Motic Images Plus 2.0) de superposición de imágenes.
Se revisaron de manera retrospectiva las historias clínicas de estos pacientes, recogiendo datos sobre la edad al diagnóstico, síntomas, niveles de ATG, haplotipo HLA, hallazgos histológicos según la clasificación de Marsh-Oberhuber y la evolución de los síntomas y de los niveles de anticuerpos ATG IgA, AAG IgA y EMA IgA, según la presencia de gluten o PLV en la dieta. Se recogieron datos del seguimiento posterior para analizar su evolución e intentar establecer un diagnóstico final.
El protocolo del trabajo fue aprobado por el Comité de Ética del Hospital Universitari i Politècnic La Fe (Valencia).
Las variables cualitativas se han expresado en frecuencia absoluta (n) y relativa (porcentaje) y las variables cuantitativas en forma de mediana y cuartiles (percentil 25 [P25] y percentil 75 [P75]). Se analizaron los datos mediante el programa estadístico SPSS® 21.0.
ResultadosDe 629 pacientes estudiados por sospecha de EC en el período 2002-2010, se registraron 11 casos (1,7%) con un comportamiento serológico atípico. Se excluyeron 2 casos debidos a etiología infecciosa (Giardia lamblia y Campylobacter jejuni). En los 9 pacientes restantes (1,4%), se había descartado infección intestinal. La mediana y cuartiles del tiempo de seguimiento de los casos ha sido de 10 años (8-12,5).
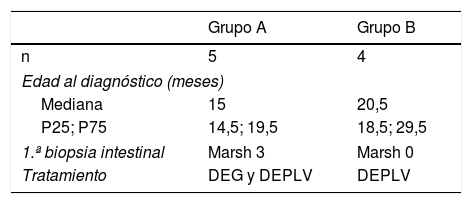
Se dividieron en 2 grupos: 5 casos con afectación histológica Marsh 3 en la biopsia inicial y con diagnóstico de EC (grupo A); en estos pacientes se retiró el gluten de la dieta en el momento del diagnóstico. Los otros 4 casos presentaron una biopsia inicial sin alteraciones histológicas reseñables (grupo B) y en estos no se retiró el gluten.
En ambos grupos se retiraron las PLV por diferentes motivos. En el grupo A, por ser lactantes menores de 24 meses con afectación nutricional en fase diagnóstica de un síndrome de malabsorción intestinal y en el grupo B por sospecha de alergia no IgE mediada como causa de los síntomas gastrointestinales (tabla 1).
Características de los pacientes con comportamiento serológico atípico sin causa infecciosa
| Grupo A | Grupo B | |
|---|---|---|
| n | 5 | 4 |
| Edad al diagnóstico (meses) | ||
| Mediana | 15 | 20,5 |
| P25; P75 | 14,5; 19,5 | 18,5; 29,5 |
| 1.ª biopsia intestinal | Marsh 3 | Marsh 0 |
| Tratamiento | DEG y DEPLV | DEPLV |
Grupo A: pacientes con afectación histológica en la primera biopsia intestinal y diagnóstico de enfermedad celíaca.
Grupo B: pacientes con biopsia intestinal normal y sospecha de alergia no IgE mediada a proteínas de leche de vaca.
DEG: dieta exenta de gluten; DEPLV: dieta exenta de proteínas de leche de vaca.
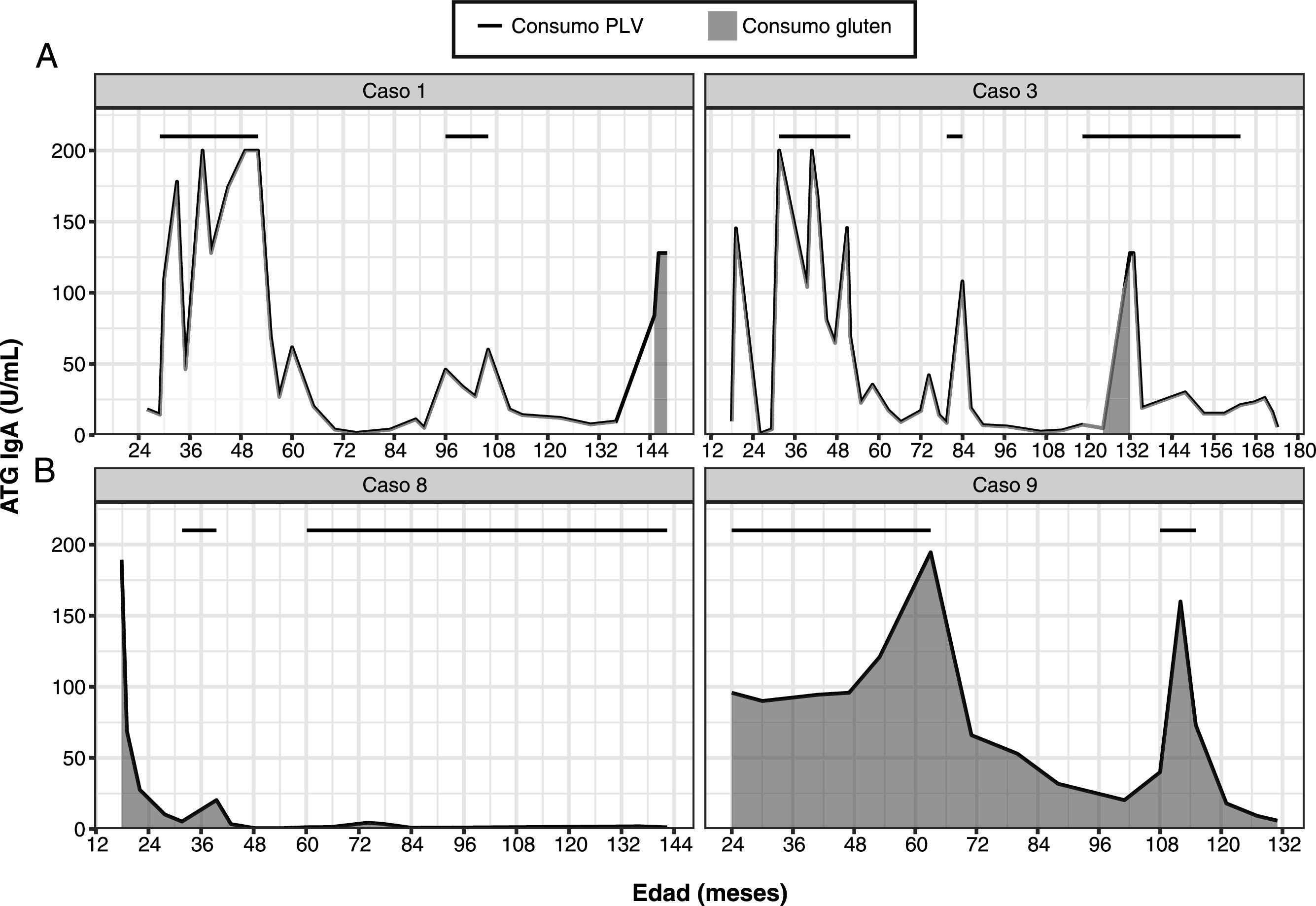
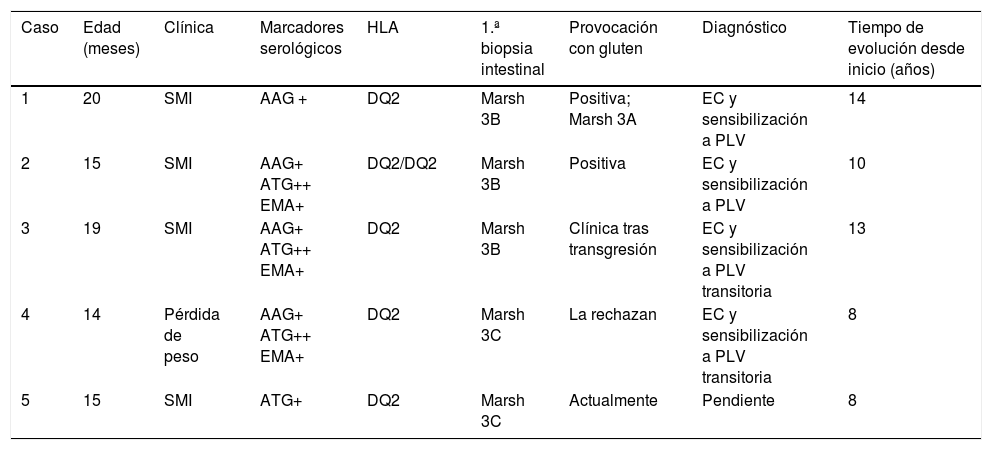
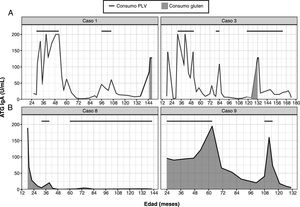
En el grupo A, una vez se realizó la biopsia intestinal y con el diagnóstico de EC, se retiró el gluten de la dieta. Se observó un descenso en los valores de ATG. Posteriormente, tras mejoría del estado nutricional, se reintrodujeron las PLV y, coincidiendo con esta reintroducción, se observó un aumento de los ATG que previamente se habían negativizado, con presencia de los anticuerpos EMA negativos (fig. 1A). De estos pacientes, uno presentó diarrea y los 4 restantes permanecieron asintomáticos. En todos ellos se confirmaron los resultados en diferentes muestras, tras descartar transgresiones de la dieta sin gluten (tras encuesta dietética y teniendo en cuenta que los anticuerpos AAG eran negativos). Al retirar de nuevo las PLV, los marcadores serológicos se volvieron a normalizar. Tras una 2.ª provocación con leche de vaca, el paciente 3 mantuvo los anticuerpos ATG negativos, en los casos 1, 2 y 4 volvieron a ser positivos y la paciente 5 está pendiente de evolución. En 3 de los 5 pacientes de este grupo, se confirmó tras provocación con gluten que eran celíacos (casos 1, 2 y 3). De los 2 restantes, uno rechazó la provocación con gluten (caso 4) y la paciente 5 está realizándola en el momento actual. En los pacientes 1 y 2ha persistido la sensibilización a las proteínas bovinas tras 12 y 8 años de seguimiento, respectivamente (tabla 2). La paciente 4 está tomando PLV en la dieta y mantiene ATG negativos, por lo que se ha resuelto la sensibilización a las PLV en 5 años.
Grupo A: Pacientes con afectación histológica en la primera biopsia intestinal
| Caso | Edad (meses) | Clínica | Marcadores serológicos | HLA | 1.ª biopsia intestinal | Provocación con gluten | Diagnóstico | Tiempo de evolución desde inicio (años) |
|---|---|---|---|---|---|---|---|---|
| 1 | 20 | SMI | AAG + | DQ2 | Marsh 3B | Positiva; Marsh 3A | EC y sensibilización a PLV | 14 |
| 2 | 15 | SMI | AAG+ ATG++ EMA+ | DQ2/DQ2 | Marsh 3B | Positiva | EC y sensibilización a PLV | 10 |
| 3 | 19 | SMI | AAG+ ATG++ EMA+ | DQ2 | Marsh 3B | Clínica tras transgresión | EC y sensibilización a PLV transitoria | 13 |
| 4 | 14 | Pérdida de peso | AAG+ ATG++ EMA+ | DQ2 | Marsh 3C | La rechazan | EC y sensibilización a PLV transitoria | 8 |
| 5 | 15 | SMI | ATG+ | DQ2 | Marsh 3C | Actualmente | Pendiente | 8 |
AAG: anticuerpos antigliadina IgA; ATG: anticuerpos antitransglutaminasa IgA; EC: enfermedad celíaca; EMA: anticuerpos antiendomisio IgA; HLA: human leukocyte antigen (antígeno leucocitario humano); PLV: proteínas de leche de vaca; SMI: síndrome de malabsorción intestinal.
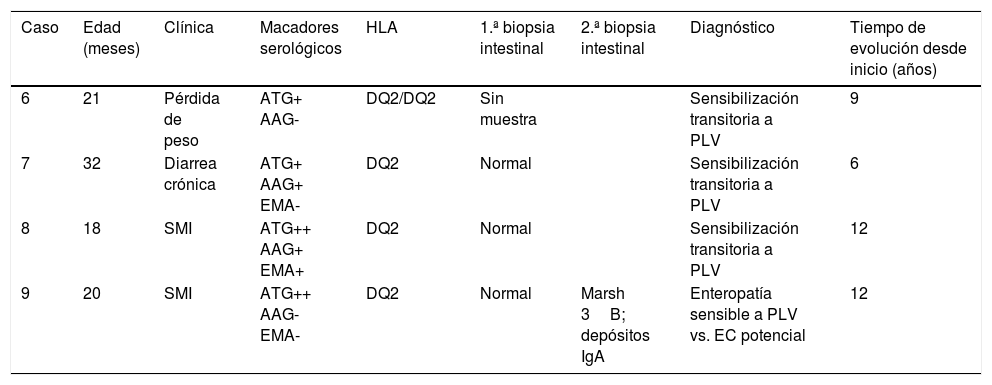
En el grupo B, tras retirar las PLV de la dieta, desaparecieron los síntomas y se negativizaron los anticuerpos ATG y EMA (fig. 1B). En 2 de los pacientes (6 y 7) se mantuvieron los marcadores serológicos negativos sin síntomas al reintroducirlas en la dieta. En cambio, los otros 2 pacientes (8 y 9) volvieron a presentar síntomas y elevación de los anticuerpos ATG al reintroducir las PLV en la dieta. En el caso 8 se realizó una 2.ª provocación tras un año, sin que reaparecieran los síntomas y manteniendo ATG negativos. En el caso 9, se realizó una 2.ª provocación con PLV de la misma manera, presentando anticuerpos ATG y EMA positivos, con ferropenia, por lo que se realizó una biopsia intestinal que mostró una afectación grado Marsh 3B y presencia de depósitos subepiteliales de antitransglutaminasa IgA en la mucosa intestinal. A pesar de estos hallazgos, se retiraron de nuevo las PLV de la dieta, tras lo cual se normalizaron los niveles de ATG y EMA, y está pendiente la realización de biopsia intestinal para descartar una EC latente (tabla 3).
Grupo B. Pacientes con biopsia intestinal normal y sospecha de alergia no IgE mediada a las proteínas de leche de vaca
| Caso | Edad (meses) | Clínica | Macadores serológicos | HLA | 1.ª biopsia intestinal | 2.ª biopsia intestinal | Diagnóstico | Tiempo de evolución desde inicio (años) |
|---|---|---|---|---|---|---|---|---|
| 6 | 21 | Pérdida de peso | ATG+ AAG- | DQ2/DQ2 | Sin muestra | Sensibilización transitoria a PLV | 9 | |
| 7 | 32 | Diarrea crónica | ATG+ AAG+ EMA- | DQ2 | Normal | Sensibilización transitoria a PLV | 6 | |
| 8 | 18 | SMI | ATG++ AAG+ EMA+ | DQ2 | Normal | Sensibilización transitoria a PLV | 12 | |
| 9 | 20 | SMI | ATG++ AAG- EMA- | DQ2 | Normal | Marsh 3B; depósitos IgA | Enteropatía sensible a PLV vs. EC potencial | 12 |
AAG: anticuerpos antigliadina IgA; ATG: anticuerpos antitransglutaminasa IgA; EC: enfermedad celíaca; EMA: anticuerpos antiendomisio IgA; HLA: human leukocyte antigen (antígeno leucocitario humano); PLV: proteínas de leche de vaca; SMI: síndrome de malabsorción intestinal.
En este grupo de pacientes, observamos el aumento de ATG como una respuesta inmunológica a proteínas de la dieta diferentes al gluten, tanto en pacientes celíacos (grupo A) como en no celíacos (grupo B).
En los pacientes celíacos esta elevación de los ATG coincidió con la reintroducción de las PLV en su dieta. Se descartó que la elevación de los ATG fuera debida a transgresiones con gluten, ya que, tras revisar el cumplimiento de la dieta exenta de gluten en sucesivas visitas, persistieron los resultados y los anticuerpos AAG fueron negativos. En el momento actual, con las nuevas técnicas de detección de péptidos del gluten en heces, la información sobre las no transgresiones dietéticas podría haber sido corroborada15.
Al volver a realizar una dieta de exclusión de proteínas bovinas se negativizaron de nuevo los anticuerpos ATG. Este hecho apoyaría nuestra sospecha de que las PLV son capaces de generar esta respuesta inmunológica, tal y como también se ha descrito en la literatura. Cabrera-Chávez et al. postulan como determinados epítopos de las PLV pueden ser capaces de desencadenar síntomas en pacientes celíacos. La homología entre algunos péptidos de las cadenas α y ß de la caseína bovina con péptidos del gluten explicaría esta reactividad mediada por anticuerpos de clase IgA11,12.
En 2 de nuestros 5 pacientes celíacos (pacientes 3 y 4) esta respuesta fue transitoria. En cambio, en otros 2 (1 y 2) ha persistido hasta el momento actual, a pesar de 12 y 8 años, respectivamente, con dieta sin gluten desde el diagnóstico. En celíacos no tratados podría explicarse por el aumento del paso de macromoléculas a través de la barrera intestinal. Sin embargo, en celíacos con dieta exenta de gluten, con integridad de la mucosa intestinal, desconocemos si podría ser debido a una persistencia del aumento de permeabilidad intestinal o a otros factores proinflamatorios7.
Todos los pacientes celíacos en los que ha ocurrido esta respuesta habían llevado una dieta de exclusión de PLV, por lo que podría ser esta la causa de la reactividad posterior. Además, todos tenían una edad menor o igual de 2 años, momento en el que hay una mayor reactividad a los antígenos de la dieta16,17. Esto hace que nos planteemos si debemos evitar la dieta de exclusión de PVL cuando tenemos una alta sospecha de EC.
El comportamiento serológico de los pacientes del grupo B podría obedecer a otros mecanismos, puesto que no se ha demostrado que se trate de pacientes celíacos, aunque todos presentan un haplotipo de susceptibilidad para EC. Tal y como se describe en la literatura, algunos agentes infecciosos son capaces de desencadenar también esta respuesta inmune con elevación de los anticuerpos ATG en pacientes no celíacos8. Sin embargo, no hemos encontrado referencia a las proteínas bovinas de la dieta como posible desencadenante de la elevación de anticuerpos ATG en pacientes no celíacos, tal y como ocurre en nuestros pacientes del grupo B. Todos los pacientes son portadores del HLA DQ2 o DQ8. ¿Podría actuar la caseína en estos casos como la gliadina en los pacientes celíacos, pero sin ocasionar daño en la mucosa intestinal? Como ya hemos referido anteriormente, la respuesta inmune frente a la caseína podría estar implicada en la patogénesis de algunos trastornos autoinmunes, como la enfermedad de Behçet, a través de la modulación de los linfocitos T y de los macrófagos13.
En el 80% de nuestros pacientes esta respuesta ha sido transitoria. En la paciente 9, en cambio, persiste la respuesta en el tiempo, con desarrollo de daño intestinal y de depósitos de IgA en la mucosa intestinal, con lo que no puede descartarse que se trate de una CE latente.
Además de anticuerpos ATG elevados, el paciente 8 de este grupo ha presentado AAG y EMA positivos, que luego han desaparecido, sin presentar lesión histológica de EC y con normalización posterior permanente con una dieta con gluten. El paciente 7 también presentó AAG positivos de forma transitoria. Esto podría explicarse por el aumento de la permeabilidad intestinal en niños con procesos inflamatorios secundarios a infecciones o a alergias alimentarias. En el caso de estos pacientes, el proceso que motivó el desarrollo de una alergia no IgE mediada a las PLV fue probablemente una gastroenteritis infecciosa, puesto que ambos previamente tomaban PLV sin incidencias y la intolerancia se desencadenó a los 32 y 18 meses. Ese mismo proceso pudo también condicionar el aumento de estos marcadores, como se ha descrito previamente en otras series18.
El cumplimiento de una dieta estricta sin PLV es difícil en nuestra sociedad actual, más si cabe que una dieta estricta sin gluten. El etiquetado de los alimentos envasados es confuso. Las PLV pueden estar presentes en forma de diferentes aditivos con nombres poco claros y en todo tipo de alimentos. Sería, por lo tanto, de utilidad, disponer de algún marcador que nos pudiera orientar sobre si esta respuesta serológica en pacientes celíacos en los que se han descartado transgresiones en la dieta sin gluten se puede relacionar con las proteínas de vacuno, antes de añadir nuevas restricciones dietéticas. Por otro lado, puesto que parece que se trata de una reactividad mediada por IgA, es esperable que estos pacientes presenten niveles de IgA frente a caseína más elevados. Los datos publicados al respecto muestran que los anticuerpos IgG e IgA frente a proteínas bovinas están más elevados en pacientes celíacos no tratados que en celíacos con dieta sin gluten y con la mucosa normalizada, quienes muestran niveles más bajos16, aunque serían necesarios más estudios para poder establecer esta relación.
La muestra de nuestro estudio es pequeña, pues hemos seleccionado únicamente pacientes con biopsia intestinal, y procedentes de un único centro. Sin embargo, el tiempo de seguimiento prolongado nos ha permitido observar este comportamiento.
En nuestra experiencia, en algunos pacientes celíacos, la reintroducción de PLV en la dieta tras un período de exclusión induce un aumento de los anticuerpos ATG IgA, la mayoría de las veces sin síntomas. Pensamos que habiendo descartado transgresiones con el gluten se debe tener en cuenta a las PLV como causa de esta respuesta inmune. Hemos observado también esta respuesta en pacientes con alergia no IgE mediada por las PLV, portadores del haplotipo de susceptibilidad HLA DQ2/DQ8.
En conclusión, los anticuerpos ATG pueden estar presentes en pacientes con otras afecciones distintas a las EC y es importante tener en cuenta el posible papel de los antígenos alimentarios, en especial las PLV, en estas situaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Unidad de Bioestadística IISLAFE.
Este trabajo ha sido presentado en el XX Congreso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP) 2013 como comunicación oral con el título «Anticuerpos antitransglutaminasa elevados. ¿Enfermedad celíaca o sensibilización a las proteínas de leche de vaca?», en el IV Congreso Nacional de la Sociedad Española de Enfermedad Celíaca (SEEC) en Valencia, en noviembre de 2014 como comunicación oral con el título «Anticuerpos antitransglutaminasa elevados no relacionados con la ingesta de gluten» y en el International Celiac Disease Symposium (ICDS) celebrado del 21 al 24 de junio de 2015 en Praga, como póster titulado «Are antitransglutaminase antibodies related always to gluten ingestion?».