Los niños afectados de inmunodeficiencias primarias presentan infecciones graves y mayor prevalencia de manifestaciones autoinmunitarias, alergias y enfermedad linfoproliferativa. El trasplante alogénico de precursores hematopoyéticos ha sido el único tratamiento curativo durante décadas.
Pacientes y métodosPacientes con inmunodeficiencias primarias que recibieron trasplante alogénico de precursores hematopoyéticos desde 1985 hasta 2011, recogidos en el Registro Nacional del Grupo Español para Trasplante de Médula Ósea en Niños.
ResultadosCiento cincuenta y nueve niños recibieron un total de 173 trasplantes, 97 por inmunodeficiencia combinada grave, 30 por enfermedades de disregulación inmunitaria, 25 por síndrome de Wiskott-Aldrich y 21 por defectos de número y/o función de los fagocitos.
La mediana de edad al diagnóstico fue de 6 meses (17 días-168 meses) y de 12 meses (1 mes-189 meses) al trasplante.
Los donantes fueron hermano HLA idéntico en 30 (19%), donante familiar alternativo en 40 (25%) y donante no emparentado en 89 (56%). La fuente de progenitores fue médula ósea en 68 (43%), sangre de cordón umbilical en 52 (33%) y sangre periférica en 39 (24%).
Permanecen vivos 98 niños (61,6%), 57 (35,9%) fallecieron. La supervivencia libre de enfermedad a los 10 años fue del 63, el 90% para los pacientes trasplantados de hermano HLA idéntico, el 36% para los trasplantados de un donante familiar alternativo y el 66 para los trasplantados de donante no emparentado.
ConclusionesLos mejores resultados se obtienen con un hermano HLA idéntico, cuando no se dispone de este, otros donantes deben ser considerados.
Children with primary immunodeficiency have severe life-threatening infections and a higher prevalence of autoimmune problems, allergy and lymphoproliferative disorders. Allogenic hematopoietic stem cell transplantation has been the only potentially curative option.
Patients and methodsPatients with primary immunodeficiency underwent allogenic stem cell transplantation in the period 1985-2011, and registered in the Spanish Working Party for Bone Marrow Transplantation in Children.
ResultsOne hundred and fifty nine patients underwent 173 allogenic stem cell transplantations, of whom 97 had severe combined immunodeficiency, 30 with immune dysregulation disorders, 25 Wiskott-Aldrich syndrome, and 21 phagocyte disorders.
The median patient age at diagnosis was 6 months (range: 17 days – 168 months) and the median patient age at transplant was 12 months (range: 1 month – 189 months).
The donors were 30 (19%) identical siblings, 40 (25%) alternative family donors, and 89 (56%) unrelated donors. The source of stem cells was bone marrow in 68 (43%), cord blood in 52 (33%), and peripheral blood in 39 (24%).
Ninety eight (61.6%) are alive, 57 (35.9%) died. Event-free survival at 10 years was 63%, with 90% for children transplanted from identical siblings, 36% for those transplanted from alternative family donors, and 66% for those transplanted from unrelated donors.
ConclusionsThe best results have been obtained with identical siblings, but other options may be considered.
Las inmunodeficiencias primarias (IDP) son un grupo heterogéneo de más de 200 enfermedades congénitas causadas por alteraciones cuantitativas y/o funcionales de distintos mecanismos implicados en la respuesta inmunitaria. Están caracterizadas por una mala respuesta frente a agentes infecciosos, presentando infecciones de repetición y una mayor prevalencia de manifestaciones autoinmunitarias, alergias y enfermedad linfoproliferativa1.
Alrededor del 60% de estas enfermedades se diagnostican en la edad pediátrica1.
La clasificación actual realizada por la International Union of Immunology Societies define 8 grupos: inmunodeficiencias combinadas de células T y B, déficit predominante de anticuerpos, enfermedades de disregulación inmunitaria, defectos del número y/o función de los fagocitos, defectos en la inmunidad innata, deficiencias del complemento, y alteraciones autoinflamatorias y otros síndromes de inmunodeficiencias bien definidas1,2.
La clínica de las IDP incluye un amplio espectro de manifestaciones, siendo los principales signos de alarma que deben hace pensar en una inmunodeficiencia: infecciones de repetición (más de 8 otitis medias en un año, más de 2 neumonías confirmadas radiológicamente en un año, más de 2 sinusitis en un año, más de 2 infecciones de tejidos profundos en un año o de localización inusual, infecciones cutáneas profundas o abscesos recurrentes, infecciones por organismos no habituales u oportunistas, 2 o más meningitis o infecciones graves), retraso ponderoestatural, fenónemos de autoinmunidad frecuentes, muguet o candidiasis cutánea en paciente mayor de un año, rasgos dismórficos asociados a infecciones frecuentes, infecciones posvacunales en vacunas a virus vivos, retraso en la caída del cordón umbilical, aftas orales recurrentes, fiebre con sospecha de periodicidad y bronquiectasias sin causa aparente.
La inmunodeficiencia combinada grave (IDCG) constituye la forma más grave de IDP, con una esperanza de vida menor al año sin trasplante alogénico de precursores hematopoyéticos (alo-TPH) o corrección genética del defecto subyacente3. En otras IDP, como los defectos de la inmunidad innata u otras inmunodeficiencias de las células T, la esperanza de vida no supera la tercera o cuarta década de la vida4.
El alo-TPH ha sido el único tratamiento curativo para un amplio espectro de IDP de la pediatría durante décadas4-6. En 1968 se realizó el primer trasplante de médula ósea de hermano HLA-idéntico con éxito en un niño afectado de inmunodeficiencia combinada grave7. Desde entonces, se han realizado trasplantes con otras fuentes y tipos de donantes, con buenos resultados4-6. El trasplante de donante haploidéntico y el trasplante de sangre de cordón umbilical (SCU) son 2 opciones válidas en aquellos casos en los que el alo-TPH es una urgencia médica4-6,8,9.
La reconstitución inmunitaria tras el alo-TPH es un proceso lento, no alcanzándose valores de células T circulantes normales hasta los 6-12 meses después del trasplante, consecuentemente la morbimortalidad durante el primer año post-TPH puede ser alta8.
Se presentan los resultados del alo-TPH en niños afectados de IDP reportados en el Registro del Grupo Español para el Trasplante de Médula Ósea en Niños (GETMON).
Pacientes y métodosPacientes con IDP que recibieron un trasplante alo-TPH desde 1985 hasta 2011, recogidos en el Registro Nacional del GETMON.
GETMON es un grupo colaborativo formado por 14 centros hospitalarios a nivel nacional que realizan alo-TPH. Fue creado con el objetivo de desarrollar protocolos comunes, verificar prácticas y ampliar conocimientos. Con tal propósito, creó un Registro Nacional, que recoge datos básicos de todos los pacientes que recibieron un TPH desde 1985, con fines epidemiológicos. El análisis de esta base de datos permite sacar conclusiones sobre las indicaciones del trasplante y los resultados de este.
El registro recoge características como edad, sexo, centro hospitalario, enfermedad de base, tipo de donante, tipo de fuente de progenitores hematopoyéticos y seguimiento post-TPH.
Los datos fueron registrados previo consentimiento informado de los padres o los tutores.
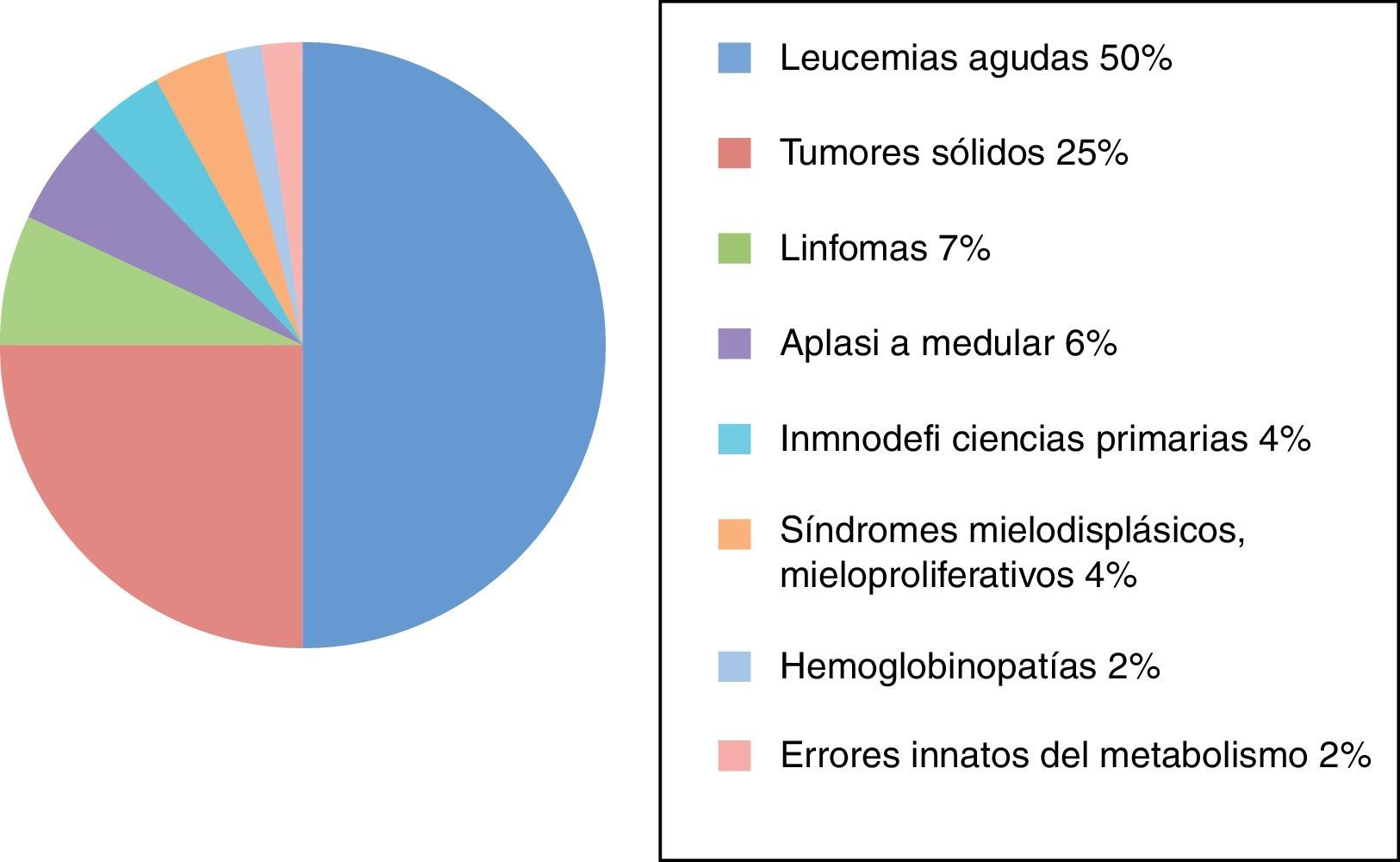
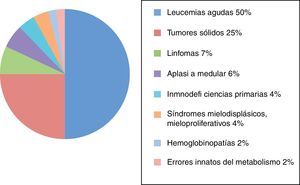
ResultadosDesde su creación en 1985, fueron recogidos en el Registro Nacional de GETMON 4.330 trasplantes realizados a pacientes afectados de leucemia aguda (50%), tumores sólidos (25%), linfomas (7%), aplasia medular (6%), inmunodeficiencias primarias (4%), síndromes mielodisplásicos y mieloproliferativos (4%), hemoglobinopatías (2%) y errores innatos del metabolismo (2%) (fig. 1).
Entre febrero de 1985 y diciembre del 2011, 159 pacientes con IDP recibieron un total de 173 alo-TPH en centros pertenecientes a GETMON. De los 173 alo-TPH, 156 (90%) se concentraron en 4 centros: 71 (41%) en el Hospital Vall d’Hebron, 41 (24%) en el Hospital La Paz, 29 (16%) en el Hospital del Niño Jesús y 15 (9%) en el Hospital Santa Creu i Sant Pau. Cincuenta y cinco pacientes recibieron un alo-TPH en el periodo cronológico entre 1985 y 2001, y 104 entre 2002 y 2011.
Características de los pacientesDel total de pacientes, 109 (68%) eran niños y 50 (32%) niñas. La mediana de edad al diagnóstico fue de 6 meses (intervalo: 17 días-168 meses).
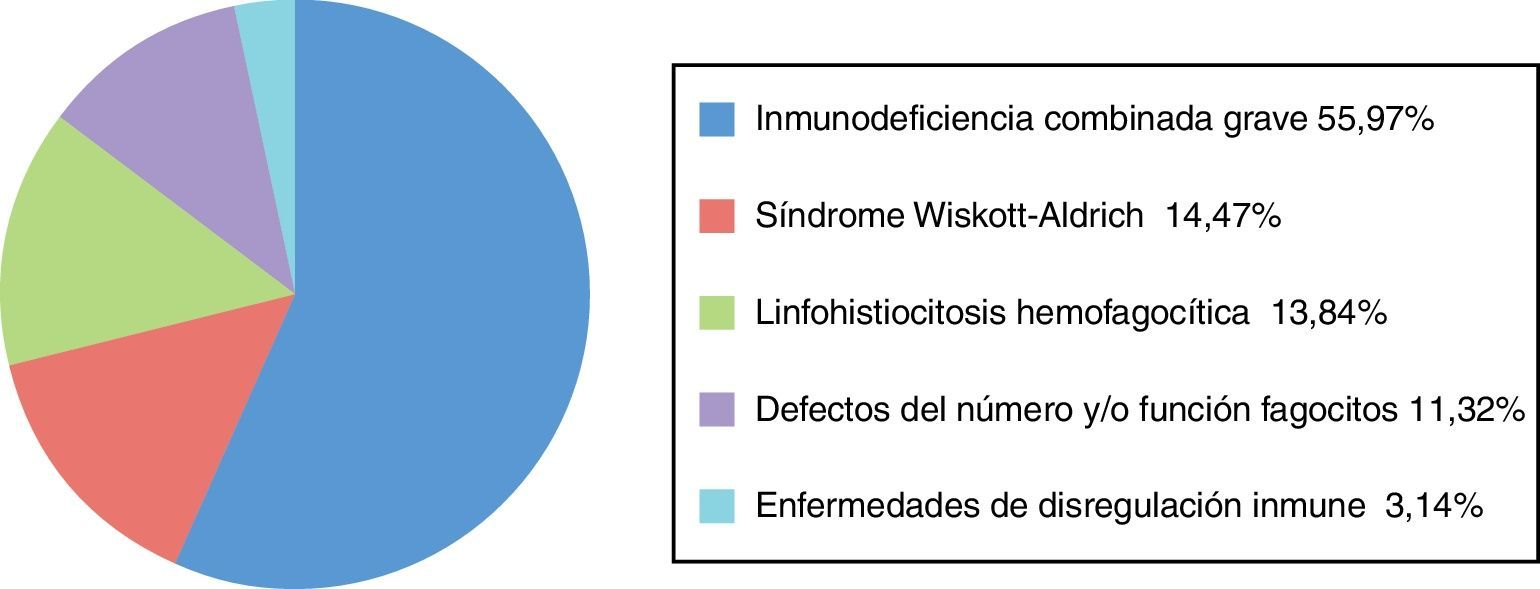
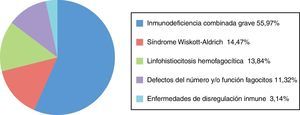
Noventa y siete pacientes estaban afectados de IDCG (55,97%), 30 de enfermedades de disregulación inmunitaria (17,34%) (24 [13,87%] afectados de linfohistiocitosis hemofagocítica, 6 [3,47%] afectados de otras enfermedades de disregulación inmunitaria no especificadas), 25 de síndrome de Wiskott-Aldrich (WAS) (14,47%), 21 de defectos del número y/o función de los fagocitos (11,32%) (neutropenia congénita y enfermedad granulomatosa crónica) (fig. 2).
Características del trasplanteCiento cuarenta y cinco pacientes recibieron un trasplante, 14 pacientes requirieron 2 trasplantes. Las características de los primeros trasplantes (159 en total) se describen a continuación.
Los donantes fueron un hermano HLA-idéntico en 30 (19%), un donante familiar alternativo (incluyendo donante haploidéntico y donante con una diferencia antigénica o alélica) en 40 (25%) y un donante no emparentado (DNE) en 89 (56%).
La mediana de edad al trasplante fue 12 meses (intervalo: un mes-189 meses).
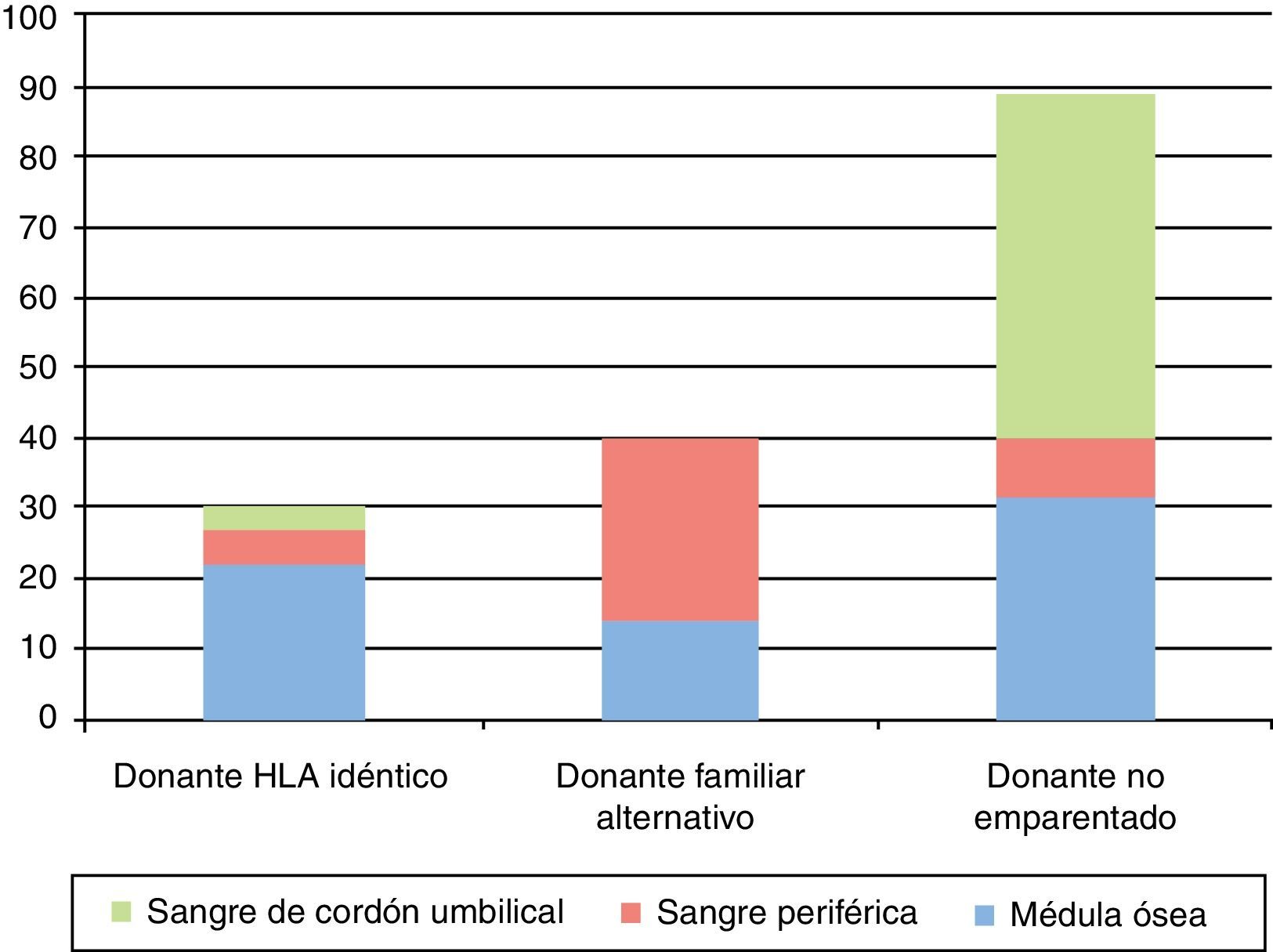
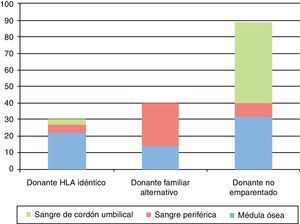
La fuente de progenitores hematopoyéticos fue la médula ósea en 68 casos (43%), la sangre de cordón umbilical en 52 (33%) y la sangre periférica en 39 (24%). En el caso de TPH de donante hermano HLA-idéntico, la fuente más utilizada fue la médula ósea, en el TPH de donante familiar alternativo la sangre periférica y en el TPH de DNE la sangre de cordón umbilical (fig. 3).
El tratamiento de acondicionamiento pretrasplante, el tipo de profilaxis de la enfermedad de injerto contra huésped y el tratamiento de soporte recibido se realizaron según la enfermedad de base, el tipo de donante y la fuente utilizada, así como los protocolos vigentes en cada centro en los diferentes periodos cronológicos.
Evolución postrasplanteNoventa y ocho niños (61,6%) permanecen vivos, 57 (35,9%) fallecieron y en 4 (2,5%) se perdió el seguimiento.
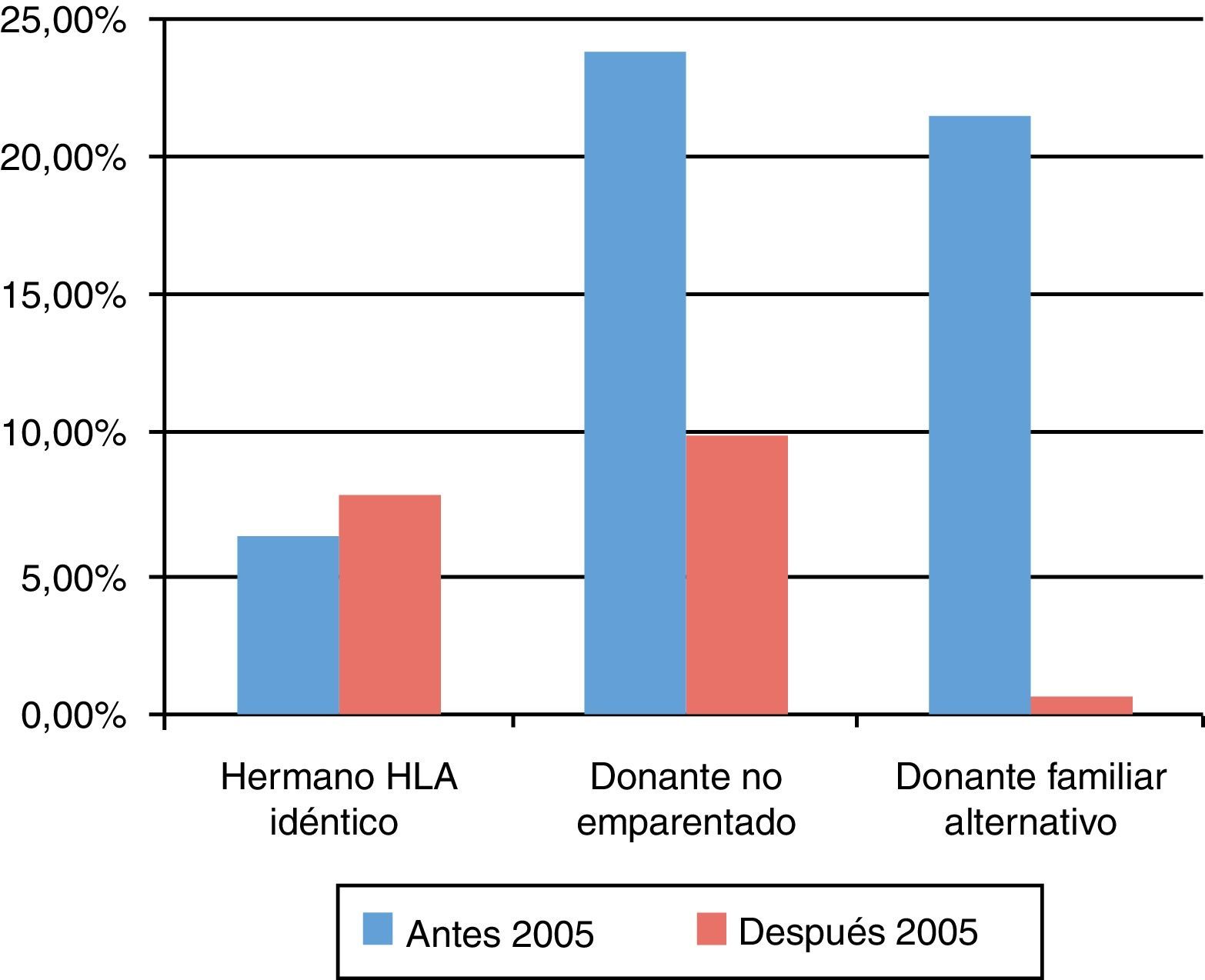
La mortalidad a los 100 días postrasplante varió según el tipo de donante y disminuyó a lo largo de los años. Fue menor en los pacientes trasplantados de un hermano HLA idéntico que en los pacientes trasplantados a partir de un donante familiar alternativo o un DNE (fig. 4).
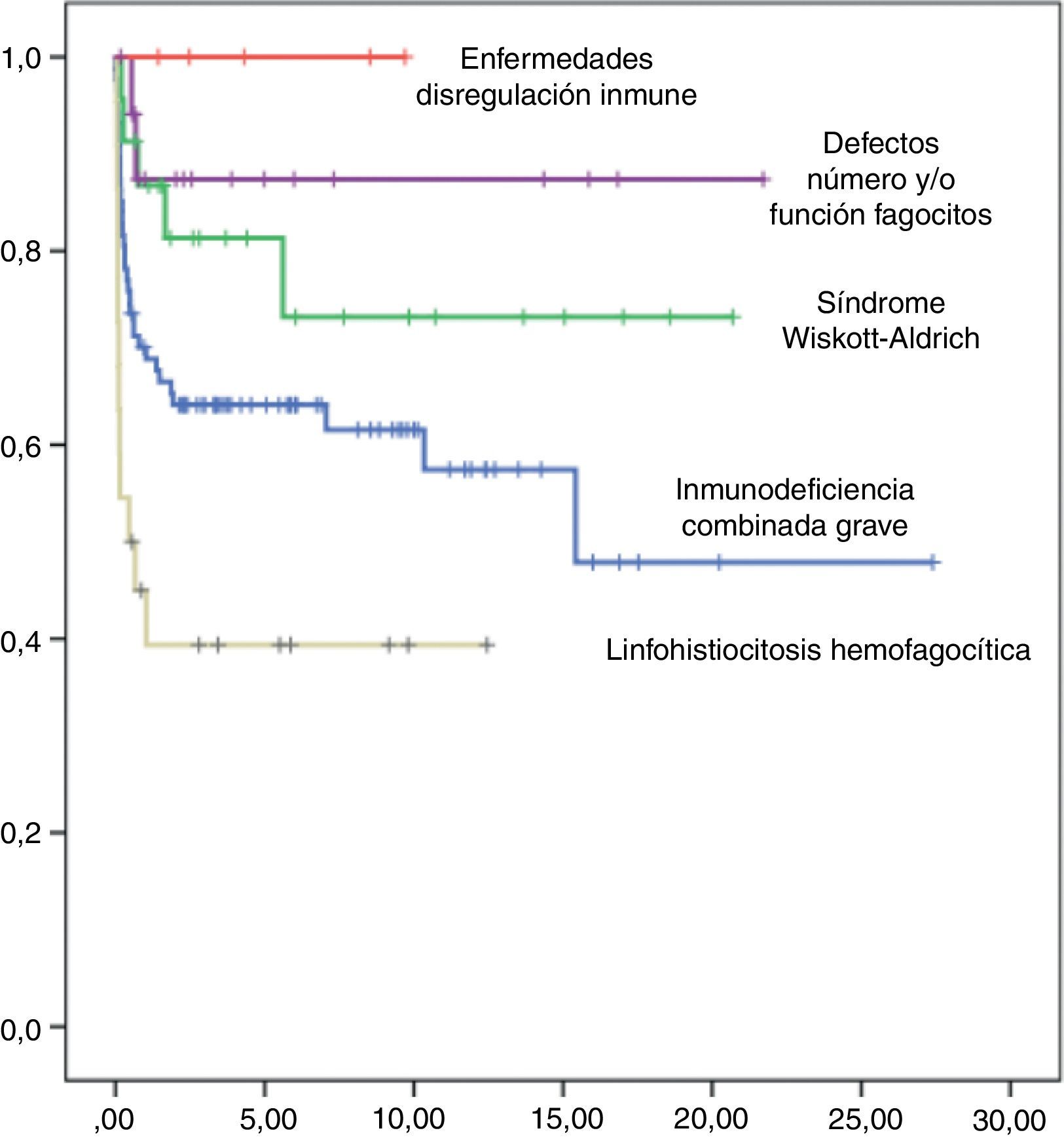
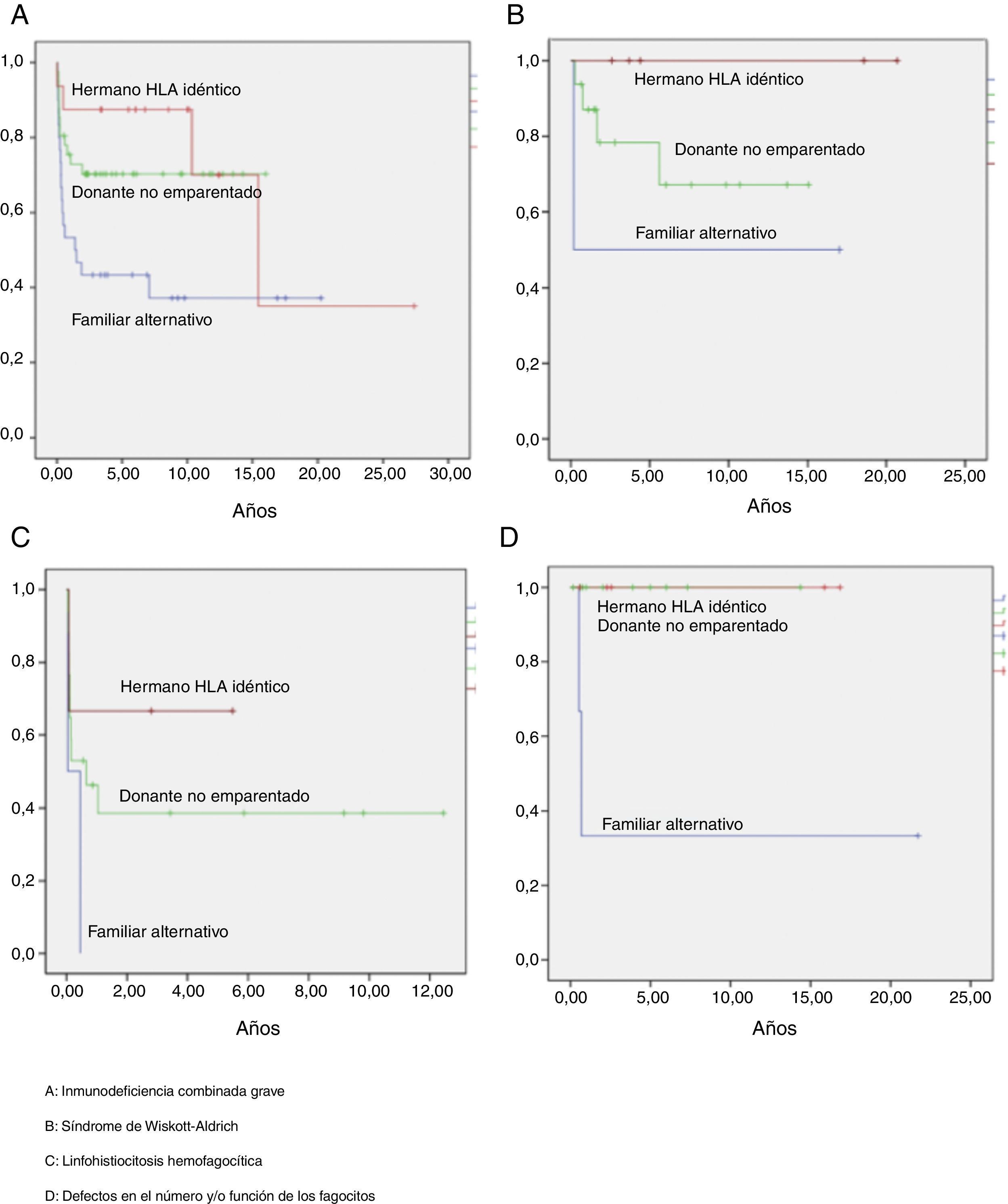
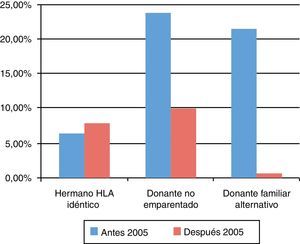
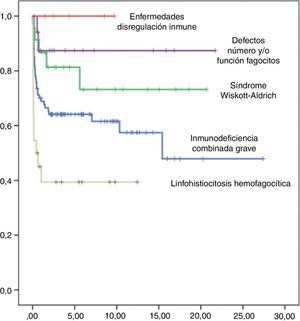
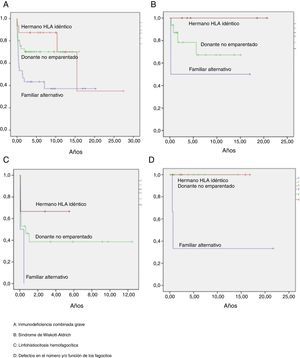
La supervivencia libre de enfermedad (SLE) a los 10 años postrasplante fue del 63%, siendo del 58% en el grupo de niños trasplantados antes del año 2005 y del 75% en los trasplantados posteriormente. Según el tipo de donante, la SLE a los 10 años postrasplante de hermano HLA idéntico fue del 90%, postrasplante de DNE del 60% y postrasplante de donante familiar alternativo del 36%. Según el tipo de inmunodeficiencia primaria, la SLE a los 10 años postrasplante de los niños afectados de IDCG fue del 60%, de los afectados de WAS del 75%, de los pacientes con defectos de los fagocitos del 88% y de los niños con linfohistiocitosis hemofagocítica del 40% (fig. 5). Las curvas de SLE de los pacientes según el tipo de inmunodeficiencia primaria y el tipo de donante se presentan en la figura 6.
Los pacientes con IDP fueron históricamente la primera cohorte de pacientes pediátricos tratados con alo-TPH (d). En 1968, se realizó el primer TPH con éxito en un paciente afectado de IDP; se trataba de un trasplante de médula ósea de hermano HLA-idéntico en un niño afectado de IDCG7. Desde entonces, el TPH se ha convertido en el tratamiento curativo para más de 30 IDP, con resultados cada vez más satisfactorios4-6.
Los mejores resultados publicados para el alo-TPH en pacientes afectados de IDP son para el grupo de pacientes afectados de IDCG. Las IDCG son las formas más graves de IDP y se caracterizan por ausencia de inmunidad mediada por células T en todos ellos y fallo variable en la función de células B10,11. El espectro fenotípico puede ser T-B+ Nk+, T-B+ Nk–, T-B-Nk+, T-B-Nk–. Aquellos pacientes con IDCG T-B- y déficit de ADA tienen un pronóstico peor11.
La IDCG es una urgencia médica. El diagnóstico y el TPH precoz permiten mejorar la supervivencia. Con el fin de diagnosticar precozmente esta afección, en diferentes países se ha implantado el cribado neonatal mediante técnicas de amplificación de PCR y en el caso de déficit de ADA, mediante espectrometría tándem mass12,13. Los pacientes que se trasplantan precozmente antes de los 6 meses de vida obtienen mejores índices de supervivencia11,13. El donante de elección en estos pacientes es la médula ósea de hermano HLA-idéntico11,14. Los datos publicados por el registro europeo SCETIDE/EBMT (1968-2005), que incluye a 699 pacientes afectados de IDCG sometidos a alo-TPH, muestran una supervivencia en el periodo entre 2000 y 2005 próxima al 90% en 25 pacientes trasplantados de hermano HLA-idéntico, del 66% en 96 trasplantados de donante familiar alternativo y del 69% en 46 trasplantados de DNE4. En caso de urgencia médica, tanto el trasplante haploidéntico, como el TPH de SCU, son opciones válidas, con supervivencias cercanas al 70%3,14. En nuestra serie, los datos son superponibles, con una supervivencia del 88% para pacientes que recibieron un alo-TPH de hermano HLA-idéntico y del 72% en el caso pacientes trasplantados de DNE. La supervivencia de los pacientes sometidos a trasplante haploidéntico fue significativamente más baja, del 36%, pero se trata de pacientes trasplantados a finales de la década de los 80 y principios de los 90, habiendo mejorado los resultados desde entonces.
En el grupo de pacientes con otras IDP no IDCG, se incluye un amplio espectro de afecciones como WAS, linfohistiocitosis hemofagocítica, neutropenia congénita y enfermedad granulomatosa crónica en las que el alo-TPH se reserva para aquellos que presentan complicaciones o infecciones graves4. El donante de elección en estos pacientes es también la médula ósea de hermano HLA-idéntico. Los datos publicados por el registro europeo SCETIDE/EBMT (1968-2005), que incluye 783 pacientes afectados de IDP no IDCG sometidos a alo-TPH, muestran una supervivencia en el periodo entre 2000 y 2005 próxima al 80% en 73 pacientes trasplantados de hermano HLA idéntico4. La supervivencia en el caso de trasplantados de DNE (124 casos) y donante familiar alternativo (23 casos) oscila entre el 45-65% en función de la compatibilidad HLA4. Globalmente, la supervivencia en este grupo de pacientes ha experimentado un incremento en los últimos años, a pesar de lo cual no alcanza los resultados obtenidos en el grupo de la IDCG. En nuestra serie, se confirma esta tendencia, presentando, por ejemplo, en el WAS una supervivencia del 100% para TPH de hermano HLA-idéntico, del 65% en el TPH de DNE y del 55% en el caso de TPH de donante familiar alternativo.
En todas las IDP, el tratamiento de acondicionamiento será mieloablativo o de intensidad reducida, en función del tipo de donante, la fuente de precursores hematopoyéticos utilizada y las comorbilidades asociadas8,15. En los últimos años, se han demostrado mejores resultados en los pacientes acondicionados con regímenes de intensidad reducida, sobre todo en los pacientes con IDP no IDCG15. Incluso en determinadas circunstancias, como es el caso de pacientes con IDCG que reciben un trasplante de hermano HLA-idéntico, no es necesario administrar tratamiento de acondicionamiento11.
La reconstitución de niveles normales de linfocitos T circulantes no se alcanza hasta los 6-12 meses post-TPH, lo que puede ocasionar una elevada morbimortalidad8. En ocasiones, hay pacientes en los que no se consiguen niveles normales de linfocitos B, quedando estos pacientes dependientes de transfusiones de gammaglobulinas8.
En la actualidad, el TPH continúa siendo el tratamiento de elección para una gran variedad de IDP. Se han reportado los primeros casos de pacientes tratados con terapia génica y, aunque se han descrito complicaciones relacionadas con esta, como leucemias en el caso de IDCG ligada al cromosoma X, se están investigando soluciones para corregir estos problemas16-19.
A pesar de las limitaciones, este estudio, retrospectivo y descriptivo, permite extraer conclusiones sobre los resultados del alo-TPH en pacientes afectados de IDP a nivel nacional, y equiparar los resultados obtenidos con aquellos publicados a nivel internacional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.