Las infecciones relacionadas con la asistencia sanitaria (IRAS) contribuyen a la morbimortalidad y a la diseminación de organismos multirresistentes. Los niños ingresados en la unidad de cuidados intensivos son sometidos a procedimientos invasivos que aumentan su riesgo de desarrollar IRAS y sepsis. El objetivo de este estudio fue analizar los factores asociados a la letalidad por sepsis derivada de IRAS.
Pacientes y métodosEstudio de casos y controles en una unidad de cuidados intensivos pediátricos polivalente de 7 camas de un hospital universitario de tercer nivel. La muestra consistió en 90 niños ingresados entre enero de 2014 y diciembre de 2018. Los casos se definieron como fallecimientos por sepsis asociada a infecciones asistenciales principales; los controles fueron los pacientes supervivientes que presentaron sepsis asociada a las mismas infecciones.
ResultadosLa muerte se asoció a edad menor o igual a 12meses, presencia de comorbilidad, enfermedad congénita, neumonía recurrente asociada a ventilación mecánica y shock séptico. En el análisis múltiple, la cardiopatía (OR: 12,48; IC95%: 2,55-60,93; p=0,002), la infección por bacterias resistentes a carbapenémicos (OR: 31,51; IC95%: 4,01-247,25; p=0,001), el cáncer (OR: 58,23; IC95%: 4,54-746,27; p=0,002) y el uso de adrenalina (OR: 13,14; IC95%: 1,35-128,02; p=0,003) siguieron asociados a la muerte.
ConclusionesLa sepsis hospitalaria secundaria a bacterias resistentes a carbapenémicos contribuyó a una elevada tasa de mortalidad. Los niños con cardiopatía o neoplasia o que necesitaron fármacos vasopresores tuvieron peores desenlaces.
Health care-associated infections (HAIs) contribute to morbidity and mortality and to the dissemination of multidrug-resistant organisms. Children admitted to the intensive care unit undergo invasive procedures that increase their risk of developing HAIs and sepsis. The aim of the study was to analyse factors associated with mortality due to sepsis arising from HAIs.
Patients and methodsWe conducted a case-control study in a 7-bed multipurpose paediatric intensive care unit in a tertiary care teaching hospital. The sample consisted of 90 children admitted between January 2014 and December 2018. The case group consisted of patients who died from sepsis associated with the main health care-associated infections; the control group consisted of patients who survived sepsis associated with the same infections.
ResultsDeath was associated with age less than or equal to 12months, presence of comorbidity, congenital disease, recurrent ventilator-associated pneumonia and septic shock. In the multiple regression analysis, heart disease (OR: 12.48; 95%CI: 2.55-60.93; P=.002), infection by carbapenem-resistant bacteria (OR: 31.51; 95%CI: 4.01-247.25; P=.001), cancer (OR: 58.23; 95%CI: 4.54-746.27; P=.002), and treatment with adrenaline (OR: 13.14; 95%CI: 1.35-128.02; P=.003) continued to be significantly associated with death.
ConclusionsHospital sepsis secondary to carbapenem-resistant bacteria contributed to a high mortality rate in this cohort. Children with heart disease or neoplasia or who needed vasopressor drugs had poorer outcomes.
Las infecciones relacionadas con la asistencia sanitaria (IRAS) se encuentran entre los eventos adversos más comunes y constituyen un problema de salud pública que contribuye a la morbimortalidad, la duración y el coste de los ingresos hospitalarios y la selección y diseminación de organismos multirresistentes (OMR). Se estima que 7 de cada 100 pacientes hospitalizados desarrollan IRAS en países desarrollados, proporción que aumenta a 10 de cada 100 en países en vías de desarrollo1. Los costes de hospitalización de pacientes pediátricos que contraen IRAS pueden ser hasta cuatro veces superiores a los de pacientes sin dicha complicación2. Las IRAS son más frecuentes en las unidades de cuidados intensivos neonatales y pediátricas (UCIP) que en otros entornos pediátricos. Un estudio multicéntrico europeo en pacientes pediátricos encontró una prevalencia global de IRAS del 4,5% que ascendía al 15,5% en las UCIP3.
Gran parte de las IRAS se relacionan con el uso de dispositivos médicos invasivos, entre las que las más comunes son la bacteriemia relacionada con catéter (BRC), la neumonía asociada a la ventilación mecánica (NAV) y la infección del tracto urinario (ITU) asociada al uso prolongado de sondas urinarias. Los niños ingresados en la UCI son sometidos a procedimientos invasivos, como la intubación traqueal, la inserción de sondas urinarias o catéteres venosos, la aspiración traqueal y procedimientos quirúrgicos, lo que aumenta el riesgo de contraer IRAS y desarrollar sepsis, ambas asociadas a un aumento de la mortalidad4,5. La sepsis es una causa de defunción frecuente en pediatría, especialmente en países en desarrollo. A pesar de ello, a causa de la inespecificidad clínica en distintos grupos etarios, continúa estando infraestimada6,7. La sepsis hospitalaria, es decir, la sepsis relacionada con la estancia o los procedimientos realizados en el entorno hospitalario, podría ser responsable del 10% al 20% de los casos de sepsis y se asocia a una mortalidad mayor en comparación con la sepsis adquirida en la comunidad8.
Un análisis de la mortalidad por sepsis realizado en Brasil en base a datos del Sistema Único de Salud estatal entre 2006 y 2015 encontró una mortalidad media total del 46,3%, con una mortalidad del 64,5% en el entorno de cuidados intensivos y del 13,6% en el grupo de 0 a 17años de edad9.
En consecuencia, se llevó a cabo un estudio con objeto de analizar los factores asociados con la mortalidad por sepsis secundaria a IRAS en pacientes pediátricos ingresados en la UCI de un hospital universitario público en el sur de Brasil.
Materiales y métodosEstudio de casos y controles mediante la revisión de datos obtenidos de historias clínicas, el servicio de documentación y archivos y los formularios de notificación de IRAS del Comité de Control de Infecciones del hospital universitario afiliado a la Universidad Estatal de Londrina en el estado de Paraná, en el sur de Brasil. El proyecto fue aprobado por el Comité Ético de Investigación en Seres Humanos de la universidad (certificado de aprobación ética n.o 28068119.6.0000.5231; opinión n.o 3991033 del 26 de abril de 2020).
La muestra incluyó a todos los pacientes pediátricos de 29 días a 11 años, 11 meses y 29 días de edad ingresados en la UCIP del Hospital Universitario de Londrina entre enero de 2014 y diciembre de 2018 y que desarrollaron bacteriemia, neumonía o ITU asociada a dispositivos invasivos y progresaron a sepsis según el sistema de notificación de IRAS del Comité de Control de Infecciones (CCI) del hospital. Se excluyó a los pacientes que recibían cuidados paliativos.
La UCIP de nuestro hospital es una unidad de referencia de alta complejidad acreditada por el sistema de salud pública de Brasil, que maneja a pacientes de 250 municipalidades de Paraná y 100 municipalidades de otros estados. Durante el periodo de estudio, la UCIP tenía siete camas para pacientes médicos y quirúrgicos y proporcionaba una media de 159,3 días pacientes de cuidados según los cómputos mensuales realizados por el CCI. La definición de caso fue defunción por sepsis asociada a NAV, ITU o BRC; los controles fueron pacientes que desarrollaron sepsis asociada a las mismas infecciones pero no fallecieron.
Las variables independientes fueron el sexo, la edad, la presencia de comorbilidades, el diagnóstico al ingreso, el tipo de IRAS (BRC, NAV o ITU), la presencia de dos o más IRAS, los días de estancia hospitalaria, los días de tratamiento antimicrobiano, la progresión a shock séptico, el uso de catecolaminas vasoconstrictoras (noradrenalina, adrenalina), el nivel sérico de lactato y el nivel de proteínaC reactiva.
En lo que respecta al agente etiológico con perfil de resistencia a antimicrobianos, se clasificó a los patógenos como bacilos gramnegativos con resistencia a carbapenémicos (RC) y organismos multirresistentes (OMR, definidos como bacilos gramnegativos resistentes a cefalosporinas de tercera o cuarta generación, bacilos gramnegativos productores de beta-lactamasas de espectro extendido y Staphylococcus spp. resistente a oxacilina).
La asociación entre la sepsis y la mortalidad se analizó en base a la información recogida en los formularios de notificación de IRAS del CCI del hospital. Para casos en los que hubo más de una infección y progresión a sepsis, la defunción registrada en el historial se atribuyó de acuerdo con la evaluación de la muerte llevada a cabo por el CCI.
Se recogieron datos sobre las pruebas de laboratorio realizadas entre las 24horas anteriores y las 24horas posteriores a la detección inicial de la IRAS; cuando se detectó más de una infección se utilizaron los datos correspondientes a la última IRAS detectada. En cuanto a los cultivos de especímenes obtenidos de focos de infección, se consideraron aquellos recogidos en el mismo intervalo temporal.
El equipo médico del CCI del hospital aplicó los criterios de la Agencia Nacional de Vigilancia Sanitaria de Brasil para el diagnóstico de IRAS. Los criterios aplicados para el diagnóstico de sepsis y shock séptico fueron los establecidos en las guías del International Paediatric Sepsis Consensus Conference10, mientras que las recomendaciones del Surviving Sepsis Campaign11 se utilizaron para guiar el tratamiento. Todos los pacientes recibieron antibioterapia empírica seguida de tratamiento dirigido según el perfil de susceptibilidad antimicrobiana al poco tiempo de obtenerse dichos resultados.
Los datos se introdujeron en hojas de Microsoft Excel y se analizaron con el paquete Statistical Package for the Social Sciences (SPSS), versión 20.0. Las variables categóricas se expresaron como frecuencias absolutas y relativas y las variables continuas como mediana y rango intercuartílico (RIC). Para evaluar las asociaciones entre las variables categóricas y la mortalidad, se utilizó la prueba χ2 o la prueba exacta de Fisher, según correspondiera. La asociación entre variables continuas y mortalidad se analizó mediante regresión logística simple. Se realizó un análisis de regresión logística múltiple seleccionando aquellas variables con un valor de p <0,20 en el análisis bivariado. El modelo de regresión se ajustó mediante las siguientes pruebas: Omnibus, R2 de Nagelkerke, prueba de Hosmer-Lemeshow y diagnóstico de residuos. Para construir el modelo se seleccionaron las variables mediante el método de inclusión por pasos (stepwise forward). La medida empleada para cuantificar la asociación entre variables fue la odds ratio (OR) con el intervalo de confianza del 95% (IC95%). El nivel de significación estadística fue del 5% (p<0,05).
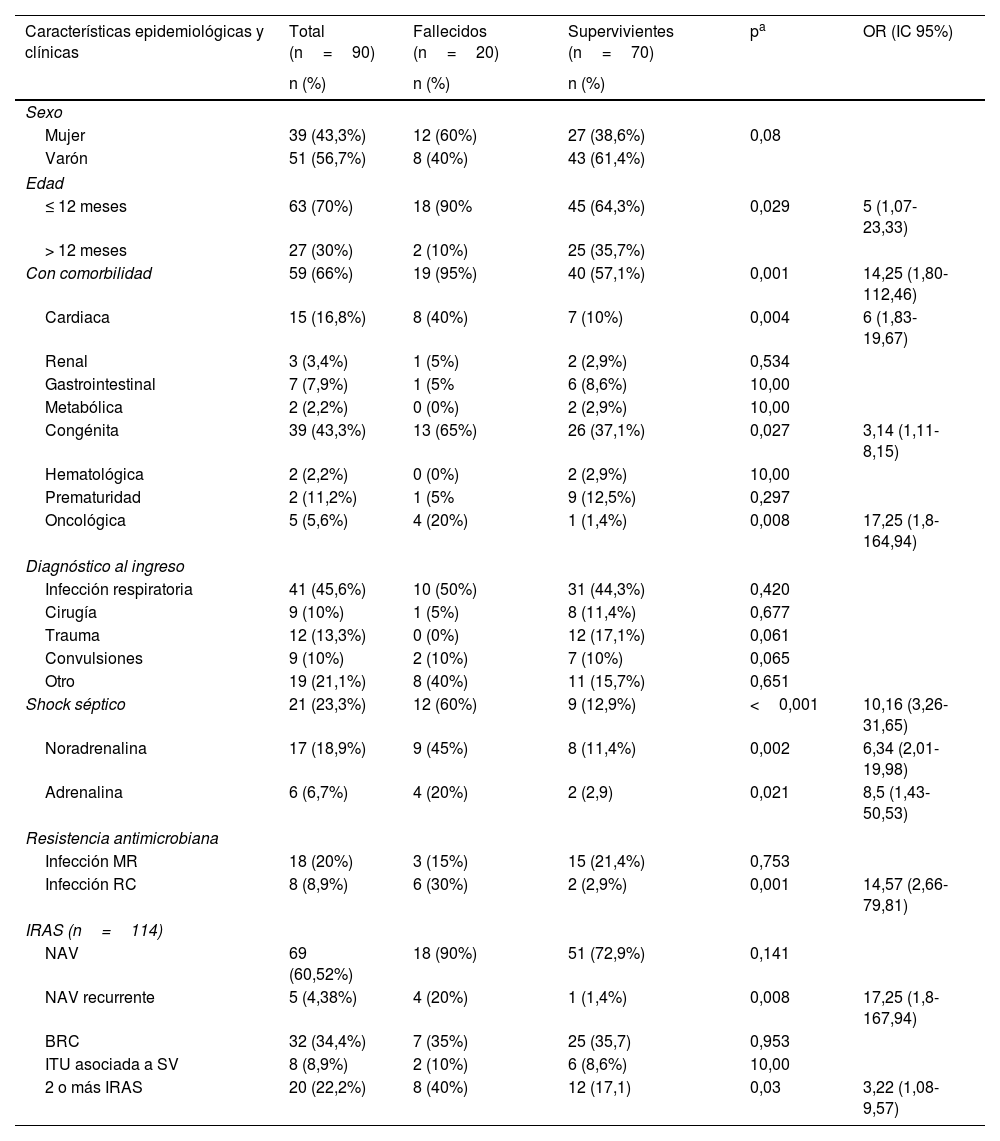
ResultadosLa muestra incluyó 90 niños con IRAS y sepsis, con predominio de pacientes de sexo masculino, menores de 12meses, con comorbilidades y con diagnóstico de enfermedad infecciosa al ingreso (tabla 1). La mediana de edad fue de 10meses (RIC: 20,7) y la mediana de estancia en la UCIP fue de 13,5días (RIC: 20). El 30% de los pacientes desarrollaron infecciones por bacterias resistentes a distintos antibióticos. Prácticamente una cuarta parte (23,3%) desarrollaron shock séptico, y la noradrenalina fue el fármaco vasoactivo utilizado en el 81% de estos casos. La tasa de letalidad de la sepsis nosocomial fue del 22,2%. Se detectaron un total de 114IRAS, de las que el tipo más frecuente fue la NAV, seguidas de la BRC y las ITU. No se encontró asociación entre el tipo de IRAS y la mortalidad (tabla 1).
Características clínicas y epidemiológicas de los pacientes con sepsis nosocomial y su asociación con la mortalidad
| Características epidemiológicas y clínicas | Total (n=90) | Fallecidos (n=20) | Supervivientes (n=70) | pa | OR (IC 95%) |
|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | |||
| Sexo | |||||
| Mujer | 39 (43,3%) | 12 (60%) | 27 (38,6%) | 0,08 | |
| Varón | 51 (56,7%) | 8 (40%) | 43 (61,4%) | ||
| Edad | |||||
| ≤ 12 meses | 63 (70%) | 18 (90% | 45 (64,3%) | 0,029 | 5 (1,07-23,33) |
| > 12 meses | 27 (30%) | 2 (10%) | 25 (35,7%) | ||
| Con comorbilidad | 59 (66%) | 19 (95%) | 40 (57,1%) | 0,001 | 14,25 (1,80-112,46) |
| Cardiaca | 15 (16,8%) | 8 (40%) | 7 (10%) | 0,004 | 6 (1,83-19,67) |
| Renal | 3 (3,4%) | 1 (5%) | 2 (2,9%) | 0,534 | |
| Gastrointestinal | 7 (7,9%) | 1 (5% | 6 (8,6%) | 10,00 | |
| Metabólica | 2 (2,2%) | 0 (0%) | 2 (2,9%) | 10,00 | |
| Congénita | 39 (43,3%) | 13 (65%) | 26 (37,1%) | 0,027 | 3,14 (1,11-8,15) |
| Hematológica | 2 (2,2%) | 0 (0%) | 2 (2,9%) | 10,00 | |
| Prematuridad | 2 (11,2%) | 1 (5% | 9 (12,5%) | 0,297 | |
| Oncológica | 5 (5,6%) | 4 (20%) | 1 (1,4%) | 0,008 | 17,25 (1,8-164,94) |
| Diagnóstico al ingreso | |||||
| Infección respiratoria | 41 (45,6%) | 10 (50%) | 31 (44,3%) | 0,420 | |
| Cirugía | 9 (10%) | 1 (5%) | 8 (11,4%) | 0,677 | |
| Trauma | 12 (13,3%) | 0 (0%) | 12 (17,1%) | 0,061 | |
| Convulsiones | 9 (10%) | 2 (10%) | 7 (10%) | 0,065 | |
| Otro | 19 (21,1%) | 8 (40%) | 11 (15,7%) | 0,651 | |
| Shock séptico | 21 (23,3%) | 12 (60%) | 9 (12,9%) | <0,001 | 10,16 (3,26- 31,65) |
| Noradrenalina | 17 (18,9%) | 9 (45%) | 8 (11,4%) | 0,002 | 6,34 (2,01-19,98) |
| Adrenalina | 6 (6,7%) | 4 (20%) | 2 (2,9) | 0,021 | 8,5 (1,43-50,53) |
| Resistencia antimicrobiana | |||||
| Infección MR | 18 (20%) | 3 (15%) | 15 (21,4%) | 0,753 | |
| Infección RC | 8 (8,9%) | 6 (30%) | 2 (2,9%) | 0,001 | 14,57 (2,66-79,81) |
| IRAS (n=114) | |||||
| NAV | 69 (60,52%) | 18 (90%) | 51 (72,9%) | 0,141 | |
| NAV recurrente | 5 (4,38%) | 4 (20%) | 1 (1,4%) | 0,008 | 17,25 (1,8-167,94) |
| BRC | 32 (34,4%) | 7 (35%) | 25 (35,7) | 0,953 | |
| ITU asociada a SV | 8 (8,9%) | 2 (10%) | 6 (8,6%) | 10,00 | |
| 2 o más IRAS | 20 (22,2%) | 8 (40%) | 12 (17,1) | 0,03 | 3,22 (1,08-9,57) |
BRC: bacteriemia relacionada con catéter; IRAS: infección relacionada con la asistencia sanitaria; ITU: infección del tracto urinario; MR: multirresistencia; NAV: neumonía asociada a la ventilación mecánica; RC: resistencia a carbapenémicos; SV: sondaje vesical.
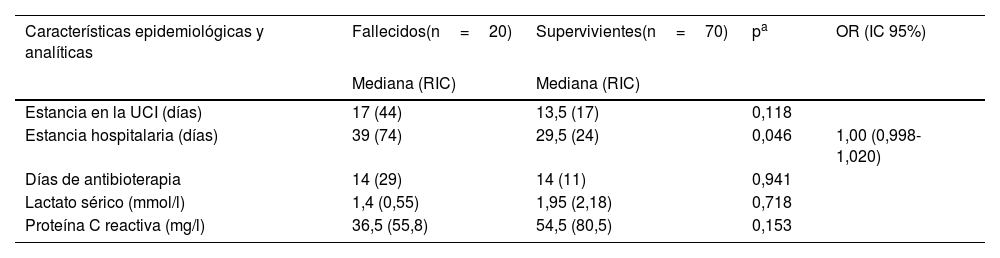
La duración de la antibioterapia en días no se asoció con la mortalidad (tabla 2). En cuanto al uso de antibioterapia empírica, la NAV se trató con mayor frecuencia con piperacilina/tazobactam y amikacina (62,3% de los tratamientos), con una duración mediana de 7días para ambos (RIC: 3). En el tratamiento de la BRC se utilizó la vancomicina en el 43,9% de los casos, con una duración mediana de 10días (RIC: 7), y para las ITU se utilizó la amikacina en el 62,5% de los casos, con una duración mediana de 7días (RIC: 3). Los antibióticos utilizados para el tratamiento empírico en niños con infecciones por microorganismos que resultaron ser RC fueron amikacina en 4 (2 con cepas RC susceptibles a amikacina que sobrevivieron, 1con una cepa RC susceptible a amikacina que falleció y 1con una cepa RC que también era resistente a la amikacina, que falleció), carbapenem en1, cefepima en1, glicopéptido en1 y polimixina en1, todos los cuales (n=4) fallecieron a pesar de haberse ajustado el tratamiento en base a los resultados del antibiograma. En todos los pacientes con infecciones por un organismo RC, el tratamiento empírico se cambió a polimixina, amikacina, tigeciclina o una combinación de ellos en cuanto estuvieron disponibles los resultados del cultivo. Por lo tanto, el tratamiento empírico fue apropiado en 4 pacientes, de los cuales 2 acabaron muriendo, e inapropiado en 4 pacientes, que fallecieron todos.
Duración del ingreso y la antibioterapia y parámetros de laboratorio en pacientes con sepsis nosocomial, y su asociación con la mortalidad
| Características epidemiológicas y analíticas | Fallecidos(n=20) | Supervivientes(n=70) | pa | OR (IC 95%) |
|---|---|---|---|---|
| Mediana (RIC) | Mediana (RIC) | |||
| Estancia en la UCI (días) | 17 (44) | 13,5 (17) | 0,118 | |
| Estancia hospitalaria (días) | 39 (74) | 29,5 (24) | 0,046 | 1,00 (0,998-1,020) |
| Días de antibioterapia | 14 (29) | 14 (11) | 0,941 | |
| Lactato sérico (mmol/l) | 1,4 (0,55) | 1,95 (2,18) | 0,718 | |
| Proteína C reactiva (mg/l) | 36,5 (55,8) | 54,5 (80,5) | 0,153 |
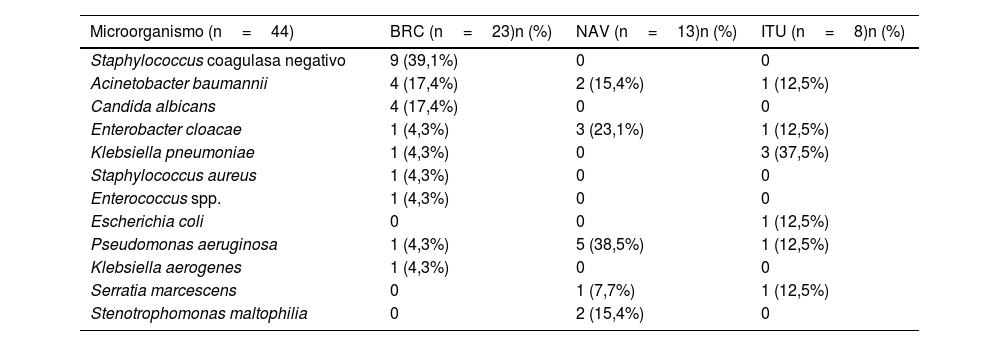
Se aisló un microorganismo en el 38,5% de las IRAS analizadas. Los bacilos gramnegativos fueron aislados con mayor frecuencia, representando el 65,9% del total de aislamientos. El agente etiológico se identificó en el 17,6% de los 74 casos de NAV y en el 71,9% de los 32 pacientes con BRC. Pseudomonas aeruginosa fue el patógeno identificado con mayor frecuencia en casos de NAV. En el grupo con BRC fue más frecuente el aislamiento de cocos grampositivos, responsables del 47,3% de los casos diagnosticados. El microorganismo aislado con mayor frecuencia en pacientes con ITU fue Klebsiella pneumoniae (tabla 3).
Agentes etiológicos involucrados en casos de sepsis por infección relacionada con la asistencia sanitaria
| Microorganismo (n=44) | BRC (n=23)n (%) | NAV (n=13)n (%) | ITU (n=8)n (%) |
|---|---|---|---|
| Staphylococcus coagulasa negativo | 9 (39,1%) | 0 | 0 |
| Acinetobacter baumannii | 4 (17,4%) | 2 (15,4%) | 1 (12,5%) |
| Candida albicans | 4 (17,4%) | 0 | 0 |
| Enterobacter cloacae | 1 (4,3%) | 3 (23,1%) | 1 (12,5%) |
| Klebsiella pneumoniae | 1 (4,3%) | 0 | 3 (37,5%) |
| Staphylococcus aureus | 1 (4,3%) | 0 | 0 |
| Enterococcus spp. | 1 (4,3%) | 0 | 0 |
| Escherichia coli | 0 | 0 | 1 (12,5%) |
| Pseudomonas aeruginosa | 1 (4,3%) | 5 (38,5%) | 1 (12,5%) |
| Klebsiella aerogenes | 1 (4,3%) | 0 | 0 |
| Serratia marcescens | 0 | 1 (7,7%) | 1 (12,5%) |
| Stenotrophomonas maltophilia | 0 | 2 (15,4%) | 0 |
BRC: bacteriemia relacionada con catéter; ITU: infección del tracto urinario; NAV: neumonía asociada a ventilación mecánica.
Del total de microorganismos aislados, el 59,1% exhibieron algún mecanismo de resistencia, de los cuales 18 (41%) fueron OMR y 8 (18,2%) fueron RC. En el subgrupo de bacterias RC, Acinetobacter baumannii fue el agente etiológico en 6IRAS (4BRC, 1NAV y 1ITU). En 2IRAS se detectó Pseudomonas aeruginosa RC (1BRC y 1NAV).
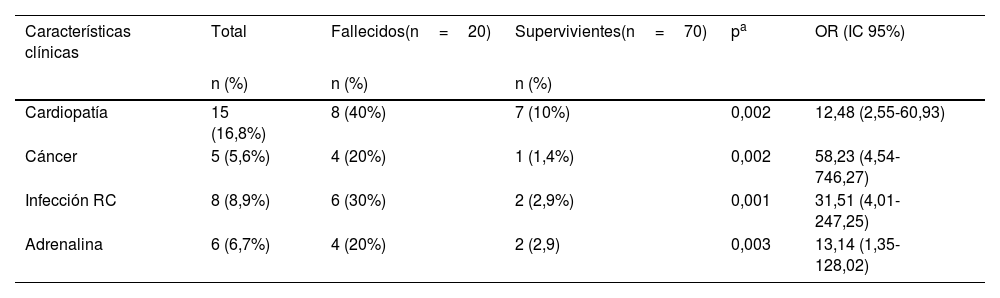
En el análisis bivariante la mortalidad se asoció a los siguientes factores: edad ≤12meses, presencia de comorbilidad, enfermedad congénita, cardiopatía, neoplasia, NAV recurrente, shock séptico, uso de noradrenalina y/o adrenalina, infección por microorganismo RC y el desarrollo de más de una IRAS (tabla 1). En el análisis de regresión logística múltiple se mantuvo la asociación de la mortalidad con la cardiopatía, la neoplasia, la infección por microorganismo RC y el uso de adrenalina (tabla 4).
Variables asociadas a la muerte por sepsis
| Características clínicas | Total | Fallecidos(n=20) | Supervivientes(n=70) | pa | OR (IC 95%) |
|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | |||
| Cardiopatía | 15 (16,8%) | 8 (40%) | 7 (10%) | 0,002 | 12,48 (2,55-60,93) |
| Cáncer | 5 (5,6%) | 4 (20%) | 1 (1,4%) | 0,002 | 58,23 (4,54-746,27) |
| Infección RC | 8 (8,9%) | 6 (30%) | 2 (2,9%) | 0,001 | 31,51 (4,01-247,25) |
| Adrenalina | 6 (6,7%) | 4 (20%) | 2 (2,9) | 0,003 | 13,14 (1,35-128,02) |
RC: resistente a carbapenémicos.
En nuestro estudio, el tipo de IRAS más frecuente en los pacientes pediátricos con sepsis fue la NAV, seguida de la BRC y las ITU. La mayoría de los estudios realizados en niños han encontrado que la BRC es la infección más común en este grupo etario3,12,13, aunque un análisis descriptivo de la epidemiología de las IRAS realizado en una UCIP del estado brasileño de Goiás encontró que el tipo más frecuente fue la NAV, seguida por la BRC y las ITU14. Hatachi et al.4 analizaron las IRAS en el entorno de la UCIP y, en consonancia con los hallazgos de nuestro estudio, no encontraron diferencias significativas en la asociación entre distintos tipos de IRAS y la mortalidad. Por lo tanto, parece que el origen de la sepsis nosocomial y su asociación con la mortalidad varían según el entorno del estudio. De acuerdo con nuestros hallazgos, la NAV continúa siendo un problema a tener en cuenta en nuestro hospital, así como en otras UCIP en Brasil y en el resto del mundo.
En cuanto a los microorganismos aislados, los más frecuentes fueron los bacilos gramnegativos, seguidos de Staphylococcus coagulasa negativos. Los resultados de un estudio multicéntrico realizado en Europa por Zingg et al.3 fueron similares. En un estudio brasileño se observó un predominio de Staphylococcus aureus en la UCIP, seguida de Enterobacter spp.15. Otro estudio realizado con datos del Sistema Nacional de Vigilancia de Infecciones Nosocomiales (NNIS) de Estados Unidos también encontró una prevalencia mayor de Staphylococcus aureus en pacientes pediátricos16. Los autores de una revisión sistemática de la evidencia de pacientes pediátricos con sepsis que no sobrevivieron encontraron una prevalencia de bacilos gramnegativos del 41% en países desarrollados y del 14% en países subdesarrollados7.
Atendiendo a los tres tipos de IRAS considerados, Staphylococcus coagulasa negativo fue el agente etiológico más común en el grupo de BRC, lo que concuerda con un estudio realizado en China en el que la proporción de casos de BRC causados por este patógeno fue del 44,4%17. En Brasil, en un estudio realizado en una UCIP del estado de São Paulo, se detectaron bacterias grampositivas en el 72% de los casos de BRC18. Otro estudio encontró una prevalencia mayor de Enterococcus faecalis en pacientes pediátricos en Estados Unidos16.
Aunque solo se aisló un agente etiológico en el 17,6% de los casos de NAV, otros autores también han descrito tasas bajas de NAV con confirmación microbiológica que oscilan entre el 24,4% y el 54% de los casos totales16,19. En nuestro estudio, el agente etiológico de NAV identificado con mayor frecuencia fue Pseudomonas aeruginosa. Un estudio realizado en la India analizó la etiología del NAV en las UCIP y encontró una mayor prevalencia de bacilos gramnegativos no fermentadores, entre los que el más frecuente fue Acinetobacter baumannii, seguido de Pseudomonas aeruginosa19; en otro estudio realizado en Estados Unidos el más frecuente fue Staphylococcus aureus, también seguido de Pseudomonas aeruginosa16.
En el grupo de ITU analizados, el microorganismo más frecuente fue Klebsiella pneumoniae. Lake et al.20 examinaron datos correspondientes a pacientes pediátricos entre 2011 y 2014 en Estados Unidos, encontrando que Escherichia coli fue el patógeno predominante, seguido por Pseudomonas aeruginosa y Klebsiella pneumoniae. En un estudio realizado en una UCIP de la India, Samraj et al.21 encontraron que los hongos de Candida spp. fueron los microorganismos causantes más frecuentes, seguidos de Escherichia coli. En la población adulta, Klebsiella pneumoniae fue el segundo patógeno identificado con mayor frecuencia en ITU asociadas a sondaje vesical, con una prevalencia alta de resistencia antimicrobiana22,23. Otro estudio realizado en España que incluyó 104 ingresos en UCIP durante un período de un año concluyó que solo 6 pacientes tenían infecciones urinarias: 4 causadas por Escherichia coli y 2 por Candida albicans24. Un estudio brasileño realizado en una ITU de adultos en el estado de Minas Gerais entre 2009 y 2010 encontró una prevalencia de ITU del 4,3% con predominio de Candida albicans, seguida de Pseudomonas aeruginosa y Enterobacter aerogenes25.
En nuestro estudio analizamos los factores asociados a la mortalidad en niños con IRAS y sepsis. Un estudio epidemiológico brasileño que incluyó tanto niños como adultos encontró una mortalidad global por sepsis en la UCI del 64,5%9, superior a la tasa en nuestra cohorte. La mortalidad por sepsis nosocomial fue del 22,2%. Una revisión sistemática con metaanálisis de Tan et al.7 que incluyó 94 estudios de mortalidad por sepsis grave y shock séptico en países de todo el mundo con representación de cada continente encontró una mortalidad agrupada del 24,7%, similar a la de nuestra cohorte. En un estudio realizado en UCIP en Sudamérica, la mortalidad asociada a la sepsis fue del 14,3%, ascendiendo al 23,1% en pacientes con shock séptico26. Otro análisis mostró que el shock séptico se asociaba a un riesgo de defunción seis veces mayor en la UCIP27. En nuestro estudio, la mortalidad por sepsis en pacientes que progresaron a shock séptico fue del 60%. En el análisis bivariante, el desarrollo de shock séptico y el uso de noradrenalina o adrenalina se asociaron con la mortalidad, asociación que siguió siendo significativa en el análisis de regresión múltiple.
La muerte por sepsis se asoció con la edad menor de 12 meses. Ruth et al.28, que analizaron datos de una UCIP en Estados Unidos, encontraron que una edad inferior a 1año se asociaba a la muerte relacionada con sepsis. Jaramillo-Bustamante et al.27 encontraron una probabilidad de muerte por sepsis tres veces mayor en lactantes menores de 2años en Colombia.
La presencia de comorbilidades se asoció significativamente con la muerte en nuestra muestra, resultados similares a los publicados por Schlapbach et al.29, que reportaron una mortalidad dos veces mayor en niños con enfermedad crónica. Souza et al.26 estudiaron la sepsis en entorno de cuidados intensivos pediátricos en 5 países sudamericanos y encontraron una asociación estadísticamente significativa entre la presencia de comorbilidades y la mortalidad, concluyendo que las enfermedades de base más frecuentes en los no supervivientes fueron las enfermedades congénitas y las cardiovasculares.
Ruth et al.28 también encontraron una asociación entre la enfermedad cardiovascular u oncológica de base y un aumento de casi el doble en la probabilidad de muerte por sepsis en pacientes pediátricos, asociación cuya significación estadística se mantuvo en el análisis de regresión múltiple en nuestro estudio.
En el estudio SPROUT, Weiss et al.30 analizaron datos de niños en 26 países con representación de todos los continentes y no encontraron una asociación significativa entre las comorbilidades o la edad y la muerte por sepsis; no obstante, la mortalidad fue mayor en niños con cáncer, enfermedades renales o inmunodeficiencias.
La NAV recurrente se asoció a la mortalidad, a diferencia del estudio de Combes et al.31 en Francia, en el que no se observó una diferencia significativa en la mortalidad en adultos con un solo episodio de NAV en comparación con más de uno. Sin embargo, variables como la edad y las puntuaciones de gravedad se asociaron a la mortalidad en estos pacientes. Otro estudio sí mostró un aumento en la mortalidad en pacientes adultos con más de un episodio de NAV, aunque la diferencia no fue estadísticamente significativa32.
La asociación significativa entre la mortalidad y la infección por bacterias RC se mantuvo en el análisis de regresión múltiple, de acuerdo con la literatura previa. Un informe emitido por el Centers for Disease Control and Prevention33 de Estados Unidos notificó que más de la mitad de los casos de bacteriemia por bacterias RC terminaron en exitus. Alvares et al.34 analizaron la mortalidad en niños con sepsis por bacterias RC en Brasil y encontraron que el 56,4% fallecieron en comparación con el 4,65% en el grupo con sepsis por bacterias sin RC (p<0,0001). Otro estudio realizado en Estados Unidos también encontró un riesgo de defunción seis veces mayor en pacientes pediátricos con infección por bacterias RC35.
La presencia de dos o más IRAS se asoció a la muerte por sepsis, en consonancia con un estudio previo que objetivó un aumento de la mortalidad por sepsis en adultos con múltiples focos de infección36.
Aunque el nivel de lactato no se asoció de manera significativa con la mortalidad, estudios previos han encontrado una asociación entre la elevación de los niveles de lactato y la mortalidad por sepsis en niños. Un estudio de cohortes en Estados Unidos concluyó que un nivel de lactato en las fases tempranas superior a 4mmol/l se asocia a un riesgo triplicado de muerte37. Jaiswal et al.38 encontraron niveles de lactato significativamente mayores en pacientes fallecidos y concluyeron que la determinación del lactato a las 6horas del diagnóstico es un predictor importante de mortalidad.
El nivel de proteína C reactiva (PCR) tampoco se asoció con la muerte. Un estudio retrospectivo pediátrico realizado en Israel encontró una asociación estadísticamente significativa entre niveles de PCR ≥30mg/dl y la mortalidad; los autores utilizaron el nivel más alto de PCR registrado del paciente durante la estancia hospitalaria para el análisis39. Un estudio llevado a cabo en Brasil en el que se analizaron los niveles de PCR en pacientes adultos con sepsis en la UCI encontró niveles significativamente más altos en los que fallecieron. La prueba mostró una capacidad de predicción buena para la mortalidad en estos pacientes, aunque en este estudio los autores realizaron determinaciones de PCR seriadas40. La asociación con la mortalidad de los niveles elevados de PCR o de lactato en estos dos estudios podría explicarse por la realización de las pruebas en días más próximos a la muerte. En nuestro estudio, en cambio, se analizó la asociación con los niveles de PCR en fases tempranas, medidos poco después del diagnóstico de sepsis a la vez que los niveles de lactato.
Nuestro estudio tiene varias limitaciones. Entre ellas se encuentran su diseño retrospectivo, el hecho de que se llevó a cabo en un solo centro y el reducido tamaño muestral debido al pequeño número de camas en la UCIP participante, lo que podría haber limitado el análisis inferencial. Nuestro análisis de la sepsis debida a otros tipos de IRAS, como la infección quirúrgica, la meningitis, la diarrea o la infección cutánea, también podría haber limitado el análisis inferencial. Además, no se estratificó a los pacientes en base a la gravedad y no se evaluó si el tratamiento antibiótico empírico inicial en el total de las IRAS resultó ser apropiado para el microorganismo aislado en el cultivo. Factores como estos pueden haber sesgado los resultados.
Por otro lado, nuestro estudio contribuye a aumentar el conocimiento sobre las principales causas de mortalidad en la UCIP. Los resultados de nuestro estudio se suman a los datos de otros hospitales universitarios25,26,34 que manejan pacientes complejos con enfermedades graves. Por añadidura, en nuestro hospital los cambios frecuentes en la composición de los equipos asistenciales, que incluyen muchos estudiantes, dificultan la mejora de la formación en medidas preventivas contra la infección y la transmisión de microorganismos. En la actualidad, las bacterias RC son prevalentes en nuestra UCIP. Cabe subrayar este aspecto, pues refleja el importante reto que supone controlar la propagación de OMR, la consiguiente dificultad del tratamiento de estas infecciones y la alta mortalidad asociada.
ConclusiónLa tasa de letalidad por sepsis nosocomial en la UCIP de nuestro hospital fue alta. La evolución fue menos favorable en los pacientes de menor edad, que requirieron vasopresores, con cardiopatía o con cáncer de base o con infecciones causadas por bacterias con resistencia a carbapenémicos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.