Las infecciones relacionadas con la asistencia sanitaria (IRAS) son frecuentes en neonatología, pero no existe un consenso en sus definiciones. Esto dificulta la comparación de incidencias entre distintas unidades o la valoración de la eficacia de los paquetes de prevención. Por ello, es que consideramos muy importante lograr un acuerdo en las definiciones y diagnóstico de una de las morbilidades más recurrentes de los neonatos hospitalizados. El presente documento pretende unificar estas definiciones en relación con las infecciones más comunes como son la bacteriemia relacionada con el catéter (BRC), la neumonía vinculada a la ventilación mecánica (NAV) y la infección de la herida quirúrgica (IHQ), así como su abordaje diagnóstico-terapéutico.
Health care-associated infections are common in neonatology, but there is no consensus on their definitions. This makes it difficult to compare their incidence or assess the effectiveness of prevention bundles. This is why we think it is very important to achieve a consensus on the definitions and diagnostic criteria for one of the most frequent causes of morbidity in hospitalised neonates. This document aims to standardise the definitions for the most frequent health care-associated infections, such as catheter-associated bloodstream infection, ventilator-associated pneumonia and surgical wound infection, as well as the approach to their diagnosis and treatment.
Las infecciones nosocomiales, también llamadas infecciones relacionadas con la asistencia sanitaria (IRAS), están ocasionadas por gérmenes presentes en el entorno hospitalario que se transmiten por contacto directo o a través de materiales contaminados. Entre ellas, las más frecuentes son aquellas vinculadas con dispositivos como la bacteriemia relacionada con catéter (BRC) y la neumonía asociada a ventilación mecánica (NAV), siendo los pacientes más susceptibles los recién nacidos (RN) de muy bajo peso (RNMBP)1. El objetivo de este documento es unificar las definiciones de estas enfermedades y su abordaje diagnóstico-terapéutico.
Sepsis relacionada con catéterDefiniciones. EpidemiologíaLa sepsis neonatal se define como la aparición de un síndrome de respuesta inflamatoria sistémica (SRIS) (tabla 1), secundario a la presencia de un agente infeccioso habitualmente en la sangre. Aunque no existe una definición de consenso internacional2, se habla de sepsis precoz y tardía en relación con el inicio de la sintomatología antes o después de las 72 horas de vida3. Sin embargo, parece menos arbitrario basar la clasificación en el mecanismo de transmisión el cual se divide en dos categorías: sepsis vertical (transmisión madre-RN) y nosocomial (adquirida en el contexto de un ingreso hospitalario) independientemente del momento en el que produzca4.
Signos y síntomas de sospecha de sepsis2
| Signos y síntomas clínicos | |
|---|---|
| Respiratorios | Hemodinámicos |
| • Dificultad respiratoria• Apneas > 20 s, aumentadas o nueva aparición• Aumento de las necesidades de O2 | • Taquicardia > 200 lpm o bradicardia < 80-100 lpm• Hipotensión arterial• Recapilarización > 2 s |
| Neurológicos | Digestivos |
| • Irritabilidad (no justificada por dolor)• Apatía/letargia | • Rechazo de tomas. Mala tolerancia digestiva• Distensión abdominal |
| Cutáneos | Otros |
| • Ictericia• Color pajizo, pálido-grisáceo• Púrpura, petequias | • Fiebre, hipotermia o mala regulación térmica• Hiperglucemia (> 140 mg/dL)• Acidosis metabólica (EB < -10 mEq/L) |
| Alteraciones analíticas/reactantes de fase aguda* | |
|---|---|
| • Leucopenia < 5.000/μL• Trombopenia < 100.000/μL• Índice neutrófilos inmaduros/totales > 0,2 | • PCR > 2,0 mg/dL• PCT > 0,5 ng/mL (RN > 3 días de vida)• Interleucina 6 > 50 pg/mL (en verticales considerar > 250-300 pg/mL) |
EB: exceso de bases; lpm: latidos por minuto; PCR: reacción en cadena de la polimerasa; PCT: procalcitonina; RN: recién nacido.
Según los datos de la red nacional Grupo Castrillo, la incidencia de la sepsis nosocomial es inferior a 2% en el RN con peso al nacimiento (PN) mayor de 1.500 g vs. 20-30% en los RN con PN inferior o igual a 1.500 g o incluso hasta 40-50% en los menores de 1.000 g4, siendo estos datos similares a los de otras series internacionales5.
La incidencia de BRC en nuestra red nacional fue de 5,6 episodios/1.000 días-catéter para catéteres centrales de inserción periférica y 7,3 episodios/1.000 días-catéter para los umbilicales4. Estas cifras pueden variar en las distintas series en función de la definición empleada en cada una de ellas6 llegando a publicarse tasas cercanas a cero7.
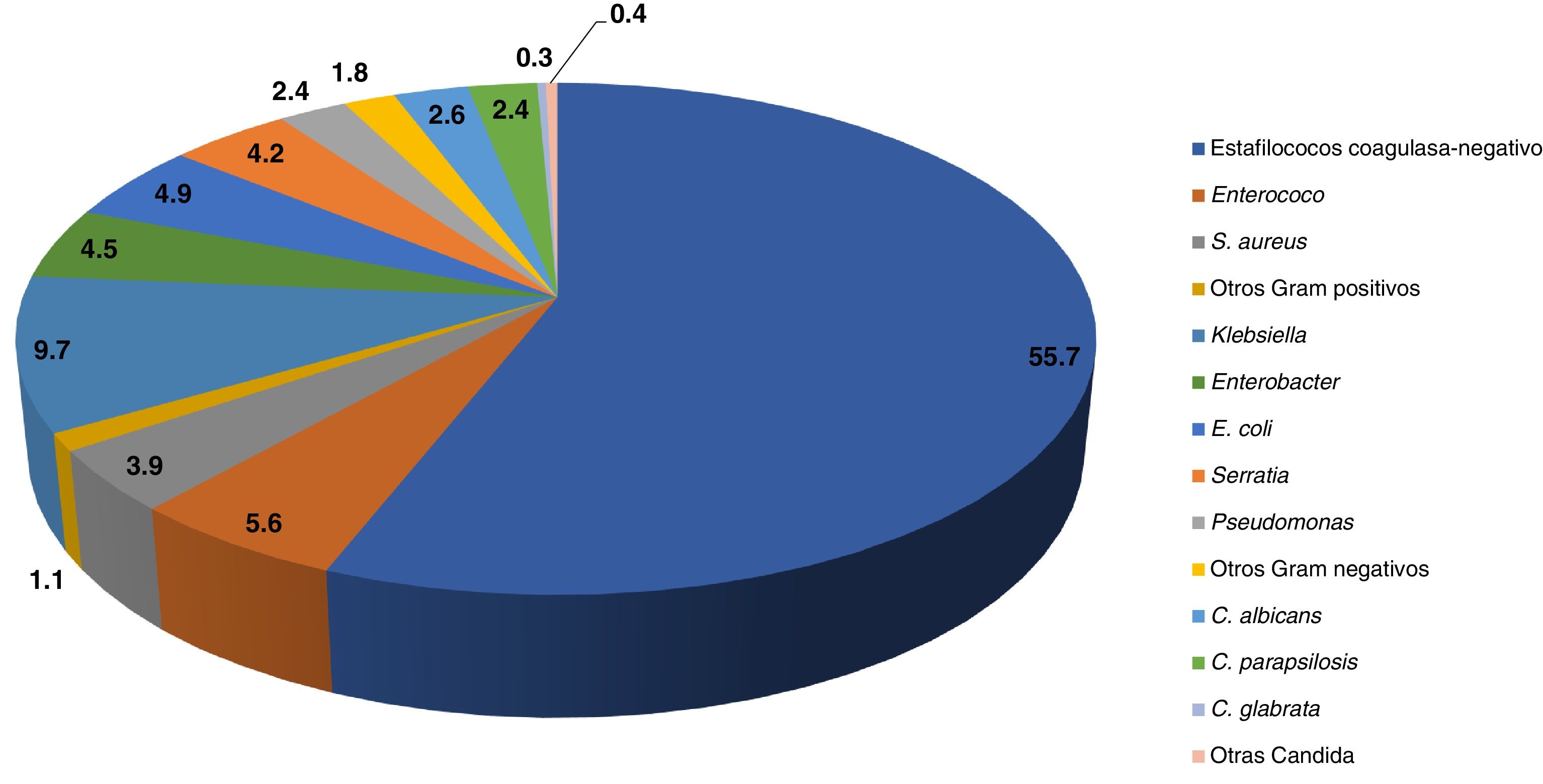
El agente etiológico principal de la sepsis nosocomial son las bacterias grampositivas (66%) (especialmente los Staphylococcus coagulasa negativos [SCoN]), seguidas por bacterias gramnegativas (28%) (sobre todo enterobacterias) y en tercer lugar por cándidas (6%)4 (fig. 1).
Criterios diagnósticosSepsis nosocomial: SRIS en un neonato ingresado con aislamiento en el hemocultivo de un germen procedente del entorno hospitalario, teniendo en cuenta que la infección no debe estar presente, ni en la fase de incubación, en el momento del ingreso en el hospital. Suelen ocasionarse después de los tres días de ingreso. Aunque el hemocultivo sigue siendo el estándar diagnóstico de sepsis, en la actualidad hay técnicas moleculares disponibles basadas en identificación de ADN/ARN bacteriano con alta sensibilidad y especificidad que ofrecen ventajas en cuanto al tiempo y capacidad de identificación8, si bien no están exentas de falsos negativos (bacterias no incluidas en los paneles) y positivos (muestra contaminada)9.
- •
En caso de aislamiento de SCoN: para descartar una posible contaminación, se requiere: dos extracciones periféricas diferentes con positividad en ambas (preferible) o en una extracción de sangre periférica y en la punta del catéter. Si hay dificultad para realizar dos extracciones sanguíneas, se puede aceptar una sola punción periférica con toma de sangre con dos equipos de extracción y siembra en dos botellas y que se aísle en ambas el mismo SCoN4. Otros protocolos únicamente requieren cumplir varios criterios de SRIS y descartar la contaminación del hemocultivo10. Por otro lado, un tiempo de positividad del hemocultivo prolongado (> 16 h), así como un volumen inadecuado de la muestra (< 0,5-1 mL) hace más probable la posibilidad de contaminación11.
Sepsis nosocomial clínica: SRIS en un RN ingresado con hemocultivo negativo, pero en el que se mantiene la antibioterapia al menos cinco días pues la infección parece la causa más plausible del cuadro clínico12.
BRC: presencia del mismo germen en el hemocultivo y en la punta del catéter (si se retira) o en la conexión y/o en la piel alrededor de la entrada del catéter (si no se retira)13. En caso de no quitar el catéter se pueden tomar dos hemocultivos, uno de vía periférica y otro del catéter central, a la misma hora y extrayendo la misma cantidad de sangre. La presencia de una carga bacteriana tres a cuatro veces superior en un hemocultivo extraído del catéter frente al proveniente de la vena periférica o el tiempo de positividad diferencial siendo dos o más horas antes en el hemocultivo de vía central, apoyaría el diagnóstico de BRC. En caso de presentar criterios clínicos de sepsis se puede hablar de sepsis relacionada con catéter (SRC).
Bacteriemia/sepsis asociadas a catéter: bacteriemia/sepsis nosocomial en un niño portador de catéter o que se haya retirado en las 48 horas previas13.
ManejoSiempre que haya una sospecha clínica de sepsis, además de la toma de hemocultivo previo al inicio del tratamiento antibiótico, se recomienda la realización de una punción lumbar para el análisis bioquímico y microbiológico de líquido cefalorraquídeo. Para el tratamiento empírico se sugiere la combinación de dos antibióticos: uno que cubra gérmenes grampositivos y uno que abarque gramnegativos. Cada unidad deberá conocer cuáles son las sensibilidades de los gérmenes que las colonizan y elegir el régimen que proporcione una mejor cobertura. Según los gérmenes causantes de sepsis nosocomial reportados al Grupo Castrillo, la mejor combinación sería la asociación de un glucopéptido (vancomicina o teicoplanina) y un aminoglucósido (amikacina o gentamicina). Es preferible la utilización del aminoglucósido a las cefalosporinas de tercera generación por el riesgo de resistencias bacterianas y candidiasis. En aquellas unidades con programas «zero» y cifras bajas de incidencia de sepsis nosocomial, se podría valorar el uso de cloxacilina en lugar del glucopéptido como tratamiento empírico para evitar la aparición de resistencias a la vancomicina y el aumento de sepsis por gramnegativos14. Una vez conocido el antibiograma, se ajustará el tratamiento definitivo, empleando monoterapia con el menor espectro posible. Si el hemocultivo es negativo se debe valorar suspender el antibiótico lo antes posible.
Respecto al tratamiento de la candidemia, se recomienda como primera línea la anfotericina B deoxicolato o las formulaciones lipídicas con menor toxicidad (anfotericina B liposomal o lipoidea). Otras opciones son la micafungina (en caso de mala respuesta o elevada toxicidad) o el fluconazol, si bien esta última opción no es válida si se está administrando de forma profiláctica15.
En casos de SRC no se recomienda la retirada rutinaria del catéter, especialmente si el paciente presenta dificultades para una nueva canalización, salvo en los siguientes casos13:
- -
Paciente con shock séptico una vez resuelto.
- -
Complicaciones del catéter: locales, tromboflebitis, endocarditis, infección metastásica en cualquier órgano (hueso, piel, hígado, etc.).
- -
Aislamiento de Cándida, Staphylococcus aureus,Bacillus subtilis o bacterias gramnegativas especialmente si son multirresistentes. Valoración individual de otros gérmenes.
- -
Bacteriemia/fungemia persistente, sin mejoría clínica o empeoramiento, tras 48-72 h de tratamiento apropiado.
En los casos en que no fuera posible la retirada, es recomendable hacer un control de hemocultivo cada 24-48 horas y si este persiste positivo se deberá proceder a la retirada del catéter. En casos de Candida spp. además se debe evitar poner un nuevo catéter hasta que el paciente haya recibido varias dosis de antifúngico13,15.
PrevenciónLas medidas de prevención deben estar destinadas a evitar la colonización del neonato por gérmenes hospitalarios. Específicamente para la prevención de la BRC se han publicado paquetes de medidas que han demostrado reducir de forma significativa su incidencia16,17. Las más importantes están incluidas en la tabla 2.
Medidas de prevención de sepsis nosocomial
| Manejo neonatal |
|---|
| • Alimentación oral precoz |
| • Uso de leche materna fresca |
| • Higiene rigurosa de manos |
| • Aplicación de paquetes de medidas para la prevención de la SRC |
| • Uso de filtros para perfusiones IV |
| • Restringir el uso de antibioterapia (especialmente la de amplio espectro) |
| • Restringir el uso de antagonistas H2 y corticoides |
| • Adecuada ratio de personal |
| • Control de brotes. Medidas de aislamiento |
| Medidas farmacológicas |
|---|
| • Probióticos |
| • Fluconazol en RNMBP de alto riesgo |
| • Lactoferrina (en estudio), sola o combinada con probióticos |
| Paquete de medidas para la prevención de la BRC |
|---|
| • Formación previa del personal que maneja los CVC |
| • Higiene de manos cada vez que se manipule el catéter, conectores o apósito |
| • Uso de técnica aséptica para la colocación y el manejo del CVC (gorro, mascarilla, bata y guantes estériles) |
| • Asepsia cutánea con clorhexidina al 2% |
| • Utilizar apósitos semipermeables que dejen visible el punto de inserción y cambiarlos cuando estén sucios o como máximo cada 7 días |
| • Cambiar los equipos de nutrición parenteral, alargaderas y filtros cada 24 h |
| • Desinfectar los bioconectores con clorhexidina alcohólica antes y después de su uso |
BRC: bacteriemia relacionada con catéter; CVC: catéter venoso central; IV: intravenosos; RNMBP: recién nacido de muy bajo peso; SRC: sepsis relacionada con catéter.
Otras alternativas farmacológicas que han demostrado eficacia son la suplementación oral con probióticos, cuyas propiedades como inmunomoduladores y antiinfecciosos los hace efectivos en la prevención de la enterocolitis necrotizante18 y el empleo de fluconazol en RNMBP para evitar las infecciones fúngicas invasivas (puede reducir la incidencia de infecciones fúngicas hasta en 90%)19. La utilización de lactoferrina sola o en combinación con probióticos está en fase de investigación, pues por su acción bifidógena, de maduración intestinal y fungicida, ha demostrado un posible efecto en la reducción de la incidencia de sepsis nosocomial y enterocolitis20.
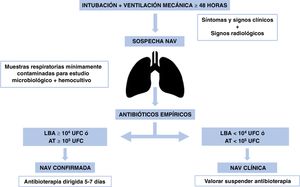
Neumonía asociada a ventilación mecánicaDefiniciónLa NAV es la que se produce en pacientes sometidos a ventilación mecánica (VM) durante al menos 48 h consecutivas. Es la segunda infección nosocomial más frecuente que representa hasta 20-30% de las IRAS. Debe medirse en densidad de incidencia (episodios de NAV/1.000 días de VM) y tener en cuenta la ratio de uso del dispositivo (VM) (días de VM/n.° pacientes diarios ingresados)21.
La incidencia en neonatos es superior a la de otras edades alcanzando cifras que oscilan entre los 2,7-37,2 episodios/1.000 días de VM, en función de la unidad y de los criterios diagnósticos utilizados. El último informe del Consorcio Internacional de Infección Nosocomial da cifras de 9,02 episodios/1.000 días de VM22. La etiología es en ocasiones polimicrobiana, siendo los gérmenes más frecuentemente aislados S. aureus y Pseudomonas aeruginosa23.
La NAV suele debutar en torno a los 20-30 días de la intubación y se asocia con un aumento de la estancia hospitalaria y en algunos trabajos con un incremento de la mortalidad24.
Criterios diagnósticosPara poder establecer el diagnóstico, deben cumplirse todos los criterios que establece el Centers for Disease Control and Prevention (CDC) para niños menores de un año, no habiendo criterios específicos para recién nacidos21 (tabla 3).
Criterios CDC para el diagnóstico de neumonía asociada a ventilación mecánica en niños menores de 1 año21
| Signos radiológicos | Paciente con una radiografía de tórax (o dos o más en aquellos con patología de base) con uno de los siguientes hallazgos:• Infiltrado persistente nuevo o progresivo• Consolidación• Cavitación• Neumatoceles |
| Síntomas y signos clínicos | Empeoramiento del intercambio gaseoso (desaturaciones, aumento de las necesidades de oxígeno, o de las necesidades ventilatorias) y tres de los siguientes signos:• Inestabilidad térmica sin otra causa reconocida• Leucopenia (< 4.000 leucocitos/mm3) o leucocitosis (> 15.000 leucocitos/mm3) y desviación izquierda (> 10% bandas)• Aparición de esputo purulento (≥ 25 neutrófilos y ≤ 10 células epiteliales escamosas/campo) o cambios en las características del mismo, aumento de las secreciones respiratorias o de la necesidad de aspiración• Apnea, taquipnea, aleteo nasal con tiraje o quejido• Sibilantes, crepitantes o roncus• Tos• Bradicardia (< 100 lpm) o taquicardia (> 170 lpm) |
| Diagnósticomicrobiológico | Al menos uno de los siguientes:• Hemocultivo positivo sin otro foco de infección• Cultivo positivo en líquido pleural• Cultivo positivo cuantitativo de muestra de TRI mínimamente contaminada/catéter telescopado (LBA [≥ 104 UFC/mL) o cepillo protegido [≥ 103 UFC/mL]) o en su defecto aspirado traqueal (≥ 106 UFC/mL).• ≥ 5% células obtenidas por LBA con bacterias intracelulares en su interior en el examen microscópico directo (tinción de Gram)• Examen histopatológico que muestre al menos una de las siguientes evidencias de neumonía:– Formación de abscesos o focos de consolidación con acumulación intensa de PMN en bronquiolos y alveolos– Cultivo cuantitativo positivo del parénquima pulmonar (≥ 104 UFC/g tejido) o evidencia de invasión del parénquima pulmonar por hifas fúngicas o pseudohifas |
CDC: Centers for Disease Control and Prevention; LBA: lavado broncoalveolar; PMN: polimorfonucleares; TRI: tracto respiratorio inferior; UFC: unidades formadoras de colonias
El diagnóstico de NAV en neonatos es especialmente difícil porque es frecuente la patología pulmonar de base; por lo que el criterio radiológico debe basarse en las alteraciones radiológicas en al menos dos imágenes sucesivas. El criterio microbiológico es imprescindible para el diagnóstico de NAV confirmada. Los casos en los que se cumpla el resto de los criterios excepto el microbiológico se definirán como NAV clínica. No obstante, algunos autores advierten del riesgo de sobrediagnóstico cuando se prescinde del aislamiento microbiológico25. Por otra parte, aunque en algunos estudios se ha utilizado el cultivo o la presencia de purulencia a partir del aspirado traqueal para el diagnóstico de NAV, otros autores insisten en la necesidad de obtener muestras de tracto respiratorio inferior mínimamente contaminadas para evitar el diagnóstico de infección en casos en los que solo se trata de colonizaciones de la vía aérea superior26.
ManejoLas poblaciones pediátrica y neonatal carecen de guías propias, más allá de documentos locales, y las guías de manejo clínico tanto americanas27 como europeas28 están referidas a la población adulta. En ambas recomiendan obtener muestras de vía aérea para el cultivo microbiológico y cubrir la flora local más habitual con dos antibióticos de amplio espectro ajustando el tratamiento al de espectro más estrecho una vez conocido el germen causal. La combinación de una penicilina o glucopéptido o linezolid con un aminoglucósido o piperacilina-tazobactam podría ser efectiva, para posteriormente emplear la terapia etiológica más adecuada en función del germen. En caso de falta de repuesta, como segunda línea se podría usar una cefalosporina antipseudomonas y en caso de Stenotrophomonas maltophilia resistente a cefalosporinas valorar el uso de cotrimoxazol29.
La duración del tratamiento no está claramente establecida, aunque ambas guías aconsejan siete días en neumonías no complicadas. Es más, en un estudio enfocado a reducir el uso de antibiótico, se trataron estas enfermedades con hemocultivo negativo durante cinco días sin objetivar reinfecciones ni aumento en la mortalidad30.
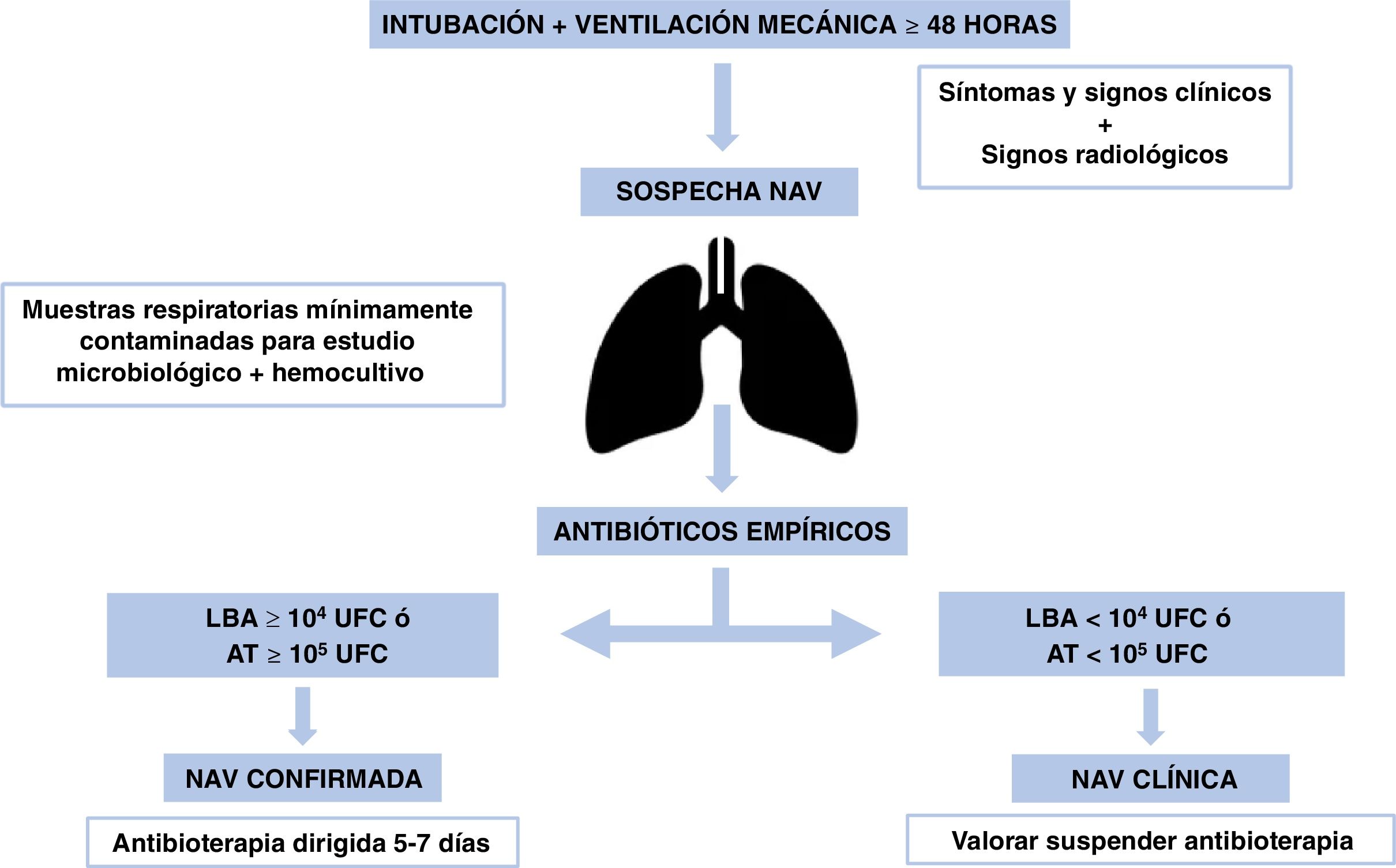
En los casos con cultivos negativos sin deterioro clínico debería suspenderse el tratamiento antibiótico31, puesto que la mayor parte de las sospechas de NAV no se confirman microbiológicamente32. En la figura 2 se muestra el algoritmo de manejo.
PrevenciónA continuación, detallamos una serie de medidas que han demostrado reducir la incidencia de NAV en neonatos de forma significativa33,34:
- 1.
Técnica de intubación y aspiración estéril, evitando el uso sistemático de soluciones salinas.
- 2.
Aspiración de secreciones de orofaringe antes de manipular el tubo endotraqueal. Uso de aspiración cerrada independiente de la aspiración oral.
- 3.
Evitar reintubaciones. Valorar diariamente la necesidad de mantener la VM.
- 4.
Cambios posturales, intentar la posición lateral. Inclinación de la cama 15°-30° si hay reflujo gastroesofágico.
- 5.
Higiene oral en encías, lengua y labios cada tres a cuatro horas y previa intubación o colocación de sonda orogástrica. Hay datos que apoyan el uso de bicarbonato o calostro frente al agua bidestilada ya que alcaliniza el pH y aumenta las concentraciones de lactoferrina e inmunoglobulina A (IgA)35; mientras que otros trabajos, pese a observar este efecto, no encuentran reducción de la colonización por gérmenes productores de NAV en prematuros extremos36.
- 6.
Cambiar los circuitos cuando indique el fabricante o previamente si están visiblemente sucios. Limpiar con alcohol las conexiones del tubo endotraqueal (bolsa autoinflable), drenar la condensación del respirador sin desconectar, usar calentadores33.
La infección de la herida quirúrgica (IHQ) es la producida en la zona de incisión o el espacio quirúrgico, pudiendo afectar a la piel, el tejido subcutáneo (eritema localizado, hinchazón, dolor o secreción purulenta en el lecho quirúrgico o cerca de él, con o sin fiebre) o a planos más profundos del área de la intervención dentro de los primeros 30 días (en caso de prótesis o cuerpos extraños puede aparecer hasta los 90 días) de la cirugía37.
La prevención de la IHQ se basa en una buena técnica quirúrgica y en las medidas de higiene y asepsia además de la profilaxis antibiótica quirúrgica (PAQ). La PAQ consiste en la administración de antibióticos antes de la intervención quirúrgica para disminuir el riesgo de IHQ y se indica de acuerdo con el tipo de cirugía que se va a realizar y con los factores de riesgo que presenta cada neonato.
Para consultar la clasificación de la cirugía para la elección de la profilaxis o el tratamiento antibiótico según el riesgo de IHQ se puede revisar la tabla 4.
Clasificación de la cirugía para la elección de la profilaxis o el tratamiento antibiótico según el riesgo de IHQ37
| Tipo de cirugía | Localización | Profilaxis antibiótica |
|---|---|---|
| Cirugía limpia | Tejido sin inflamación ni traumatismo, no implica la apertura del tracto respiratorio, digestivo o genitourinario. Tiene un cierre primario y, si es necesario, con drenaje cerrado | NingunaExcepciones:-implante de prótesis-neonatos: neurocirugía o cirugía cardiaca |
| Cirugía limpia-contaminada | Apertura del tracto respiratorio, digestivo o urinario (tracto biliar, apéndice, vagina y orofaringe) sin contaminación evidente, siempre que no haya complicaciones serias durante la técnica | Dosis única prequirúrgica(incluso en presencia de tubos de drenaje torácico o mediastínico) |
| Cirugía contaminada | Herida abierta o accidental de pocas horas de evolución, intervenciones quirúrgicas que rompen la barrera de asepsia, salida abundante secreciones intestinales o incisiones en las que se encuentra inflamación aguda no purulenta.En neonatología es difícil distinguirla de la infectada o sucia, por lo que se consideran dentro de ese grupo | No es profilaxis sino tratamiento |
| Cirugía infectada o sucia | Heridas antiguas traumáticas con retención de tejidos desvitalizados o que afectan al área de infección clínica previa o con perforación visceral | No es profilaxis sino tratamiento |
IHQ: infección de la herida quirúrgica.
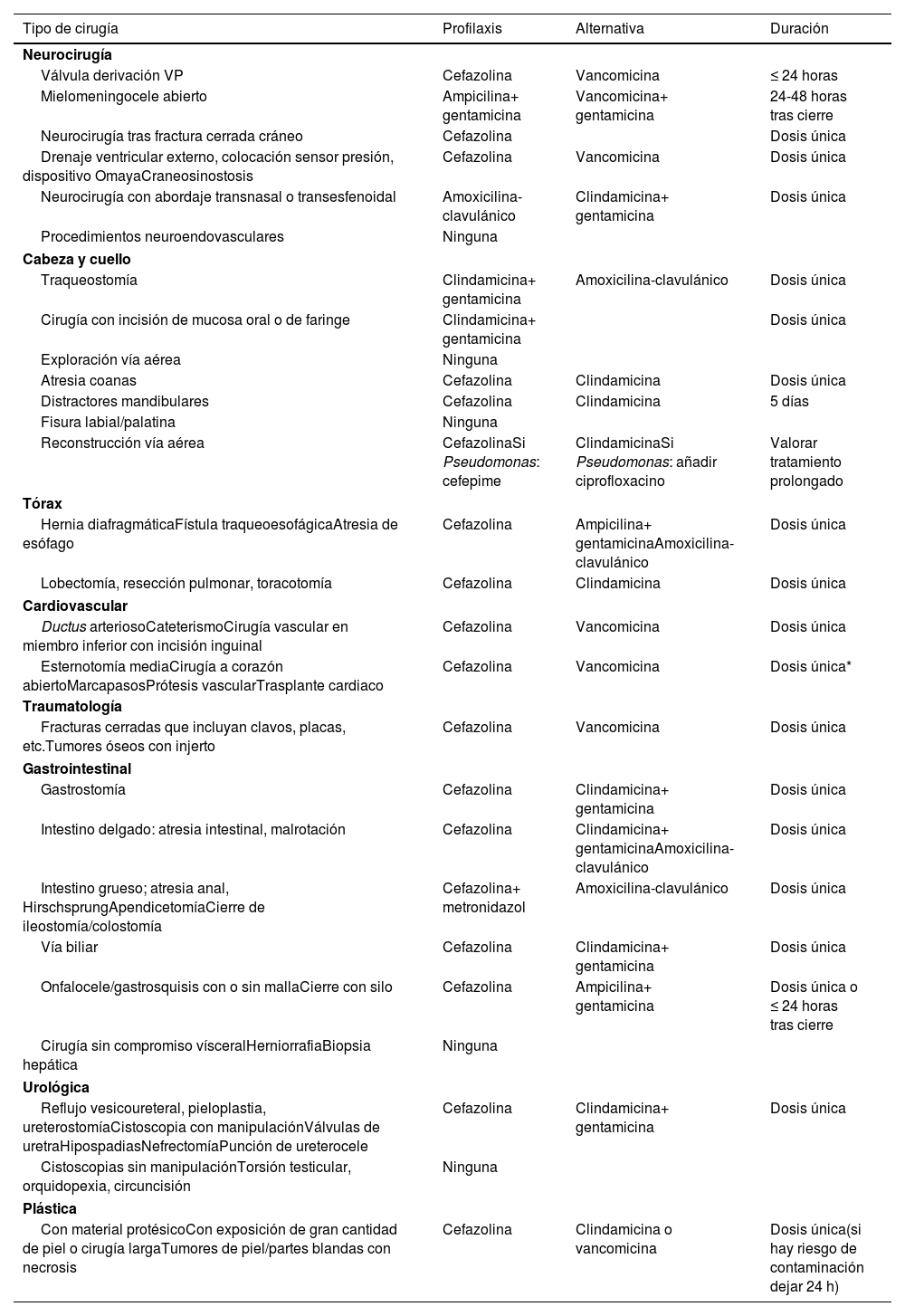
La selección adecuada de la PAQ incluye la elección del tipo de antibiótico, la vía de administración y el número de dosis38,39 (tabla 5).
Profilaxis quirúrgica recomendada según localización y tipo de cirugía38-42
| Tipo de cirugía | Profilaxis | Alternativa | Duración |
|---|---|---|---|
| Neurocirugía | |||
| Válvula derivación VP | Cefazolina | Vancomicina | ≤ 24 horas |
| Mielomeningocele abierto | Ampicilina+ gentamicina | Vancomicina+ gentamicina | 24-48 horas tras cierre |
| Neurocirugía tras fractura cerrada cráneo | Cefazolina | Dosis única | |
| Drenaje ventricular externo, colocación sensor presión, dispositivo OmayaCraneosinostosis | Cefazolina | Vancomicina | Dosis única |
| Neurocirugía con abordaje transnasal o transesfenoidal | Amoxicilina-clavulánico | Clindamicina+ gentamicina | Dosis única |
| Procedimientos neuroendovasculares | Ninguna | ||
| Cabeza y cuello | |||
| Traqueostomía | Clindamicina+ gentamicina | Amoxicilina-clavulánico | Dosis única |
| Cirugía con incisión de mucosa oral o de faringe | Clindamicina+ gentamicina | Dosis única | |
| Exploración vía aérea | Ninguna | ||
| Atresia coanas | Cefazolina | Clindamicina | Dosis única |
| Distractores mandibulares | Cefazolina | Clindamicina | 5 días |
| Fisura labial/palatina | Ninguna | ||
| Reconstrucción vía aérea | CefazolinaSi Pseudomonas: cefepime | ClindamicinaSi Pseudomonas: añadir ciprofloxacino | Valorar tratamiento prolongado |
| Tórax | |||
| Hernia diafragmáticaFístula traqueoesofágicaAtresia de esófago | Cefazolina | Ampicilina+ gentamicinaAmoxicilina-clavulánico | Dosis única |
| Lobectomía, resección pulmonar, toracotomía | Cefazolina | Clindamicina | Dosis única |
| Cardiovascular | |||
| Ductus arteriosoCateterismoCirugía vascular en miembro inferior con incisión inguinal | Cefazolina | Vancomicina | Dosis única |
| Esternotomía mediaCirugía a corazón abiertoMarcapasosPrótesis vascularTrasplante cardiaco | Cefazolina | Vancomicina | Dosis única* |
| Traumatología | |||
| Fracturas cerradas que incluyan clavos, placas, etc.Tumores óseos con injerto | Cefazolina | Vancomicina | Dosis única |
| Gastrointestinal | |||
| Gastrostomía | Cefazolina | Clindamicina+ gentamicina | Dosis única |
| Intestino delgado: atresia intestinal, malrotación | Cefazolina | Clindamicina+ gentamicinaAmoxicilina-clavulánico | Dosis única |
| Intestino grueso; atresia anal, HirschsprungApendicetomíaCierre de ileostomía/colostomía | Cefazolina+ metronidazol | Amoxicilina-clavulánico | Dosis única |
| Vía biliar | Cefazolina | Clindamicina+ gentamicina | Dosis única |
| Onfalocele/gastrosquisis con o sin mallaCierre con silo | Cefazolina | Ampicilina+ gentamicina | Dosis única o ≤ 24 horas tras cierre |
| Cirugía sin compromiso vísceralHerniorrafiaBiopsia hepática | Ninguna | ||
| Urológica | |||
| Reflujo vesicoureteral, pieloplastia, ureterostomíaCistoscopia con manipulaciónVálvulas de uretraHipospadiasNefrectomíaPunción de ureterocele | Cefazolina | Clindamicina+ gentamicina | Dosis única |
| Cistoscopias sin manipulaciónTorsión testicular, orquidopexia, circuncisión | Ninguna | ||
| Plástica | |||
| Con material protésicoCon exposición de gran cantidad de piel o cirugía largaTumores de piel/partes blandas con necrosis | Cefazolina | Clindamicina o vancomicina | Dosis única(si hay riesgo de contaminación dejar 24 h) |
VP: ventriculoperitoneal.
En la mayoría de las intervenciones se requiere una sola dosis de antibiótico que tenga una vida media lo suficientemente larga para mantener su actividad durante toda la intervención.
Se deberá administrar una segunda dosis intraoperatoria si la duración de la intervención supera a dos semividas del antibiótico utilizado, si el tiempo de cirugía es mayor de cuatro horas o, si se produce un sangrado profuso (> 20 mL/kg de peso). Fuera de esos casos, prolongar el tratamiento no ofrece ningún beneficio, incluso en cirugías gastrointestinales de alto riesgo40.
AdministraciónEs muy importante que se realice de acuerdo con la farmacocinética del antibiótico con la finalidad de alcanzar y mantener buenos niveles séricos antes de la incisión quirúrgica y hasta que se efectúe el cierre de esta.
En el caso de la cefazolina, se administrará 30-60 min antes del inicio y si se trata de la vancomicina se iniciará su infusión una a dos horas antes. La vía intravenosa (IV) es la de elección para la profilaxis en neonatos.
CribadosEn las cirugías cardiaca, ortopédica o neurocirugía se recomienda el cribado nasal de S. aureus resistente a la meticilina (SAMR) y en caso de aislamiento positivo se sugiere añadir al tratamiento profiláctico (cefazolina) una dosis de vancomicina, ya que la profilaxis solo con vancomicina se ha asociado con tasas más altas IHQ por S. aureus sensible a meticilina que la cefazolina sola. Estrategias como la mupirocina intranasal y los cambios en el agente profiláctico antimicrobiano a vancomicina disminuyen las tasas de portadores, pero no está claro su impacto global.
El cribado de microorganismos multirresistentes no es necesario para la cirugía. Los pacientes colonizados no se benefician de cambios en la PAQ. Se recomiendan las medidas de aislamiento adecuadas para impedir su diseminación.
Casos especiales- -
Alérgicos a β-lactámicos: se administrará vancomicina o clindamicina (si se comprueba su sensibilidad). Además, se asociará otro antibiótico (gentamicina) si se requiere para la cobertura de gramnegativos.
- -
Pacientes con inmunodeficiencia humoral o celular: recibirán la misma profilaxis que los inmunocompetentes.
- -
Sujetos que reciben antimicrobianos terapéuticos antes de la cirugía: también deben recibir profilaxis antimicrobiana antes de la misma para garantizar niveles adecuados de antimicrobianos en el suero y tejido con actividad contra posibles patógenos durante la operación.
- -
Pacientes con cardiopatías cianosantes no reparadas, si existe material protésico o antecedentes de endocarditis infecciosa previa: se administrará profilaxis de endocarditis bacteriana41,42.
El diagnóstico correcto y uniforme de las IRAS permite no solo optimizar el tratamiento y mejorar el pronóstico, sino tener un conocimiento real de su incidencia de cara a la implantación de medidas preventivas y la valoración de su impacto. El aislamiento de gérmenes en los cultivos sigue siendo el patrón de oro diagnóstico y el tratamiento antibiótico debe ajustarse al espectro más estrecho, suspendiéndose en aquellos casos en los que los cultivos sean negativos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comité Estándares:
Héctor Boix (Unidad de Cuidados Intensivos Neonatales, Hospital Quironsalud, Barcelona, España), María Cernada (Servicio de Neonatología, Hospital Universitari i Politècnic La Fe, Valencia, España), María Gracia Espinosa Fernández (Unidad de Neonatología, Hospital Regional Universitario de Málaga, Málaga, España), Noelia González-Pacheco (Servicio de Neonatología, Hospital General Universitario Gregorio Marañón, Madrid, España), Alejandro Pérez-Muñuzuri (Servicio de Neonatología, Hospital Clínico Universitario de Santiago, IDIS, Universidad de Santiago de Compostela, Santiago de Compostela, A Coruña, España), M.ª Dolores Sánchez- Redondo (Unidad de Neonatología, Hospital Virgen de la Salud, Toledo, España), Ana Martín-Ancel (Servicio de Neonatología, Hospital Sant Joan de Déu, Esplugues de Llobregat, Barcelona, España), María Luz Couce (Servicio de Neonatología, Hospital Clínico Universitario de Santiago, IDIS, Universidad de Santiago de Compostela, Santiago de Compostela, A Coruña, España).
Comisión Infección Neonatal:
Concepción de Alba Romero (Servicio de Neonatología, Hospital Universitario 12 Octubre, España), Belén Fernández-Colomer (Servicio de Neonatología, Hospital Universitario Central de Asturias, Oviedo, España), María Cernada (Servicio de Neonatología, Hospital Universitari i Politècnic La Fe, Valencia, España), María González-Lopez (Unidad de Neonatología, Hospital Materno-Infantil Regional de Málaga, Málaga, España), Elena Zamora Flores (Servicio de Neonatología, Hospital General Universitario Gregorio Marañón, Madrid, España), Laura Sánchez García (Servicio de Neonatología, Hospital Universitario La Paz, Madrid, España), Fátima Camba Longueira (Servicio de Neonatología, Hospital Vall d’Hebrón, Barcelona, España), M. Cruz López-Herrera (Servicio de Neonatología, Hospital Universitario de Cruces, Bilbao, España), Zenaida Galve Pradel (Servicio de Neonatología, Hospital Universitario Miguel Servet, Zaragoza, España), Carmen Ribes Bautista (Servicio de Neonatología, Hospital Vall d’Hebrón, Barcelona, España), Ana Alarcón Allen (Servicio de Neonatología, Hospital Sant Joan de Déu, Esplugues de Llobregat, Barcelona, España), Ana Baña Souto (Servicio de Neonatología, Hospital Clínico Universitario de Santiago, IDIS, Universidad de Santiago de Compostela, Santiago de Compostela, A Coruña, España).