Desde la publicación de las últimas recomendaciones ILCOR del 2005, los cambios más significativos que se han implementado en las del 2010 son los siguientes: valoración del recién nacido mediante 2 características vitales (frecuencia cardiaca y respiración) para decidir inicialmente el siguiente paso en la reanimación; evaluación de la oxigenación mediante monitorización por pulsioximetría (el color no es fiable); inicio de la reanimación con aire en el recién nacido a término en lugar de oxígeno al 100%; uso de mezcladores de oxígeno y aire para administrar oxígeno suplementario en caso de necesidad; controversia en la aspiración endotraqueal en recién nacidos deprimidos con aguas meconiales; la proporción de ventilación-compresión sigue siendo de 3/1, excepto en la parada cardiorrespiratoria de origen cardiaco, en que se debería considerar una proporción más alta; indicación de hipotermia terapéutica en recién nacidos a término o casi término diagnosticados de encefalopatía hipóxico-isquémica moderada o grave con protocolos y seguimiento coordinados por el sistema regional perinatal (cuidados posreanimación); retraso de al menos 1min en la ligadura del cordón umbilical de recién nacidos que no requieren reanimación (no existe suficiente evidencia para recomendar un tiempo de ligadura de cordón en aquellos que requieren reanimación), y si no se detecta latido cardiaco después de 10min de una correcta reanimación, se acepta desde un punto de vista ético, la posibilidad de interrumpir la reanimación, aunque muchos factores contribuyen a la decisión de seguir más allá de 10min. En determinadas situaciones, no iniciar la reanimación se puede plantear teniendo en cuenta las recomendaciones generales, los resultados propios y la opinión de los padres.
Since previous publication in 2005, the most significant changes that have been addressed in the 2010 International Liaison Committee on Resuscitation (ILCOR) recommendations are as follows: (i) use of 2 vital characteristics (heart rate and breathing) to initially evaluate progression to the following step in resuscitation; (ii) oximetry monitoring for the evaluation of oxygenation (assessment of color is unreliable); (iii) for babies born at term it is better to start resuscitation with air rather than 100% oxygen; (iv) administration of supplementary oxygen should be regulated by blending oxygen and air; (v) controversy about endotraqueal suctioning of depressed infants born through meconium-stained amniotic fluid; (vi) chest compression-ventilation ratio should remain at 3/1 for neonates unless the arrest is known to be of cardiac etiology, in which case a higher ratio should be considered; (vii) use of therapeutic hypothermia for infants born at term or near term evolving to moderate or severe hypoxic-ischemic encephalopathy, with protocol and follow-up coordinated through a regional perinatal system (post-resuscitation management); (viii) cord clamping delay for at least 1minute in babies who do not require resuscitation (there is insufficient evidence to recommend a time for clamping in those who require resuscitation) and, (ix) it is appropriate to consider discontinuing resuscitation if there has been no detectable heart rate for 10minutes, although many factors contribute to the decision to continue beyond 10minutes. Under certain circumstances, non-initiation of resuscitation could be proposed taking into consideration general recommendations, own results and parents’ opinion.
El International Liaison Committee on Resuscitation (ILCOR) es una organización mundial formada por múltiples asociaciones (tabla 1), cuyo objetivo principal es analizar, discutir y aprobar recomendaciones en reanimación. El ILCOR se subdivide a su vez en un subcomité de adultos, uno pediátrico y otro neonatal, siendo este último de reciente creación (la versión 2010 es la tercera que cuenta con esta subdivisión). Todos los integrantes realizan su actividad de forma totalmente voluntaria y la organización general está bajo la supervisión de la American Heart Association (AHA).
Delegaciones participantes del ILCOR
| American Heart Association (AHA) |
| European Resuscitation Council (ERC) |
| Heart and Stroke Foundation of Canada (HSFC) |
| Australian and New Zealand Committee on Resuscitation (ANZCOR) |
| Resuscitation Councils of Southern Africa (RCSA) |
| Inter American Heart Foundation (IAHF) |
| Resuscitation Council of Asia (RCA-current members Japan, Korea, Singapore, Taiwan) |
Los representantes son convocados 3 años antes de la publicación de las recomendaciones, desarrollándose el proceso que sigue un cronograma muy pautado para llegar a la publicación de estas en octubre cada 5 años (los terminados en 0 y en 5).
Se trata de un proceso muy estricto, desde el punto de vista metodológico1 y muy democrático en cuanto al tipo de participación de los delegados. Así, cada pregunta se desarrolla en formato PICOT (tabla 2) y es refinada y consensuada por el grupo. Luego se asigna cada pregunta por lo menos a dos profesionales. El sistema de revisión está pautado en forma sistematizada, de tal forma que la selección de la bibliografía sea verificable y reproducible (disponible en http://www.ILCOR.org).
Como gran parte de las intervenciones que se realizan en la sala de partos con los recién nacidos (RN) no cuentan con un respaldo de suficiente evidencia, a diferencia de la estrategia que se utiliza para los metaanálisis, la sistematización del ILCOR admite que las fuentes de respaldo no sean sólo originadas en estudios aleatorizados, sino que utiliza toda fuente de información disponible publicada en revistas revisadas por pares (peer reviewed journals). Por lo tanto, la información utilizada puede provenir tanto de series de casos, estudios en animales, maniquís o simuladores, revisiones retrospectivas y hasta extrapolación de estudios realizados con pacientes adultos o pediátricos. En resumen, se intenta obtener la mejor evidencia disponible, que lamentablemente en muchos casos es muy escasa. Este tipo de revisión permite además favorecer la producción de nuevos estudios, ya que colabora en la detección de las lagunas de conocimiento.
Sentadas las bases, cada colaborador a quien se le asigna una pregunta debe seguir las guías para la elaboración de una hoja de trabajo (worksheet) en la que debe describir su estrategia de búsqueda, cuáles fueron los artículos que finalmente seleccionó y por qué, clasificarlos según el nivel de evidencia (tabla 3) y según la calidad de los trabajos (buena, débil o pobre).
Niveles de evidencia de intervenciones terapéuticas ILCOR 2010
| Nivel 1: estudios controlados aleatorizados (ECA) o metaanálisis de ECA |
| Nivel 2: estudios con controles concurrentes sin verdadera aleatorización (seudoaleatorizados) |
| Nivel 3: estudios que utilizan controles retrospectivos |
| Nivel 4: estudios sin grupo control (series de casos) |
| Nivel 5: estudios no directamente relacionados con la población específica (población/pacientes diferentes, modelos animales, mecánicos, etc.) |
Una vez presentado el primer borrador, la hoja de trabajo es revisada por la AHA y por el coordinador del área y luego presentada en alguna de las reuniones parciales en las que se intenta que participen al menos 10 delegados. Se realiza además un trabajo de comparación entre los diferentes autores, intentando resolver las discrepancias. Finalmente, en febrero del año de la publicación se organiza un plenario que dura aproximadamente una semana en el que se revisan y consensúan todas las hojas de trabajo, tanto en su contenido como en su nivel de evidencia, y se elabora el documento final que incluye las recomendaciones. Es de destacar, además, el énfasis que pone el comité organizador en declarar permanentemente cualquier conflicto de interés de los autores, tanto material como intelectual. Así, como parte de este proceso se evita que un delegado elabore la revisión de un tema sobre el que haya publicado. Finalmente, luego que un subcomité centraliza la redacción del documento final, éste queda a resguardo de su difusión por algunos meses hasta su publicación.
Las recomendaciones elaboradas por el ILCOR pretenden aportar una revisión exhaustiva de la evidencia disponible junto con recomendaciones generales que sirvan de guía y/o respaldo para que cada grupo (asociaciones agrupadas por país, región, etc.) elabore sus propias guías o recomendaciones basadas en la adaptación a su realidad e idiosincrasia cultural.
El objetivo de esta revisión es analizar las últimas recomendaciones ILCOR 2010 en reanimación neonatal2, contrastarlas con las de otros organismos o asociaciones como son la de la AHA3, European Resuscitation Council (ERC)4 o las de Australia-New Zeland5, y adaptarlas a las próximas recomendaciones de nuestro país.
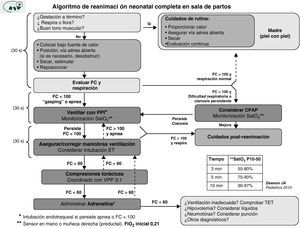
Algoritmo de reanimación neonatalLos algoritmos de reanimación neonatal recomendados por sociedades científicas y organismos internacionales han ido evolucionando en los últimos años hacia la simplificación y la inclusión de aspectos sostenidos con mayor evidencia científica. Las dos versiones de algoritmos de reanimación neonatal editados por la Sociedad Española de Neonatología (SEN) hasta la fecha6,7 se han basado principalmente en algoritmos del ILCOR modificados8,9.
En este apartado se van a comentar los cambios principales acaecidos en las últimas versiones (octubre 2010) de los algoritmos del ILCOR2 y AHA3. También se describirán algunos aspectos del algoritmo europeo (ERC 2010)4 y al final se presentará el algoritmo 2010 de la SEN.
Las partes principales del algoritmo de reanimación neonatal constan de los siguientes apartados: a) valoración inicial; b) primeros pasos en estabilización; c) evaluación inicial; d) ventilación-oxigenación; e) compresiones torácicas (CT) y f) administración de fluidos y fármacos.
Valoración inicialLa mayor parte de los RN no va a requerir reanimación en los momentos iniciales de la vida, siendo generalmente identificables al responder afirmativamente a las 3 preguntas siguientes: ¿gestación a término?; ¿llora o respira? y ¿buen tono muscular? Si la respuesta a estas 3 preguntas es afirmativa, se debe favorecer el contacto con la madre (piel-piel) con la finalidad de mantener la temperatura corporal, la vinculación afectiva y evitar las maniobras innecesarias. Además debe secarse, limpiar la vía aérea sólo si es necesario y evaluar la actividad respiratoria.
El cambio principal en relación con el algoritmo anterior es que no se considera el aspecto del líquido amniótico en las preguntas anteriores, pues aunque las aguas sean meconiales si el RN respira de forma adecuada no es prioritario aspirar y puede permanecer con la madre10.
En el supuesto de que la respuesta a alguna de las 3 preguntas sea negativa, deben iniciarse los primeros pasos de estabilización inicial. La valoración del tono muscular es subjetiva y depende de la edad gestacional, pero un RN con buen tono (postura en flexión y moviendo las extremidades) es poco probable que esté en peligro, mientras que un RN muy hipotónico (postura en extensión y sin moverse) muy probablemente necesita medidas de reanimación.
Estabilización inicial. Primeros pasosLos primeros pasos de estabilización comprenden evitar la pérdida de calor (colocar bajo fuente de calor radiante), optimizar la permeabilidad de la vía aérea (posición de olfateo y permeabilizar si es necesario), secado y estimulación táctil. La tendencia actual es limpiar la vía aérea sólo en RN con obstrucción obvia de esta vía. Estas maniobras deben realizarse en los primeros 30s de vida.
Evaluación del recién nacidoTras realizar los primeros pasos de estabilización inicial, se evalúan 2 parámetros: frecuencia cardiaca (FC) y respiración, que se comprueban cada 30s mientras la reanimación avanza. En la actualidad, se ha eliminado de la evaluación inicial y periódica el «color», al demostrarse una gran variabilidad de apreciación entre diferentes observadores, y al conocer que la adquisición de una tonalidad rosácea de la piel en el RN normal tarda bastantes minutos en producirse11. Si es necesario empezar maniobras de reanimación, se recomienda colocar un pulsioxímetro preductal (extremidad superior derecha) con la finalidad de obtener una información continuada de la FC y de la saturación de oxígeno de la hemoglobina (SatO2).
Ventilación-oxigenaciónSi la FC es inferior a 100 lpm y/o presenta gasping o apnea, se inicia ventilación con presión positiva intermitente con mascarilla facial durante 30s a un ritmo de 40-60 insuflaciones por minuto, monitorizándose la SatO2. Se considera que en 60s («minuto de oro») pueden realizarse los pasos más importantes de la reanimación, es decir, los pasos iniciales y la ventilación con presión positiva intermitente si es requerida3. En caso de que la FC sea superior a 100 lpm y la respiración sea regular se suspende la ventilación y se vigila antes de pasar a la madre.
En neonatos con una FC superior a 100 lpm pero con respiración espontánea aunque dificultosa o cianosis persistente puede considerarse el uso de presión positiva continua en la vía respiratoria (CPAP).
Dada la evidencia científica acumulada, actualmente se recomienda que en un RN a término que precisa reanimación se inicie la ventilación con oxígeno al 21%, ajustándose posteriormente la fracción inspiratoria de oxígeno (FiO2) a los valores de SatO2 preductal. El algoritmo del ERC4 muestra como valores diana de oxigenación el P25 de la SatO2 normal de los primeros 10min de vida12; en cambio, la AHA3 recomienda unos valores diana algo superiores. La SEN ha fijado los valores diana de SatO2 entre el P10 y el P50 del nomograma recientemente elaborado12, para evitar situaciones de hiperoxia y/o hipoxia perjudiciales para el paciente. Los nuevos algoritmos recalcan como aspecto importante asegurar y corregir el sellado de la mascarilla con la finalidad de proporcionar una ventilación correcta.
Compresiones torácicasEstán indicadas cuando, a pesar de 30s de ventilación adecuada, el RN presenta bradicardia marcada (< 60 lpm). La relación compresión/ventilación recomendada sigue siendo de 3/1 (90 compresiones y 30 ventilaciones por minuto) y la técnica de los 2 pulgares con las manos envolviendo el tórax es la de elección. En pacientes extremadamente prematuros, se ha sugerido la utilización de la técnica de dos dedos sobre el esternón, pero el ILCOR 2010 no se define al respecto. Las CT se mantienen 30s al cabo de los cuales se evalúa al niño: si la FC es mayor que 60 lpm se suspenden y se sigue ventilando hasta estabilizar la FC > 100 lpm y la respiración guiados por el valor de la SatO2.
Medicación y fluidosLa administración de adrenalina está indicada cuando tras 30s de ventilación adecuada con presión positiva intermitente y CT eficientes la FC permanece < 60 lpm.
La vía de elección preferida es la intravenosa, pero si el acceso vascular no está disponible, la administración por vía endotraqueal es razonable mientras se logra una vía intravenosa. Si la administración endotraqueal no es efectiva, debe administrarse una dosis intravenosa lo antes posible.
Durante este tiempo se mantienen las CT hasta que aumente la FC por encima de 60 lpm. Si el RN no presenta mejoría a pesar de todas las medidas mencionadas, se debe replantear la situación y comprobar que la ventilación es adecuada y simétrica (¿existe un neumotórax?) y valorar la administración de expansores de volumen.
El algoritmo de reanimación del RN de la SEN se muestra en la figura 1.
Pasos iniciales en estabilización inicialAnticipaciónPocos RN precisan reanimación en paritorio. De los que requieren ayuda, la mayor parte sólo necesitan ventilación asistida. Una minoría, además de la ventilación puede necesitar, por un breve periodo, CT. Los datos de un estudio sueco con alto poder estadístico13 ejemplifican estas afirmaciones: de 100.000 RN en Suecia durante un año, sólo un 10 por 1.000 (1%) de los que pesaron ≥ 2.500g necesitaron reanimación en paritorio; de éstos, el 8‰ respondieron a la ventilación con mascarilla y sólo un 2‰ precisaron intubación. En el mismo estudio se valoró la necesidad de reanimación inesperada, en niños de bajo riesgo, como por ejemplo, los RN con edad de gestación mayor de 32 semanas procedentes de un parto aparentemente normal, y se observó que sólo el 2‰ (0,2%) necesitó reanimación en paritorio, y de éstos, el 90% respondió a la ventilación con mascarilla, mientras que el otro 10% precisó intubación.
Personal de reanimaciónAunque en la mayor parte de los casos es posible predecir la necesidad de reanimación o estabilización, no siempre es así. En cada centro se debe establecer quién debe ser el responsable de atender a los RN en función de sus características asistenciales. Las recomendaciones del Grupo de RCP neonatal de la SEN6,7, en concordancia con las del ERC4, son las siguientes:
- –
En todo parto debe estar presente en paritorio una persona capaz de realizar los pasos iniciales y fácilmente localizable una persona que sea capaz de llevar a cabo todas las maniobras de reanimación.
- –
En los partos de riesgo alto en los que el RN pudiera precisar reanimación, siempre debe estar presente una persona capacitada para realizar todas las maniobras de reanimación.
- –
En los partos múltiples debe haber un equipo de reanimación por cada RN.
La reanimación en el momento del nacimiento se puede prever en la mayoría de los casos. Por tanto, es muy recomendable que el lugar y el material de reanimación estén preparados antes de que nazca el niño. La reanimación debe realizarse en un ambiente cálido, bien iluminado, en el que no haya corrientes de aire y sobre una superficie blanda precalentada bajo una fuente de calor radiante. Todo el material de reanimación debe estar fácilmente accesible, y debe ser revisado y repuesto tras cada parto.
Control de temperaturaEl RN, desnudo y húmedo, no puede mantener la temperatura corporal a pesar de que la habitación mantenga un ambiente térmico confortable para un adulto. Los niños con depresión neonatal (hipotónicos, en apnea o con respiración inadecuada y/o con bradicardia) son especialmente vulnerables. La exposición del RN al estrés por frío produce disminución de la presión arterial de oxígeno y acidosis metabólica. Para prevenir la pérdida de calor es necesario:
- –
Evitar la exposición del RN a corrientes de aire.
- –
Mantener el paritorio caldeado a 26°C, especialmente en prematuros de menos de 28 semanas de gestación14,15. Si el RN es a término y no precisa ninguna maniobra de reanimación, se debe colocar al niño «piel con piel» sobre su madre, y cubrir a ambos con una toalla. Si no es colocado piel-piel con la madre, alternativamente se le puede secar inmediatamente después del nacimiento. Se aconseja cubrir la cabeza y el cuerpo, dejando libre la cara, con una toalla caliente para impedir la pérdida posterior de calor.
- –
Colocar al RN sobre una superficie caliente y bajo una fuente de calor radiante cuando precisa reanimación, evitando la hipertermia.
- –
Utilizar envoltorios o bolsas de plástico de polietileno, debajo de la fuente de calor radiante, en prematuros menores de 28 semanas, sin secarlos previamente. Los envoltorios deben mantenerse hasta el ingreso y tras comprobar la temperatura. En caso de no disponer de bolsas, el uso de colchones exotérmicos puede prevenir la pérdida de calor16.
En los centros en los que la temperatura del paritorio es inferior a 26°C, los prematuros de 28-32 semanas se pueden beneficiar también del uso de envoltorio de plástico. Es preciso determinar la temperatura del RN a menudo, especialmente si se realizan todas estas medidas al mismo tiempo, para evitar la hipertermia.
Valoración inicialLa evaluación inicial se realiza en los segundos inmediatos al nacimiento mediante la respuesta a tres preguntas: ¿gestación a término?, ¿llora o respira?, ¿buen tono muscular?
Cuando la respuesta a todas las preguntas es afirmativa, se coloca sobre la madre piel con piel y se seca al RN con una toalla precalentada y se cubre a ambos con una sábana o manta para evitar la pérdida de calor. Ello no obvia que en los primeros minutos de vida se deba controlar al RN mediante la valoración de la respiración, la actividad y el color, aunque este último puede inducir a engaño.
Si el niño nace vigoroso, aunque las aguas sean meconiales, se le puede dejar con la madre y no está indicado aspirarle10.
Cuando el RN es a término y está sano se aconseja retrasar al menos 1min la ligadura del cordón umbilical17. Existe evidencia clara (nivel de evidencia 1) respecto al beneficio de retrasar el pinzamiento del cordón umbilical entre 30 y 180s en los partos prematuros no complicados (los RN prematuros a los que se retrasó el pinzamiento del cordón umbilical presentaron mayor presión arterial durante la estabilización, menor incidencia de hemorragia intraventricular y recibieron menos transfusiones de sangre, aunque precisaron fototerapia más frecuentemente18), como queda recogido en las conclusiones de las worksheets (hojas de trabajo) de ILCOR 201019. Pese a ello, las nuevas guías internacionales no establecen recomendaciones al respecto. Por otro lado, no hay suficiente evidencia para recomendar el tiempo óptimo de ligadura del cordón en niños que necesitan reanimación.
Si alguna de las respuestas es negativa (esto es, el niño es prematuro, presenta apnea o un patrón respiratorio inadecuado y/o está hipotónico), se procederá a su estabilización.
Estabilización inicial. Primeros pasosColocar al RN en una zona bien iluminada, sobre una superficie caliente, bajo una fuente de calor radiante y con acceso fácil al material que se pueda requerir en la reanimación. La posición correcta es en decúbito supino y con la cabeza en posición de olfateo (una toalla de 2cm de grosor colocada bajo los hombros puede ser útil para mantener la posición de la cabeza). Se le debe secar con una toalla precalentada y realizar una estimulación táctil suave; ambas maniobras son estímulos suficientes en la mayor parte de los casos para que el niño inicie la respiración y/o el llanto. La succión orofaríngea y nasal puede retrasar el inicio de la respiración espontánea, producir espasmo laríngeo y bradicardia vagal, por lo que sólo se debe usar cuando el retraso en el inicio de la respiración se pueda relacionar con la obstrucción de la vía aérea por secreciones.
Tras realizar las maniobras de estabilización se valora nuevamente al RN mediante dos parámetros:
- –
Respiración.
- –
FC (medida en lpm).
Si el RN va a precisar reanimación, se recomienda entonces la colocación de un pulsioxímetro para utilizar como guía la SatO2.
RespiraciónEl RN puede estar en apnea o tener una respiración ineficaz. Se debe valorar la frecuencia, profundidad y simetría de la respiración, así como las alteraciones del patrón respiratorio (gasping) o quejido.
Frecuencia cardiacaLa determinación de la FC se realizará preferentemente por auscultación del precordio. Otra posibilidad es la palpación de la base del cordón umbilical, aunque este método sólo es fiable si la FC es superior a 100 lpm20. En niños que requieren reanimación y/o soporte respiratorio prolongado, la pulsioximetría proporciona una FC segura siempre y cuando la curva de pulso registrada sea adecuada21. Para obtener una lectura lo más rápida y fiable posible, se recomienda utilizar pulsioxímetros de última generación, colocar primero el sensor en la mano o muñeca derechas del RN (localización preductal) y posteriormente conectarlo al monitor ya encendido22.
Una FC superior a 100 lpm, o un aumento de esta, es el indicador más fiable y rápido de una adecuada ventilación.
Se ha demostrado que el color no es un buen parámetro para valorar la oxigenación11. La cianosis periférica es habitual y no indica por sí misma hipoxemia. La palidez cutánea mantenida a pesar de una adecuada ventilación puede indicar acidosis, hipotensión con o sin hipovolemia y a veces anemia.
Tras esta segunda valoraciónSi el RN tiene un patrón respiratorio adecuado, y la FC es superior a 100 lpm se le puede dejar con la madre y posteriormente realizar los cuidados de rutina. En todo RC que ha requerido la más mínima maniobra para favorecer la adaptación posnatal se debe vigilar la evolución durante un tiempo.
Si el RN está en apnea o tiene una respiración inadecuada (gasping o distrés) y/o la FC es inferior a 100 lpm, se debe iniciar la ventilación con presión positiva intermitente.
Cuando el RN respira espontáneamente y la FC es superior a 100 lpm pero existe dificultad respiratoria o cianosis persistente, se puede considerar el uso de CPAP y monitorizar la SatO2. Actualmente, no hay evidencia para apoyar o rechazar el uso de CPAP en paritorio en el RN a término con distrés. Si persiste la cianosis se debe pasar a ventilar con presión positiva intermitente. La ventilación con CPAP en el nacido a término requiere un ajuste perfecto de la mascarilla, así como una presión (por lo menos 5cm H2O) y un flujo adecuado (8 l/min) para ser eficaz.
Suplementación con oxígenoUna de las novedades más destacables de la nueva guía de ILCOR 2010 hace mención a la suplementación con oxígeno. La evidencia acumulada en años recientes ha demostrado que el uso sistemático de oxígeno al 100% (FiO2 de 1) en pacientes con depresión neonatal moderada a grave produce un retraso significativo en el inicio de la respiración espontánea y/o del llanto23–26. La evidencia nos muestra que los RN que son ventilados con elevadas concentraciones de oxígeno alcanzan cifras de presión parcial de oxígeno en sangre arterial que exceden los valores fisiológicos durante un tiempo superior a 15min25. Los quimiorreceptores carotídeos se pueden ver así saturados y los impulsos al tronco cerebral para que se reinicie la respiración, abolidos25. La consecuencia es que el reanimador prolonga la ventilación al creer que el paciente sigue con depresión respiratoria y, al final, el tiempo de reanimación se prolonga innecesariamente y la «carga de oxígeno» recibida deviene excesiva y ello ocasiona estrés oxidativo23–25. Sin embargo, la asociación más importante que se ha podido establecer con la utilización de un exceso de oxígeno ha sido el incremento de la mortalidad entre los neonatos que se han reanimado con oxígeno puro frente a los que han recibido aire ambiente. Metaanálisis realizados por diferentes grupos de investigadores han constatado que tanto en estudios aleatorizados y ciegos, como en cuasi aleatorizados y no cegados, la mortalidad era consistentemente más elevada en los pacientes reanimados con 100% de oxígeno frente a los que habían sido reanimados con aire27–29.
La evolución de la oxigenación en la transición fetal neonatal es gradual y el tiempo que tarda el RN en alcanzar saturaciones consideradas dentro de la normalidad (≥ 90%) es inversamente proporcional a la edad de gestación del neonato. Ello se ha podido constatar por investigadores de Australia y España mediante la confección de un «nomograma» de saturación de oxígeno medido en sangre arterial mediante el uso de pulsioxímetros de última generación con máxima sensibilidad y promediando las lecturas cada 2s en RN que no precisaron suplementación de oxígeno en la sala de partos. Los resultados recientemente publicados indican que un RN a término puede requerir 5min y un nacido pretérmino hasta 10min en alcanzar saturaciones ≥ 90%12. Ello nos indica que mientras la FC se mantenga > 100 lpm y el tono y la respuesta a estímulos sean adecuados, no es preciso suplementar con oxígeno. La administración suplementaria de oxígeno, en el caso de que fuera necesaria, se ajustaría individualmente intentando mantener la SatO2 entre los percentiles P10 y 50 para evitar hipoxia o hiperoxia12. Un problema todavía no resuelto en el caso del prematuro es la FiO2 con la que se debería iniciar la reanimación. Estudios piloto con tamaño muestral pequeño han venido consistentemente a mostrar que el inicio de la reanimación con aire ambiente en el prematuro de < 30 semanas de gestación conduce frecuentemente a la hipoxemia y a la necesidad de incrementar la FiO2 significativamente para luego ir bajándola gradualmente30–33. En dos de esos estudios el inicio de la ventilación con FiO2 de 0,3 mostró la ausencia de hipoxemia severa y de necesidad de incrementos bruscos de FiO231,32. Los pacientes se mantuvieron con una FC adecuada y su SatO2 se fue elevando progresivamente, de acuerdo con los objetivos diana establecidos simplemente con ajustes individualizados y secuenciales en la FiO231,32. Por lo tanto, aunque las normas dejan al neonatólogo la libre elección de la FiO2 a utilizar inicialmente, una concentración inicial del 30-50% parece razonable siempre y cuando se tenga al paciente monitorizado con pulsioximetría y se ajuste el mezclador de aire/oxígeno para mantenerle dentro de los percentiles P10 a P50 (véase la tabla en figura 1). Una vez el prematuro recibe oxígeno, una SatO2 máxima del 90% como referencia puede ser suficiente, dado que una saturación superior no se correlaciona bien con la presión arterial de oxígeno (dada la forma sinusoidal de la curva de saturación de hemoglobina) y es fácil provocar hiperoxia5.
En ausencia de mezclador de gases, se recomienda empezar la reanimación con aire. En todos los casos, la primera prioridad es asegurar la adecuada insuflación pulmonar, seguido del incremento en la concentración de oxígeno sólo si es necesario.
VentilaciónLas primeras insuflaciones en RN apneicos favorecen el establecimiento de la capacidad residual funcional. En la actualidad, no existe evidencia suficiente para recomendar tiempos inspiratorios cortos o largos en el RN a término, estando todavía sin demostrar el posible beneficio de la insuflación mantenida en el RN pretérmino. El pico inicial de insuflación necesario para conseguir un aumento rápido de la FC o elevación del tórax con cada respiración es variable e impredecible y debe individualizarse. Si la presión puede monitorizarse, una presión positiva inspiratoria (PIP) de 20-25cmH2O puede ser efectiva en RN pretérmino34 y de 30cmH2O en el RN a término35, pero si no se produce un aumento de la FC una vez comprobado el buen sellado, puede ser necesario en éstos emplear valores ≥ 30-40cmH2O36. En situaciones en que no sea posible medir la presión de insuflación, se debe emplear la minima insuflación necesaria para conseguir un aumento de la FC. Se debe evitar el movimiento torácico exagerado durante la ventilación inicial en prematuros, ya que un volumen corriente elevado, asociado a una insuflación excesiva, puede producir daño pulmonar37.
El empleo de presión positiva al final de la espiración (PEEP) parece que puede ser beneficioso38 durante la estabilización inicial de RN pretérmino apneicos que requieren ventilación con presión positiva intermitente, por lo que debería utilizarse por lo menos 5cmH2O si nuestro dispositivo de ventilación lo permite5. En este sentido, y siendo la ventilación la intervención más eficaz en la reanimación, las salas de partos de los centros de referencia deberían estar dotadas con todos los medios tecnológicos actuales para poder suministrar al RN el modo de ventilación más adecuado en cada caso para facilitarle la transición fetal neonatal en óptimas condiciones, dentro de lo que se conoce como concepto DRICU (acrónimo inglés de delivery room intensive care unit)39. En el momento actual, el RN pretérmino con respiración espontánea que tiene dificultad respiratoria puede ser ayudado con CPAP o con intubación y ventilación mecánica40. La elección más apropiada puede estar basada en la experiencia local y sus resultados. No existe evidencia para rechazar o apoyar el empleo de CPAP en la sala de partos en RN a término con dificultad respiratoria.
En cuanto al sistema de ventilación, se puede realizar una ventilación adecuada empleando mascarillas unidas a sistemas con tubo en «T» con limitación de presión y ajuste de presión al final de la espiración, o a bolsas autoinflables o inflables por flujo, no habiéndose detectado en estudios clínicos diferencias en la eficacia entre ellos. No obstante, en modelos mecánicos se ha comprobado que se consigue la presión de insuflación deseada y la PEEP de forma más consistente con el sistema de tubo en «T» frente a los otros sistemas41–43. La monitorización del volumen tidal y el cálculo de fugas en el sellado de mascarilla demuestran que existe una gran variabilidad de éstos entre reanimadores, así como en la percepción individual que se tiene de estos parámetros en la reanimación44.
Aunque no se ha demostrado la superioridad de ningún sistema de ventilación, parece ser que con la utilización de la pieza en «T» se logra una mayor homogeneidad de las curvas de presión volumen. Son necesarios más estudios con pacientes reales para determinar la superioridad de un sistema sobre otro.
La optimización del soporte respiratorio requiere que la interfase utilizada (cánulas nasales o mascarilla) sea la adecuada en tamaño y esté bien posicionada. Aparte de las dificultades técnicas, no existen datos suficientes para recomendar la monitorización rutinaria del volumen corriente durante la ventilación en la reanimación.
No existen cambios en las recomendaciones en el empleo de mascarilla laríngea y deberá considerarse su uso durante la reanimación en > 2.000g o ≥ 34 semanas de edad gestacional, si la ventilación con mascarilla es ineficaz y la intubación endotraqueal fracasa y/o no es posible. No se ha evaluado la mascarilla laríngea en ≤ 2.000g o < 34 semanas de edad gestacional, en casos de síndrome de aspiración meconial (SAM), durante las CT o para la administración de medicación intratraqueal.
La intubación endotraqueal puede estar indicada a diversos niveles durante la reanimación neonatal, debiendo estar disponible el material adecuado. La intubación puede ser necesaria cuando la ventilación con bolsa es ineficaz o prolongada, acompañando a las CT y en situaciones especiales como el RN de extremado bajo peso, en la hernia diafragmática congénita, en el RN con FC indetectable y si se decide realizar aspiración endotraqueal en el RN con aguas meconiales. La tabla 4 muestra la longitud de introducción del tubo endotraqueal (TET) al fijarse en la comisura labial4. La detección de CO2 exhalado (método colorimétrico o por capnografía)45,46, sin olvidar la importancia de la evaluación clínica, es el método recomendado para la confirmación de la intubación, siempre que exista estabilidad hemodinámica, ya que la existencia de un pobre flujo pulmonar puede dar lugar a un falso negativo a pesar de una buena colocación del TET.
Longitud del tubo endotraqueal desde comisura labial
| Edad gestacional (semanas) | Tubo endotraqueal en labios (cm) |
| 23-24 | 5,5 |
| 25-26 | 6 |
| 27-29 | 6,5 |
| 30-32 | 7 |
| 33-34 | 7,5 |
| 35-37 | 8 |
| 38-40 | 8,5 |
| 41-43 | 9 |
Tomado de Richmond y Wyllie4.
El inicio de CT o masaje cardíaco externo está indicado cuando tras 30s de ventilación adecuada con presión positiva intermitente (VPPI) y oxígeno suplementario, la FC es menor de 60 lpm2–4.
Es importante asegurarse de que la VPPI es eficaz antes de y durante las CT.
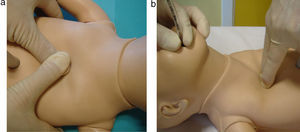
La técnica de elección para las CT es la de los dos pulgares (fig. 2A). Se abraza el tórax del RN con ambas manos, que actúan de plano duro debajo de la espalda, y con los dos pulgares se realizan las CT en el tercio inferior del esternón, debajo de la línea imaginaria que une las dos mamilas. La profundidad adecuada equivale a un tercio del diámetro antero-posterior del tórax. Esta técnica produce un mayor pico sistólico y una mayor presión de perfusión coronaria2,3.
Como técnica alternativa, se pueden realizar CT con la técnica de los 2 dedos (fig. 2B), mediante la cual, y con una segunda mano sirviendo de plano duro en la espalda del RN, se comprime el mismo lugar con los dedos índice y medio o medio y anular a la misma profundidad2,3. Los dedos deben colocarse perpendicularmente al esternón, evitando la presión sobre las costillas.
Ya sea con una técnica u otra, se debe permitir la relajación y expansión completa de la caja torácica tras cada compresión, sin perder el lugar de contacto, evitando la coincidencia de compresión y ventilación y manteniendo una relación de 3 compresiones por cada ventilación (3/1). Con esta relación, cada evento debe durar 0,5s y cada ciclo completo de 3 compresiones y una ventilación durará 2s, reproduciendo así en 1min 90 compresiones y 30 ventilaciones.
Esta relación 3/1 favorece la ventilación minuto, por lo que en RN, en que la causa respiratoria constituye la inmensa mayoría de las causas de bradicardia y/o parada cardiaca, es la relación que debe mantenerse, pudiendo considerarse una relación 15/2, es decir 15 compresiones y 2 ventilaciones, si existen indicios de causa cardiaca de la parada2,3.
Una vez se han iniciado las CT, deben interrumpirse lo menos posible. Se recomienda evaluar periódicamente (cada 30s) la FC, la actividad respiratoria y la oxigenación mediante pulsioximetría y mantener las CT hasta que la FC sea igual o mayor de 60 lpm.
La concentración de oxígeno se aumentará al 100% al iniciar las CT, si ésta previamente era inferior. Cuando las CT son efectivas, se pueden ver ondas de pulso en el pulsioxímetro.
Medicación y expansores de volumenLa administración de medicación durante la reanimación neonatal supone un hecho muy infrecuente. Ello condiciona la poca evidencia científica al respecto, de cara a respaldar o rechazar los fármacos y las dosis utilizados hasta la actualidad. Pese a todo, es evidente que cabe establecer unas recomendaciones, que se van a detallar a continuación.
La bradicardia persistente sólo se valora como subsidiaria de ser tratada con fármacos tras la comprobación de una ventilación eficaz (preferentemente, mediante intubación endotraqueal) y unas CT correctamente realizadas. En este momento cabe considerar el uso de adrenalina, expansores de volumen o ambos. El uso de otros fármacos, como bicarbonato y naloxona, ya no tiene cabida en la reanimación neonatal. Es más, los efectos indeseables de ambos en estudios experimentales recomiendan su no utilización2,47. Por otro lado, los vasopresores pueden ser útiles después de la reanimación, pero difícilmente en las actuales salas de partos. Si en el futuro se considera la sala de partos de alto riesgo como una prolongación de la UCIN, entonces se podrán aplicar al RN todas las técnicas médicas intensivas previo a su traslado a la UCIN propiamente dicha39. El importantísimo papel de la administración de glucosa en la estabilización tras la reanimación se discute al final.
La vía preferida para la administración de fármacos durante la reanimación neonatal es la vía venosa umbilical. Si su instauración no es posible, la vía endotraqueal puede ser una alternativa sólo válida para la adrenalina, aparte del uso de surfactante en prematuros.
AdrenalinaSuele ser el primer fármaco que se utiliza en la reanimación neonatal. Se recomienda su administración si la FC permanece por debajo de 60 lpm tras haber asegurado una ventilación eficaz y haber realizado correctamente CT durante 30s; en total, por tanto, no antes de 90s de iniciadas las maniobras de reanimación.
Su administración debe ser preferentemente intravenosa, a una dosis de 0,01-0,03mg/kg. En caso de no disponer de vía venosa, la única alternativa aceptable es la vía endotraqueal. La evidencia científica no permite llegar a un consenso firme en cuanto a la seguridad y la eficacia de la adrenalina administrada por vía endotraqueal (los estudios se basan en pacientes adultos y animales), pero se considera que en este caso deben utilizarse dosis mayores, entre 0,05 y 0,1mg/kg48. Estas dosis no deben ser administradas por vía intravenosa, ya que pueden ser nocivas.
Sea cual sea la vía de administración, la dilución aconsejada es 1:10.000 (0,1mg/ml)3. Dosis repetidas de adrenalina pueden considerarse cada 3-5min si la FC permanece por debajo de 60 lpm.
Expansores de volumenLas nuevas recomendaciones establecen pocas variaciones respecto a la práctica habitual. No hay un momento determinado para utilizarlos, y por tanto se debe considerar administrar una carga de volumen en caso de pérdida sanguínea evidente o sospechada clínicamente (pulso débil, palidez, mala perfusión periférica), cuando el bebé no responde al resto de las maniobras (ventilación, compresiones y adrenalina). La dosis recomendada es 10ml/kg de una solución cristaloide, o sangre 0 Rh negativa, o sangre cruzada que se puede repetir si la respuesta clínica es satisfactoria3,4.
En ausencia de historia de pérdida hemática o de clínica compatible, la administración de volumen de forma rutinaria en caso de falta de respuesta al resto de las maniobras no posee evidencia científica suficiente49. En estos casos, no obstante, se puede hacer una prueba terapéutica2.
El uso de expansores de volumen en los RN prematuros sigue siendo controvertido, ya que se asocia a la presencia de hemorragia intraventricular si se administran rápidamente. Por ello, pese a no estar contraindicado, se debe ser especialmente cauteloso en estos casos.
Otros fármacosBicarbonatoEl uso de bicarbonato durante la RCP neonatal prácticamente desaparece tras las nuevas recomendaciones internacionales. Queda, por tanto, la consideración —controvertida— de utilizarlo para los cuidados posreanimación. Sin embargo, en una reciente publicación en la que se reflejan los resultados de una encuesta realizada en servicios de neonatología europeos, se ha podido constatar que en los países del sur de Europa el bicarbonato sería todavía un fármaco ampliamente utilizado en la sala de partos para corregir la acidosis secundaria a la asfixia intraparto, sin que haya una justificación fisiopatológica50.
NaloxonaHistóricamente, la naloxona había aparecido en todas las guías de reanimación neonatal, pese a una evidencia científica muy pobre. Actualmente, no se recomienda su uso para la sala de partos, ya que no se ha demostrado que mejore de forma relevante los resultados de la reanimación51, frecuentemente se utiliza de forma inadecuada52 y existe preocupación sobre su seguridad a corto y largo plazo en RN.
Por lo tanto, en caso de depresión respiratoria por exposición materna a opiáceos, el objetivo es mantener la ventilación asistida mientras el RN esté apneico.
GlucosaLos RN que sufren una situación de hipoxia-isquemia presentan una incidencia mayor de encefalopatía grave si se asocia hipoglucemia53. Por otro lado, niveles elevados de glucemia en caso de hipoxia-isquemia no han demostrado efectos adversos en estudios en niños54 ni en animales55. Así, pese a que los niveles de euglucemia no están bien definidos, la administración de glucosa en forma de perfusión por vía intravenosa debe ser lo más precoz posible tras la reanimación, incluso en el paritorio, en aras de evitar cualquier posibilidad de hipoglucemia.
Los estudios experimentales indican que la glucosa es, junto con la hipotermia, uno de los protectores más eficaces para el sistema nervioso central en situaciones de asfixia56. Por lo tanto, se debería entrenar al personal que atiende al RN en la sala de partos a cateterizar vías centrales umbilicales para la administración por vía intravenosa de glucosa (4-6mg/kg/min, que equivale a unos 60ml/kg/día de suero glucosado al 10%) durante la estabilización y antes de iniciar el transporte a la UCIN, especialmente en aquellos hospitales donde el tiempo de demora que se produce en el traslado es superior a 15min.
Situaciones clínicas especialesManejo de la vía aérea en presencia de líquido meconialEl paso de meconio al líquido amniótico es más frecuente en gestaciones prolongadas. Este líquido amniótico meconial puede ser inhalado antes o durante el parto y producir inflamación pulmonar u obstrucción de la vía aérea (SAM) y, por lo tanto, todos los RN con líquido meconial deben ser considerados de riesgo. Las complicaciones por aspiración de meconio son más probables en RN de bajo peso para su edad gestacional y los postérmino o con compromiso fetal significativo.
Aspiración de vías altas intrapartola aspiración de secreciones de boca y faringe durante el parto, antes de asomar los hombros, no ofrece ninguna diferencia en el pronóstico y no está actualmente recomendada57,58.
Aspiración endotraqueal después del nacimientoInmediatamente después del nacimiento con aguas meconiales, la aspiración endotraqueal sistemática del RN vigoroso (que respira o llora y tiene buen tono muscular) está desaconsejada, pues no mejora el pronóstico y puede producir yatrogenia10,59.
Estudios observacionales sugieren que los RN deprimidos nacidos con aguas meconiales tienen mayor riesgo de desarrollar SAM, pero no parece que la aspiración endotraqueal rutinaria reduzca su incidencia o mortalidad60,61. Ante la ausencia de estudios aleatorizados y controlados en RN deprimidos con líquido amniótico meconial, no hay suficiente evidencia para recomendar un cambio en la práctica actual de realizar aspiración intratraqueal directa. Sin embargo, si los intentos de intubación se prolongan o no son efectivos, o si no existe impresión de obstrucción de la vía aérea, debería iniciarse la ventilación con bolsa y mascarilla particularmente si la FC es < 100 lpm2–4.
Si se realiza la aspiración endotraqueal, debe tenerse presente:
- –
La experiencia del equipo de reanimación y la disponibilidad del equipo necesario.
- –
El inicio de la aspiración inmediatamente tras el parto, sin haber estimulado la respiración espontánea y antes de la instauración de cualquier ventilación.
- –
La realización de la maniobra en unos segundos, mediante adaptador y con presión negativa máxima de 100mmHg.
- –
El hecho de que la intubación repetida para aspirar la tráquea no tiene soporte científico y puede retrasar las maniobras de reanimación.
Los RN con asfixia y/o aspiración de líquido meconial pueden requerir mayores presiones de inspiración de vía aérea (> 30cmH2O) durante la reanimación36.
Todos los RN con aguas meconiales deberían ser evaluados cuidadosamente después del parto y en las siguientes 24-48h62.
Manejo respiratorio en el prematuro extremoLas nuevas recomendaciones refuerzan el potencial efecto beneficioso del uso de CPAP en el paritorio, del uso de PEEP si se ventila con presión positiva intermitente, del control del pico de presión y del uso de pulsioximetría para evitar la hiperoxemia e hipoxemia.
Soporte respiratorio con presión positiva continua en la vía respiratoriaLa mayoría de los RN muy prematuros necesitan algún tipo de apoyo respiratorio después del parto. El modo de soporte respiratorio ideal cuando el prematuro respira espontáneamente pero con dificultad no está claro. Algunos expertos recomiendan una intubación endotraqueal electiva mientras otros preconizan el uso de la CPAP inmediatamente tras el parto, o bien la administración de surfactante precoz. En este aspecto, cabe destacar que la experiencia y el dominio del equipo en determinadas técnicas permite realizarlas con excelencia y, por lo tanto, las comparaciones de diferentes técnicas intracentro o intercentros son muy difíciles de evaluar.
Existe creciente experiencia en que muchos prematuros extremos pueden ser manejados con CPAP sin requerir intubación ni ventilación mecánica40,63–65. El uso de CPAP, cuando se compara con la intubación y la ventilación intermitente, reduce la incidencia de ventilación mecánica en la unidad neonatal y la administración de surfactante, sin efectos adversos en la incidencia de mortalidad o necesidad de oxígeno a las 36 semanas corregidas40. Para ello, la experiencia del equipo reanimador es determinante. Si se utiliza CPAP, la presión debe ser de al menos 5cmH2O para favorecer el establecimiento de una capacidad residual funcional y mejorar la oxigenación. Las presiones altas (8-12cmH2O) pueden reducir el flujo pulmonar y provocar neumotórax2.
Ventilación con presión positiva intermitenteEl prematuro apneico necesita la aplicación de presión positiva intermitente para reclutar el pulmón. En las primeras insuflaciones, el tiempo inspiratorio ideal para producir un buen reclutamiento pulmonar actualmente no está establecido, así como el efecto beneficioso potencial de una insuflación sostenida66.
El pico inspiratorio tiene que ser el mínimo y suficiente para aumentar la FC o visualizar el movimiento del tórax, pero debe evitarse la observación de un movimiento torácico excesivo. El pico puede ser variable e impredecible y, por lo tanto, debe individualizarse en cada inspiración. Una presión inicial de 20-25cmH2O puede ser adecuada para la mayoría de los prematuros extremos. El uso de dispositivos con monitorización de presión, aunque no guardan correlación con el volumen tidal administrado ya que la dinámica respiratoria es cambiante, puede permitir la administración más consistente de presión positiva y evitar la administración de presiones innecesariamente altas. Si se monitoriza el volumen tidal, una vez reclutado el pulmón, se debe mantener entre 4-6ml/kg para evitar la sobredistensión pulmonar67. Si no se obtiene una respuesta rápida en la FC o movimiento torácico, puede ser necesario aumentar la presión.
La PEEP es beneficiosa para los prematuros apneicos que requieren VPPI y debería suministrarse si se dispone del equipo necesario para ello. Los dispositivos de pieza en T suministran una PEEP más consistente que la bolsa autoinflable o la inflable por flujo.
Si se requiere intubación, la administración precoz de surfactante puede mejorar la respuesta al tratamiento68.
Suplementación con oxígenoEste aspecto ya se ha descrito en el apartado correspondiente.
Aspectos éticosEn las recomendaciones de la ERC4, se establecen algunos de los conceptos éticos referentes a la atención domiciliaria si el nacimiento se produce fuera del hospital. Si la familia acepta el parto domiciliario, el equipo que lo atiende debe garantizar la cumplimentación de las recomendaciones en reanimación neonatal inicial. Inevitablemente, en los partos domiciliarios existe la limitación de la distancia a un centro sanitario si el RN precisase de una asistencia posterior. Este hecho debe ser puesto en conocimiento de la familia cuando se planea el parto domiciliario, ya que es la madre como persona autónoma la que debe conocer la posibilidad de que un RN requiera reanimación y saber por tanto la relación riesgo/beneficio que pudiera existir en dicho proceso. Lo deseable es que estén presentes en el parto dos profesionales y que al menos uno de ellos esté entrenado, y tenga experiencia, en la ventilación con mascarilla y CT. El ILCOR2 no hace mención al lugar donde deben nacer los niños, exceptuando los RN prematuros que deben beneficiarse de la asistencia en centros que cuenten con la posibilidad de administrar diferentes concentraciones de oxígeno, así como la monitorización con pulsioxímetro.
La mortalidad y la morbilidad de los RN varían en relación con la zona y los recursos disponibles69. Los estudios en ciencias sociales indican que los padres desean un mayor protagonismo en las decisiones de reanimar y continuar el soporte vital en niños gravemente afectados68. Las opiniones varían entre los profesionales, los padres y la sociedad en relación con el balance de las ventajas y desventajas de usar tratamientos agresivos en estos niños70-72.
No inicio de la reanimaciónHay situaciones que están asociadas a una alta mortalidad y un mal pronóstico en las que puede ser razonable no iniciar la reanimación, especialmente si se tiene la oportunidad de discutirlo con los padres para la realización de la toma de decisiones compartida73–75. Hay casos individuales en los que la prioridad inicial más importante debería ser la coordinación perinatal (obstetricia y neonatología) y los padres76. De hecho, iniciar la reanimación y posteriormente retirar dicho tratamiento es una opción considerada similar desde un punto de vista ético y legal; por ello, los clínicos no deberían dudar la retirada de soporte vital cuando la posibilidad de supervivencia funcional es altamente improbable. Las siguientes recomendaciones deben interpretarse de acuerdo con los propios resultados de los diferentes hospitales y centros de referencia:
Cuando la gestación, el peso al nacimiento y/o las malformaciones congénitas están asociados con una muerte precoz y una inaceptablemente alta morbilidad entre los escasos supervivientes, la reanimación no debería iniciarse2. Entre dichos casos se incluyen: prematuridad extrema (edad de gestación inferior a 23 semanas o peso al nacimiento menor de 400g) o anomalías tales como anencefalia y trisomías 13 o 18 confirmadas.
La reanimación está indicada en aquellos casos con una tasa de supervivencia alta y una aceptable morbilidad. Esto generalmente incluye a niños con edad de gestación de 25 semanas o más (a menos que haya evidencia de infección intrauterina o hipoxia-isquemia) y aquéllos con malformaciones congénitas mayores subsidiarios de tratamiento.
En condiciones asociadas con pronóstico incierto con supervivencia en el límite, tasa de morbilidad relativamente alta, y cuando la carga que presupone el niño es intensa, los deseos de los padres de cara a la reanimación deben ser tenidos en cuenta.
Interrupción de la reanimaciónLos datos de niños sin signos de vida al nacimiento, y que persiste en esa condición durante 10min o más, muestran una mortalidad alta y grave discapacidad en el desarrollo neurológico entre los sobrevivientes77,78. Ante un RN sin latido cardiaco que persiste durante más de 10min a pesar de las maniobras de reanimación adecuadas, es aceptable el considerar la interrupción de la misma. La decisión de continuar las maniobras de reanimación cuando en el niño no se detecta latido cardiaco durante más de 10min es a menudo compleja y puede estar influida por motivos como la presunta causa de la parada, la edad de gestación del niño, la potencial reversibilidad de la situación y el deseo previo de los padres de aceptación del riesgo de morbilidad. En estos casos, una vez que la reanimación ha sido iniciada, puede ser recomendable la decisión de la retirada del aporte cardiorrespiratorio y ofrecer cuidados de confort en dichos pacientes. Si la FC < 60 lpm y persiste durante 10-15min, la situación es menos clara y no se pueden establecer recomendaciones firmes.
Aspectos docentes en reanimación neonatalSimulaciónAlgunos estudios han demostrado que la simulación como método docente puede mejorar la actuación tanto en situaciones clínicas reales79,80 como durante la simulación de reanimación81,82 y, aunque algunos estudios no confirman la ventaja de los métodos de simulación frente a los métodos de formación tradicionales83,84, el ILCOR recomienda este método docente, utilizado de forma estructurada en los cursos de reanimación de la SEN.
Briefing y debriefingAmbos términos en inglés han sido incorporados al lenguaje docente. El briefing consiste en la explicación al alumno de la situación y cómo se va a desarrollar la práctica. Por debriefing se entiende la corrección de los errores, generalmente visualizando la actuación del alumno que ha sido previamente grabada. En diversos estudios81,85,86 se ha documentado la seguridad y efectividad de este método docente. Solo un estudio87 no ha demostrado la efectividad de esta metodología, aunque en ninguno se han evidenciado efectos negativos.
Comentarios finalesLa asfixia perinatal es una de las principales causas de mortalidad neonatal y de secuelas en el mundo. El adecuado manejo del RN en los primeros minutos de vida es crucial para el futuro de cada individuo.
La adecuada capacitación profesional y la aplicación de procedimientos reglados, coordinados, actualizados y basados en la mejor evidencia disponible mejorarán sustancialmente la supervivencia y las consecuencias a corto y largo plazo en estos niños. Es muy importante además que cada región adapte las recomendaciones a su realidad.
La aplicación sistematizada de las recomendaciones favorece no solamente el trabajo coordinado de cada equipo, sino que facilita la evaluación de las diferentes intervenciones.
Tal vez sea preocupante en nuestro propio ámbito que los contenidos de las guías terapéuticas nacionales y/o internacionales aún siendo conocidas no sean trasladadas a la práctica, como se refleja en un estudio reciente del Grupo de reanimación neonatal de la SEN especialmente en los hospitales de primer y segundo nivel. Sería importante que, además de impartir y certificar los cursos de reanimación neonatal, se arbitrasen mecanismos para la potenciación de su aplicación en la práctica diaria en todos los niveles de competencia hospitalaria, incluida la dotación necesaria de los equipos de reanimación en las salas de partos88.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Constituido por M. Iriondo, M. Thió, E. Burón, E. Salguero, J. Aguayo, C. Ruiz, D. Elorza, M. Vento, J R. Fernández Lorenzo (Hospital Xeral de Santiago de Compostela); L. Paisán (Hospital Donostia de San Sebastián), y I. Reyes (Hospital Insular de Las Palmas de Gran Canaria).
El listado de los miembros del Grupo de reanimación de la neonatal de la Sociedad Española de Neonatología se presenta en el Anexo 1.