Sr. Editor:
La acidosis láctica es un trastorno del equilibrio ácido-base caracterizado por un descenso del pH, aumento del anión gap e incremento de las concentraciones de lactato. Su asociación con el uso de β2 inhalados o i.v. ha sido descrita durante el tratamiento de crisis asmáticas en adultos y excepcionalmente en niños1–4 Se presenta el caso de una paciente con acidosis láctica tras el tratamiento de una hiperpotasemia con dosis elevadas de salbutamol inhalado.
Se trata de una niña de 14 años, con trasplante hepático ortotópico realizado 2 meses antes por fallo hepático secundario a síndrome de Budd-Chiari con mutación heterocigótica del factor V de Leiden y con una evolución postrasplante satisfactoria.
Se realizó consulta por dolor abdominal, estreñimiento, vómitos y malestar general, de varios días de evolución, acompañados de oligoanuria en las últimas 24h. En urgencias se constata un regular estado general y de hidratación, aumento de urea y creatinina, hiponatremia con normocloremia e hiperpotasemia, y acidosis metabólica con anión gap y lactato normales en sangre venosa (tabla 1). El resto de datos complementarios, incluyendo transaminasas, enzimas de colestasis y bilirrubina son normales, con concentraciones de inmunosupresores en el rango terapéutico y sin alteraciones en la ecogenicidad hepática ni renal, con flujos de arteria hepática y porta en límites normales, y con ECG normal.
Evolución de los datos gasométricos, analíticos y concentraciones de lactato
| Horas tras el ingreso | 0 | 3 | 8 | 10 | 18 | 48 |
| pH | 7,23 | 7,36 | 7,34 | 7,32 | 7.49 | 7,47 |
| PCO2 (mmHg) | 34,3 | 31,9 | 29,7 | 25,3 | 35 | 41 |
| CO3H (mEq/l) | 14 | 17,5 | 17 | 14,1 | 26,7 | 29 |
| Exceso de bases | −12 | −6,9 | −6 | −9,9 | 3,5 | 5,4 |
| Lactato (mmol/l) | 1,33 | 3,4 | 5,7 | 7,8 | 2,9 | 2,16 |
| Glucosa (mg/dl) | 220 | 245 | 175 | 157 | 132 | 130 |
| Urea (mg/dl) | 148 | 174 | 144 | 120 | 63 | 46 |
| Creatinina (mg/dl) | 3,8 | 4,5 | 3,1 | 2.2 | 0,9 | 0,9 |
| Sodio (mEq/l) | 116 | 115 | 116 | 117 | 127 | 129 |
| Potasio (mEq/l) | 6,9 | 7,4 | 5,4 | 5,1 | 4,5 | 4,8 |
| Cloro (mEq/l) | 95 | 86 | 83 | 81 | 93 | 98 |
| Anión gap (mEq/l) | 7 | 11,5 | 16 | 22 | 7,3 | 2 |
Como antecedentes destacan una sobredosificación accidental de espironolactona durante varios días, y la administración de IECA e ibuprofeno, como probables desencadenantes de la insuficiencia renal.
La paciente ingresa en la unidad de cuidados intensivos pediátricos (UCIP), donde se expande volemia con suero fisiológico, se inicia nebulización constante de salbutamol y perfusión de furosemida. La evolución es satisfactoria, con diuresis adecuada y normalización de la función renal y del desequilibrio hidroelectrolítico en 48h (tabla 1). Sin embargo, en las primeras horas aparece una acidosis láctica progresiva, sin signos de disfunción hemodinámica ni hipoxemia. Tras suspender el tratamiento con salbutamol nebulizado, las cifras de lactato descienden rápidamente, y se normaliza el equilibrio ácido-base (tabla 1).
La acidosis láctica es un trastorno grave del metabolismo intermediario, potencialmente letal. El lactato es el producto final del metabolismo anaerobio de la glucosa en los animales, resultado de la fermentación del ácido pirúvico5. En condiciones normales, el piruvato se oxida a CO2 y agua en la mitocondria, pero en ausencia de O2 (o si no se puede utilizar) el pirúvico sufre una fermentación en el citosol.
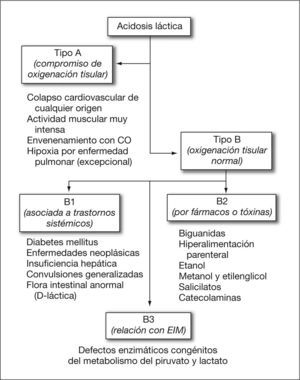
La hipoxia tisular es la causa más común de acidosis láctica (acidosis láctica tipo A); sin embargo, también puede aparecer sin hipoxemia o hipoperfusión (acidosis láctica tipo B), asociada con una mayor producción de ácido pirúvico, por inhibición o por saturación de la vía aerobia y/o de la neoglucogénesis (conversión de lactato a glucosa). Así, se produciría acidosis láctica tipo B ante una estimulación excesiva de la glucólisis (como sucede con el exceso de catecolaminas), en la alcalosis metabólica (en la que el lactato aumenta como mecanismo compensador) o en el contexto de algunos errores innatos del metabolismo, el fallo hepático o con ciertos fármacos (fig. 1)5.
La fisiopatología de la acidosis láctica durante las crisis asmáticas es incierta, y se ha atribuido a hipoxia, aumento de trabajo respiratorio y un eventual compromiso hemodinámico6. Sin embargo, su aparición en pacientes con ventilación mecánica, farmacológicamente relajados, sin hipoxia y con hemodinámica estable, hace pensar en un mecanismo diferente, relacionado con el tratamiento1,2,7–9.
Los β2 adrenérgicos inducen glucogenólisis y lipólisis10, y aumentan la producción de piruvato, que ve comprometido su metabolismo aeróbico por la inhibición directa de la piruvato deshidrogenasa por los β2 adrenérgicos y por el exceso de acetil-CoA, lo que provoca un incremento de lactato.
En nuestra paciente, tras iniciar el tratamiento de la hiperpotasemia con salbutamol, apareció una acidosis metabólica con aumento del anión gap y de los valores de lactato, que no se normalizaron hasta suspender el β2 inhalado. Este hallazgo, no descrito en la bibliografía médica fuera del contexto de una crisis asmática, confirmaría que el uso de β2 inhalados induce acidosis láctica en ausencia de hipoxia o de hipoperfusión tisular. No está claro a partir de qué dosis se produce este fenómeno (aunque en todos los casos descritos se utilizaron dosis elevadas), ni si existen unas condiciones en el paciente que lo favorezcan. Su evolución es favorable, y la acidosis láctica remite a las pocas horas de suspender el tratamiento.
En conclusión, el uso de β2 inhalados, con independencia del contexto en el que se utilicen, puede producir acidosis láctica. Por tanto, su administración, más si es a dosis elevadas y/o asociada a otras catecolaminas, debe acompañarse de un control del pH y de las concentraciones de lactato, interrumpiendo su administración en caso de acidosis láctica.