Las directrices europeas para el diagnóstico de la enfermedad celiaca (EC) han sido actualizadas en 2020. El objetivo primario fue revisar el grado de cumplimiento de los criterios diagnósticos de EC publicados por la ESPGHAN en 2012. Secundariamente, describir las características clínicas de los pacientes incluidos y valorar los cambios que implicaría la aplicación de los nuevos criterios 2020.
Pacientes y métodosEstudio multicéntrico retrospectivo con participación de 10 centros. Se incluyeron pacientes de 0 a 16 años de nuevo diagnóstico de EC en 2018-2019. Se recogieron variables clínicas, serológicas y realización de biopsia intestinal (BI).
ResultadosIncluimos 163 pacientes (57% mujeres), de edad media 7,6 años (DE 4,4). La forma de presentación fue: 47,8% clásica, 30,7% no clásica y 21,5% asintomáticos, con diferencias según la edad. Todos los centros determinaron IgA total y anticuerpos antitransglutaminasa IgA como primer escalón diagnóstico. Los anticuerpos antiendomisio IgA (AAE) se realizaron en el 80% y el haplotipo HLA en el 95%. Del total, 78 casos (47,9%) cumplieron criterios para no realizar BI. En los restantes 85 pacientes estaba indicada BI, no realizándose en 29 casos (17,8%). La realización de BI fue menor en los hospitales secundarios que en los terciarios (p < 0,05).
Si aplicáramos los criterios ESPGHAN-2020, prescindiríamos del estudio del HLA y 21 pacientes más no hubieran precisado BI (pasando de un 47,9% a un 60,7% del total).
ConclusionesSe observan discrepancias en la aplicación de los criterios diagnósticos ESPGHAN-2012 debido a la diferente accesibilidad a los AAE y BI endoscópica en centros secundarios. Con los criterios ESPGHAN-2020, en torno a un 60% de los pacientes podrán ser diagnosticados sin precisar BI, siempre que se asegure la determinación de AAE.
European guidelines for the diagnosis of celiac disease (CD) have been updated in 2020. The primary objective was to review the compliance with the diagnostic criteria for CD, according to ESPGHAN 2012. Secondarily, to describe the clinical characteristics of the patients and to assess the changes that would be implied by the application of the new 2020 criteria.
Patients and methodsRetrospective multicenter study in which 10 centers participated. Patients from 0 to 16 years old with a new diagnosis of CD in 2018-2019 were included. Clinical, serological variables and the performance of intestinal biopsy (IB) were collected.
Results163 patients were included (57% female) with a median age of 7.6 years (SD 4.4). The form of presentation was: 47.8% classical, 30.7% no classical and 21.5% asymptomatic, with differences depending on age. Total IgA and anti-transglutaminase IgA antibodies were performed in all centers as the first diagnostic step. IgA anti-endomysial antibodies (EMA) were performed in 80%, and HLA haplotype in 95%. Of the total, 78 cases (47.9%) met criteria for not performing intestinal biopsy (IB). IB was indicated in the remaining 85 patients, but was not performed in 29 cases (17.8%). The performance of IB was lower in the secondary hospitals than in the tertiary ones (p < 0.05).
If we applied the ESPGHAN 2020 criteria, we would disregard the HLA study, and 21 more patients would not have required IB (going from 47.9% to 60.7% of the total).
ConclusionsDiscrepancies are observed in the application of the ESPGHAN 2012 diagnostic criteria due to the different accessibility to EMA and endoscopic IB in secondary centers. With the ESPGHAN-2020 criteria, around 60% of patients will be able to be diagnosed without IB, provided that the determination of EMA is ensured.
La enfermedad celiaca (EC) es una enfermedad sistémica mediada inmunológicamente, desencadenada por la ingesta de gluten y prolaminas relacionadas, en individuos susceptibles genéticamente. Se caracteriza por la presencia de manifestaciones clínicas variables, anticuerpos específicos, haplotipos HLA DQ2 o DQ8 y enteropatía1.
Respecto a la presentación clínica, cada vez se observan más casos con clínica leve, inespecífica o incluso pacientes asintomáticos2. La edad del diagnóstico también se ha modificado, pasando de ser una enfermedad de debut en la infancia a diagnosticarse en todas las edades3.
Los nuevos conocimientos, especialmente los avances en la serología específica, han hecho que los criterios diagnósticos de la EC también cambien a lo largo de los años4. Esto ha sido gracias a la identificación de anticuerpos antitransglutaminasa tisular (AATG) y anticuerpos antiendomisio (AAE) y la demostración de la buena correlación entre títulos altos de AATG y el grado de atrofia vellositaria5,6, así como del valor de los AAE como predictores de enfermedad7. La precisión de estos marcadores serológicos actuales ha hecho que se replantee el papel de la biopsia intestinal (BI) en el diagnóstico de la EC8,9.
En este sentido, en el año 2012 se publicaron unas directrices de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) para el diagnóstico de la EC, estableciendo que la BI podía omitirse en casos seleccionados: pacientes sintomáticos con AATG elevados 10 veces por encima del valor normal, AAE positivos en una segunda muestra de suero y HLA DQ2 o DQ81. En 2020 se han actualizado dichas recomendaciones, estableciendo que si se cumplen los criterios serológicos (elevación de AATG 10 veces y positividad de AAE en otra muestra diferente) se pueden ampliar los casos en que puede omitirse la BI a casos asintomáticos y no sería necesario el estudio HLA10.
El objetivo primario del presente estudio fue revisar el grado de cumplimiento de los criterios ESPGHAN 2012 en una cohorte de pacientes pediátricos diagnosticados de EC en los años 2018 y 2019, en un estudio de diseño multicéntrico. Los objetivos secundarios fueron describir las características clínicas y epidemiológicas de la muestra, y valorar los cambios que implicaría en el diagnóstico la aplicación de los nuevos criterios 2020 publicados recientemente.
Pacientes y métodosEstudio multicéntrico retrospectivo en el que han participado las unidades de gastroenterología pediátrica de 10 centros hospitalarios (dos terciarios y ocho secundarios). Se incluyeron pacientes de 0 a 16 años de edad con nuevo diagnóstico de EC en el período 2018-2019. Se recogieron variables epidemiológicas, clínicas, serológicas y genéticas. También se documentó la realización o no de BI endoscópica, graduando las lesiones histológicas según la clasificación de Marsh-Oberhuber11. Se excluyeron los pacientes que habían iniciado dieta sin gluten antes de completar el diagnóstico.
Respecto a la presentación clínica, se clasificaron los pacientes en «asintomáticos», pacientes con «clínica clásica» (con signos o síntomas de síndrome malabsortivo: diarrea, pérdida de peso y/o distensión abdominal) y pacientes con «clínica no clásica» (que no presentaban signos ni síntomas malabsortivos)12.
Los datos de antropometría se recogieron en el momento del diagnóstico. Se calcularon los z scores de peso, talla e IMC, según los patrones de la Organización Mundial de la Salud (OMS)13,14.
Para evaluar el cumplimiento de los criterios ESPGHAN 2012 se definieron dos grupos. El grupo 1 incluyó a los pacientes que cumplían criterios para omitir la BI: síntomas sugestivos, AATG ≥ 10 veces su valor normal, AAE positivos en una muestra de sangre diferente y HLA DQ2 o DQ8. El grupo 2 incluía el resto de los pacientes que no cumplía alguno de los cuatro criterios anteriores, en los que habría que haber realizado BI1.
Para valorar los cambios que supondría la aplicación del diagnóstico, según ESPGHAN 2020, se excluyeron los síntomas y el HLA del grupo 1, manteniendo el resto de criterios10.
Para el análisis estadístico, se utilizó el Statistical Package for the Social Sciences (SPSS), versión 22.0. El nivel de significación empleado en todos los análisis bivariantes fue del 5% (α = 0,05). Se realizó un análisis descriptivo de las variables en estudio. Con las variables nominales y ordinales, se utilizaron los estadísticos frecuencia y porcentajes. Con variables continuas se analizaron las medidas de tendencia central (media y mediana) y de dispersión (desviación estándar, DE). Para comparar variables nominales se ha utilizado la prueba de chi-cuadrado o el test de Fisher. Para la comparación de variables cuantitativas se ha utilizado la t de Student si presentaban una distribución normal, o los test no paramétricos U de Mann-Whitney y Kruskal-Wallis si no tenían distribución normal.
Este estudio cumple los aspectos éticos de la última Declaración de Helsinki (www.wma.net), las Normas de Buena Práctica Clínica de la Conferencia Internacional de Armonización (GPC/ICH) y cumple la legislación española vigente (www.aemps.es/).
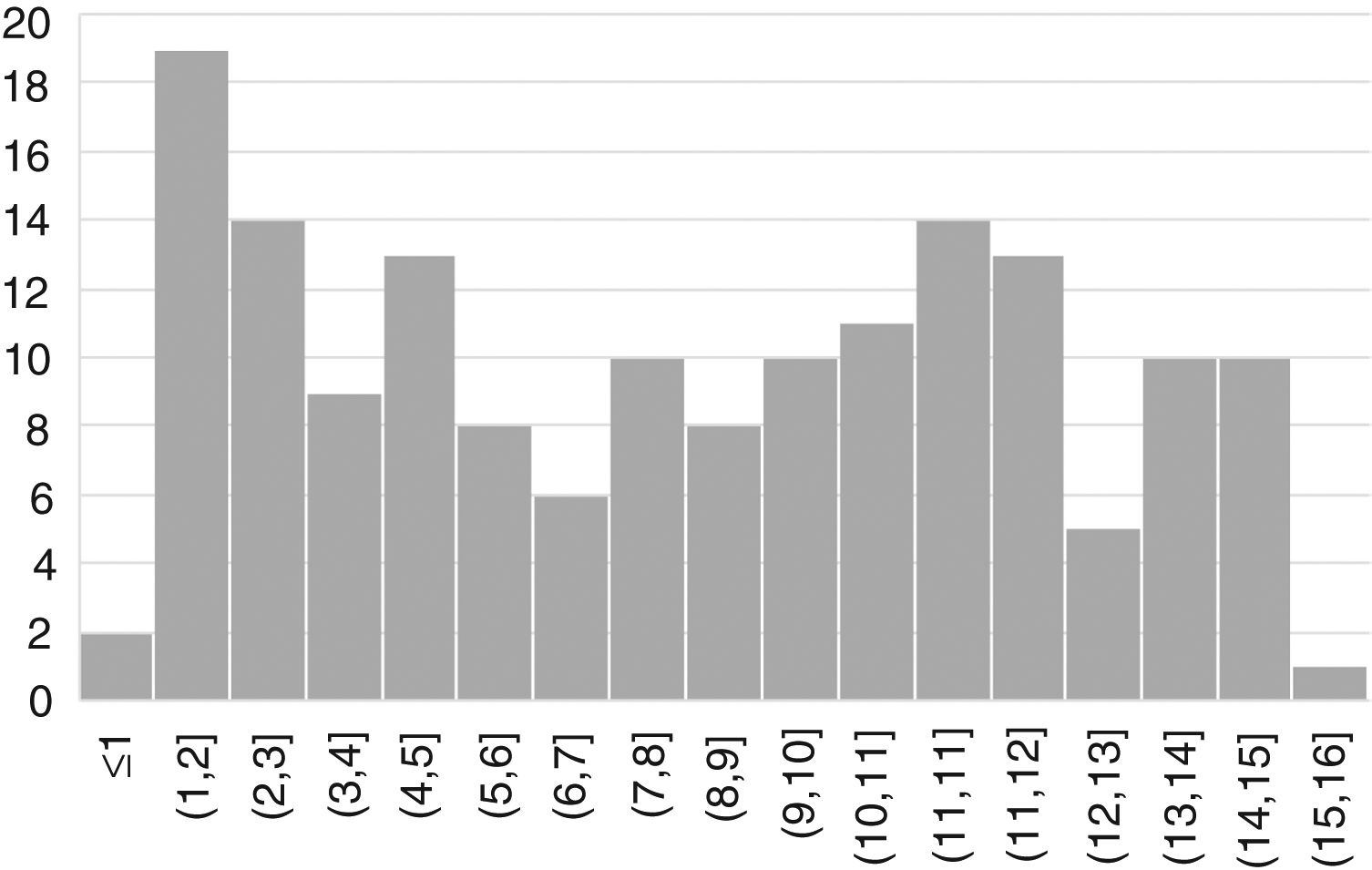
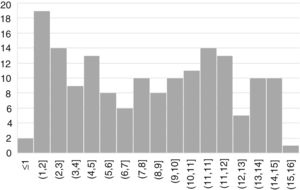
ResultadosSe incluyeron 163 pacientes (57% mujeres) con una edad media de edad de 7,6 años (desviación estándar 4,4) (fig. 1).
En 110 casos (67,5%), el estudio se realizó por síntomas sugestivos de EC, en 16 (9,8%) por cribado de grupos de riesgo y en 37 (22,7%) por otros motivos. El 20% de los niños diagnosticados en este período tuvieron antecedentes familiares de EC (12% de primer grado y 8% de segundo grado). Respecto a enfermedades asociadas a EC, cinco niños presentaban diabetes mellitus, dos, trastorno del espectro autista y dos síndrome de Down. No encontramos otras asociaciones en nuestra muestra.
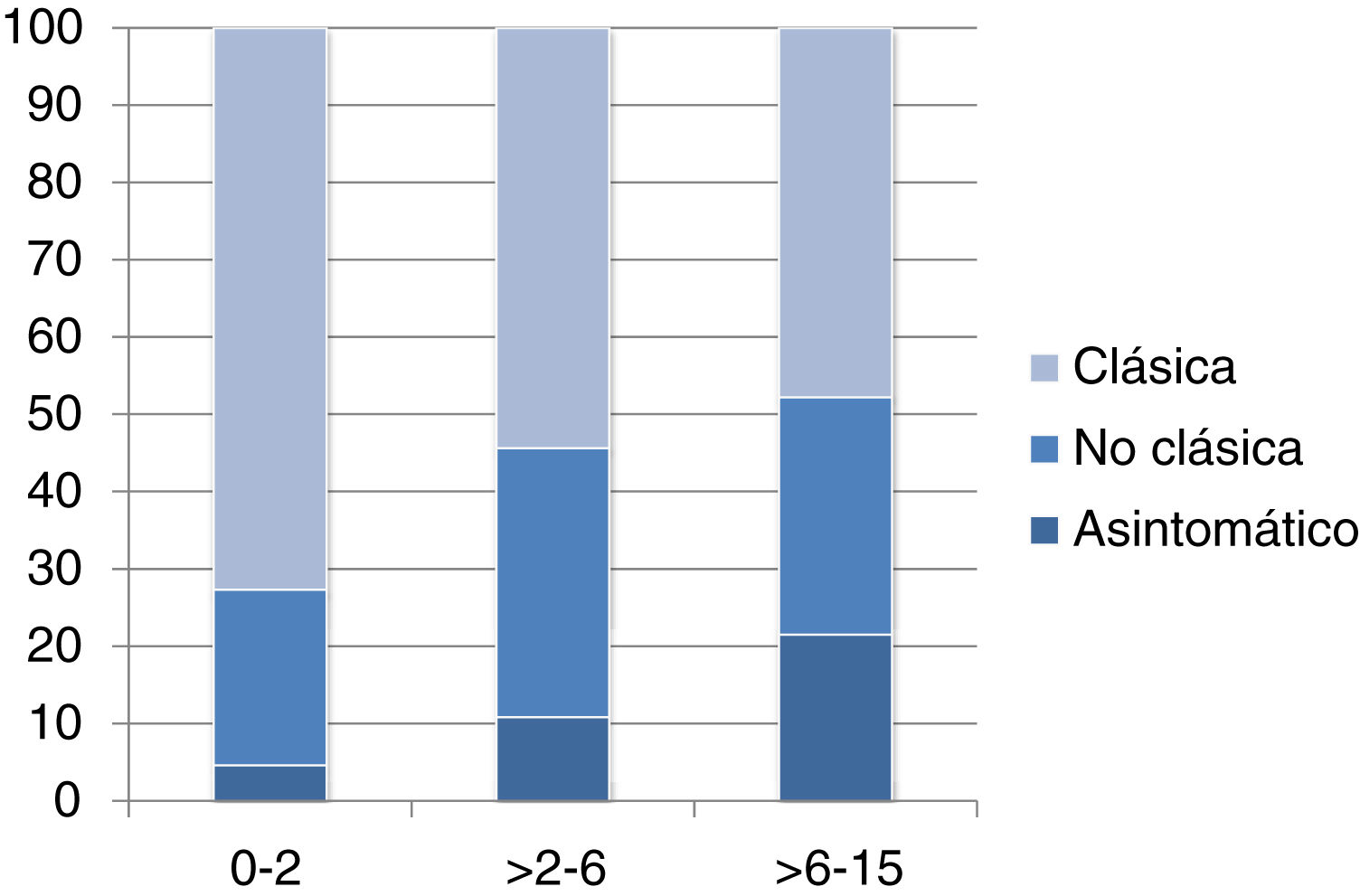
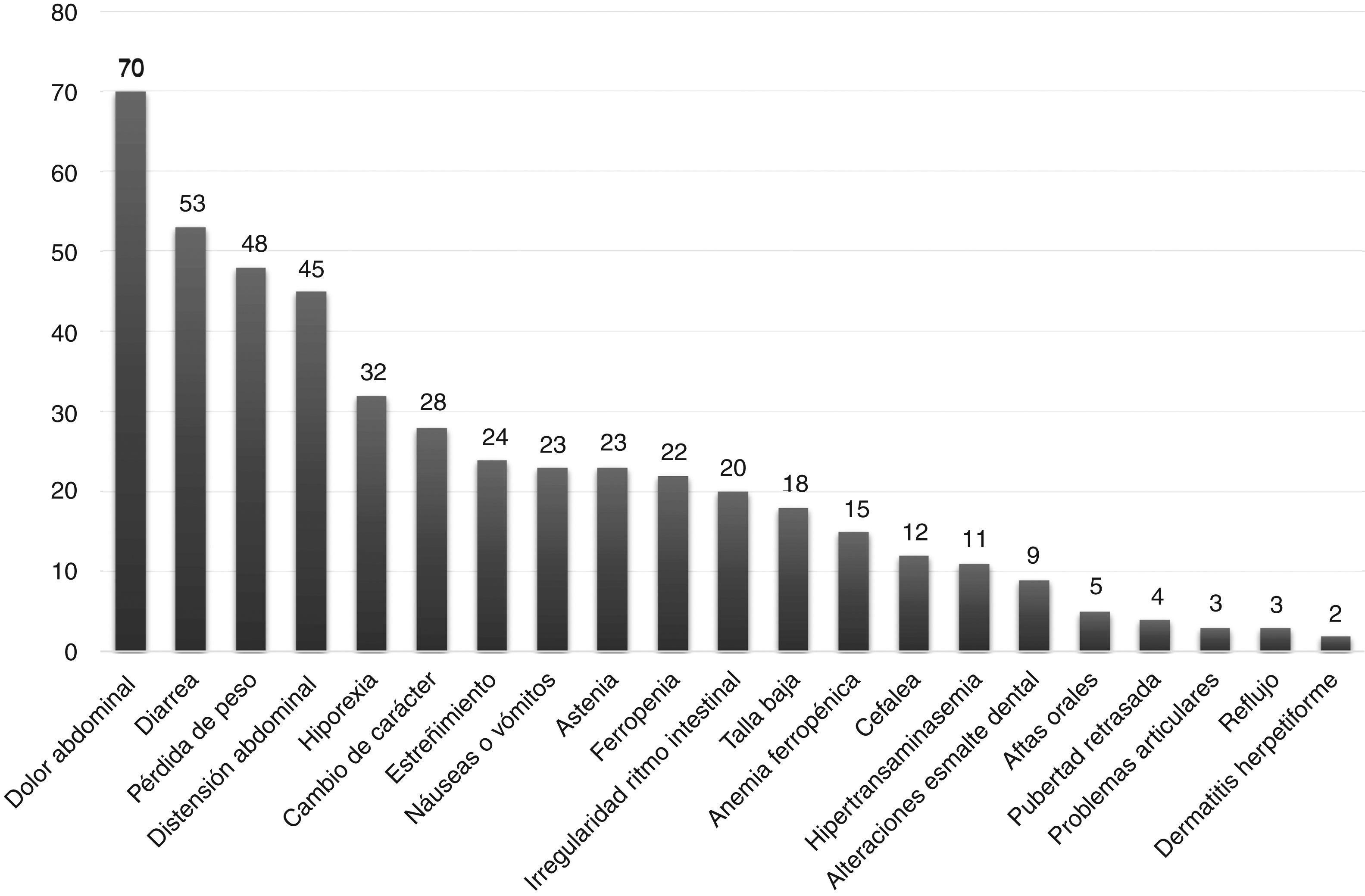
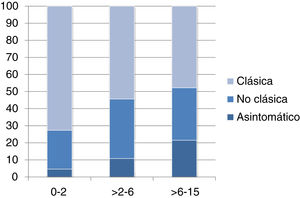
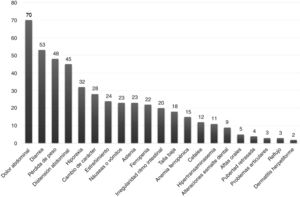
La forma de presentación fue: 78 pacientes forma clásica (47,8%), 50 forma no clásica (30,7%) y 35 asintomáticos (21,5%). Hubo diferencias significativas (p 0,006) en la forma de presentación según la edad (fig. 2), siendo más frecuentes las formas clásicas en los niños menores de dos años y las asintomáticas en los mayores de seis años. Con relación a los síntomas de presentación en el momento del diagnóstico, los resultados se muestran en la figura 3, destacando como más frecuente el dolor abdominal crónico.
Respecto a la antropometría en el momento del diagnóstico (tabla 1), se observa que los parámetros antropométricos son inferiores en los pacientes menores o iguales de dos años, de forma estadísticamente significativa.
Comparación de los z scores de las variables antropométricas al diagnóstico entre los menores o igual a dos años y los mayores
| Parámetro antropométrico | Menores o igual dos años | Mayores dos años | Sig.* |
|---|---|---|---|
| z score peso (media ± DE) (rango) | -1,24 ± 1,17(-3 a 1,3) | - 0,22 ± 1,02(-2,9 a 2,8) | 0,000 |
| z score talla (media ± DE) (rango) | - 1,03 ± 1,3(-4 a 0,77) | - 0,39 ± 1,3(-4,04 a 2,96) | 0,032 |
| z score IMC (media ± DE) (rango) | -0,75 ± 1,2(-2,74 a 1,9) | 0,03 ± 1,09(-2,22 a 2,9) | 0,024 |
En todos los centros se determinaron los niveles de IgA total y AATG IgA como primer escalón diagnóstico, siendo positivos en todos los casos, excepto en cuatro pacientes que presentaban déficit de IgA, y estando elevados por encima de 10 veces los valores normales en 134 pacientes (82%). Los AAE IgA se realizaron en 130 pacientes (79,6% del total), siendo positivos el 95,5%. Del total de los AAE realizados, en 25 casos (19%) no se realizaron en una muestra de suero diferente a los AATG. El haplotipo HLA constaba en 154 pacientes (95%), siendo un 83% DQ2, 9% DQ8, 6% DQ2/DQ8 y el 2% restante un alelo DQ2A o DQ2B.
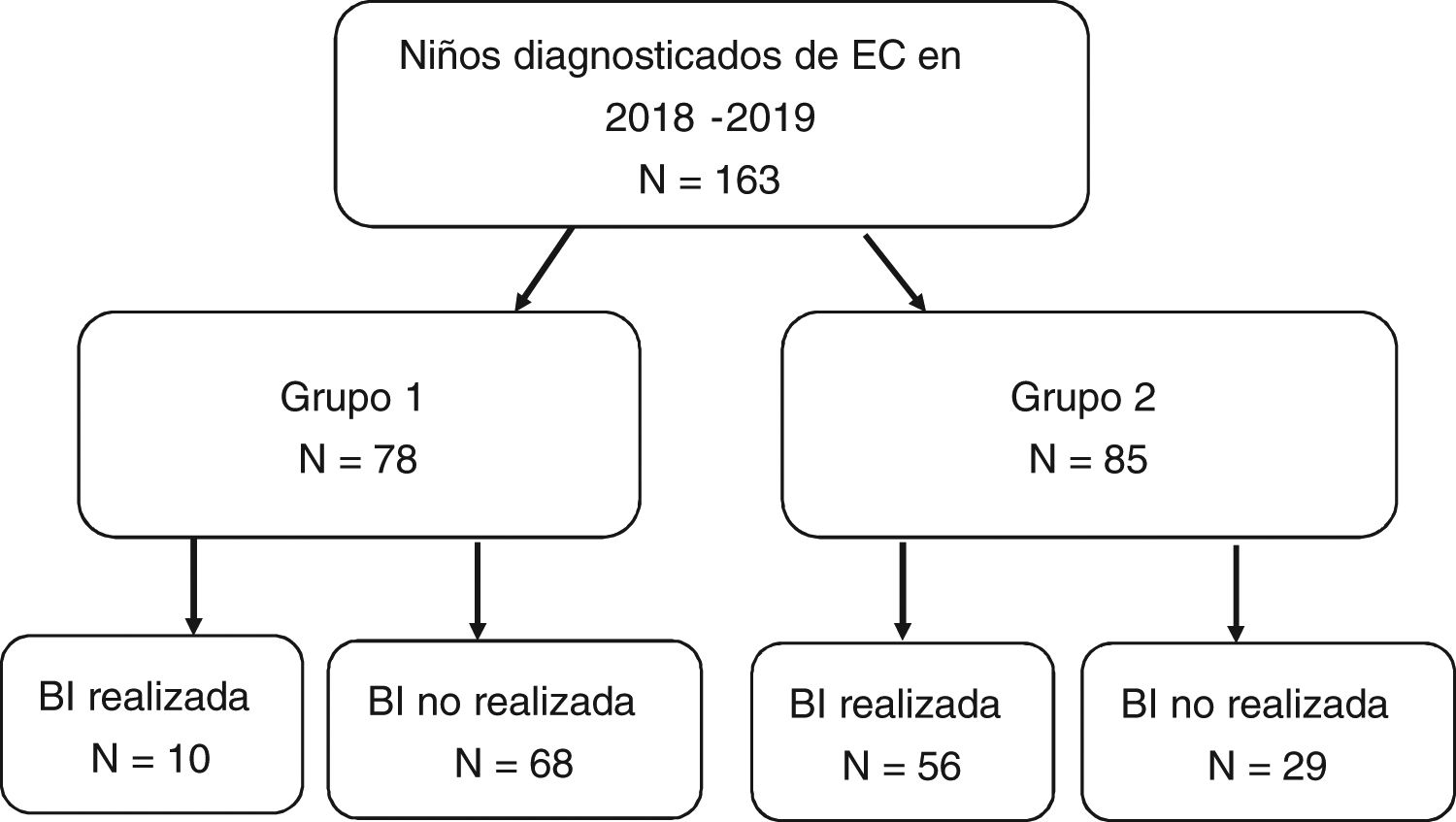
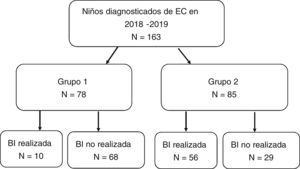
La realización de la BI en relación con los criterios ESPGHAN-2012 se expresa en la figura 4. El grupo 1, que incluía los pacientes que cumplían los criterios para no realizar BI, constó de 78 casos (47,9% del total). De ellos, la BI se realizó en 10 casos por manifestaciones clínicas leves (en muchos de estos casos por presentar sólo dolor abdominal inespecífico). El grupo 2 comprendió los restantes 85 pacientes, en los que estaba indicado realizar BI por no cumplir todos los criterios. Sin embargo, en 29 casos (17,8% del total) no se realizó BI estando indicada. Estos 29 pacientes se detallan en la tabla 2. Observamos que la realización de BI fue estadísticamente inferior en los hospitales secundarios frente a los terciarios, con un porcentaje de BI de 29,1% en los primeros y un 58,3% en centros terciarios (p < 0,05). Los hallazgos histológicos de los pacientes que disponían de BI, según la clasificación de Marsh-Oberhuber, fueron: dos pacientes grado 2 (3%), 15 grado 3a (22,7%), 28 grado 3b (42,4%) y 21 grado 3c (31,8%). No encontramos correlación entre los niveles de AATG y el grado de clasificación histológica.
Realización o no de biopsia intestinal (BI) en relación con el cumplimiento de los criterios diagnósticos ESPGHAN 2012.
Grupo 1: Cumplen criterios ESPGHAN-2012 para ser diagnosticados sin BI (síntomas, AATG elevados 10 veces por encima de lo normal, AAE positivos en muestra de sangre diferente y HLA compatible).
Grupo 2: No cumplen criterios ESPGHAN-2012 para ser diagnosticados sin BI.
Casos en que estaba indicada la biopsia intestinal para el diagnóstico de enfermedad celíaca y no se realizó
| Motivo | Número de pacientes | |
|---|---|---|
| Según criterios ESPGHAN 2012 | Según criterios ESPGHAN 2020 | |
| Pacientes asintomáticos con AATG elevados (>10xLSN) y AAE positivos (cribado realizado por ser población de riesgo): | ||
| Por antecedentes familiares de primer grado | 3 | 0 |
| Diabetes mellitus tipo 1 | 3 | 3 |
| Síndrome de Down | 1 | 0 |
| Cribado realizado por otros motivos | 2 | 0 |
| No disponer de determinación de AAE | 12 | 12 |
| AAE no realizados en muestra de sangre diferente | 3 | 3 |
| AATG elevados (>10xLSN) pero AAE negativos | 2 | 2 |
| Déficit de IgA | 2 | 2 |
| Clínica clásica y elevación de AATG 3xLSN. Rechazo de los padres a realizar BI. | 1 | 1 |
| Total (%) | 29 (17,8%) | 23 (14,7%) |
AATG: Anticuerpos anti-transglutaminasa tisular. LSN: Límite superior de la normalidad. AAE: Anticuerpos antiendomisio. IgA: Inmunoglobulina A. BI: Biopsia intestinal.
Al aplicar los criterios ESPGHAN 2020, observamos que podríamos haber prescindido del estudio del HLA en 138 pacientes: los 154 en que se determinó menos 16 en que sí habría estado indicado por realizarse como cribado en grupos de riesgo. Por otro lado, 21 pacientes más de nuestra muestra no hubieran precisado BI al estar asintomáticos, pero cumplir criterios serológicos, pasando de 78 (47,9%) a 99 pacientes (60,7%). Además, de los 29 pacientes incorrectamente diagnosticados, según las guías de 2012, había nueve niños asintomáticos con AATG muy elevados y AAE positivos en muestra de sangre diferente. Si tenemos en cuenta que tres eran diabéticos, los restantes seis pacientes estarían correctamente diagnosticados, según las guías 2020, pues no precisarían BI actualmente. Se pasaría, por tanto, de un 17,8% de diagnósticos que no cumplían estrictamente los criterios a un 14,7%.
DiscusiónEl presente estudio ha tenido como principal objetivo revisar el grado de cumplimiento de los criterios diagnósticos ESPGHAN de EC y, secundariamente, analizar las características clínicas y epidemiológicas actuales de la EC en los pacientes pediátricos de nuestro medio, en una amplia muestra que incluye diferentes centros. Al incluir centros de nivel terciario y secundario hemos querido reflejar la realidad de cómo se está diagnosticando la EC a partir de los cambios que implicó la aparición de los criterios ESPGHAN 2012. Observamos que el diagnóstico de EC se realiza a todas las edades, siendo la media de edad de nuestros pacientes mayor a la descrita en otros estudios15,16, lo que indica la tendencia a diagnosticarse cada vez en edades más avanzadas17-19. Se observa también un predominio en niñas, con un porcentaje similar al descrito en otros estudios15,19-22. El alto porcentaje de casos con antecedentes familiares (20%) indica que en nuestros centros se investiga de forma activa a los familiares de los casos diagnosticados, y es similar a los descritos previamente23,24. Además, la diabetes mellitus25 y el síndrome de Down26 son las asociaciones más frecuentemente descritas. No observamos otras asociaciones descritas de riesgo como síndrome de Turner o de Williams, probablemente por la menor frecuencia de estos trastornos.
Respecto a la presentación clínica, las manifestaciones más frecuentes fueron las denominadas clásicas (47,8%), con dolor abdominal crónico, diarrea crónica, pérdida de peso y distensión abdominal, siendo la forma de presentación más común en niños menores de dos años, al igual que reflejan estudios previos20,24,27,28. Queremos destacar el amplio número de pacientes que presentaban síntomas o signos menos típicos (30,7%), como ferropenia, alteraciones del esmalte dental, aftas, hipertransaminasemia, talla baja, etc. Encontramos 21,5% de casos asintomáticos, en los que el estudio serológico se había realizado por tener antecedentes familiares, pertenecer a un grupo de riesgo o por otros motivos, y fueron más frecuentes a mayor edad. Se observa que las formas asintomáticas son cada vez más frecuentes, oscilando entre 16-28% de los casos, según diferentes estudios17,29.
Cabe destacar que la mayor frecuencia de síndrome malabsortivo en niños pequeños condiciona también que la afectación antropométrica sea mayor en estos, con unos z scores de peso, talla e IMC significativamente inferiores que en los niños mayores de dos años, aspectos ya descritos previamente16,20.
Centrándonos en el diagnóstico, hemos observado que en todos los centros existía accesibilidad a realizar AATG, siendo realizados como screening inicial en todos los casos. Encontramos además, un elevado porcentaje de pacientes (82%) que presentaban AATG elevados 10 veces por encima de lo normal, siendo el porcentaje superior al descrito en otros estudios30. Sin embargo, en relación con los AAE, al tratarse de una técnica de inmunofluorescencia indirecta que requiere personal específico y es más cara y costosa de realizar31, hemos objetivado que algunos centros tienen dificultades para realizarlos. Se aprecia además, que la recomendación de determinar los AAE en una muestra de sangre diferente a los AATG no se cumplió en el 19% de los casos.
Respecto a la determinación de HLA, estaba ampliamente disponible en los diferentes centros y se realizó en el 95% de los pacientes. En nuestra serie, la distribución de los alelos HLA resultó acorde con lo descrito previamente, salvo una frecuencia discretamente mayor de DQ8 (9% frente al 5% descrito en población española)20,32. En consonancia con los nuevos criterios de 2020, se ha visto que no añade certeza al diagnóstico si se cumplen el resto de criterios10. Por tanto, dado que es una técnica de alto coste y su interés radica en su valor predictivo negativo, se ha propuesto reservar su determinación para estudio de grupos de riesgo o casos dudosos.
El porcentaje de casos que cumplían criterios para evitar BI, según los criterios de 2012, fue de 47,9%, concordante con otros estudios que describen que la realización de la BI podría evitarse en aproximadamente la mitad de los pacientes24. Sin embargo, en 10 de estos casos de nuestro estudio se llevó a cabo la BI por tener síntomas leves o inespecíficos, agrupándose estos casos en los centros terciarios, probablemente por la mayor accesibilidad a la realización de endoscopias en dichos centros. El hecho de haber realizado BI a pesar de tener clínica pudo estar justificado en casos de presentación no clásica, en los que se ha descrito menor especificidad que la forma clásica24. En este estudio, la no realización de BI en 29 casos en los que estaba indicada, se debió en gran parte a pacientes diagnosticados en hospitales comarcales, con AATG muy elevados, pero que estaban asintomáticos, no disponían de determinación de AAE, o bien estos no se habían realizado en una muestra de sangre diferente.
Si aplicamos los criterios 2020, observamos que seis pacientes de este grupo pasarían a estar correctamente diagnosticados al encontrarse asintomáticos y cumplir criterios serológicos. En el resto de casos, debería replantearse el diagnóstico y valorar evolutivamente si son susceptibles de realizar una provocación con gluten a lo largo de su seguimiento. Esto resalta la importancia de disponer de la determinación de AAE en todos los centros, ya que para diagnosticar EC sin BI es esencial aplicar de forma estricta los criterios establecidos para evitar sobrediagnosticar, ya que esto implicaría instaurar una dieta sin gluten de por vida sin ser necesario.
La principal limitación del presente estudio es que al tener un carácter retrospectivo y multicéntrico, las determinaciones de AATG y AAE no se han realizado en un mismo laboratorio.
Como conclusiones, la EC se diagnostica en un amplio rango de edades en nuestro medio. Las manifestaciones clásicas siguen siendo más frecuentes, sobre todo en menores de dos años, siendo las formas no clásicas y los asintomáticos más frecuentes en edades más avanzadas. Respecto al diagnóstico, las discrepancias observadas en la aplicación de los criterios ESPGHAN-2012 se deben fundamentalmente a la diferente accesibilidad a la realización de AAE y BI endoscópica entre diferentes centros. Con los criterios ESPGHAN actuales de 2020, la proporción de pacientes que podrían ser diagnosticados sin BI se ampliaría hasta en torno a un 60%, y en nuestra muestra los pacientes incorrectamente diagnosticados disminuirían de un 18,4% a un 14,7%. Sin embargo, es necesario ser cautos y aplicar de forma estricta los criterios serológicos, asegurando la determinación de AAE en todos los centros. Harán falta estudios más amplios y de corte prospectivo para evaluar y validar estos nuevos criterios diagnósticos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.