Conocer las concentraciones plasmáticas de homocisteína total en niños afectados de diabetes mellitus tipo 1 y su relación con el control de la enfermedad.
Material y métodosEstudiamos un total de 46 pacientes con edades comprendidas entre los 4 y los 19 años. Las variables analizadas fueron: sexo, edad, estadio puberal de Tanner, índice de masa corporal, años de evolución de la enfermedad, autocontrol, patologías asociadas, homocisteína total (tHcy), ácido fólico, vitamina B12, hemoglobina glucosilada (HbA1c), perfil lipídico y función renal.
ResultadosLa homocisteína (Hcy) media fue de 5,48±1,64μm/l, similar a la de nuestra población control.
Analizando el estadio puberal mediante la escala Tanner encontramos una correlación positiva con la Hcy. Los años de evolución de la diabetes oscilaban entre 0,4 y 15, con una media de 5,77±3,69, sin correlación con la Hcy. La HbA1c media era del 7,35 %, sin correlación con la Hcy. Las concentraciones de ácido fólico y vitamina B12 fueron similares a la población control. El lipidograma de nuestros pacientes fue normal, sin relación con las cifras de Hcy. No hallamos correlación entre el índice de filtrado glomerular (GFR) y la Hcy.
ConclusionesUn correcto control clínico de los niños afectados de diabetes mellitus tipo 1 parece garantizar una homocisteinemia total normal, sin diferencias significativas con los individuos sanos de su misma edad y ambiente social.
To measure the plasma levels of total homocysteine (tHcy) in children with type I diabetes mellitus and their relationship with the control of the disease.
Material and methodsWe studied a total of 46 patients with ages between 4 and 19 years. The analyzed variables were: sex, age, puberty stage by Tanner, BMI, years of evolution of the illness, self-momitoring, associated diseases, tHcy, folic acid, vitamin B12, glycosylated haemoglobin (HbA1c), lipid profile and renal function.
ResultsThe mean tHcy was of 5.48±1,64μm/l, similar to that in our control population.
There was a positive correlation with tHcy when analyzing the puberty stage by the Tanner scale. The years of evolution of diabetes varied between 0.4 and 15, with a mean of 5.77 ± 3.69, with no correlation with tHcy. The glycosylated haemoglobin mean was 7.35 %, with no correlation with tHcy. The levels of folic acid and vitamin B12 were similar to the control population. The lipid profile of our patients was normal, with no association with tHcy levels. There was no correlation between GFR and tHcy.
ConclusionsA clinically correct control of children with diabetes mellitus type 1, appears to ensure a normal total homocysteinemia, with no significant differences with the healthy individuals of the same age and social environment.
La homocisteína (Hcy) es un aminoácido sulfurado que se origina a partir de la metionina, un aminoácido esencial que procede de las proteínas de la dieta. La metionina y sus derivados están involucrados en múltiples y fundamentales procesos metabólicos.
La homocisteína se encuentra en el plasma en diversas formas moleculares: homocisteína en forma libre (1 %), unido a proteínas plasmáticas (albúmina) por un puente disulfuro, que constituye aproximadamente el 70% de la homocisteína total (tHcy). Forma dímeros gracias a su reactividad con los grupos sulfhidrilo, que es lo que se denomina homocistina; y estableciendo puentes disulfuro con la molécula de cisteína. La suma de todas estas formas es lo que denominamos tHcy, y es a lo que nos referimos con el término homocisteína.
Con independencia de las hiperhomocisteinemias de origen genético, las concentraciones de tHcy en la población general están condicionados por factores tales como la edad, sexo, raza, estado vitamínico, hábitos dietéticos, estilos de vida (tabaco, alcohol, actividad física, etc.), índice de masa corporal (IMC), ingesta de algunos fármacos, enfermedades renales y otros de menor importancia como la tensión arterial o la concentración de lípidos plasmáticos. En la práctica, los principales determinantes de la homocisteinemia entre la población general sana son la concentración de ácido fólico plasmático y la de la vitamina B12, por este orden. Concentraciones superiores a 15μm/l se consideran hiperhomocisteinemia1.
Está comprobado que la hiperhomocisteinemia es un factor de riesgo independiente para el desarrollo de ateroesclerosis, y se ha relacionado con diversas patologías como enfermedad cerebrovascular, renal y demencia senil2. La diabetes mellitus es un factor de riesgo no sólo para el desarrollo de patología vascular, sino también para su rápida progresión. Se cree que la hiperglucemia es la principal causa de las complicaciones microvasculares en pacientes diabéticos y también tiene un importante papel en la aparición de enfermedad macrovascular. Para el desarrollo de esta patología influyen, además, otros factores entre los que se encuentra la hiperhomocisteinemia. La asociación en un paciente diabético de hiperglucemia e hiperhomocisteinemia parece tener un efecto sinérgico en la patogénesis del daño del endotelio vascular3, lo cual tiene gran importancia en la prevención del daño vascular. Estudios con pacientes diabéticos adultos muestran una mayor incidencia de hiperhomocisteinemia respecto a la población control, y es aún mayor en aquéllos afectados de nefropatías3. El objetivo de nuestro estudio es conocer las concentraciones plasmáticas de tHcy en niños diabéticos y su relación con el control de la enfermedad.
Material y métodosSe estudiaron 46 pacientes (16 mujeres y 30 hombres) afectados de diabetes mellitus tipo 1 de edades comprendidas entre 4 y 19 años, con una media de 12,14 ± 4,06 años.
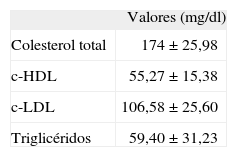
Las variables analizadas fueron las siguientes: sexo; edad; estadio puberal según la escala de Tanner; IMC; años de evolución de la enfermedad; autocontrol de la diabetes mediante el cuaderno diario de pacientes (consideramos dos grupos: control bueno y malo); patologías asociadas o complicaciones surgidas; homocisteinemia en μmol/l; ácido fólico en ng/ml; vitamina B12 en pg/ml; hemoglobina glucosilada (HbA1c); colesterol total, colesterol de las lipoproteínas de alta densidad (c-HDL), colesterol de las lipoproteínas de baja densidad (c-LDL) y triglicéridos; función renal (índice de filtrado glomerular [GFR]), y microalbuminuria.
La toma de muestras de sangre se realizó en todos los casos coincidiendo con la extracción necesaria para otras pruebas complementarias y de acuerdo con el comité de ética del hospital. Se extrajeron 2ml de sangre venosa recogida en tubos con anticoagulante EDTA, previamente enfriados y protegidos de la luz ambiental. Se trasladaron al laboratorio a temperatura entre 0 y 4°C (sobre hielo) y posteriormente se procedió al centrifugado de la muestra, separando el plasma en tiempo inferior a 1h. Si el ensayo se realizaba durante las 72h siguientes a la recogida de la muestra, se almacenaban a una temperatura entre 2 y 8°C. Si se retrasaba más, las muestras se congelaban a una temperatura de −40°C hasta el momento del análisis.
Para la determinación de tHcy se utilizó inmunoensayo de polarización de la fluorescencia (FPIA) con el analizador Imx de la casa Abbott Científica S.A. El fundamento de la técnica se basa en la reducción de todas las formas de homocisteína presentes en el plasma y su conversión enzimática en S-adenosil-homocisteína (SAH).
Para el análisis estadístico de las variables cualitativas se han utilizando tablas de frecuencias y gráficos de sectores y barras. Para las variables cuantitativas se han calculado medidas como el mínimo, máximo, media, desviación estándar y el intervalo de confianza de la media del 95 %.
Se ha realizado un estudio bivariante para ver la relación, si existiese, entre las variables analizadas y la homocisteína y se ha estudiado, además, la posible correlación entre dichas variables. Para las variables cualitativas se ha aplicado el test de chi al cuadrado de Pearson, con la corrección de Yates o la prueba exacta de Fisher (en tablas 2 × 2), cuando no se cumplen las hipótesis para la chi al cuadrado. Si una variable toma valores cualitativos y otra cuantitativos se ha aplicado la prueba de la t de Student (2 categorías de variable cualitativa) o el análisis de varianza (más de 2 categorías de variable cualitativa), si se cumplen las hipótesis necesarias (normalidad de los datos, igualdad de varianzas y de escala intervalo). Para variables cuya distribución no se ajusta a la normal, se han utilizado las técnicas no paramétricas de la U de Mann–Whitney (2 categorías de variable cualitativa) o el test de Kruskal-Wallis (más de 2 categorías de variable cualitativa) dependiendo del número de categorías de la variable en estudio. En los casos en los que el análisis de la varianza o el test de Kruskal-Wallis es significativo, se han realizado las comparaciones múltiples entre los grupos para ver cuales de ellos son significativamente diferentes entre sí. Si ambas variables toman valores cuantitativos se ha aplicado el coeficiente de correlación; si ambas son de escala intervalo, se ha aplicado el coeficiente de correlación de Pearson; en caso contrario, se ha usado el coeficiente de rangos de Spearman.
El índice de confianza escogido para los diferentes test es del 95%.
Como grupo control se empleó una muestra de niños sanos españoles, con edades comprendidas entre 0 y 14 años. La determinación de tHcy se realizó en nuestro hospital con la misma técnica empleada en niños diabéticos.
ResultadosLa homocisteína plasmática media de todo el grupo fue de 5,48 ± 1,64μm/l, con un rango de 3,16-12,81μm/l; sin diferencias estadísticamente significativas entre la tHcy de los niños diabéticos y la de los niños sanos de control (5,43μm/l).
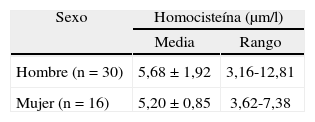
Los 30 pacientes varones (65,22%) tenían una homocisteína de 5,68 ± 1,92μm/l (rango: 3,16-12,81μm/l) y las 16 pacientes mujeres (34,78%) tenían una homocisteinemia de 5,2 ± 0,85μm/l (rango: 3,62-7,38μm/l) sin diferencias entre ambos grupos (tabla 1).
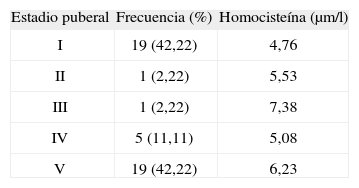
La edad media del grupo fue de 12,14 ± 4,06 años, con rango entre 4,34 y 19 años de edad. El estadio puberal (Tanner) estaba distribuido como se recoge en la tabla 2, con una correlación positiva entre el valor de homocisteína y el estadio puberal, de tal modo que al aumentar este último, aumenta la homocisteinemia.
La media del IMC fue de 19,56 ± 2,67, con un rango de 13,77-26,18, observando una correlación positiva entre la homocisteinemia y el IMC.
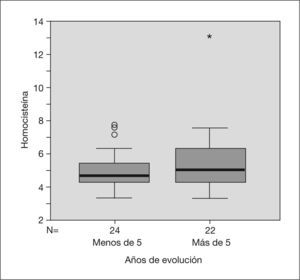
Los años de evolución de la enfermedad oscilaban entre 0,4 y 15 años, con una media de 5,77 ± 3,69 años y no se detectó correlación entre las concentraciones de tHcy y los años de evolución de la enfermedad.
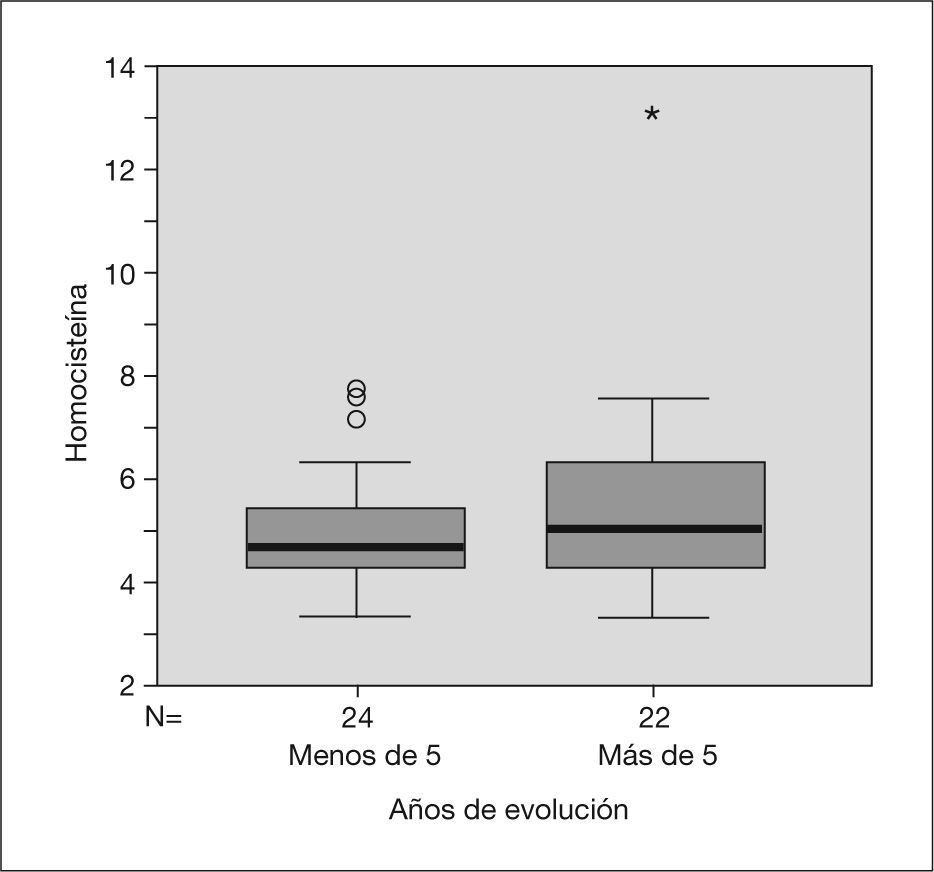
En los individuos con más de 5 años de evolución (n = 24) la homocisteinemia fue de 5,813μm/l, y en aquéllos con menos de 5 años de evolución, de 5,180μm/l. No fue significativa, tampoco, la diferencia entre ambos grupos (fig. 1).
Mediante el examen del cuaderno de autocontrol de glucemias de cada niño diabético, únicamente 5 casos presentaban un mal control, con una homocisteinemia media de 5,144μm/l. El resto de los pacientes (n = 40), con buen control de glucemia, tenían homocisteinemias medias de 5,534μm/l, sin diferencias entre ambos grupos.
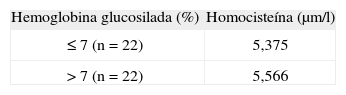
Como marcador más objetivo del control de la enfermedad se estudió la hemoglobina glucosilada (HbA1c). Los valores de todo el grupo oscilaban entre 4,8 y 12,6%, con una media del 7,35%. Según las concentraciones de HbA1c fueran mayores o menores del 7 % establecimos dos subgrupos cuyos valores de tHcy se muestran en la tabla 3. No encontramos diferencias en las concentraciones de tHcy según las cifras de HbA1c ni tampoco correlación entre ambas variables.
La función renal de los pacientes según el índice de filtrado glomerular (GFR) presentaba una media de 128,17ml/min/1,73 m2 (rango: 83,2-200ml/min/1,73 m2). Sólo uno de los niños estaba afectado de microalbuminuria. No se identificó correlación entre GFR y tHcy.
Ninguno de los niños presentaba anticuerpos antitiroideos ni otro tipo de patología asociada.
Los valores plasmáticos de los principales determinantes de la tHcy, el ácido fólico y la vitamina B12, estaban dentro del rango de la normalidad en todos los pacientes. La concentración media de ácido fólico fue de 10,49 ± 6,85ng/l, con un rango entre 4,00 y 36,50ng/l. La media de vitamina B12 en sangre fue de 798,55 ± 497,50ng/l, con un rango de 298–2581ng/l. No se encontró correlación entre ambas variables y la homocisteína total.
El perfil lipídico de los niños no puso en evidencia ningún caso con valores fuera del rango de la normalidad y ninguno de los componentes (colesterol total, c-HDL, c-LDL y triglicéridos) mostró correlación con la tHcy (tabla 4).
DiscusiónLos valores medios de tHcy de la muestra fueron normales (5,48 ± 1,64μmol/l, con un rango de 3,16-12,81μmol/l), sin diferencias en función del sexo ni con el grupo control de niños sanos, pero se aprecia una correlación positiva entre la concentración de tHcy y el estadio puberal de Tanner y con el IMC, como es de esperar de acuerdo con los datos de la bibliografía5. En este sentido, nuestros pacientes se comportan como la población general. Otros estudios de adolescentes diabéticos sí muestran cifras de tHcy mayores que los pacientes control5, lo que puede poner en evidencia un mayor número de complicaciones debido a una evolución de la enfermedad más larga.
En nuestros pacientes, el tiempo de evolución de su diabetes era ya significativo, con una media de 5,77 y un rango de 0,4-15 años, pero a pesar de ello, no se ha encontrado correlación entre el tHcy del grupo total y los años de evolución de la enfermedad, con independencia de que ésta fuera mayor o menor de 5 años. Los resultados de otros estudios al respecto son contradictorios. Hay autores que muestran hiperhomocisteinemia en niños con más de 10 años de evolución de la enfermedad6, mientras que otros no muestran relación4, y eso es debido seguramente a la calidad del control de la enfermedad. En adultos, los resultados son distintos, ya que la mayoría son enfermos de larga evolución y con desarrollo de complicaciones propias de la diabetes, con lo que la concentración de tHcy está más influida por las propias complicaciones que por los años de evolución.
Todos los niños estudiados presentaban concentraciones de ácido fólico y vitamina B12 en rangos normales y similares a nuestra población control. Wiltshire et al7 encontraron que los pacientes diabéticos tenían mayores concentraciones séricas de folato y de vitamina B12, lo que seguramente reflejaría cambios en la dieta respecto a los niños sanos.
Para valorar el control de la enfermedad se utilizó como marcador biológico la HbA1c en sangre, puesto que su formación es una reacción lenta que depende de la concentración de glucosa en sangre y continúa de forma irreversible durante toda la vida del eritrocito. Evidencia la glucemia promedio durante los 2–3 meses previos y, por tanto, a concentraciones más bajas, mejor control metabólico de la enfermedad. En sujetos normales, las cifras suelen ser inferiores al 7 %. En diabéticos, cifras del 6–9 % representan un buen control metabólico, el 9-12% es aceptable y valores superiores al 12% indican mal control. En nuestra serie los valores oscilaban entre 4,8 y 12,6%, con una media de 7,35 ± 1,60% y no se encontró correlación entre los valores de tHcy y la HbA1c. Distribuidos los pacientes según que sus cifras de HbA1c fueran mayores o menores de 7, no se encontraron tampoco diferencias significativas entre la homocisteinemia de ambos grupos. Otro estudio en niños españoles obtuvo medias de Hba del 9,2 % sin relación con las concentraciones de tHcy4. Sin embargo, en otro grupo de niños italianos se obtuvieron concentraciones medias de HbA1c de 7,3 ± 1,9% que sí mostraban correlación con la homocisteinemia5. Estas diferencias podrían deberse a la alimentación seguida por los pacientes y al manejo de la insulinoterapia. El hecho de que nuestra muestra tenga cifras de HbA1c bajas apoya el buen control de la enfermedad, tanto con la dieta como con el tratamiento con insulina.
Para valorar el control general diario de la enfermedad, se utilizó el cuaderno de autocontrol de cada paciente, y no se encontraron diferencias en los valores de tHcy en niños con control bueno o malo de la enfermedad. Un total de 5 de los niños presentaron un mal autocontrol de las glucemias; su tHcy fue de 5,144μmol/l. El resto de los niños (n = 40) tenía cifras de tHcy media de 5,534 (p = 0,687).
Ninguno de los niños de nuestra serie presentaba insuficiencia renal, aunque sí observamos casos de hiperfiltración glomerular. No encontramos asociación entre la homocisteinemina y el GFR, a pesar de que la tHcy se elimina fundamentalmente por el riñón8, pero es posible que la tHcy sea normal en la diabetes temprana debido a la hiperfiltración glomerular9. Estudios en adolescentes diabéticos muestran asociación entre la tHcy plasmática y la microalbuminuria5. En nuestro grupo, únicamente un niño presentaba microalbuminuria, pero su tHcy era similar a la media para su edad (niña de 10 años con tHcy de 4,60μmol/l).
Todos nuestros pacientes tenían, asimismo, un perfil lipídico normal y sin relación con los valores de tHcy, lo que parece indicar un excelente control de su enfermedad.
En conclusión, podemos afirmar que un correcto control clínico de los niños afectados de diabetes mellitus tipo 1, parece garantizar una homocisteinemia total normal, sin diferencias significativas con los individuos sanos de su misma edad y ambiente social.
Con un adecuado control clínico y analítico, no existe correlación entre las cifras de homocisteína con los años de evolución de la enfermedad, ni con los valores de HbA1c, ni con el filtrado glomerular. Esto sugiere que la buena evolución de la enfermedad impide la aparición de alteraciones de riesgo relacionadas con el metabolismo de la homocisteína en estos pacientes.
Un control regular de las concentraciones sanguíneas de homocisteína total en los niños diabéticos es un buen instrumento para detectar situaciones de riesgo vascular en edades más avanzadas de la vida.