Recientemente, algunas publicaciones pediátricas han planteado la utilidad de la terapia intracoronaria con células progenitoras autólogas (CPA) derivadas de la médula ósea en niños con miocardiopatía dilatada (MCD) e insuficiencia cardiaca. Describimos la utilidad de este tratamiento en dos lactantes con MCD e insuficiencia cardiaca grave, que habían sido trasladados a nuestro centro para valoración de trasplante cardiaco.
Pacientes y métodosEl primer paciente es un varón de 3 meses de edad y 4kg de peso. El segundo es un varón de 4 meses de edad y 5kg de peso. En el momento del ingreso, ambos presentan mala situación clínica (NYHA IV), dilatación y disfunción sistólica grave (fracción de eyección [FE]<30%) del ventrículo izquierdo y marcada elevación de NT-proBNP, precisando tratamiento con ventilación mecánica e inotrópicos en perfusión iv. Tras movilización con G-CSF durante 4 días, las CPA se obtienen desde la sangre periférica mediante leucocitoaféresis. Se administran por vía intracoronaria, con catéter-balón y técnica de stop-flow, 6,15 x 106 células CD34-positivas/kg en el primer paciente, y 10,55 x 106 células CD34-positivas/kg en el segundo.
ResultadosYa en la primera semana tras el procedimiento, la situación clínica de los pacientes mejora significativamente y en la ecocardiografía se objetiva una disminución importante de la dilatación del ventrículo izquierdo. Un mes después, también se evidencia mejoría importante en la FE (>40%) y de los niveles de NT-proBNP, que se mantiene en el tiempo posteriormente. No obstante, en el primer paciente, a los cuatro meses del tratamiento, el ventrículo izquierdo se dilata de nuevo y empeora discretamente su función, aunque sin existir repercusión clínica significativa.
ConclusionesLa terapia intracoronaria con CPA puede suponer una alternativa terapéutica en niños, especialmente de corta edad, con MCD y fallo cardiaco, pudiendo disminuir la mortalidad en lista, mejorar su situación clínica y ofrecer mayor tiempo de espera para recibir un órgano idóneo o, incluso, hacer innecesario el trasplante.
Some paediatric publications have recently raised the value of intracoronary therapy with autologous bone marrow-derived progenitor cells (APCs) in children with dilated cardiomyopathy (DCM) and heart failure. We describe the usefulness of this treatment in two infants with severe DCM and heart failure, who had been transferred to our hospital for cardiac transplant evaluation.
Patients and methodsThe first patient was a 3 months old male weighing 4kg. The second was a 4 months old male weighing 5kg. At the time of admission, both were in poor clinical condition (NYHA IV), with severe dilation and systolic dysfunction (ejection fraction [EF]<30%) of the left ventricle and marked elevation of NT-proBNP, requiring treatment with mechanical ventilation and inotropic iv infusion. After mobilization with G-CSF for 4days, APCs were obtained from peripheral blood by leukocytapheresis, administering them by a slow intracoronary bolus injection using a stop-flow technique (6.15x106 CD34-positive cells/Kg in the first patient, and 10.55x106 CD34-positive cells/Kg in the second).
ResultsSince the first week after the procedure, clinical status of patients improved and echocardiography showed a decrease in left ventricular dilation. A month later, there was a significant improvement in EF (> 40%) and NT-proBNP levels, subsequently maintained throughout the follow-up. However, four months later in the first patient, the left ventricle dilated again and its function slightly worsened, but without any significant impact in his clinical status.
ConclusionsIntracoronary therapy with APCs can be an alternative in children, especially infants, with DCM and heart failure. It can reduce the waiting list mortality, improve clinical status and provide more time on the waiting list to receive a suitable organ, or even to make transplantation unnecessary.
La miocardiopatía dilatada (MCD) es la miocardiopatía más frecuente a nivel mundial. En el paciente pediátrico, la incidencia anual es de 0,5-1,2 casos por 100.000, con una presentación 8-12 veces más frecuente en lactantes (4,4 por 100.000) que en niños mayores1. Con respecto a la etiología, el 57-68% de las MCD en el paciente pediátrico son idiopáticas, lo que contribuye al mal pronóstico global de esta patología. Fisiopatológicamente, la enfermedad se caracteriza por la existencia de una dilatación del ventrículo izquierdo, que presenta una configuración esférica, y por la presencia de una función sistólica disminuida. En consecuencia, los pacientes presentan signos típicos de insuficiencia cardiaca congestiva (taquicardia, taquipnea, sudoración, hepatomegalia, edemas, fallo de medro) y, en fases avanzadas, de bajo gasto sistémico (oliguria, disminución del nivel de conciencia, hipotensión arterial). La MCD asocia una morbimortalidad elevada, y aproximadamente un tercio de los niños diagnosticados mueren o son trasplantados en el primer año tras el diagnóstico, sin que haya variado el pronóstico a pesar de las mejoras en los últimos años en los tratamientos médicos o de soporte circulatorio mecánico2–4. En este contexto, y considerando el pronóstico limitado del trasplante cardiaco a largo plazo y la ausencia de suficientes donantes pediátricos, se justifican todas aquellas estrategias que pretendan mejorar los tratamientos médicos actuales e investigar opciones terapéuticas alternativas.
En los últimos años son cada vez más los estudios que demuestran que el tratamiento con células progenitoras, tanto administradas por vía intracoronaria como por vía intramiocárdica, puede conseguir una mejoría sostenida de la función cardiaca en los pacientes adultos con cardiopatía isquémica aguda o crónica5–12. Recientemente, algunos autores también han confirmado que la administración intracoronaria de células madre puede mejorar la función cardiaca y la situación clínica de pacientes pediátricos en situación de insuficiencia cardiaca grave, secundaria a miocardiopatía dilatada o a cardiopatía congenita13–16. No obstante, los mecanismos por los que la terapia celular puede ser beneficiosa siguen siendo actualmente tema de estudio y discusión. En este sentido, el potencial de las células administradas para diferenciarse en tejido vascular y/o en cardiomiocitos, podría inducir la revascularización local y la formación de nuevo tejido contráctil, favoreciendo de esta manera la recuperación de la función miocárdica16.
En este artículo se describen los resultados iniciales del tratamiento con células progenitoras autólogas (CPA) derivadas de la médula ósea, en dos lactantes en situación de insuficiencia cardiaca grave y portadores de una miocardiopatía dilatada.
Pacientes y métodosLos pacientes estudiados son dos lactantes, varones, diagnosticados de MCD e insuficiencia cardiaca grave, que habían sido inicialmente referidos a nuestro centro para considerar la realización de un trasplante cardiaco.
El paciente 1 es un lactante de 3 meses y 4kg de peso. El diagnóstico de MCD con insuficiencia cardiaca se había establecido 24h antes del traslado a nuestra unidad, aunque los signos clínicos habían comenzado 2 semanas antes, en forma de taquipnea, sudoración, vómitos y disminución de la ingesta. No existían antecedentes familiares de miocardiopatía ni de infecciones recientes. Al ingreso el paciente estaba en mala situación clínica, precisando ventilación mecánica, inotrópicos (dopamina y milrinona) en perfusión iv y diuréticos de asa. La radiografía de tórax mostraba cardiomegalia (índice cardiotorácico 0,67) importante con edema pulmonar. El estudio ecocardiográfico objetivó una marcada dilatación del ventrículo izquierdo (36,2mm; Z+3,5) con datos de disfunción sistólica grave (fracción de eyección [FE] 30%). Bajo monitorización hemodinámica con el monitor PiCCO 2™ (PULSION medical systems, Munich, Germany) se confirmó la presencia de gasto cardiaco disminuído (IC 2,5 L/min/m2), con disminución del volumen sistólico (VSI 20mL/m2) y de la contractilidad ventricular (dP/dt 400mmHg). Los niveles plasmáticos de NT-proBNP estaban muy aumentados (33.484 pg/mL). La resonancia magnética (RM) cardiaca confirmó la dilatación y la disfunción ventricular detectadas en la ecografía, sin encontrarse alteraciones de señal en el miocardio sugestivas de miocarditis. Se obtuvieron biopsias endomiocárdicas, no detectando datos de inflamación miocárdica en los estudios anatomopatológicos, ni presencia de microorganismos en el tejido por técnica de PCR. Otras causas sistémicas y metabólicas de miocardiopatía también fueron excluidas.
El paciente 2 es un lactante de 4 meses de edad y 6kg de peso. El diagnóstico de MCD e insuficiencia cardiaca se había establecido 3 semanas antes del traslado a nuestra unidad. En este caso tampoco existían antecedentes de miocardiopatía en la familia ni de infección reciente. En el momento del ingreso el paciente estaba en aceptable situación clínica, aunque la radiografía de tórax mostraba una marcada cardiomegalia (índice cardiotorácico 0,71) y la ecocardiografía una dilatación severa del ventrículo izquierdo (39mm; Z+5,7) con datos de disfunción sistólica grave (FE 23%). Ni en la RM ni en la biopsia endomiocárdica se encontraron datos de miocarditis. Durante el procedimiento de toma de biopsias, el paciente sufrió una perforación cardiaca con taponamiento, siendo necesaria la realización de una esternotomía urgente para reparar el ventrículo. Tras esta complicación, la función ventricular empeoró significativamente, siendo necesario el tratamiento con ventilación mecánica e inotrópicos en perfusión iv (milrinona y adrenalina a dosis baja). La monitorización hemodinámica con el monitor PiCCO 2™ confirmó la situación de gasto cardiaco disminuido (IC 2,6 L/min/m2), con volumen sistólico (VSI 25mL/m2) y contractilidad (dP/dt 300mmHg) disminuidos. Los niveles plasmáticos de NT-proBNP también estaban muy aumentados (49.467 pg/mL). En los siguientes días la situación clínica del paciente progresivamente mejoró, pudiéndose extubar y suspender los inotrópicos iv. No obstante, la dilatación y la disfunción sistólica del ventrículo izquierdo permanecieron severamente alteradas, siendo los datos ecocardiográficos similares a los del ingreso.
En ambos casos, antes de establecerse la indicación de inclusión en lista de trasplante cardiaco, se propuso la infusión intracoronaria de CPA como tratamiento compasivo. Se obtuvo la aprobación del Comité de Ética local, así como el consentimiento informado por escrito de los padres.
Inicialmente, los pacientes recibieron tratamiento con G-CSF (10 mcg/Kg/día), durante 4 días, con objeto de favorecer la movilización de las células progenitoras desde la médula ósea a la sangre periférica. Al quinto día de iniciar el tratamiento con G-CSF, y tras canalizarse un catéter de doble luz (6,5 Fr) en la vena yugular interna derecha, se realizó en la UCI una leucocitoaféresis (COBE® Spectra Apheresis System-AutoPBSC). En el primer paciente la duración del procedimiento fue de 135 minutos y la dosis obtenida de células CD34+ fue de 6,15 x 106/kg. En el segundo paciente la duración del procedimiento fue de 140 minutos y la dosis obtenida de células CD34+ fue de 10,55 x 106/kg. Tras un proceso de purificación y centrifugación (1.800rpm x 10 minutos) las células fueron resuspendidas en un volumen final de 10mL en el paciente 1 y 7,5mL en el paciente 2, para su posterior administración. A las dos horas tras la finalización de la leucocitoaféresis, los pacientes se trasladaron a la sala de hemodinámica. Bajo anestesia general, se canalizó la arteria femoral con un introductor 4F. Posteriormente se realizó coronariografía selectiva, comprobándose las características anatómicas de la circulación y la dominancia coronaria. Tras sondaje selectivo de ambas coronarias, se administraron las CPA, distribuyendo la dosis total a partes iguales entre la arteria coronaria derecha, la descendente anterior y la circunfleja. Para la infusión se utilizó la técnica de stop-flow con catéter balón descrita previamente, con objeto de enlentecer el flujo coronario durante la administración y, de esta manera, favorecer la adhesión y potencial transmigración de las CPA a través del endotelio hasta el miocardio5–14. Para ello, se infló a baja presión el balón del catéter, causando una obstrucción transitoria al flujo coronario, inyectando distalmente y de manera lenta (aprox 1 minuto/vaso) las CPA. Durante el procedimiento se monitorizó de manera continua el electrocardiograma, la presión arterial invasiva y la pulsioximetría. En ambos pacientes se registraron elevaciones transitorias del segmento ST, sin trastornos significativos del ritmo cardiaco, pudiéndose completar el procedimiento con éxito.
ResultadosTras la administración de las CPA, los pacientes ingresaron en la UCIP. Se realizó monitorización continua electrocardiográfica y de las constantes vitales, y se extrajeron controles analíticos periódicos. En ambos pacientes se pautó tratamiento anticongestivo con digoxina (5-7,5 mcg/kg/día), captopril (1mg/kg/día), carvedilol (0,08mg/kg/día), espironolactona (2mg/kg/día) y furosemida (1mg/kg/día), junto con sildenafilo (2mg/kg/día) y eritropoyetina (dos veces en semana), estos dos últimos por su potencial repercusión sobre el anidamiento y posterior diferenciación de las células administradas16. Además, durante las primeras 48h tras el procedimiento también se les administró heparina sódica (15 U/kg/h) y nitroglicerina a dosis baja (0,1 mcg/kg/min) en perfusión iv continua.
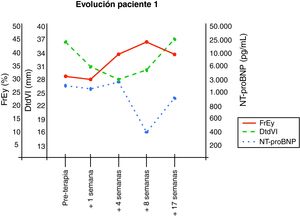
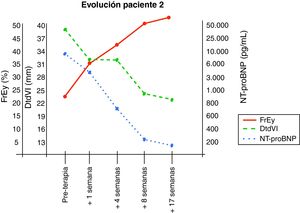
En la tabla 1 y en las figuras 1 y 2 se resume la evolución en ambos pacientes de los parámetros clínicos, analíticos y ecocardiográficos más relevantes.
Resumen de la evolución en ambos pacientes de los principales parámetros clínicos, analíticos y ecocardiográficos
| Pre-tratamiento | 1 semana | 4 semanas | 8 semanas | 17 semanas | |
|---|---|---|---|---|---|
| Paciente 1 | |||||
| Peso (kg) | 5 | 5,2 | 5,4 | 6,6 | 8,2 |
| DtdVI (mm) | 36,2 | 31 | 28 | 30,2 | 36,5 |
| FE (%) | 30 | 28 | 38 | 43 | 40 |
| ProBNP (pg/mL) | 33.484 | 1.935 | 2.149 | 444 | 960 |
| Paciente 2 | |||||
| Peso (kg) | 6 | 6,6 | 7 | 8,2 | 9 |
| DtdVI (mm) | 39 | 31,7 | 31,5 | 24,3 | 23 |
| FE (%) | 22,8 | 36,8 | 42,8 | 54 | 60 |
| ProBNP (pg/mL) | 11.146 | 4.251 | 730 | 213 | 143 |
DtdV: diámetro telediastólico del ventrículo izquierdo; FE: fracción de eyección.
En el paciente 1, la extubación y la suspensión de la milrinona se realizaron a las 24h del procedimiento, administrándose posteriormente una dosis de levosimendan (0,2 mcg/kg/min en 24h). En las primeras 24h se observaron pequeñas depresiones del segmento ST en el electrocardiograma, así como discreta elevación de los niveles plasmáticos de troponina I, normalizándose ambos en los siguientes 4 días. Bajo monitorización continua con dispositivo PiCCO 2™, se objetivó una rápida mejoría hemodinámica a lo largo de la primera semana tras el tratamiento con células madre, con significativa elevación del gasto cardiaco (IC 3,6-4,2 L/min/m2), del volumen sistólico (32mL/m2) y de la contractilidad (dP/dt 700mmHg/s). La ecocardiografía también confirmó una reducción de un 15% en el grado de dilatación del ventrículo izquierdo (31mm) en la primera semana, aunque con una FE persistentemente disminuida (28%). En este contexto, la situación clínica del paciente también mejoró rápidamente y fue dado de alta de la UCI a los 8 días, y a su domicilio a los 22 días tras el tratamiento, no considerando necesaria su inclusión en lista de trasplante. Posteriormente, se le realizaron controles mensuales en la consulta externa del Servicio de Cardiología Infantil. Durante los 4 meses de seguimiento, el paciente permaneció en buena situación clínica. Progresivamente la dilatación ventricular y la FE fueron mejorando. La FE aumentó desde el 28% a la semana del procedimiento hasta el 38% al mes y el 43% a los dos meses, y la dilatación ventricular disminuyó desde 36,2mm hasta 30,2mm. Durante el periodo de seguimiento, los valores plasmáticos de NT-proBNP disminuyeron desde 1.935 pg/mL hasta 444 pg/mL. En la revisión realizada a los 4 meses, se detectó un nuevo aumento de la dilatación ventricular (36mm) y de los niveles de NT-proBNP (996 pg/mL) con discreto empeoramiento funcional (FE 36%), aunque el paciente se mantenía en buena situación clínica y con buena ganancia ponderal.
En el paciente 2, la extubación se realizó en la sala de cateterismo, y aunque antes del procedimiento no estaba siendo tratado con inotrópicos iv, también recibió una dosis de levosimendan tras la terapia con CPA. En este caso, no se presentaron alteraciones en el electrocardiograma ni en los niveles plasmáticos de troponina I tras el procedimiento. Como en el primer paciente, ya en la primera semana la ecocardiografía demostró disminución de un 18% en el grado de dilatación ventricular (31,7mm) y elevación de la FE (desde 22,8% hasta 36,8%). Su situación clínica también mejoró rápidamente y fue dado de alta de la UCIP a los 2 días y a su domicilio a los 8 días, evitándose también su inclusión en lista de trasplante. En las visitas de seguimiento posteriores, la dilatación ventricular y la FE continuaron mejorando progresivamente. La FE se elevó hasta 43% al mes y hasta 54% a los dos meses, y la dilatación ventricular disminuyó hasta 25mm. Los niveles de NT-proBNP se normalizaron (< 300 pg/mL) a los 2 meses del procedimiento. Actualmente, cuatro meses después del tratamiento, sigue en buena situación clínica, habiéndose normalizado la función sistólica (FE 60%) y el diámetro del ventrículo izquierdo (24mm).
DiscusiónAunque aproximadamente el 30% de los pacientes con insuficiencia cardiaca y miocardiopatía dilatada se recuperan, en el 60% de ellos el fallo cardiaco no mejora o continua empeorando. En este sentido, publicaciones recientes han demostrado que hasta el 40% de los pacientes pediátricos con MCD sintomática, no mejoran con tratamiento anticongestivo17, siendo el trasplante cardiaco su única opción terapéutica. Aunque la supervivencia a largo plazo del paciente pediátrico trasplantado de corazón ha mejorado significativamente en la última década, ofreciendo actualmente una supervivencia a los 5 años de aproximadamente el 70% y a los 10 años del 60%, los prolongados tiempos de espera en lista como consecuencia de la escasez de donantes continúan generando una nada despreciable morbimortalidad, especialmente en el grupo de los lactantes18,19. Esto justifica el espectacular incremento en la utilización de diferentes dispositivos de asistencia ventricular de media y larga duración en la edad pediátrica, como por ejemplo el dispositivo EXCOR Berlin Heart, que se han convertido en terapias de soporte fundamentales para mantener a los pacientes pediátricos, especialmente a los lactantes, hasta el trasplante cardiaco20–23. En este contexto, parecen justificados todos los esfuerzos destinados a mejorar los tratamientos médicos y, sobretodo, los encaminados a encontrar terapias alternativas para estos pacientes.
En el año 2001 se demostró la capacidad de las células progenitoras pluripotenciales (CD34+) derivadas de médula ósea de diferenciarse en cardiomiocitos24. Posteriormente, se han realizado diferentes estudios en adultos con patología isquémica aguda o crónica, demostrándose en la mayoría de ellos que la administración de CPA por vía intracoronaria puede reducir la extensión de la lesión isquémica y mejorar la función contráctil del ventrículo dañado5–12. Sin embargo, actualmente la experiencia con esta terapia en el paciente pediátrico es muy escasa. En el año 2009 Olgunturk et al. publicó la utilidad de la terapia intracoronaria con CPA en dos pacientes de 9 y 6 años, diagnosticados desde hacía 6 y 1 año, respectivamente, de insuficiencia cardiaca y MCD. La dosis administrada de células CD34+ fue de 1,96 x 106/kg en el primer paciente y de 0,27 x 106/kg en el segundo, observándose en ambos casos mejoría suficiente y sostenida de la función ventricular como para no precisar trasplante cardiaco13. También en el año 2009 Rupp et al describieron mejoría de la función ventricular en un paciente de 2 años con MCD e insuficiencia cardiaca, tras la administración intracoronaria de CPA (dosis CD34+: 10,15 x 106/kg)14. Existen además otras dos publicaciones en la literatura, en las que se describe la utilidad de esta terapia en dos pacientes pediátricos que sufren disfunción ventricular sistólica grave, de origen hipóxico-isquémico, como complicación postoperaotoria de cirugías de cardiopatía congénita15,16.
Sin embargo, los mecanismos por los cuales la terapia con CPA puede mejorar la función ventricular en pacientes con MCD sigue siendo motivo de discusión. En este sentido se han propuesto diferentes mecanismos, como la inducción de la revascularización local mediante la diferenciación en tejido vascular, y la formación de nuevo tejido contráctil mediante la diferenciación en cardiomiocitos. También se ha sugerido que, probablemente por mecanismos paracrinos, las células progenitoras administradas podrían estimular a otras células progenitoras locales, así como inhibir la apoptosis y mejorar la función de las células miocárdicas dañadas y/o disfuncionantes, favoreciendo su recuperación funcional y promoviendo el remodelado del miocardio enfermo24–28.
Por otro lado, tanto la vía de administración como el tipo y la dosis de células progenitoras administradas parecen influir de manera determinante en el porcentaje de células que consigue anidar en el interior del miocardio y diferenciarse en otros tejidos y, por tanto, en la eficacia de la terapia29. En este sentido, la limitada experiencia con este tratamiento, y las particularidades relativas a la vía de administración y a las características de las diferentes patologías en las que se ha empleado, no han permitido que se establezcan recomendaciones sobre la dosis terapéutica de células progenitoras. Por otro lado, aunque la administración intramiocárdica consigue un mayor porcentaje de anidamiento en comparación con la vía intracoronaria, la mayor invasividad de la técnica la hace menos viable en muchas ocasiones, especialmente en el paciente pediátrico30.
En nuestro caso, se empleó la terapia intracoronaria con células progenitoras (CD34+) autólogas derivadas de la médula ósea, obtenidas de sangre periférica por técnica de leucocitoaféresis, en dos pacientes en situación de insuficiencia cardiaca grave que habían sido diagnosticados recientemente de miocardiopatía dilatada. La decisión de administrar este tratamiento se fundamentó en base a su potencial para inducir la regeneración miocárdica y la recuperación de la función ventricular, y a la viabilidad y relativa seguridad del mismo, con la esperanza de demorar o evitar el trasplante cardiaco12.
La evolución de nuestros pacientes tras recibir el tratamiento fue favorable. En los dos casos, la cantidad de CPA CD34+ administrada fue relativamente alta, en comparación con las descritas en la literatura (paciente 1: 6,15 x 106/kg; paciente 2 10,55 x 106/kg), lo que pudo influir en la buena evolución posterior. Por otro lado el tratamiento previo con G-CSF para movilizar los progenitores, también pudo influir en la mejoría de la función ventricular, pues se sabe que los cardiomiocitos y otra serie de células cardiacas poseen receptores para este factor de crecimiento, y que el tratamiento de pacientes con infarto de miocardio con G-CSF también puede mejorar la función cardiaca31,32. Por ello, el tratamiento combinado de G-CSF e infusión intracoronaria de CPA podría tener un efecto sinérgico. Aunque algunos estudios han señalado que la administración intracoronaria de CPA puede generar embolismos en la microcirculación coronaria, precipitando cuadros de isquemia aguda y/o arritmias graves, en nuestro caso no se presentaron complicaciones durante el procedimiento33.
En ambos pacientes, nos llamó significativamente la atención la precocidad con la que se objetivaron datos clínicos, ecocardiográficos y analíticos que traducían mejoría de la función ventricular. En este sentido, ya a los siete días del tratamiento se pudo comprobar una mejoría significativa de la situación clínica de los pacientes, junto con elevación de la fracción de eyección y descenso de los niveles plasmáticos de NT-proBNP. No obstante, la disminución en el grado de dilatación ventricular fue más progresiva a lo largo de los siguientes meses. Quizá la mejoría inicial observada pudiera estar más en relación con la los efectos paracrinos de la terapia arriba descritos, mientras que la reducción de la dilatación ventricular podría ser consecuencia de sus efectos sobre la regeneración miocárdica y el remodelado ventricular.
Obviamente, teniendo en cuenta las limitaciones de las actuales técnicas de diagnóstico, no podemos estar seguros de que la mejoría de la función ventricular en ambos pacientes sea consecuencia directa e inequívoca de la acción de la terapia celular, ni de si el mecanismo fundamental por el que mejoraron fue la regeneración del miocardio. Ni siquiera podemos precisar la rentabilidad de la técnica con respecto al porcentaje de células administradas que finalmente anidaron en el miocardio, ya que no se dispuso de ningún método de marcaje que facilitara la posterior identificación de las mismas mediante técnicas de imagen. Sin embargo, el hecho de que en ambos pacientes se hubiera descartado razonablemente el origen infeccioso/inflamatorio de la dilatación miocárdica, mediante RM y biopsia endomiocárdica, hace que la recuperación espontánea de la función cardiaca fuera poco probable y que, por tanto, la terapia con CPA hubiera tenido un papel determinante en su mejoría.
La dilatación ventricular detectada en el primer paciente a los 4 meses del procedimiento es inquietante y, a pesar de que su situación clínica no empeoró, planteamos la posibilidad de que, quizás, la mejoría en la función ventricular inducida por la terapia celular pueda ser pasajera en determinados pacientes, pudiéndose plantear en este caso la reinfusión periódica de CPA como tratamiento de soporte a largo plazo34.
En reumen, el tratamiento con CPA derivadas de la médula ósea administradas por vía intracoronaria podría convertirse en una alternativa terapéutica en niños, especialmente de corta edad, con miocardiopatía dilatada y fallo cardiaco. En comparación con el trasplante cardiaco la terapia con CPA ofrece ventajas importantes como la inmediatez y la mínima invasividad necesarias para obtener las células, la relativa facilidad y seguridad con la que se pueden administrar, y que el tratamiento con inmunosupresores no es necesario. Además, al mejorar la situación clínica y funcional, podría disminuir la mortalidad en lista de espera, demorando o, lo que sería más deseable, evitando el trasplante cardiaco, con el impacto tan positivo que ello supondría para el paciente, su familia y el conjunto de la sociedad, lo que disminuiría en gran medida los costes asistenciales de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.