En la última década el tratamiento de las hiperlipidemias se ha modificado sustancialmente debido a la introducción de las estatinas, fármacos inhibidores de la enzima hidroximetilglutaril-coenzima A (HMG-CoA) reductasa. Su uso ha sido demostrado como eficaz y seguro en adultos, por lo que podría ser también beneficioso para el tratamiento de las hipercolesterolemias durante la infancia. Hasta el momento, seis han sido utilizadas en población infantil: lovastatina, fluvastatina, pravastatina, simvastatina, atorvastatina y más recientemente rosuvastatina. En algunos de estos estudios el seguimiento ha sido de 3 años y, sobre su uso en la infancia, puede concluirse que a la vez de seguras, son muy eficaces para reducir las concentraciones tanto de colesterol total (CT) como de colesterol de las lipoproteínas de baja densidad (c-LDL) en sangre.
In the last decade treatment of hyperlipidemia has changed substantially due to the use of statins, a group of drugs that inhibit the enzyme hydroxymethylglutaryl coenzyme-A-reductase (HMG-CoA reductase). Its use has been proven to be efficient and safe in adults, and could also be of benefit in the treatment of hypercholesterolemia in children. Up to date, six of these drugs have been used in children: lovastatin, fluvastatin, pravastatin, simvastatin, atorvastatin and more recently, rosuvastatin. In some of these studies the follow-up has been up to three years and, as regards their use during childhood, we can conclude that they are safe as well as efficient in reducing the blood levels of total cholesterol (TC) and low-density lipoproteins cholesterol (LDL-C).
El tratamiento farmacológico de las anomalías lipídicas de alto riesgo, sobre todo el aumento de las concentraciones de colesterol de las lipoproteínas de baja densidad (c-LDL), ha producido grandes avances en la prevención y tratamiento de la enfermedad arteriosclerótica en el adulto. Existe hoy día suficiente grado de evidencia para afirmar que el proceso arteriosclerótico se inicia en la infancia y que su tasa de progresión se ve enormemente incrementada por las hiperlipemias y su gravedad. La prevalencia de las anomalías de los lípidos está aumentando en la población infantil, sobre todo con relación a su asociación con la epidemia de obesidad y síndrome metabólico que vivimos. Dado que se ha demostrado que el sobrepeso en niños y sus anomalías lipídicas asociadas persisten hacia la vida adulta, la epidemia de riesgo cardiovascular elevado puede pronto desembocar en una epidemia de enfermedad cardiovascular temprana. A pesar de que para revertir esta tendencia es esencial y prioritario llevar a cabo estrategias eficaces de medicina preventiva y salud pública, algunos individuos seleccionados que presentan anomalías lipídicas más extremas o asociadas a condiciones de alto riesgo pueden beneficiarse de un tratamiento farmacológico.
Aunque ha existido una reticencia general al uso de tratamiento farmacológico para tratar las dislipemias en los niños, se va incrementando la evidencia que sugiere una efectividad y seguridad a corto y medio plazo similares a las del adulto. Los propósitos de este artículo son examinar el proceso arteriosclerótico en niños y su relación con las anomalías de los lípidos; revisar y discutir las guías de tratamiento existentes y sus limitaciones, destacar los conocimientos actuales en relación al tratamiento con estatinas en niños y ofrecer recomendaciones generales para su uso durante la infancia en sujetos de alto riesgo.
POBLACIONES PEDIÁTRICAS DE RIESGOHabitualmente, las hiperlipidemias se clasifican en dos grupos: primarias y secundarias1,2. La población pediátrica que más podría beneficiarse de una reducción de su conentración de colesterol es la afectada de una hiperlipidemia primaria. Éstas son debidas a anormalidades genéticas que producen alteraciones en el metabolismo de los lípidos (tabla 1)3–7. La más común es la hipercolesterolemia familiar monogénica (HFM), que se asocia fundamentalmente a elevaciones de c-LDL, aunque en ocasiones se observan también concentraciones altas de triglicéridos y bajas de colesterol de las lipoproteínas de alta densidad (c-HDL). Su patrón de herencia es autosómico dominante, con una frecuencia que oscila desde 1:500 de la forma heterocigótica a 1:1.000.000 de la homocigótica. En ambas, una deficiente función de los receptores de las LDL, produce una elevación del colesterol total (CT) entre 230–500mg/dl en la forma heterocigótica, y mucho mayor, 600–1.200mg/dl, en la homocigótica. El gen responsable de dicha enfermedad se localiza en el brazo corto del cromosoma 19 y se conocen más de 850 mutaciones en individuos con HFM. El déficit familiar de apolipoproteína B (apo-B) presenta unas alteraciones bioquímicas y unas manifestaciones clínicas similares. Estas dos entidades están claramente relacionadas con un aumento de la morbilidad y mortalidad precoz debidas a efectos adversos cardiovasculares, fundamentalmente enfermedad coronaria precoz. En la HFM homocigótica no tratada, los pacientes suelen morir en la segunda década de la vida; este desenlace se retrasa hasta la cuarta década de la vida en las otras dos entidades. Además de las hiperlipidemias primarias, existen otras que aparecen en diferentes situaciones clínicas y que también podrían requerir tratamiento, sobre todo por aparecer asociadas a otros factores de riesgo cardiovascular como obesidad, hipertensión o alteraciones del metabolismo de la glucosa. Una entidad representativa sería el síndrome metabólico, definido como la asociación de varios factores de riesgo precursores de enfermedad cardiovascular arterioesclerótica y de diabetes tipo 2, en la que tanto la obesidad como la insulinorresistencia desempeñan un papel patogénico primordial8. Otras condiciones médicas asociadas también con hipercolesterolemias susceptibles de ser tratadas con estatinas son: la diabetes, el trasplante de órganos, la infección por el virus de la inmunodeficiencia humana (VIH), el lupus eritematoso sistémico y el síndrome nefrótico.
Hiperlipidemias primarias
| Genes y cromosomas | |
| Hipercolesterolemias | |
| Hipercolesterolemia familiar | rLDL (cr 19) |
| Apo-B-100 defectuosa familiar | apo-B (cr 2) |
| Hipercolesterolemia asociada a NARC14 | PCSK9 (cr 1) |
| Sitosterolemia5 | ABCG5 y ABCG8 (cr 2) |
| Hipercolesterolemia autosómica recesiva6 | ARH (cr 1) |
| Hipercolesterolemia asociada con litiasis biliar7 | CYP7A1 (cr 8) |
| Hipercolesterolemias asociadas a variantes raras de apo-E | apo-E |
| Hipercolesterolemia poligénica | Desconocido |
| Hiperlipidemias mixtas | |
| Hiperlipemia familiar combinada | Desconocido |
| Hiperlipoproteinemia tipo III (disbetalipoproteinemia) | apo-E, LH |
apo: apolipoproteína; NARC1: neural apoptosis-regulated convertase 1.
Además de por la elevada y temprana mortalidad causada por estas entidades, la necesidad de un tratamiento precoz en estos pacientes ha sido sustancialmente apoyada por estudios que han constatado que la enfermedad cardiovascular arterioesclerótica se inicia en la infancia y es progresiva9,10. La anomalía anatomopatológica más temprana en la arteriosclerosis es la estría lipídica, que representa el cúmulo de macrófagos cargados de lípidos en la íntima arterial. Con la edad, continúa el depósito de lípidos con proliferación de los macrófagos y células de músculo liso, que migran hacia la íntima y media arterial y que forman la placa fibrosa, que con el tiempo se puede romper, iniciando la cascada de eventos que conducen a la formación del trombo. Es bien conocido que autopsias realizadas a jóvenes soldados muertos en combate en las guerras de Corea y Vietnam mostraron presencia de enfermedad arteriosclerótica, con la limitación de no haber conocido sus factores de riesgo cardiovascular asociados. Posteriores estudios necrópsicos sí tuvieron en cuenta dichos factores de riesgo, y los relacionaron con el estadio de la lesión arteriosclerótica en jóvenes. El estudio multicéntrico PDAY mostró que factores de riesgo cardiovascular, tales como las concentraciones elevadas de colesterol y las cifras de presión arterial, se asociaban con la extensión de las estrías grasas y placas fibrosas en sujetos jóvenes11. El Bogalusa Heart Study12, un estudio epidemiológico basado en la comunidad, ha recogido una gran cantidad de información sobre factores de riesgo cardiovascular durante la infancia. Mostró que las estrías grasas estaban presentes en casi el 50 % de los individuos en la infancia y en el 85 % de jóvenes adultos y que la prevalencia de las placas fibrosas aumentó del 8 % en la infancia al 69% de los jóvenes adultos. La extensión de las lesiones arterioscleróticas se correlacionó de forma significativa con las elevaciones del c-LDL, los triglicéridos, la presión arterial y el índice de masa corporal. Incluso se han descrito lesiones arterioscleróticas tempranas en autopsias de fetos de madres hipercolesterolémicas, así como la progresión de estas lesiones en la aorta abdominal, a pesar de tener estos niños concentraciones normales de CT. Esto sugiere que la exposición a un ambiente hiperlipémico en el útero puede haber programado a estos niños para una arterioesclerosis acelerada. Todos estos hallazgos indican que dicho proceso se inicia en la infancia y que las anomalías de los lípidos contribuyen al mismo. Aunque los estudios anatomopatológicos son útiles, se ven limitados por la baja mortalidad entre pacientes pediátricos y por el escaso rigor con el que se pueden determinar los factores de riesgo en los sujetos autopsiados. Por ello, se requieren métodos no invasivos para medir in vivo la presencia y progresión de las lesiones arterioescleróticas. En los últimos años se han desarrollado dos interesantes métodos de estudio: a) Estudio de anomalías en la estructura vascular: La medición del grosor del complejo íntima-media (GIM) en localizaciones estandarizadas de las arterias carótidas, como indicador de afectación vascular arteriosclerótica. Este grosor aumenta a medida que aumentan los factores de riesgo cardiovascular y algunos autores han observado que el incremento de las concentraciones de c-LDL puede predecir el GIM en jóvenes adultos13. b) Estudio de anomalías en la función vascular: La dilatación mediada por flujo (DMF), que permite establecer las propiedades funcionales de las arterias, incluyendo las propiedades mecánicas tales como rigidez y distensibilidad, y las propiedades adaptativas tales como la vasodilatación, en respuesta a un estímulo. Este estudio se utiliza principalmente en la arteria braquial mediante técnica estandarizada por Correti14. Con un manguito para medición de presión arterial se induce, tras desinflarlo, un incremento de flujo en el territorio de la arteria braquial. Este aumento de flujo produce un estrés en el endotelio, con producción de óxido nítrico, que induce una vasodilatación. Podemos medir en el eje longitudinal la luz arterial antes y después del incremento del flujo y calcular el porcentaje de incremento del diámetro del vaso producido por la vasodilatación. Si el endotelio está afectado por factores de riesgo cardiovascular, la respuesta vasodilatadora se verá mermada (arterias más rígidas, menos reactivas). Permite el estudio de las fases más tempranas de la arterioesclerosis en niños, con lo cual nos dará una oportunidad para instaurar medidas preventivas de cara a la vida adulta.
Recientemente, numerosos estudios han mostrado tanto una alteración del DMF como un incremento del GIM en niños con hipercolesterolemias familiares, cuando son comparados con sujetos normales. Más relevante aún es el dato de que el tratamiento con estatinas no sólo disminuye las concentraciones de colesterol, sino que revierte considerablemente estos fenómenos de arterioesclerosis, mejorando el DMF y reduciendo la progresión del engrosamiento de la íntima-media en la carótida15.
INDICACIONES TERAPÉUTICAS ACTUALES EN EL TRATAMIENTO DE LAS HIPERCOLESTEROLEMIASEn la actualidad, las recomendaciones para el tratamiento de la hipercolesterolemia en niños son las propuestas por el National Cholesterol Education Program (NCEP) en 1992 y pasan inicialmente por la instauración de una dieta apropiada junto con modificaciones del estilo de vida, destinadas a aumentar la actividad física para evitar el sobrepeso u obesidad16. En relación con la dieta, algunos estudios han demostrado que los fitosteroles o esteroles vegetales (componentes naturales de las plantas que se encuentran en aceites vegetales de consumo habitual como la soja, el girasol, el maíz, la oliva, etc.) evitan la absorción intestinal del colesterol. En nuestro país están incorporados en margarina, leche y yogur (productos de Flora Pro-Activ® y Benecol®) y han de ingerirse al menos 2g al día para reducir hasta en un 7,5-10% las concentraciones de c-LDL17. Si estas primeras medidas no se demostraran efectivas, sólo a partir de los 8–10 años de edad y con concentraciones de c-LDL mayores de 190mg/dl o mayores de 160mg/dl en presencia de una historia familiar positiva para enfermedades cardiovasculares tempranas (antes de los 55 años) o de otros factores de riesgo (obesidad, diabetes, hipertensión), se recomienda el tratamiento farmacológico. Hasta el momento, los fármacos de elección en este caso han sido las resinas de intercambio iónico como la colestiramina o el colestipol, que actúan en el intestino interrumpiendo el ciclo enterohepático, impidiendo la reabsorción de colesterol y ácidos biliares. Las dosis de inicio son de 4–5g/día, y pueden ser aumentadas hasta 20g/día. Desgraciadamente, los ensayos con estos fármacos han mostrado un cumplimiento pobre, con un elevado porcentaje de abandonos debido tanto a su mal sabor como a sus efectos secundarios, fundamentalmente digestivos: estreñimiento, meteorismo y dolor cólico. También pueden elevar las concentraciones de triglicéridos e interferir en la absorción de vitaminas liposolubles. Incluso un buen cumplimiento del tratamiento sólo produce una reducción en torno al 15-20% de las concentraciones de c-LDL, claramente insuficiente en aquellos pacientes cuyos valores medios de c-LDL son habitualmente mayores de 300mg/dl18. Con estos antecedentes no es de extrañar el interés que han despertado las estatinas entre los pediatras, de forma que en los últimos años se han publicado más estudios en niños y adolescentes que documentan la excelente seguridad y efectividad a corto plazo de los inhibidores de la enzima hidroximetilglutaril-coenzima A (HMG-CoA) reductasa o estatinas, que los que nunca se hayan realizado con las resinas.
Como siempre que se incorpora un nuevo fármaco al arsenal terapéutico, uno de los objetivos principales de todos estos ensayos es demostrar la seguridad del uso de los mismos durante la infancia.
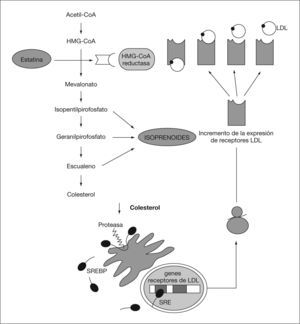
MECANISMO DE ACCIÓN DE LAS ESTATINASLas estatinas disminuyen la síntesis endógena de colesterol mediante inhibición competitiva de la enzima HMG-CoA reductasa, enzima limitante en la biosíntesis del colesterol. Ocupan una porción del receptor bloqueando la unión del sustrato al lugar de actividad enzimática19. Como ilustra la figura 1, el la deplección de colesterol activa una proteasa, la cual escinde proteínas de unión al elemento regulador de esteroles (SREBP) desde el retículo endoplásmico. Los SREBP son traslocados al núcleo, aumentando la expresión de genes de receptores de LDL, lo que origina un incremento en la endocitosis mediada por receptor de LDL con la subsiguiente disminución sérica de la concentración de LDL. La inhibición de HMG-CoA reductasa también reduce las concentraciones intracelulares de isoprenoides, intermediarios en la biosíntesis de colesterol20. Un beneficio adicional de la terapia con estatinas consiste en modificar los porcentajes de las subfracciones de LDL, y da como resultado un perfil menos aterogénico al disminuir el porcentaje de partículas de LDL pequeñas y densas21. Además, alguna de ellas como la atorvastatina, también reduce la producción de las lipoproteínas de muy baja densidad (VLDL) a través de un efecto mediado por la secreción hepática de apo-B lo cual se asocia con una disminución de la actividad de la HMG-CoA reductasa después del tratamiento farmacológico.
Su eficacia en niños en la reducción de las concentraciones de c-LDL oscila entre el 17 y el 45 % dependiendo de la estatina y la dosis utilizada (tabla 2)22–29,31,32,34. También son efectivas reduciendo el CT (13-37%) y la apoB100 (18-34%). Tienen un efecto modesto sobre el c-HDL (elevaciones discretas del 1-11%). Asimismo, son eficaces en la reducción de las concentraciones de triglicéridos (hasta el 17%) y dicho efecto también depende de las dosis. El mecanismo es una disminución de la síntesis de VLDL y el aclaramiento de partículas remanentes por receptores LDL apo-B/E. Parte de la variabilidad en la respuesta y efectos secundarios de las estatinas pueden estar relacionados con diferencias genéticas en la tasa de metabolización de la droga. Un ejemplo de esto sería la ausencia de actividad de CYP2D6, un miembro de la superfamilia de citocromo P-450, presente en el 7% de caucasianos y afroamericanos y que parece ser importante en pacientes tratados con simvastatina, y que puede afectar a su potencia y tolerabilidad. También existen polimorfismos en el gen que codifica el HMGCoA reductasa que pueden afectar a la respuesta individual a las estatinas.
Revisión de ensayos con estatinas en niños
| Ensayo | Tratamiento | N.o de sujetos | Edad media años (rango) | Seguimiento (semanas) | Reducción media de LDL (%) | |
| Placebo | Estatina | |||||
| Knipscheer et al31 | Pravastatina 5–20mg | 18 | 54 | 12 (8-16) | 12 | 23-33 |
| Lambert et al29 | Lovastatina 10–40mg | 69 | 12,8 | 8 | 21-36 | |
| Couture et al26 | Simvastatina 20mg | 16 | 47 | 12,6 (8-17) | 6 | 31-38 |
| Stein et al28 | Lovastatina 10-40mg | 65 | 67 | 13,2 (10-17) | 48 | 17-27 |
| Stefanutti et al27 | Simvastatina 10mg | 8 | 8 | 9 (4–12) | 52 | 29 |
| Ducobu et al25 | Simvastatina 10–40mg | 32 | < 17 | 104 | 37 | |
| De Jongh et al23 | Simvastatina 10–40mg | 69 | 106 | 14,2 (10–17) | 48 | 31-41 |
| Athyros et al35 | Atorvastatina 10–40mg | 16 | 13 (10–17) | 156 | 45 | |
| Dirisamer et al24 | Simvastatina 5–20mg | 20 | 13 (10–17) | 52 | 25-36 | |
| McCrindle et al34 | Atorvastatina 10–20mg | 47 | 140 | 14,1 (10–17) | 26 | 40 |
| Wiegman et al32 | Pravastatina 20–40mg | 108 | 106 | 13 (8–18) | 104 | 27 |
LDL: lipoproteínas de baja densidad.
Los principales efectos adversos encontrados en adultos han sido gastrointestinales (estreñimiento, diarrea, meteorismo, dolor abdominal y dispepsia), musculares (mialgias, rabdomiolisis), hepáticos (elevación de enzimas hepáticas), cefaleas, astenia, exantemas cutáneos, prurito y trastornos del sueño. De todos ellos, el más alarmante es la rabdomiolisis, cuyo riesgo se incrementa si estos fármacos se dan conjuntamente con otros también metabolizados vía citocromo P-450 como la ciclosporina, eritromicina, itraconazol, ketoconazol, ácido nicotínico y fibratos, especialmente gemfibrozil. Salvo la pravastatina y la rosuvastatina, todas las demás son metabolizadas por dicha enzima.
UTILIZACIÓN EN NIÑOS Y ADOLESCENTEEl hecho de que el colesterol sea un componente esencial de la estructura celular, un precursor de las hormonas esteroideas, de los metabolitos de la vitamina D y de los ácidos biliares, además de un factor primordial en la mielinización y crecimiento cerebral, ha contribuido a crear aún más incertidumbres sobre sus posibles efectos sobre los procesos fisiológicos del crecimiento y pubertad, así como sobre el sistema endocrinológico (síntesis de hormonas cuyo precursor es el colesterol: glucocorticoides, mineralcorticoides y andrógenos). Por todo ello, su incorporación al arsenal terapéutico pediátrico no ha sido todo lo rápido que habríamos deseado, aun más en pacientes prepuberales.
Se han obtenido resultados alentadores en los ensayos clínicos con estatinas en niños y adolescentes con historia familiar de hipercolesterolemia grave. Los efectos adversos no parecen ser mayores de los apreciados en estudios clínicos en adultos y, aunque en algunos de estos ensayos el seguimiento ha sido de hasta 3 años, siguen siendo motivo de preocupación su seguridad y el cumplimiento del tratamiento a muy largo plazo, así como su impacto sobre la enfermedad clínica. Hasta el momento, seis estatinas han sido utilizadas en población infantil (lovastatina, fluvastatina, pravastatina, simvastatina, atorvastatina y rosuvastatina), aunque sólo cuatro de ellas (lovastatina, simvastatina, pravastatina y atorvastatina) han sido aceptadas para uso pediátrico por la US Food and Drug Administration (FDA)23–37. Tanto Rodenburg et al22 como Arambepola et al38, en dos excelentes revisiones sobre su utilización en la infancia, concluyen que a la vez que seguras, son muy eficaces para reducir las concentraciones tanto del CT como del c-LDL22,38. Dicha reducción ha oscilado entre el 17 y el 45 % de las concentraciones iniciales, dependiendo de la estatina utilizada, así como de la dosis empleada. Las reducciones más importantes se han observado con el uso de la atorvastatina a 10–40mg/día. Uno de los interrogantes cuando se utilizan estatinas en niños es saber cuál es la dosis adecuada. Habitualmente, suele comenzarse con la más baja utilizada en adultos, con elevaciones progresivas hasta alcanzar las concentraciones de c-LDL deseadas. En adultos se ha observado una relación lineal entre el aumento de la dosis y el porcentaje de descenso del c-LDL, de manera que cada vez que se duplica aquélla, la reducción de este último es aproximadamente del 6 %. Últimamente, se está imponiendo una nueva forma de proceder, que es la asociación de ezetimibe (un inhibidor de la absorción intestinal de colesterol) con estatinas, en vez de la utilización de dosis altas de estas últimas39. Esta práctica ha demostrado un reducción adicional del 20 % en las concentraciones de c-LDL. Ya han sido publicados algunos casos de utilización de esta asociación durante la infancia40,41.
En cuanto a los efectos adversos, no se han publicado casos de miositis, miopatía o rabdomiólisis. Se han encontrado algunos casos de elevaciones asintomáticas de la creatinfosfocinasa y enzimas hepáticas, que han revertido con un descenso de las dosis de la medicación sin necesidad de suspender el tratamiento. Tampoco se han encontrado trastornos del crecimiento, el desarrollo puberal ni del metabolismo de las vitaminas.
Las guías para el inicio, dosificación y monitorización de la terapia con estatinas en niños pueden verse en la tabla 342.
Recomendaciones para el uso de estatinas en niños y adolescentes con hiperlipidemia
| Selección de pacientes |
| Iniciar siguiendo los criterios actuales (v. tabla 4) |
| La edad y nivel de LDL al cual iniciar el tratamiento con estatinas puede verse influido por otros factores de riesgo cardiovascular, así como por la presencia de xantomas cutáneos. |
| En general, no empezar hasta los 10 años de edad en varones y preferentemente hasta la menarquia en niñas. Idealmente estadios de Tanner ≥ 2 |
| Asegurarse de que no existen contraindicaciones para el tratamiento con estatinas (enfermedad hepática importante, paciente con VIH en tratamiento con inhibidores de proteasas o azoles, adolescentes |
| Inicio y dosificación |
| Empezar con la dosis más baja una vez al día, generalmente al acostarse. Medir concentraciones basales de CPK, ALT y AST |
| Instruir al paciente para que comunique cualquier efecto adverso, |
| sobre todo las molestias musculares, de forma inmediata |
| Advertir de interacciones con otros fármacos, sobre todo eritromicina, ciclosporina, medicación frente a VIH, algunos antifúngicos, etc. |
| La meta es conseguir niveles de LDL: mínimo < 130mg/dl, ideal: < 110mg/dl |
Tras 4 semanas de tratamiento, determinar: perfil de lipoproteínas en ayunas, CPK, ALT, AST. Nos debe preocupar si:
|
| Si se consiguen los valores diana de LDL y no hay anomalías de laboratorio, continuar el tratamiento y repetir control analítico a las 8 semanas y a los 3 meses |
| Si hay anomalías de laboratorio o aparecen síntomas, suspender temporalmente el fármaco y repetir analítica en 2 semanas. Cuando los valores retornen a la normalidad, el fármaco puede reiniciarse con monitorización estrecha |
| Si no se alcanzan los valores diana, hay que duplicar la dosis y repetir la analítica a las 4 semanas. Continuar aumentando la dosis de forma progresiva hasta la dosis máxima recomendada, hasta conseguir niveles diana de LDL o aparición de signos de toxicidad |
| Seguimiento |
| Monitorizar crecimiento (peso, talla, índice de masa corporal, estadio de Tanner) |
| Monitorizar perfil de lipoproteínas en ayunas, CPK, ALT y AST cada 3–6 meses |
| Insistir al paciente sobre medidas dietéticas e informar sobre otros factores de riesgo tales como sobrepeso, sedentarismo, tabaquismo |
ALT: alanina aminotransferasa; AST: aspartato transaminasa;
CPK: creatinfosfocinasa; LDL: lipoproteínas de baja densidad;
VIH: virus de la inmunodeficiencia humana.
El mejor conocimiento de la fisiopatología del proceso arterioesclerótico junto con la mayor experiencia en el uso de las estatinas durante la infancia han llevado a proponer algunas modificaciones en las recomendaciones para el tratamiento farmacológico de la hiperlipidemia de alto riesgo en niños y adolescentes. Las modificaciones más llamativas son que pueden elegirse las estatinas como fármacos de inicio y que, en determinados casos, pueden utilizarse en niños menores de 10 años de edad (tabla 4)42.
Recomendaciones para el tratamiento farmacológico de la hiperlipidemia de alto riesgo en niños y adolescentes
| Recomendaciones originales de la NCEP |
| Considerar tratamiento farmacológico en niños ≥ 10 años (generalmente esperar hasta la menarquia en niñas) tras al menos 6–12 meses de dieta baja en grasa y colesterol. |
Considerar tratamiento farmacológico si:
|
| Existe historia familiar de enfermedad cardiovascular temprana (< 55 años) |
| Hay otros 2 o más factores de riesgo en el niño tras intentar controlar dichos factores |
Metas terapéuticas:
|
| Modificaciones actuales |
| Si hay sobrepeso u obesidad junto con anomalías de los lípidos, efectuar cribado de otros aspectos del síndrome metabólico |
| En niños que cumplen criterios para iniciar tratamiento farmacológico, se recomienda una estatina como tratamiento de primera línea |
| En niños con anomalías lipídicas de alto riesgo, la presencia de factores de riesgo adicionales pueden determinar el descender los puntos de corte de LDL para iniciar el tratamiento y los valores diana perseguidos, y en casos seleccionados, pueden conducir a considerar el inicio de tratamiento por debajo de los 10 años de edad. Estos factores de alto riesgo pueden incluir: a) sexo masculino; b) fuerte historia familiar de enfermedad cardiovascular temprana, y c) presencia asociada de otras alteraciones lipídicas como niveles bajos de c-HDL o altos de triglicéridos, sobrepeso, obesidad, síndrome metabólico, síndrome nefrótico, hipertensión, tabaquismo, otras enfermedades asociadas a riesgo arteriosclerótico (tales como diabetes), VIH, lupus, trasplante y supervivientes de cáncer infantil |
c-HDL: colesterol de las lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NCEP: National Cholesterol Education Program; VIH: virus de la inmunodeficiencia humana.
En resumen, hemos de enfatizar que la evidencia en la que se basan estas recomendaciones se deriva de estudios efectuados en el contexto de niños afectados casi exclusivamente de hipercolesterolemia familiar y que, por lo tanto, se necesitan estudios realizados en otras situaciones. También debemos reseñar que el tratamiento farmacológico debe ser dirigido únicamente hacia individuos con anomalías lipídicas o situaciones de alto riesgo en las que no se han alcanzado las concentraciones diana de lípidos habiendo llevado a cabo previamente modificaciones en su estilo de vida.