El tratamiento quirúrgico estándar del tumor testicular es la orquiectomía, sin embargo, se podría recurrir a la cirugía conservadora en casos seleccionados, basándonos en la edad del paciente, marcadores tumorales, tamaño tumoral y hallazgos histopatológicos. Nuestro objetivo es dar a conocer cuáles son las variables que tener en cuenta para indicar una cirugía conservadora como tratamiento de una masa testicular palpable y no palpable encontrada como hallazgo incidental.
Material y métodosEstudio retrospectivo en 22 pacientes menores de 18 años, diagnosticados de tumor testicular entre 2000 y 2014. Revisamos el motivo de consulta, antecedentes, ecografía, estudio histopatológico, marcadores tumorales (BHCG, AFP), actitud terapéutica y evolución.
ResultadosDe los 22 pacientes (10 prepuberales), el 82% presentaron masa palpable y el 18% fueron hallazgos incidentales. Dos presentaban criptorquidia. La BHCG estaba aumentada en el 27% y la AFP en el 45%. Se realizaron 18 orquiectomías y 4 tumorectomías. La histología fue en un 72% de células germinales, 14 orquiectomías y 2 tumorectomías (2 teratomas); y en un 27% de tumores de células no germinales, en 4 orquiectomías y 2 tumorectomías (2 tumores de células de Leyding). Seis pacientes recibieron quimioterapia postoperatoria (tumores mixtos). La mediana del tamaño de la tumoración fue de un cm (0,4-1,5) en las tumorectomías y de 2,5 cm (0,5-14) en las orquiectomías. El seguimiento fue de 5 años (1-15). Un paciente falleció por enfermedad metastásica. No hubo recidiva local en la evolución de las tumorectomías.
ConclusionesPonemos de manifiesto una tendencia al cambio en nuestra actitud terapéutica. Planteamos una cirugía conservadora mediante tumorectomía en los pacientes que cumplan con los criterios de benignidad de la masa testicular (pequeño tamaño y marcadores tumorales negativos).
Although standard surgical treatment of a testicular tumour is orchiectomy, use can be made of testis-sparing surgery in selected cases, based on tumour markers, tumour size, and histopathological findings. Our objective is to become acquainted with the indications of testis-sparing surgery as a treatment for the incidental finding of a palpable and non-palpable testicular mass.
Material and methodsA retrospective study was conducted on 22 patients younger than 18 years diagnosed with a testicular tumour between 2000 and 2014. An assessment was made of the condition, the history, ultrasound, histopathology, tumour markers (BHCG, AFP), therapeutic approach, and outcome.
ResultsOf the 22 patients (10 prepubertal age) studied, 82% had palpable mass, and 18% were incidental findings. Two had cryptorchidism. The BHCG was increased in 27% and AFP in 45% of cases. There were 18 tumorectomies and 4 orchiectomies performed. The histopathology found 72% germ cell, 14 orchiectomy, and 2 tumorectomies (2 teratomas), with 27% non-germ cell tumours in 4 orchiectomies and 2 tumorectomies (2 cells of Leydig). Six patients received post-surgical chemotherapy (mixed tumours). The median tumour size was 1 (0.4-1.5) cm in tumorectomies, and 2.5 (0.5-14) cm in orchiectomies. The mean follow-up was 5 (1-15) years. One patient died due to metastatic disease. There was no local recurrence in the follow up of the tumorectomies.
ConclusionsA change in the trend of our therapeutic approach is demonstrated. We propose that testis-sparing surgery is indicated in prepubertal patients who meet the benignity criteria of the testicular mass (small size and negative tumour markers).
Los tumores testiculares en la infancia representan el 1-2% de las neoplasias sólidas, con 2picos de presentación: el primero entre los 2 y los 4 años de edad y el segundo hacia los 15 años1. Su incidencia en la población general es de 0,5-2 por cada 100.000 personas, con un aumento en la población adulta en los últimos años2,3.
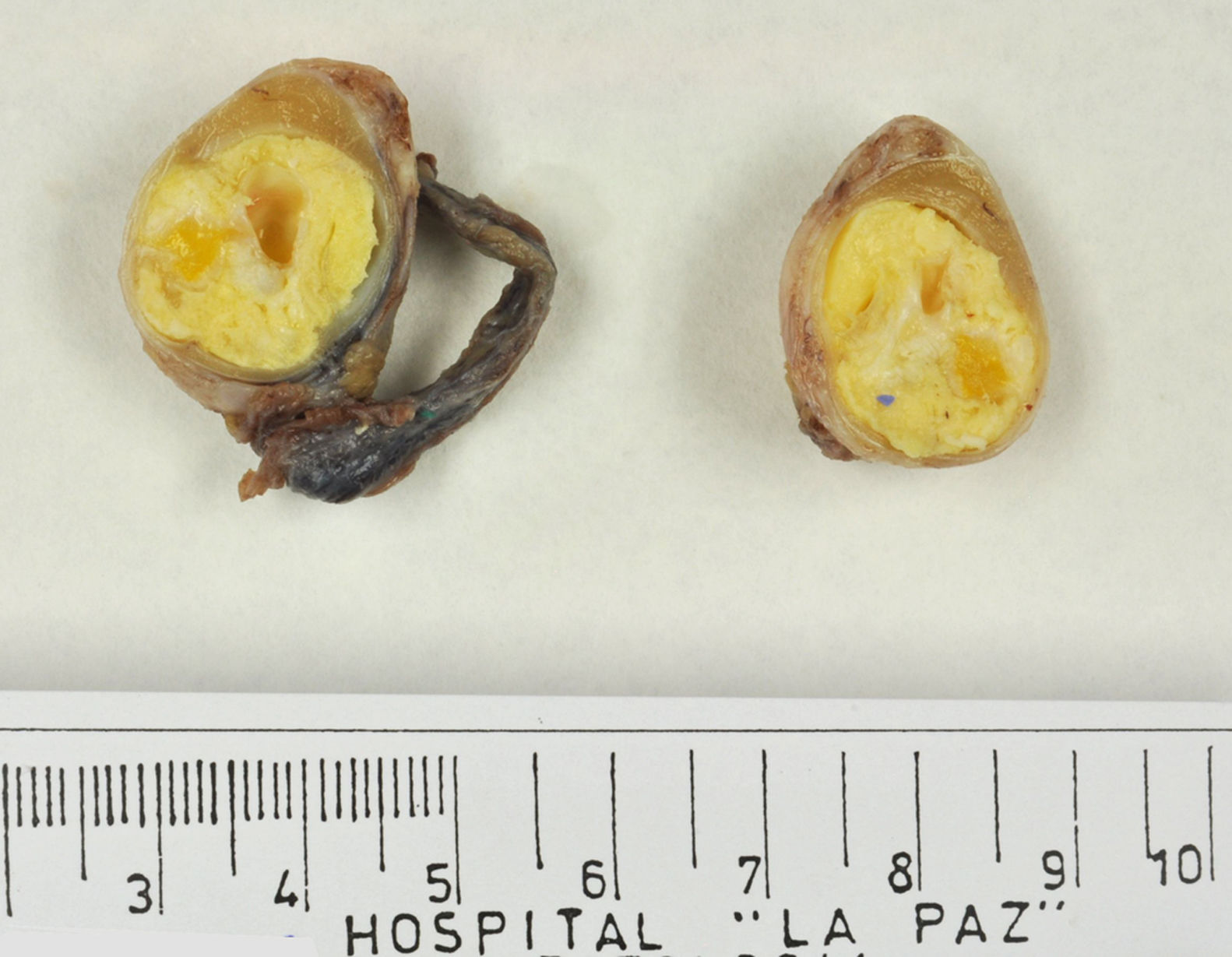
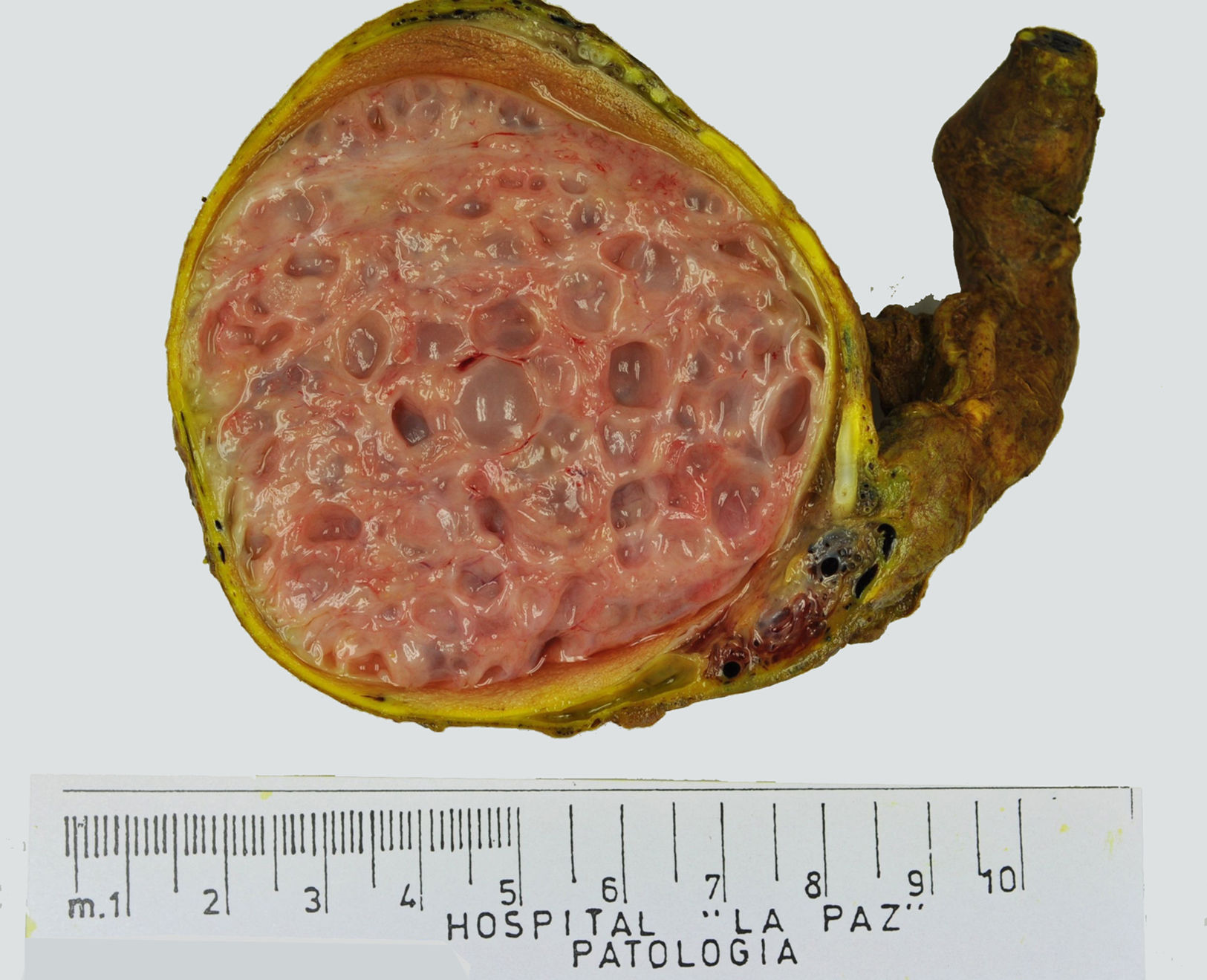
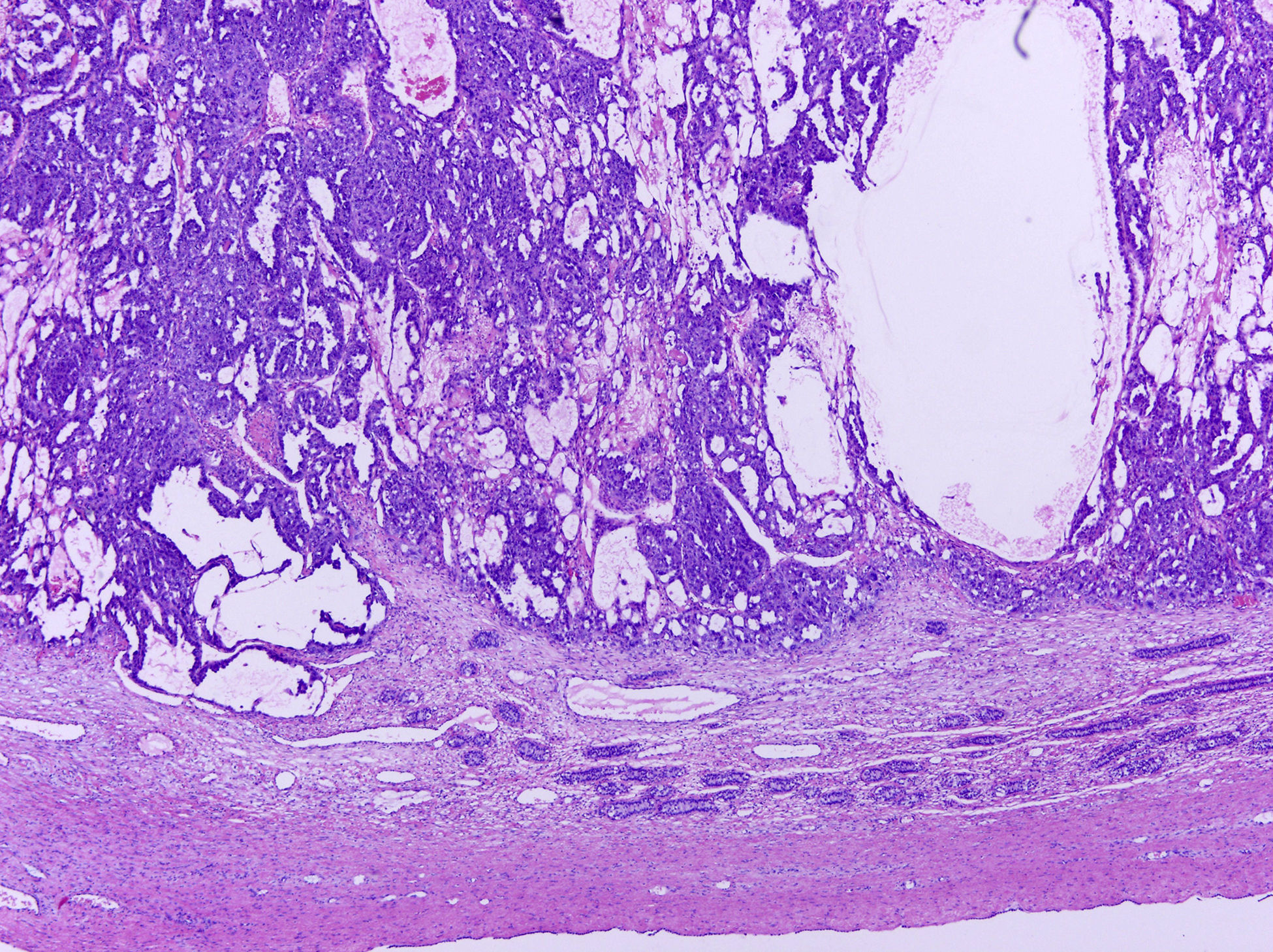
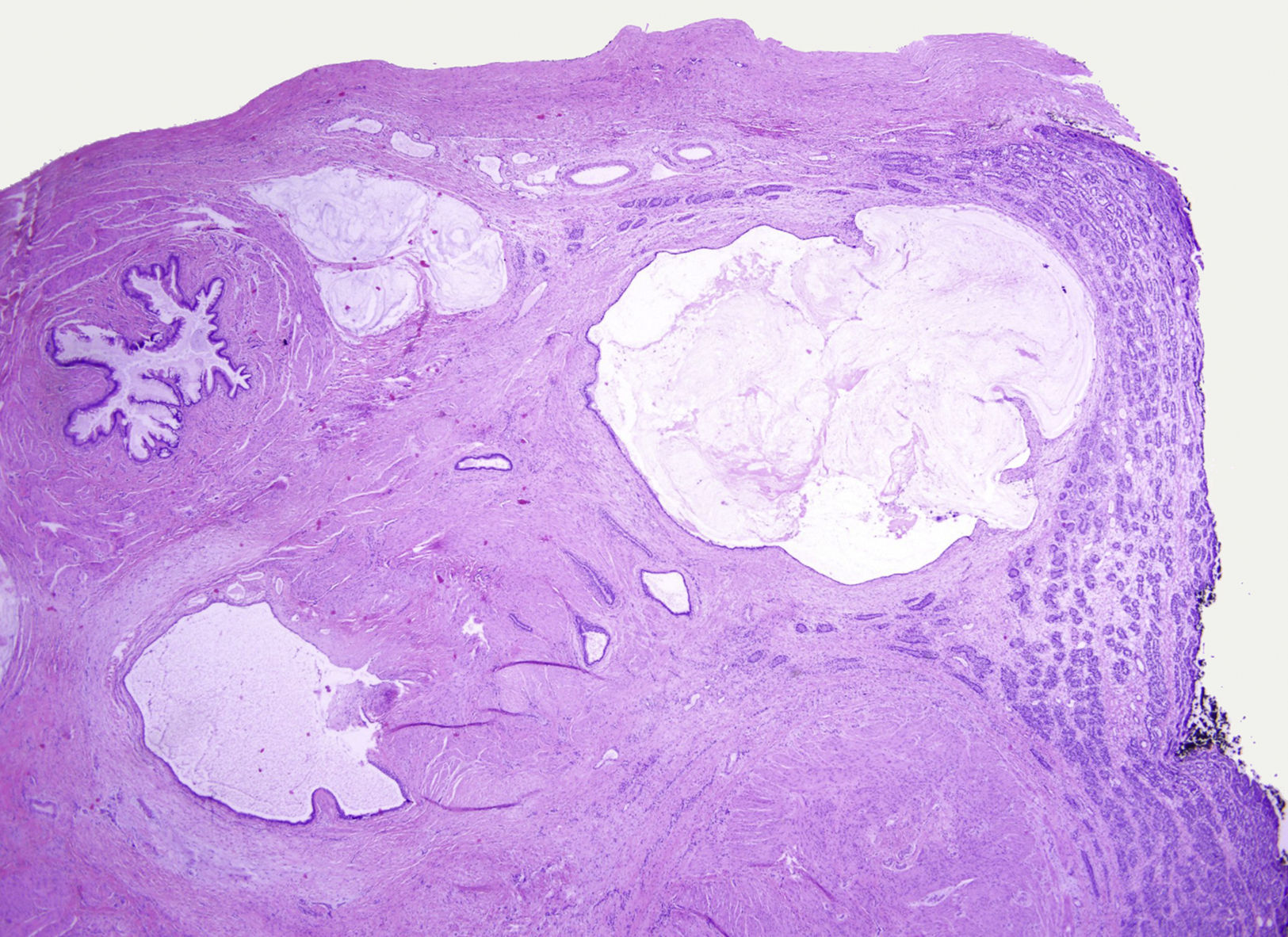
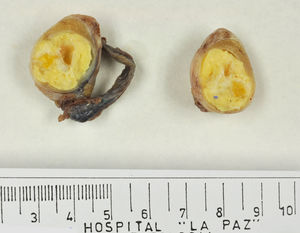
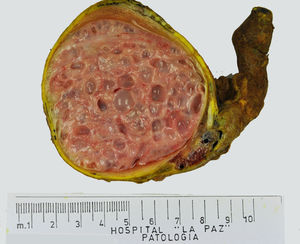
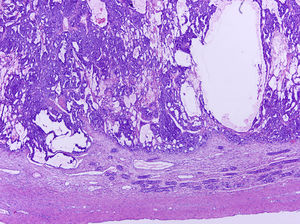
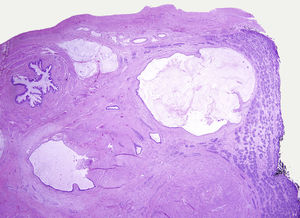
Los tumores testiculares se dividen en 6 grupos (clasificación anatomopatológica según la Organización Mundial de la Salud, 20164: 1) tumores de células germinales derivados de neoplasia de células germinales in situ (NCGIS) que incluyen seminoma, carcinoma embrionario, tumor del saco vitelino pospuberal, teratoma de tipo pospuberal, tumores trofoblásticos y tumores de células germinales de tipo desconocido (tumor quemado); 2) tumores de células germinales no relacionados con NCGIS que comprenden tumor espermatocítico, teratoma de tipo prepuberal, tumor del saco vitelino de tipo prepuberal y tumor mixto teratoma-tumor del saco vitelino de tipo prepuberal; 3) tumores de los cordones sexuales/estroma gonadal (tumores de células de Leydig, de Sertoli o de la granulosa); 4) tumores que contienen elementos de células germinales y de cordones sexuales/estroma gonadal; 5) tumores misceláneos y 6) tumores hematolinfoides. En esta nueva clasificación se distinguen 2tipos de teratoma (figs. 1 y 2), y de tumor del saco vitelino, de tipo prepuberal (no relacionados con NCGIS) y de tipo pospuberal (derivados de NCGIS) con significativo mejor pronóstico en los primeros. Existe un predominio claro (90-95%) de los tumores de células germinales; son el teratoma de tipo prepuberal y los tumores del saco vitelino de tipo prepuberal los más frecuentes en la infancia5-8 (fig. 3). Los teratomas de tipo prepuberal tienden a ser quísticos y con arquitectura organoide (fig. 4). Se incluyen en este grupo el quiste epidermoide, el quiste dermoide y los tumores neuroendocrinos bien diferenciados.
Microfotografía de un teratoma de tipo prepuberal en el que se identifica un aspecto organoide. Destacan los quistes revestidos por epitelio glandular mucoso rodeados de tejido muscular liso. En la periferia, parénquima testicular prepuberal sin presencia de neoplasia de células germinales in situ.
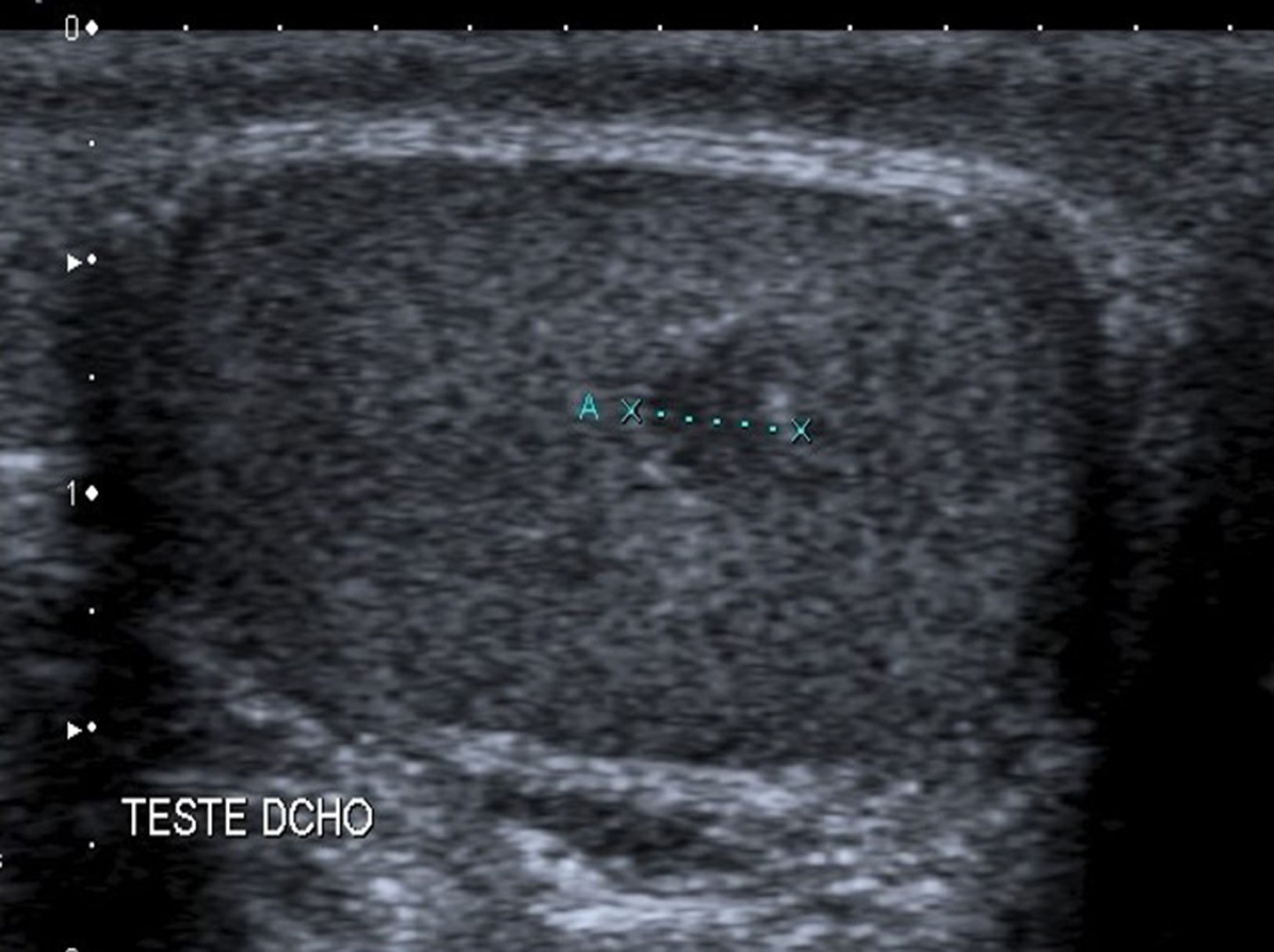
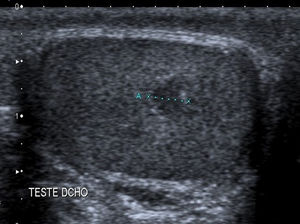
Debido al uso estandarizado de la exploración ecográfica, está aumentando el número de casos de masas testiculares no palpables9,10 (fig. 5).
La orquiectomía radical se ha considerado como el tratamiento estándar de masas testiculares en todas las edades. Sin embargo, en los niños, debido a su comportamiento benigno1,10,11, en los últimos años se ha replanteado la actitud médico-quirúrgica. Esto supone un cambio en el abordaje terapéutico inicial, al tomar en consideración la realización de una cirugía conservadora (tumorectomía)11-13, apoyándonos en los valores de los marcadores tumorales (BHCG, AFP), tamaño tumoral y hallazgos histopatológicos14-19.
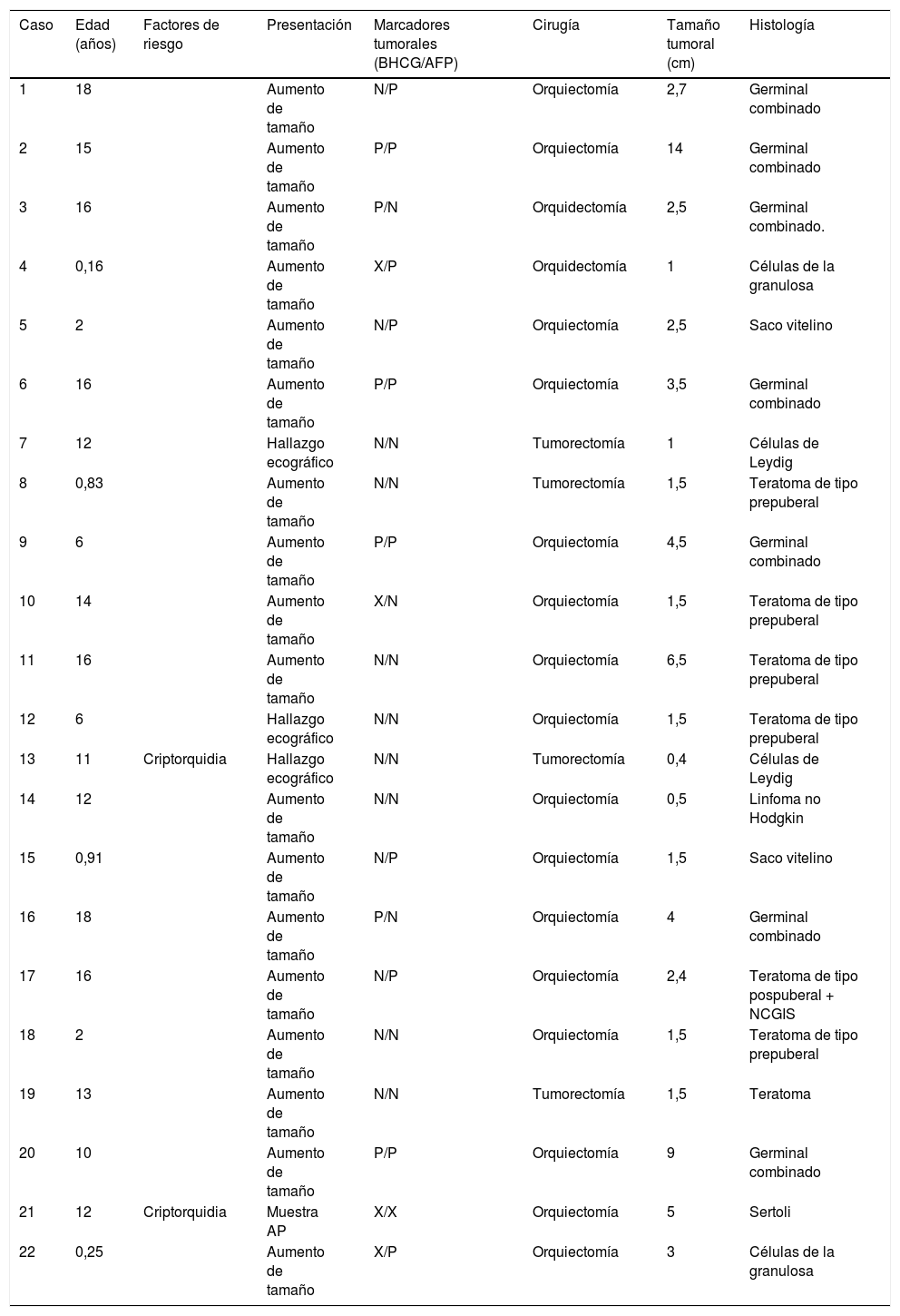
La opción de una cirugía conservadora mediante tumorectomía debe ser una decisión consensuada entre los médicos (tabla 1) responsables del paciente y la intervención ha de practicarse en un centro con experiencia2.
Resumen de casos clínicos
| Caso | Edad (años) | Factores de riesgo | Presentación | Marcadores tumorales (BHCG/AFP) | Cirugía | Tamaño tumoral (cm) | Histología |
|---|---|---|---|---|---|---|---|
| 1 | 18 | Aumento de tamaño | N/P | Orquiectomía | 2,7 | Germinal combinado | |
| 2 | 15 | Aumento de tamaño | P/P | Orquiectomía | 14 | Germinal combinado | |
| 3 | 16 | Aumento de tamaño | P/N | Orquidectomía | 2,5 | Germinal combinado. | |
| 4 | 0,16 | Aumento de tamaño | X/P | Orquidectomía | 1 | Células de la granulosa | |
| 5 | 2 | Aumento de tamaño | N/P | Orquiectomía | 2,5 | Saco vitelino | |
| 6 | 16 | Aumento de tamaño | P/P | Orquiectomía | 3,5 | Germinal combinado | |
| 7 | 12 | Hallazgo ecográfico | N/N | Tumorectomía | 1 | Células de Leydig | |
| 8 | 0,83 | Aumento de tamaño | N/N | Tumorectomía | 1,5 | Teratoma de tipo prepuberal | |
| 9 | 6 | Aumento de tamaño | P/P | Orquiectomía | 4,5 | Germinal combinado | |
| 10 | 14 | Aumento de tamaño | X/N | Orquiectomía | 1,5 | Teratoma de tipo prepuberal | |
| 11 | 16 | Aumento de tamaño | N/N | Orquiectomía | 6,5 | Teratoma de tipo prepuberal | |
| 12 | 6 | Hallazgo ecográfico | N/N | Orquiectomía | 1,5 | Teratoma de tipo prepuberal | |
| 13 | 11 | Criptorquidia | Hallazgo ecográfico | N/N | Tumorectomía | 0,4 | Células de Leydig |
| 14 | 12 | Aumento de tamaño | N/N | Orquiectomía | 0,5 | Linfoma no Hodgkin | |
| 15 | 0,91 | Aumento de tamaño | N/P | Orquiectomía | 1,5 | Saco vitelino | |
| 16 | 18 | Aumento de tamaño | P/N | Orquiectomía | 4 | Germinal combinado | |
| 17 | 16 | Aumento de tamaño | N/P | Orquiectomía | 2,4 | Teratoma de tipo pospuberal + NCGIS | |
| 18 | 2 | Aumento de tamaño | N/N | Orquiectomía | 1,5 | Teratoma de tipo prepuberal | |
| 19 | 13 | Aumento de tamaño | N/N | Tumorectomía | 1,5 | Teratoma | |
| 20 | 10 | Aumento de tamaño | P/P | Orquiectomía | 9 | Germinal combinado | |
| 21 | 12 | Criptorquidia | Muestra AP | X/X | Orquiectomía | 5 | Sertoli |
| 22 | 0,25 | Aumento de tamaño | X/P | Orquiectomía | 3 | Células de la granulosa |
N: negativa; NCGIS: neoplasia de células germinales in situ; P: positiva; X: no se realizó.
Nuestro objetivo es dar a conocer cuáles son las variables que tener en cuenta para indicar una cirugía conservadora como tratamiento de una masa testicular palpable y no palpable encontrada como hallazgo incidental.
Material y métodosRealizamos un estudio retrospectivo en 22 pacientes menores de 18 años, diagnosticados y tratados en nuestro centro de tumor testicular entre 2000 y 2014. Excluimos tumores en pacientes con disgenesia gonadal por ser un grupo que precisa de un seguimiento y control diferente. Revisamos la edad al diagnóstico, antecedentes, forma de presentación, hallazgos ecográficos, estudio histopatológico, valor de los marcadores tumorales (BHCG, AFP), actitud terapéutica (orquiectomía vs. tumorectomía) y seguimiento, que era realizado en la consulta de urología y oncología si lo precisaban.
ResultadosLa edad media de los 22 pacientes fue de 9,6 años (de 2 meses a 18 años), 10 casos diagnosticados en edad prepuberal. En cuanto a la forma de presentación, la masa palpable fue el hallazgo más frecuente en 18 (82%) de los casos, 2 de ellas diagnosticadas en revisión pediátrica rutinaria. En 4 casos (18%), fueron hallazgos incidentales, de ellos, 3 en ecografía solicitada para la valoración por talla baja, orquidodinia, criptorquidia contralateral y el último paciente fue intervenido de criptorquidia: se le extirpó el teste por atrofia y posterior diagnóstico en pieza quirúrgica de enfermedad tumoral.
Dos pacientes presentaron antecedentes de criptorquidia, uno contralateral al tumor y otro criptorquidia bilateral.
Al diagnóstico, la BHCG se realizó en 18 (82%) pacientes y la AFP en 21 (95%), con los marcadores tumorales aumentados en 27 y 45%, respectivamente.
La ecografía se realizó en el 90% de los pacientes; la mediana de tamaño de las masas palpables fue de 3,5 cm (1,2-7) y de las masas no palpables de 1 cm (0,4-1,5).
Se realizaron 18 orquiectomías y 4 tumorectomías. El abordaje quirúrgico fue vía inguinal en todos los pacientes. La indicación de tumorectomía se basó en el tamaño tumoral (menor de 2cm) y en marcadores tumorales negativos.
La histología fue en un 72% de tumores de células germinales, 14 orquiectomías (7 tumores germinales combinados —de los cuales 6 tenían componente de coriocarcinoma o carcinoma embrionario—, 5 teratomas, 2 tumores del saco vitelino) y 2 tumorectomías (2 teratomas). El otro 27% fueron tumores de células no germinales en 4 orquiectomías (2 tumores de células de la granulosa, uno de células de Sertoli, un linfoma no Hodgkin) y 2 tumorectomías (2 tumores de células de Leydig). La mediana del tamaño de la tumoración fue 1 cm (0,4-1,5) en las tumorectomías y 2,5 cm (0,5-14) en las orquiectomías.
La BHCG que estaba aumentada al diagnóstico correspondía a tumores de extirpe coricocarcinomatosa y la AFP a pacientes con tumores con algún componente de tumor de saco vitelino.
El seguimiento que se realizó en estos pacientes fue una visita en nuestra consulta a la semana del posquirúrgico, al mes, a los 6 meses y cada año. En todas las revisiones se solicitó una ecografía testicular para evaluar las características del parénquima y una analítica con marcadores tumorales para comprobar su descenso. Todos los pacientes fueron remitidos al Servicio de Hemato-Oncología, en donde, en función de los hallazgos histopatológicos, valoraron la actitud terapéutica y seguimiento en sus consultas.
Seis pacientes recibieron quimioterapia postoperatoria con 2 ciclos de bleomicina/etopósido/cisplatino, todos correspondientes a tumores de células germinales mixtas en el estudio histopatológico. Durante el seguimiento se observó la negativización de los marcadores en todos los pacientes, excepto en uno, que falleció por enfermedad metastásica. El seguimiento fue de 5 años (1-15); 4 pacientes continúan su seguimiento en su hospital de origen según protocolo.
Falleció un paciente que presentaba un tumor de células germinales mixto (50% de componente de coriocarcinoma) con metástasis pulmonares y hepáticas, con aplasia medular secundaria a quimioterapia y shock séptico. Ningún otro paciente ha presentado recidiva local ni metástasis en su evolución. Solo a un paciente se le realizado la colocación de prótesis testicular.
DiscusiónEl tumor testicular en la edad pediátrica es una enfermedad poco frecuente. Los factores epidemiológicos de riesgo en el desarrollo de tumores testiculares en todas las edades que se describen son: antecedentes de criptorquidia, síndrome de Klinefelter, antecedentes de cáncer de testículo en familiares de primer grado, presencia de tumor contralateral, infertilidad2. Entre estos factores solo encontramos en nuestro estudio 2 casos de criptorquidia.
En nuestro estudio la masa palpable fue la forma de presentación más frecuente (82%), al igual que en otros estudios5,10. En el 13% fue un hallazgo ecográfico. El uso generalizado de la ultrasonografía ha dado lugar a una mayor detección incidental de pequeñas masas testiculares, definidas como masas intraescrotales no palpables, <2cm de diámetro y consideradas benignas en el 80% de los casos12, que pueden ser tratados mediante cirugía conservadora. En nuestra muestra, el estudio histopatológico posterior corroboró la benignidad de estas masas no palpables.
Entre los marcadores tumorales, la AFP se encuentra elevada (> 10ng/ml) en el 92-100% de los pacientes con tumor de saco vitelino y la BHCG puede estar elevada en los tumores de células germinales (ligeramente en el carcinoma embrionario o seminoma cuando contienen células de sincitiotrofoblasto y marcadamente en casos con componente de coriocarcinoma)3. En nuestro estudio, al diagnóstico, la AFP estaba aumentada en un 45% (en todos los tumores del saco vitelino y tumores con algún componente teratoide) y la BHCG en un 27% (todos los tumores con componente de coriocarcinoma o presencia de células del sincitiotrofoblasto). En el seguimiento, se negativizaron los marcadores, excepto en un paciente que murió por enfermedad metastásica avanzada. Debemos tener en cuenta en el diagnóstico y seguimiento que, en los pacientes menores de 12 meses de edad, la AFP puede estar elevada de manera fisiológica, sin sobrepasar los valores 100ng/ml8.
El tipo histológico varía en función de la estirpe celular que lo produce: es más frecuente la aparición de los tumores de células germinales, que alcanza hasta el 95% de los casos en los adultos y un 65% en la edad pediátrica5. En nuestra serie representan un 75% de los casos.
Los teratomas suelen ser benignos en pacientes prepuberales, por lo que podría realizarse tumorectomía en aquellos tumores testiculares en los que en la ecografía el tejido testicular normal parece viable, con niveles de AFP normales, o en menores de 12 meses con niveles de AFP alta, pero menor de 100ng/ml8. El tumor del saco vitelino es el tumor testicular maligno más frecuente en la infancia; junto con el carcinoma embrionario aparecen sobre todo en menores de 2 años5–8. El tratamiento se basa en la orquidectomía radical. En adultos se practicaba linfadenectomía retroperitoneal radical, mientras que en los niños dependía del estadio, debido a que la mayoría de los casos prepuberales (85%) presentaban un estadio I. Actualmente, la linfadenectomía no se realiza de rutina, salvo en estadios avanzados. Los tumores estromales son raros en edad prepuberal y se pueden asociar al desarrollo de pubertad precoz. El que aparece con más frecuencia es el tumor de células de Sertoli, con pico de incidencia a los 6 meses. Un 30% de los tumores de células de Sertoli se asocian a síndromes u otras alteraciones endocrinológicas (síndrome de Peutz-Jeghers, el complejo de Carney, la enfermedad de Cushing, adenomas hipofisarios). La extirpación del tumor en niños suele ser curativa2. Los pocos casos malignos suelen aparecer en niños mayores, por lo que se recomienda en mayores de 5 años la realización de orquidectomía radical y seguimiento posterior10. Los tumores de células de Leydig aparecen entre los 5-10 años, son generalmente benignos y la extirpación del tumor suele ser curativa. El tumor de células de la granulosa de tipo juvenil suele aparecer en el primer año de vida, normalmente en los primeros 6 meses; es el tumor testicular más frecuente en neonatos con una evolución favorable, a diferencia de los casos que se presentan en los pacientes pospuberales10.
El tratamiento quirúrgico empleado en un 82% (18 pacientes) fue la orquiectomía, de ellos, 6(5 en edad puberal) recibieron quimioterapia postoperatoria con 2 ciclos de bleomicina/etopósido/cisplatino, todos correspondientes a tumores mixtos con componente de coriocarcinoma o carcinoma embrionario.
La cirugía conservadora mediante tumorectomía se lleva a cabo en nuestro centro desde 2009 y fue empleada en el 18% de nuestra muestra. Lo que nos indujo a modificar la actitud terapéutica frente a las masas testiculares fue la posibilidad de preservar la mayor cantidad de tejido testicular; esto, gracias a la evolución benigna de la enfermedad en la edad prepuberal, a la mayor frecuencia de histopatología benigna y a la baja probabilidad de recurrencia1,3,7-11.
Realizando un análisis retrospectivo de los casos de nuestra muestra, encontramos que en 3 pacientes se habría podido recurrir a la tumorectomía, pues cumplían con los criterios necesarios para poder tratarlos con este procedimiento (prepuberales, marcadores tumorales negativos, tamaño menor a 2cm).
Durante el seguimiento, falleció un paciente que, al diagnóstico, padecía una enfermedad avanzada con metástasis a distancia. No hubo otro caso de recidiva ni en el grupo de orquiectomía ni en el de tumorectomía, lo que nos demuestra la alta tasa de curación tanto en los pacientes con histología favorable como no favorable2,12,14-19.
En conclusión, los pacientes prepuberales con una masa testicular conforman un grupo diferente a los pospuberales, ya que presentan características epidemiológicas, histológicas y una evolución distintas. Por lo tanto, el enfoque de tratamiento no tendría que ser el mismo: podemos plantearnos un manejo quirúrgico conservador mediante tumorectomía en los pacientes que cumplan con los criterios de benignidad de la masa testicular (pequeño tamaño y marcadores tumorales negativos).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.