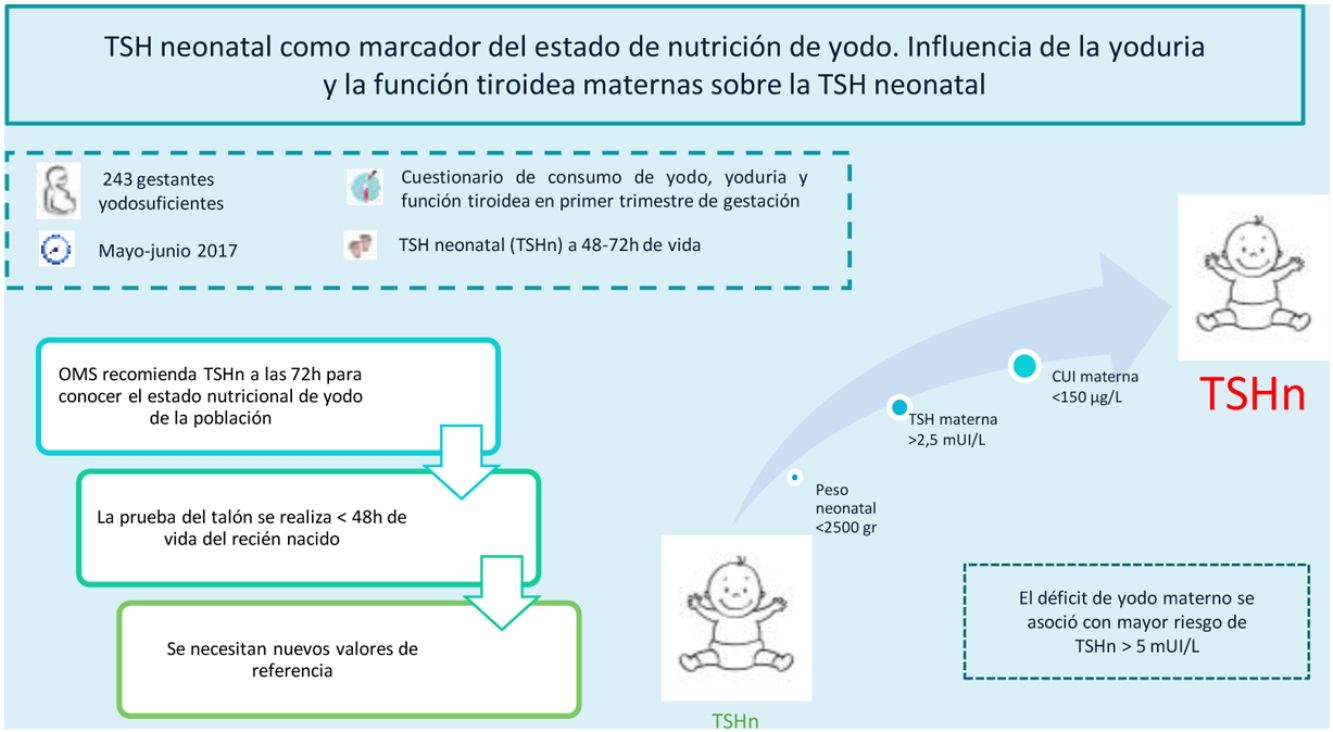
La TSH neonatal (TSHn) es un marcador de nutrición de yodo en la población. La OMS relaciona una prevalencia<3% de TSHn>5mUI/L, obtenida a partir de las 72h del nacimiento, con un adecuado estado nutricional de yodo. El objetivo de este estudio es conocer la prevalencia de TSHn>5mUI/L en una población yodosuficiente y su relación con factores maternos, neonatales y obstétricos.
Materiales y métodosSe reclutaron 243 gestantes entre mayo-junio de 2017 en nuestra área sanitaria. Se realizó un cuestionario sobre consumo de yodo y determinación de yoduria, función y autoinmunidad tiroideas en el primer trimestre de gestación. Se analizó la TSHn entre 48-72h del nacimiento, así como otros factores obstétricos y neonatales.
ResultadosLa TSHn media fue 2,43±1,68mUI/L, con un 7,8% de neonatos con TSHn>5mUI/L. La TSHn más elevada pertenecía a los neonatos de madres con yodurias insuficientes (p=0,021) o con TSH>2,5mUI/L, tanto en autoinmunidad tiroidea negativa (p=0,049) como positiva (p=0,006). La yoduria materna<150μg/L fue un factor de riesgo de TSHn>5mUI/L (3,70 [1,06-14,60], p=0,046), mientras que el peso neonatal ≥2500g fue un factor protector (0,14 [0,02-1,00], p=0,038).
ConclusionesLa prevalencia de TSHn>5mUI/L en nuestra área sanitaria fue elevada, según las recomendaciones de la OMS. Se asoció el déficit de yodo materno con mayor riesgo de TSHn>5mUI/L. Dado que en la actualidad la determinación de la TSHn se realiza antes de las 72h del nacimiento, precisamos de nuevos puntos de corte para continuar empleando la TSHn como marcador de nutrición de yodo.
Neonatal thyroid stimulating hormone (nTSH) is a marker of iodine nutrition status in the population. The WHO considers a prevalence of less than 3% of nTSH levels greater than 5mIU/L in samples obtained within 72h from birth indicative of iodine sufficiency. The aim of this study was to determine the prevalence of nTSH levels greater than 5mIU/L in an iodine-sufficient population and its association with maternal, neonatal and obstetric factors.
Materials and methodsA total of 243 pregnant women were recruited between May and June 2017 in our health area. A questionnaire of iodine intake was administered, in addition to determination of ioduria, thyroid function and autoimmunity in the first trimester of gestation. We analysed nTSH levels in samples collected between 48 and 72h post birth and other obstetric and neonatal factors.
ResultsThe mean nTSH level (standard deviation) was 2.43 (1.68mIU/L), with 7.8% of neonates having levels greater than 5mIU/L. The highest nTSH levels corresponded to neonates of mothers with insufficient ioduria (p=.021) or TSH levels greater than 2.5mIU/L, in both the case of negative (p=0.049) and positive (p=0.006) thyroid autoimmunity results. Maternal ioduria greater than 150μg/L was a risk factor for nTSH levels greater than 5mIU/L (3.70 [1.06–14.60]; p=0.046), while a neonatal weight of 2500g or greater was a protective factor (0.14 [0.02–1.00]; p=0.038).
ConclusionsThe prevalence of nTSH levels greater than 5mIU/L in our health area was high based on the WHO recommendations. Maternal iodine deficiency was associated with a higher risk of nTSH levels less than 5mIU/L. Given that nTSH is currently measured before 72h post birth, we need new cut-off points to keep on using nTSH as a marker of iodine nutritional status.
El yodo es un oligoelemento esencial para la síntesis de las hormonas tiroideas. Su déficit en población adulta se asocia con disfunción tiroidea y bocio, mientras que en población gestante se ha descrito mayor tasa de abortos y mortalidad perinatal y anomalías congénitas en los recién nacidos1, asociándose con alteraciones del crecimiento y del neurodesarrollo2. El déficit de yodo sigue siendo la primera causa de daño neurológico prevenible3. La Organización Mundial de la Salud (OMS) recomienda la yodación universal de la sal y el uso de suplementos yodados en población de riesgo, así como la realización de estudios periódicos para monitorizar el estado de nutrición de yodo de la población4.
La determinación de la concentración urinaria de yodo (CUI) o yoduria en población escolar es el principal método para evaluar el estado de nutrición de yodo de una población5. Sin embargo, disponemos de otros marcadores como son la TSH neonatal (TSHn)4,6,7, la prevalencia de bocio en la población escolar6 o la determinación de tiroglobulina sérica8.
La TSHn se emplea en el cribado del hipotiroidismo congénito en los recién nacidos, pero además es un buen marcador del estado nutricional de yodo debido a que su bajo contenido en el tiroides neonatal obliga a un alto recambio, con el consiguiente aumento de la TSH en caso de déficit de yodo3,4. De acuerdo con las recomendaciones de la OMS, una prevalencia menor del 3% de recién nacidos con TSHn>5mUI/L indica un adecuado estado nutricional de yodo en la población4. Sin embargo, además de la nutrición materna de yodo, existen numerosos factores obstétricos y neonatales que pueden influir sobre la TSHn9,10.
El objetivo de este estudio es conocer la prevalencia de recién nacidos con TSHn>5mUI/L en nuestra área sanitaria. El segundo objetivo del estudio es conocer la influencia que la ingesta de yodo, la yoduria y la función tiroidea maternas tienen sobre la TSHn. Finalmente, también se analizaron otros factores obstétricos y neonatales que pueden interferir en la TSHn.
Materiales y métodosPoblación de estudioEstudio observacional, longitudinal, descriptivo y analítico realizado en gestantes y neonatos de nuestra área sanitaria, que abarca una población de 330.560 personas. El estado nutricional de yodo en esta región es adecuado, tanto en población general11 como en población gestante12.
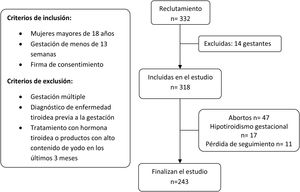
El reclutamiento se realizó entre todas las gestantes que acudieron a la primera visita con su matrona entre los meses de mayo y junio de 2017. Los criterios de inclusión y exclusión aplicados se explican en el diagrama de flujo (fig. 1).
El estudio fue aprobado por el Comité Ético de Investigación de nuestra región. Todas las participantes firmaron el documento de consentimiento informado.
Variables de estudioEn la primera visita con la matrona se realizó un cuestionario para valorar la ingesta de yodo, donde se recogieron los datos correspondientes al consumo habitual de sal yodada (sí/no) y productos lácteos (raciones diarias de leche, yogures y queso), así como la toma de suplemento yodado (sí/no). Los resultados del cuestionario de ingesta de yodo se encuentran publicados en González et al.12.
Se realizaron las determinaciones de concentración urinaria de yodo (CUI), función tiroidea y autoinmunidad tiroidea en el primer trimestre de gestación, cuyos resultados se encuentran publicados en González et al.12, y se recogieron los datos de TSHn en los recién nacidos.
Para determinar la CUI materna se recogió una muestra aleatoria de orina y se determinó mediante espectrometría de masas con plasma de acoplamiento inductivo (ICP-MS). Se utilizó un equipo ICP-MS 7700x (de Agilent Technologies, Santa Clara, CA, EE.UU.). El método presentó una buena linealidad entre 10 y 450μg/L (R2>0,99), con una imprecisión intralaboratorio ≤2,9% y un error total ≤7,3%.
De forma simultánea se recogió una muestra de sangre a la madre para la determinación de la TSH y autoinmunidad tiroidea (anticuerpos antiperoxidasa [TPOAb] y anticuerpos antitirogloblina [TgAb]). Estas variables se analizaron mediante inmunoanálisis por electroquimioluminiscencia (Roche Diagnostics, Basel, Suiza). El coeficiente de variación (CV) de la TSH fue del 0,8-2,9%. Para el primer trimestre de gestación el intervalo de referencia de la TSH en nuestra área sanitaria fue de 0,20-4,50mIU/L. El intervalo de referencia para la TPOAb fue <34UI/mL y TgAb<18UI/mL.
A los recién nacidos se les recogió una muestra de sangre capilar del talón preferentemente entre las 48-72h de vida impregnada en tarjetas de papel Whatman® 903 dentro del programa de cribado de hipotiroidismo congénito. La determinación de la TSHn se realizó mediante fluoroinmunoensayo DELFIA (Dissociation Enhancement Lanthanide Fluoroinmmunoassay) en el laboratorio de Bioquímica Clínica de nuestro hospital. Un valor de TSHn<10mUI/L se consideró dentro de la normalidad. En caso de TSHn entre 10-20mUI/L se realizó una nueva determinación y si la TSHn fue>20mUI/L se remitió a la unidad clínica.
Finalmente se recogieron datos sobre peso del recién nacido y edad gestacional al nacimiento, tipo de parto (eutócico —que no precisa de la intervención del médico/matrona—, vaginal instrumental o cesárea), motivo de parto vaginal instrumental o cesárea, presencia de riesgo de pérdida del bienestar fetal (RPBF) y puntuación del test de Apgar al minuto de nacimiento (Apgar1). La presencia de RPBF fue considerada por el obstetra en caso de signos o síntomas clínicos sugestivos de ser secundarios a una acidosis hipóxica metabólica, que incluye tanto situaciones clínicas graves como alteraciones en las distintas pruebas empleadas para el control del bienestar fetal como son el patrón cardiotocográfico, la pulsioximetría, el equilibrio ácido-base o el estudio Doppler.
Análisis estadísticoSe realizó un análisis descriptivo proporcionando distribuciones de frecuencias relativas y absolutas para variables cualitativas y medidas de posición y dispersión para las cuantitativas. Las diferencias de variables numéricas entre dos grupos se estudiaron a través del test t de Student o el test de Wilcoxon para muestras independientes, según se verificase la hipótesis de igualdad. En caso de grupos de tres o más variables se empleó el test de ANOVA o el test de Kruskal-Wallis, en función del cumplimiento de la hipótesis de normalidad y/u homocedasticidad. Las relaciones entre dos variables cualitativas se valoraron con el test de Chi-cuadrado de Pearson o test de Fisher, en función de cumplirse o no la hipótesis sobre frecuencias esperadas. El test de McNemar fue aplicado en el caso de proporciones relacionadas. Se plantearon dos modelos de regresión logística binaria multivariante para predecir niveles de TSHn>5mUI/L, calculando odds ratio (OR), intervalo de confianza al 95% y la significación del test de Wald.
Los datos se registraron en ACCESS-SQL 2010. El análisis estadístico se llevó a cabo mediante el programa R (R Development Core Team), versión 3.6.0. El nivel de significación empleado fue 0,05.
ResultadosSe reclutaron 332 gestantes, 14 de las cuales fueron retiradas por cumplir uno o varios de los criterios de exclusión. Las pérdidas de pacientes fueron por abortos (n=47) o por diagnóstico de hipotiroidismo gestacional (n=17) o por pérdida del seguimiento (n=11). Finalmente disponemos de datos de 243 parejas de madres y recién nacidos.
De los recién nacidos, 124 fueron varones. La edad gestacional media fue de 39,8±1,6 semanas, con 13 niños nacidos prematuros (<37 semanas de gestación). El peso medio al nacimiento fue de 3260±517,5g, con 16 neonatos de <2500g al nacimiento.
TSH neonatalLa determinación de la TSHn se realizó entre las 48-72h de vida en el 90,4% de los recién nacidos, con un p95 de 72h.
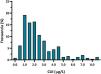
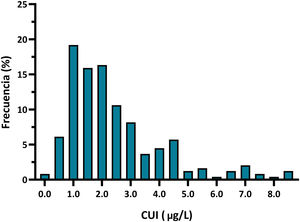
La TSHn media fue de 2,43±1,68mUI/L. El p5-p95 fue de 0,60-6,60mU/L, mientras que el p1-p99 fue de 0,25-8,60mUI/L. Todos los recién nacidos presentaban una TSHn dentro de la normalidad, con un 7,8% de neonatos con TSH>5mUI/L. La distribución de la TSHn se expresa en la figura 2.
Se analizó la TSHn según la hora de extracción de la muestra. La TSH media obtenida de las muestras obtenidas antes de las 48h fue de 3,36±1,83mUI/L, significativamente más elevada que la de las muestras obtenidas entre las 48-72h (2,44±1,69mUI/L) y las obtenidas pasadas las 72horas de vida del recién nacido (1,79±1,80mUI/L, p=0,020).
Factores maternos: ingesta de yodo, concentración urinaria de yodo y función tiroideaSe analizó la relación entre la ingesta de yodo (sal yodada, productos lácteos y suplementos yodados) y la TSHn, sin encontrar diferencias estadísticamente significativas.
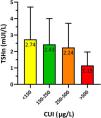
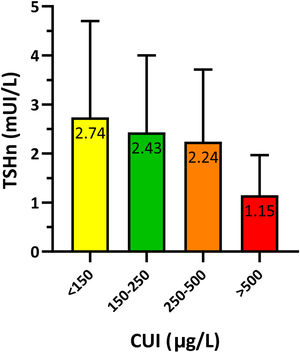
Para estudiar la relación entre la TSHn y la yoduria materna en el primer trimestre de gestación se agrupó a los recién nacidos según su madre presentase una yoduria insuficiente (<150μg/L), adecuada (150-250μg/L), «más que adecuada» (250-500μg/L) o excesiva (>500μg/L). Los resultados presentaban significación estadística (p=0,021) y se resumen en la figura 3.
Se analizó el porcentaje de niños con TSHn>5mUI/L según la yoduria materna, observándose diferencias estadísticamente significativas (p=0,014). El 11,9% de los niños de madres con CUI insuficiente presentaban TSHn>5mUI/L, frente al 8,3% de los nacidos de madres con CUI adecuada. Todos los nacidos de madres con CUI>250μg/L presentaron valores de TSHn menores de 5mUI/L.
La relación entre la TSHn y la función tiroidea materna se estudió únicamente en aquellos casos en los que disponíamos de datos de autoinmunidad tiroidea (n=128). Estos resultados se encuentran resumidos en la tabla 1. Se observó que la TSHn media era significativamente más baja en recién nacidos de madres con TSH<2,50mUI/L, independientemente del estado de la autoinmunidad tiroidea, aunque las diferencias eran más marcadas en los niños de madres con autoinmunidad positiva. Todos los niños de madres con TSH<2,50 con autoinmunidad tiroidea negativa presentaban TSHn≤5mUI/L.
Factores obstétricos y neonatalesPartoEl 56,0% de los niños nacieron de parto eutócico, el 28,4% nacieron por cesárea y el 15,6% nacieron de parto vaginal instrumental. La TSHn media fue de 2,04±1,52mUI/L en los nacidos mediante parto eutócico, 3,04±1,79mUI/L por cesárea y de 2,88±1,72mUI/L mediante parto instrumental (p<0,001).
El 4,4% de los nacidos de parto eutócico tenían una TSHn>5mUI/L frente al 7,9% de los nacidos por cesárea y el 14,5% de los nacidos de parto vaginal instrumental (p=0,039).
Peso y edad gestacionalSe analizó la TSHn de los recién nacidos de menos de 2500g comparándola con la de los recién nacidos de ≥2500g, sin encontrar significación estadística (2,73±2,71mUI/L vs. 2,41±1,59mUI/L, p=0,345).
También se analizó la TSHn de los recién nacidos de <37 semanas en comparación con la de los nacidos de 37 o más semanas. No se encontraron diferencias significativas (3,34±3,17mUI/L vs. 2,40±1,60mUI/L, p=0,224).
Riesgo de pérdida de bienestar fetalEl 24,7% de los recién nacidos presentaron RPBF. De los recién nacidos de <2500g el 31,2% presentaron RPBF frente al 19,8% de los nacidos de ≥2500g. El 23,1% de los nacidos de <37 semanas sufrieron RPBF frente al 24,8% de los nacidos de ≥37 semanas. El RPBF supuso la primera causa de realización de cesárea (41,5% del total) y de parto instrumental (64,2% del total).
Se analizó la TSHn de los niños que sufrieron RPBF comparándola con la TSHn de niños nacidos de cesárea o parto instrumental que no sufrieron RPBF y con la de niños nacidos de parto eutócico. La TSHn media de cada grupo fue: 3,22±1,84mUI/L, 2,67±1,75mUI/L y 2,02±1,52mUI/L, respectivamente (p<0,001). El 15,0% de los niños nacidos por cesárea o parto instrumental por RPBF presentaban una TSHn>5mUI/L, frente al 10,4% de los niños nacidos por cesárea o parto instrumental sin RPBF y el 4,3% de los nacidos por parto eutócico (p=0,026).
APGAR 1 minutoEl 20,2% de los recién nacidos presentaron una puntuación en el test de Apgar menor de 9 puntos en el primer minuto de vida. En estos recién nacidos la TSHn es mayor que en aquellos con Apgar1 ≥9 puntos (2,80±1,84mUI/L vs. 2,34±1,63), aunque sin significación estadística (p=0,087). El 16,3% de los recién nacidos con Apgar1 <9 puntos presentaban una TSHn>5mUI/L, frente al 5,7% de los recién nacidos con Apgar1 ≥9 puntos (p=0,031). La media de puntuación del Apgar1 en los recién nacidos con TSHn≤5mUI/L era mayor que la obtenida en los niños con TSHn>5mUI/L (8,80±0,91 puntos vs. 7,84±1,74 puntos, p=0,002).
Análisis multivarianteSe realizó el análisis univariante, así como dos modelos de análisis de regresión logística binaria multivariante (tabla 2). La variable independiente en ambos modelos fue una TSHn>5mUI/L. En el modelo 1 se analizaron las variables de ingesta de yodo, yoduria materna y función tiroidea materna. En este primer análisis se obtuvo que la yoduria materna <150μg/L era un factor de riesgo para presentar TSHn>5mUI/L (OR 3,27 [1,03-11,55], p=0,049). En el modelo 2, además de las variables previas, se analizaron las variables de tipo de parto, peso y edad gestacional, presencia de RPBF y puntuación de Apgar1. En este modelo se observó de nuevo que la yoduria materna <150μg/L fue un factor de riesgo de TSHn>5mUI/L (OR 3,70 [1,06-14,60], p=0,046), mientras que el peso neonatal ≥2500g fue un factor protector (OR 0,14 [0,02-1,00], p=0,038). Una puntuación en el Apgar1>9 puntos quedó próxima a significación estadística como factor protector de TSHn>5mUI/L.
Análisis univariante y análisis de regresión logística binaria multivariante con TSHn>5mUI/L como variable dependiente
| Análisis univariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | p | OR | IC 95% | p | |
| Modelo 1 | ||||||
| Sal yodada | ||||||
| No | - | - | - | - | - | - |
| Sí | 0,83 | 0,29-2,44 | 0,723 | 1,30 | 0,42-4,25 | 0,655 |
| Productos lácteos | ||||||
| <2 raciones | - | - | - | - | - | - |
| ≥2 raciones | 0,86 | 0,30-2,38 | 0,767 | 0,80 | 0,22-2,62 | 0,718 |
| Suplemento yodado | ||||||
| No | - | - | - | - | - | - |
| Sí | 0,92 | 0,24-6,05 | 0,913 | 0,76 | 0,15-5,66 | 0,758 |
| CUI (μg/L) | ||||||
| ≥150 | - | - | - | - | - | - |
| <150 | 3,06 | 1,18-8,53 | 0,024 | 3,27 | 1,03-11,55 | 0,049 |
| TSH (mUI/L) | ||||||
| <2,50 | - | - | - | - | - | - |
| ≥2,50 | 0,90 | 0,31-2,37 | 0,835 | 1,00 | 0,26-3,29 | 0,995 |
| Modelo 2 | ||||||
| Sal yodada | ||||||
| No | - | - | - | - | - | - |
| Sí | 0,83 | 0,29-2,44 | 0,723 | 1,48 | 0,42-5,58 | 0,548 |
| Productos lácteos | ||||||
| <2 raciones | - | - | - | - | - | - |
| ≥2 raciones | 0,86 | 0,30-2,38 | 0,767 | 0,76 | 0,19-2,82 | 0,690 |
| Suplemento yodado | ||||||
| No | - | - | - | - | - | - |
| Sí | 0,92 | 0,24-6,05 | 0,913 | 1,05 | 0,16-10,09 | 0,961 |
| CUI (μg/L) | ||||||
| ≥150 | - | - | - | - | - | - |
| <150 | 3,06 | 1,18-8,53 | 0,024 | 3,70 | 1,06-14,60 | 0,046 |
| TSH (mUI/L) | ||||||
| <2,50 | - | - | - | - | - | - |
| ≥2,50 | 0,90 | 0,31-2,37 | 0,835 | 0,77 | 0,17-2,88 | 0,715 |
| Parto | ||||||
| Eutócico | - | - | - | - | - | - |
| Cesárea | 1,86 | 0,38-7,42 | 0,398 | 1,87 | 0,21-12,21 | 0,527 |
| Instrumental | 3,67 | 1,30-11,24 | 0,016 | 3,76 | 0,78-18,43 | 0,093 |
| Peso neonatal (g) | ||||||
| <2500 | - | - | - | - | - | - |
| ≥2500 | 0,33 | 0,09-1,54 | 0,107 | 0,14 | 0,02-1,0 | 0,038 |
| Edad gestacional (semanas) | ||||||
| <37 | - | - | - | - | - | - |
| ≥37 | 0,44 | 0,11-3,00 | 0,312 | 2,14 | 0,19-60,45 | 0,584 |
| RPBF | ||||||
| No | - | - | - | - | - | - |
| Sí | 2,03 | 0,72-5,33 | 0,158 | 0,47 | 0,09-2,16 | 0,340 |
| Apgar1 (puntos) | ||||||
| <9 | - | - | - | - | - | - |
| ≥9 | 0,31 | 0,12-0,84 | 0,018 | 0,28 | 0,07-1,04 | 0,054 |
CUI: concentración urinaria de yodo; IC: intervalo de confianza; OR: odds ratio; RPBF: riesgo de pérdida del bienestar fetal; TSHn: TSH neonatal.
En nuestro estudio la TSHn media fue de 2,43mUI/L, sin detectarse casos de TSHn>10mUI/L. La incidencia de TSHn>5mUI/L fue del 7,8%. La OMS relaciona una prevalencia mayor o igual al 3% de neonatos con TSH>5mUI/L con déficit de yodo en la población4, criterio validado posteriormente por Zimmermann et al.7. Sin embargo, las gestantes de nuestro estudio presentaban un adecuado estado nutricional de yodo12 y nuestra población general también es yodosuficiente11.
El principal motivo que puede justificar una elevada prevalencia de TSHn>5mUI/L en una población yodosuficiente es el tiempo de vida del neonato al recoger la muestra de sangre. El tiroides fetal comienza a sintetizar hormonas tiroideas a partir de la semana 18-20 de gestación2. Desde entonces se produce un aumento progresivo de la TSH, que alcanza su pico máximo a los 30-60minutos del nacimiento, con niveles de hasta 60-100mUI/L, para descender de forma brusca en las siguientes 48h y estabilizarse entre el 3°-5° día de nacimiento13,14. La OMS recomienda que se emplee una muestra de sangre total impregnada en papel y especifica que la recogida de la muestra debe realizarse a partir de las 72h del nacimiento4. Sin embargo, en nuestro estudio, como en muchos de los estudios recientes, las muestras se recogieron dentro del cribado del hipotiroidismo congénito entre las 48-72h de vida del recién nacido. En nuestro estudio se confirmó que los niveles de TSHn continúan descendiendo más allá de las 72h del nacimiento.
La medición de la TSHn es el método más sensible para detectar hipotiroidismo congénito15, pero su valor puede verse influido por múltiples factores9,10. Uno de esos factores es el estado nutricional de yodo de la madre. El tiroides fetal es muy sensible al déficit de yodo, pero también a su exceso. Esto se debe a que, en casos de exceso de yodo, el tiroides del feto no es suficientemente maduro como para escapar del efecto inhibitorio de Wolff-Chaikoff hasta la semana 36 de gestación16,17. Esto se ve reflejado en los múltiples estudios en los que la ingesta excesiva de yodo en la madre se relaciona con hipotiroidismo congénito17,18 o el uso de antisépticos yodados durante el parto induce un hipotiroidismo transitorio en los neonatos19.
En nuestro estudio no se observó relación significativa entre la TSHn y la ingesta materna de yodo, pero sí con la CUI materna en el primer trimestre de gestación. Los nacidos de madres con yodurias suficientes no presentaron TSHn>5mUI/L y, en resumen, cuanto más baja era la yoduria materna, más elevada era la TSHn. En los dos modelos del análisis multivariante se observó que el déficit de yodo materno es un factor de riesgo para presentar TSHn>5mUI/L, por lo que se confirma la relación entre la nutrición de yodo materna y la TSHn. En otros estudios los resultados son heterogéneos, con datos que confirman20,21 o rechazan22,23 esta asociación.
Otro de los factores que puede influir sobre la TSHn es la función tiroidea materna22,24. En nuestro estudio se observó que los niños nacidos de madres con TSH<2,50mUI/L presentaban cifras de TSHn significativamente más bajas que los nacidos de madres con TSH ≥2,50mUI/L, siendo estas diferencias más llamativas en los casos de madres con autoinmunidad tiroidea positiva. Además, todos los niños de madres con TSH<2,5mUI/L y autoinmunidad negativa presentaban una TSHn≤5mUI/L.
La TSHn, además de verse influida por la nutrición de yodo o la función tiroidea materna, puede modificarse por múltiples factores maternos, neonatales u obstétricos que ocasionen estrés fetal14,25. Entre estos factores se encuentra el tipo de parto, el parto pretérmino o el bajo peso gestacional.
El parto por cesárea se relaciona con las cifras de TSHn más bajas, frente al parto vaginal instrumental y el parto eutócico14,26. Estas diferencias se justifican por el aumento de catecolaminas asociado al parto vaginal9,14. Sin embargo, también hay estudios en los que no se observan diferencias según el tipo de parto22,27 y otros en los que las cifras de TSHn más elevadas corresponden a los niños nacidos por cesárea28,29. En nuestro estudio los niños nacidos por cesárea son los que presentaron una TSHn más elevada, aunque el análisis multivariante no demostró relación entre el tipo de parto y la TSHn.
Los niños nacidos pretérmino o con bajo peso presentan una mayor incidencia de hipotiroidismo congénito debido a la inmadurez del eje hipotálamo-hipofisario30. Los niños prematuros pueden presentar hipotiroxinemia transitoria en las primeras semanas de vida, con un retraso en el pico de la TSHn posnatal que se produce entre las 2-6 semanas del nacimiento2,31. El bajo peso fetal es otro factor independiente que puede influir sobre la TSHn28,32. En nuestro estudio el peso neonatal>2500g se relacionó con menor riesgo de TSHn>5mUI/L, no siendo así en el caso de la edad gestacional.
Finalmente analizamos dos factores que son indicadores directos de estrés fetal como son el riesgo de pérdida de bienestar fetal y la puntuación en el test de Apgar1. Ninguno de estos factores consiguió alcanzar significación estadística, sin embargo, en Korevaar et al.24 se asociaron diversos factores relacionados con estrés fetal, como el distrés respiratorio, con alteraciones transitorias en la función tiroidea neonatal. En esta misma línea disponemos de otros estudios que relacionan el distrés fetal33 o puntuaciones bajas en el test de Apgar34 con alteración de la función tiroidea neonatal.
La principal limitación de nuestro estudio es el bajo tamaño muestral que, aunque nos ha permitido examinar nuestros objetivos principales, nos ha impedido alcanzar significación estadística en algunos de los análisis realizados. Otra limitación del estudio es que al tratarse de un estudio retrospectivo puede haber otros factores confusores no estudiados que interfieran en nuestros resultados.
En conclusión, la prevalencia de TSHn>5mUI/L en nuestra área sanitaria fue elevada según las recomendaciones de la OMS, a pesar de tratarse de una población yodosuficiente. La TSHn es un buen marcador del estado de nutrición de yodo, como se observó por su relación con la yoduria materna en el primer trimestre de gestación, asociándose el déficit de yodo materno con mayor riesgo de TSHn>5mUI/L. Sin embargo, dado que en la actualidad la determinación de la TSHn se realiza antes de las 72h de vida del recién nacido, dentro del cribado del hipotiroidismo congénito, necesitamos nuevos puntos de corte para continuar empleando este parámetro como marcador de nutrición de yodo, para lo que se precisan de nuevos estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.