Aunque la trombosis de senos venosos cerebrales es rara, se asocia con mayor frecuencia en niños con leucemia linfoblástica aguda.
Se aporta el caso de una niña de 7 años que desarrolla una trombosis masiva de senos venosos cerebrales en el día 22 del tratamiento de inducción de leucemia linfoblástica aguda de alto riesgo. Clínicamente se manifestaron de forma progresiva cefalea, disminución del nivel de conciencia y hemiplejía izquierda. El estudio de trombofilia posterior reveló heterocigosis para la variante de la protrombina G20210A en la niña y en la madre. Se analizan los factores protrombóticos encontrados en el caso antes y después de la trombosis.
Se confirma la importancia de investigar precozmente tanto los factores de riesgo de trombosis adquiridos como los estados de trombofilia primaria en niños con leucemia linfoblástica. Esta estrategia podría ayudar a identificar a pacientes de especial riesgo e instaurar en ellos tromboprofilaxis.
Although cerebral venous thrombosis is rare, it is more commonly associated with children suffering from acute lymphoblastic leukaemia.
We report the case of a 7-year-old girl who developed massive cerebral sinovenous thrombosis on day 22 of induction therapy for high-risk acute lymphoblastic leukaemia. Clinical symptoms were gradual onset of headache, decreasing consciousness, and ensuing left hemiplegia. A subsequent prothrombotic study revealed a heterozygous prothrombin G20210A variant in the child and mother. We analysed the prothrombotic factors found in the case before and after thrombosis.
We confirm the importance of early exploration of patients for clinical predisposing risk factors of thrombosis and primary prothrombotic states in children with acute lymphoblastic leukaemia. This might help identify patients at particular risk from thrombosis and so administer thromboprophylaxis.
La incidencia anual de trombosis venosa en población pediátrica se estima en uno por 100.000 niños. El factor adquirido más importante es el uso de un catéter venoso central (CVC), si bien se utiliza en patologías que por sí solas predisponen a la trombosis1–4 (tabla 1). El riesgo de trombosis se incrementa en niños con leucemia linfoblástica aguda (LLA)2,5, y los mecanismos que contribuyen son la administración de L-asparraginasa junto con prednisona5–7 y la concurrencia de trombofilia primaria5,8 o alteraciones adquiridas, como la presencia de infección y de anticuerpos antifosfolípidos9.
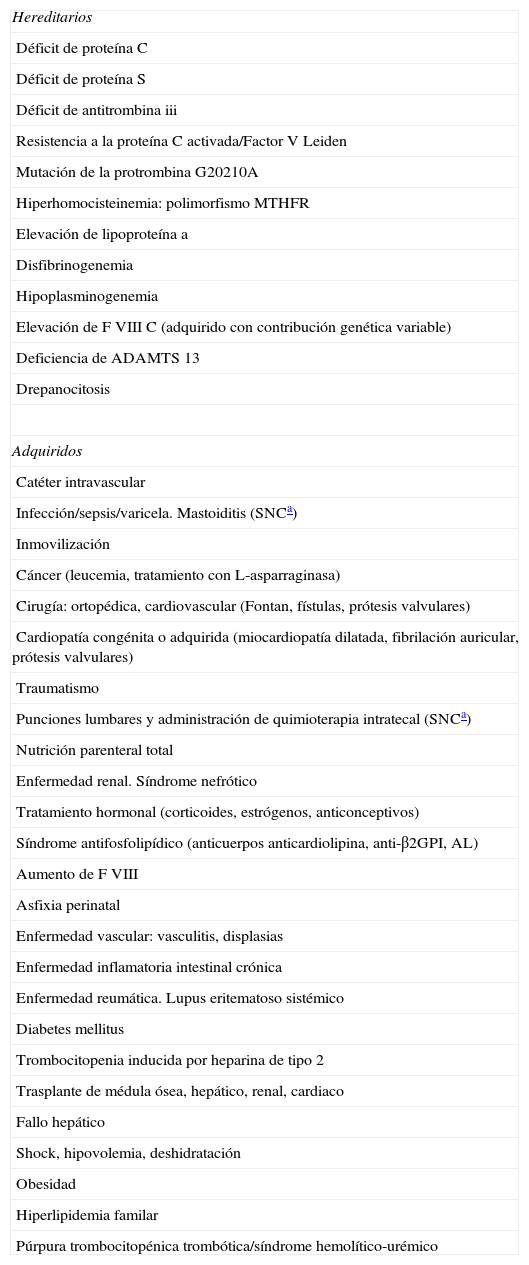
Factores generales de riesgo trombogénico hereditarios y adquiridos
| Hereditarios |
| Déficit de proteína C |
| Déficit de proteína S |
| Déficit de antitrombina iii |
| Resistencia a la proteína C activada/Factor V Leiden |
| Mutación de la protrombina G20210A |
| Hiperhomocisteinemia: polimorfismo MTHFR |
| Elevación de lipoproteína a |
| Disfibrinogenemia |
| Hipoplasminogenemia |
| Elevación de F VIII C (adquirido con contribución genética variable) |
| Deficiencia de ADAMTS 13 |
| Drepanocitosis |
| Adquiridos |
| Catéter intravascular |
| Infección/sepsis/varicela. Mastoiditis (SNCa) |
| Inmovilización |
| Cáncer (leucemia, tratamiento con L-asparraginasa) |
| Cirugía: ortopédica, cardiovascular (Fontan, fístulas, prótesis valvulares) |
| Cardiopatía congénita o adquirida (miocardiopatía dilatada, fibrilación auricular, prótesis valvulares) |
| Traumatismo |
| Punciones lumbares y administración de quimioterapia intratecal (SNCa) |
| Nutrición parenteral total |
| Enfermedad renal. Síndrome nefrótico |
| Tratamiento hormonal (corticoides, estrógenos, anticonceptivos) |
| Síndrome antifosfolipídico (anticuerpos anticardiolipina, anti-β2GPI, AL) |
| Aumento de F VIII |
| Asfixia perinatal |
| Enfermedad vascular: vasculitis, displasias |
| Enfermedad inflamatoria intestinal crónica |
| Enfermedad reumática. Lupus eritematoso sistémico |
| Diabetes mellitus |
| Trombocitopenia inducida por heparina de tipo 2 |
| Trasplante de médula ósea, hepático, renal, cardiaco |
| Fallo hepático |
| Shock, hipovolemia, deshidratación |
| Obesidad |
| Hiperlipidemia familar |
| Púrpura trombocitopénica trombótica/síndrome hemolítico-urémico |
AL: anticoagulante lúpico; Anti-β2GPI: anticuerpos frente a β2 glucoproteína i; SNC: sistema nervioso central.
Niña de 7 años y 9 meses de edad, con antecedentes de síndrome de West idiopático en tratamiento con levetiracetam. Ingresa por haber presentado 20 días antes una anemia aguda. Mediante estudio de aspirado medular es diagnosticada de LLA de estirpe B, inmunofenotipo común, ausencia de alteración citogenética/molecular desfavorable y estudio de líquido cefalorraquídeo normal. Previa implantación de CVC se inicia tratamiento de inducción de riesgo estándar con daunorrubicina, vincristina, prednisona, ciclofosfamida, L-asparraginasa y triple intratecal (citarabina, metotrexato e hidrocortisona), según protocolo LAL/SHOP-2005.
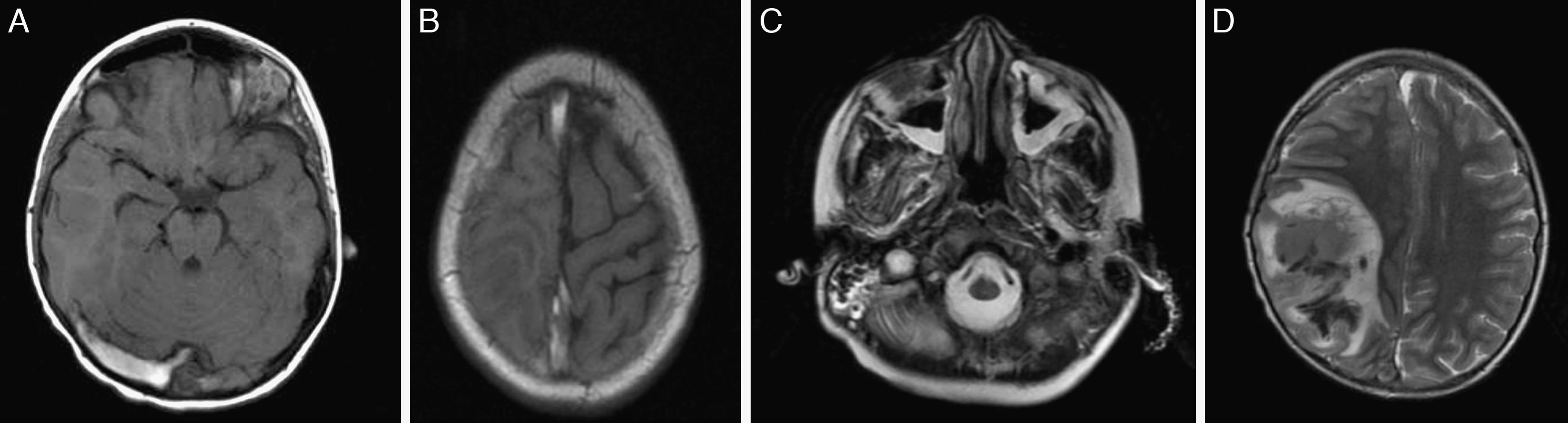
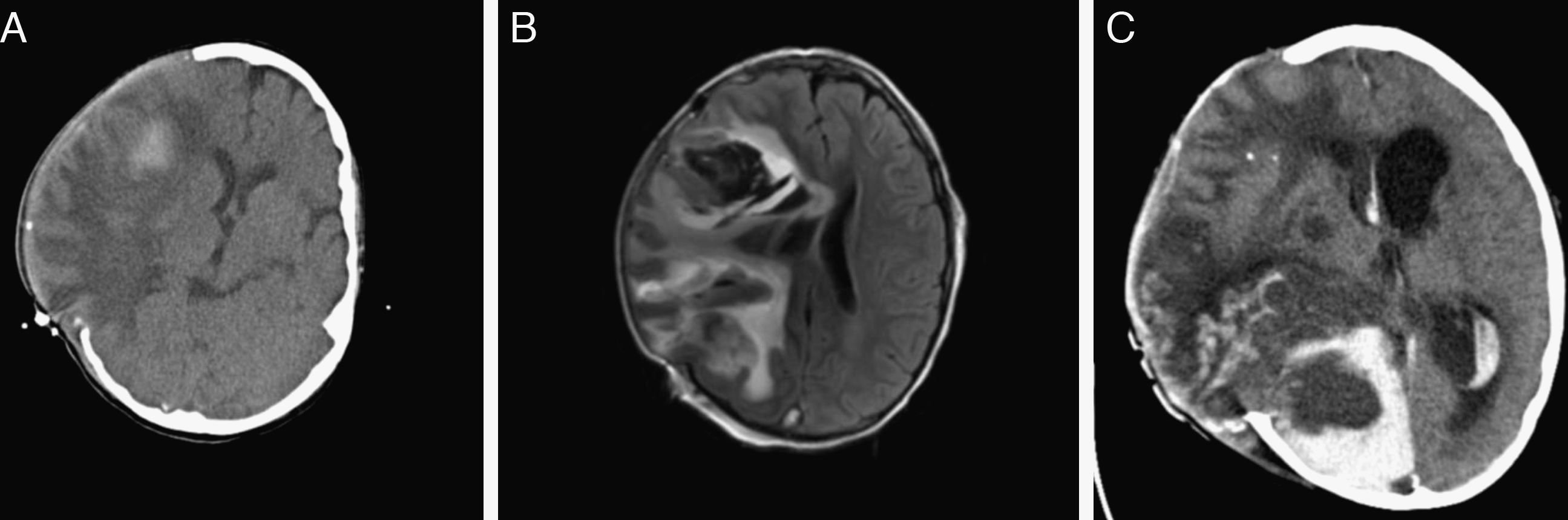
En el día +9, coincidiendo con neutropenia grave, inicia proceso febril de 4 días de evolución, evidenciándose condensación neumónica y aislamiento en los hemocultivos de Streptococcus pneumoniae y Staphilococcus aureus. Tratamiento con antibioterapia parenteral de larga duración. En el día +14 se apreció un 13% de blastos en médula ósea, determinando el cambio hacia paciente de alto riesgo. En el día +22, tras la administración de la quinta dosis de L-asparraginasa, inicia cefalea intensa y un día después se objetivan somnolencia y hemiplejía braquiocrural izquierda que motivan la realización de TAC y RMN cerebral, encontrándose trombosis venosa del seno longitudinal superior, transverso y sigmoideo derecho que llega hasta la vena yugular interna y el catéter central, y hemorragia intracraneal parietal derecha, además de ocupación de senos maxilares y mastoiditis derecha (fig. 1). La paciente fue trasladada a la Unidad de Cuidados Intensivos. Se instauró tratamiento con heparina sódica intravenosa, presentando a las 48h nuevo sangrado parenquimatoso con signos de herniación, por lo que se realizó craniectomía descompresiva, a pesar de lo cual posteriormente presentó resangrado y persistencia de la trombosis masiva (fig. 2). Se suspendió la administración de asparraginasa manteniendo el resto de quimioterapia, presentando en el día +30 una enfermedad mínima residual del 2,3%. Después del diagnóstico de trombosis se evidenció disminución de las tasas de antitrombina iii (33%) y de fibrinógeno (<0,5g/l), y el estudio de trombofilia mostró mutación de la protrombina G20210A en heterocigosis y anticoagulante lúpico positivo. Ante la progresión de la leucemia y la intensa afectación neurológica se decidió evolutivamente realizar tratamiento paliativo, falleciendo la paciente a los 2 meses del ingreso. En el estudio familiar la madre presentó mutación de la protrombina.
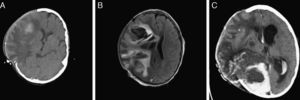
Imágenes de TC (A) y resonancia magnética (B y C) evolutivas. Progresión del hematoma parietal hacia lóbulo frontal que precisa craniectomía descompresiva (A y B). C) Estadio final con aumento del edema y por tanto de su efecto compresivo sobre el parénquima cerebral que protruye sobre la craniectomía. Hematomas intraparenquimatosos de nueva aparición en hemisferio cerebral derecho. Hematoma subdural y hemorragia intraventricular de nueva aparición. Hidrocefalia tetraventricular.
La incidencia de trombosis en niños con LLA presenta variabilidad según las series2. Un metaanálisis que incluyó 1.752 niños establece una incidencia global del 5,2%, y del 2,9% para la trombosis del sistema nervioso central (SNC)5. Se produce principalmente durante la fase de inducción del tratamiento y puede ser potencialmente fatal en el 50% de los casos2. En la patogenia se incluyen una combinación de elementos que se relacionan con la propia enfermedad, su tratamiento y factores individuales del paciente6,10 (tabla 2).
Factores de riesgo trombótico demostrados en niños con leucemia aguda linfoblástica y factores encontrados en nuestra paciente antes y después del diagnóstico de trombosis
| Factores de riesgo trombótico demostrados en niños con LLA | Factores de riesgo trombótico presentes en la paciente previamente al diagnóstico de trombosis | Factores de riesgo trombótico encontrados en la paciente posteriormente al diagnóstico de trombosis |
| Factores adquiridos presentes de forma muy constante por el diagnóstico y tratamiento | ||
| 1. Enfermedad maligna | Sí | |
| 2. Catéter intravascular | Sí | |
| 3. Tratamiento con L-asparraginasa concomitante a prednisona | Sí | Disminución de antitrombina iii y fibrinógeno |
| 4. Infección secundaria a inmunodeficiencia | Sí | |
| 5. Punciones lumbares y administración de quimioterapia intratecala | Sí | |
| Factores adquiridos variables | ||
| 6. Estratificación de la LLA en alto riesgo | Sí | |
| 7. Edad mayor de 10 años | ||
| 8. Anticuerpos antifosfolípidos adquiridos | Sí | |
| 9. Afectación leucémica del SNCa | ||
| 10. Mastoiditisa | Sí | |
| Factores hereditarios | ||
| 11. Concomitancia con algún defecto congénito protrombótico | Sí: mutación de la protrombina G20210A | |
LLA: leucemia aguda linfoblástica; SNC: sistema nervioso central.
Un importante factor trombogénico en los niños con LLA son los agentes quimioterápicos. La L-asparraginasa produce un descenso de la síntesis hepática de proteínas dependientes de la L-asparragina, causando inhibición de factores anticoagulantes como la antitrombina iii (que predispone a la trombosis) y fibrinógeno (que predispone a la hemorragia), estableciendo un equilibrio más inestable. Muchos estudios encuentran relación directa entre su administración y trombosis2,9–11, y la asociación de trombosis del SNC se reporta con una frecuencia de entre el 1 y el 3%12. Además se ha establecido un mayor potencial efecto trombogénico de la L-asparraginasa al asociarse con corticoides, encontrándose mayor incidencia cuando se asocia prednisona (10,4%) que dexametasona (1,8%)13. También aumenta la incidencia en pacientes de alto riesgo, por el uso de dosis más altas de esteroides y L-asparraginasa11, y en pacientes por encima de los 10 años, pero este efecto puede reflejar la influencia de la edad en la estratificación del riesgo11. Además se han reportado algunas diferencias en la incidencia de trombosis entre diferentes dosis, duración y tipo de procedencia de L-asparraginasa5.
En cuanto a otros posibles factores adquiridos estudiados en niños con LLA y trombosis, se ha encontrado mayor tasa de infección y de anticuerpos antifosfolípidos9. Para la trombosis de senos venosos del SNC son factores de riesgo adquiridos la presencia de infiltración leucémica en el SNC, la administración de terapia intratecal y la infección de senos o mastoides7.
En niños con LLA se ha documentado la misma frecuencia de trombofilia congénita que en la población general, siendo esta concurrencia un importante factor de variabilidad en cuanto al riesgo de trombosis8. Algunos autores no encuentran aumento de riesgo9,14,15 y otros sí16,17; un metaanálisis establece que la presencia de al menos un factor de trombofilia primaria aumenta 8 veces el riesgo de trombosis en niños con LLA5.
Previamente al diagnóstico de la trombosis nuestra paciente presentó 6 de los 11 factores de riesgo trombótico establecidos, revisados con anterioridad (tabla 2). Analizando los factores de riesgo presentes antes del diagnóstico, es posible que muchos de los niños con LLA presenten el mismo número. Sin embargo, cuando se amplió el estudio después del diagnóstico de trombosis, se encontraron 2 nuevos factores adquiridos (anticuerpos antifosfolípidos y mastoiditis) y un factor congénito protrombótico (mutación de la protrombina) y, como resultado, la presencia de 9 de los factores (tabla 2).
Algunas iniciativas de tromboprofilaxis se han realizado para intentar disminuir la frecuencia y gravedad de la trombosis en niños con LLA. El uso de anticoagulantes no se ha extendido porque estos pacientes presentan alto riesgo de hemorragia11. Se ha utilizado la administración de antitrombina iii18, plasma fresco19 o heparina de bajo peso molecular 14, sin resultados concluyentes. Sin embargo, numerosos autores concluyen que la profilaxis podría ser eficaz si se administrara a grupos de pacientes con especial riesgo11,14,18,19. Se han buscado marcadores de riesgo de trombosis durante el tratamiento de la LLA, pero no se ha encontrado valor predictivo para niveles de antitrombina iii, dímero D y otros parámetros20.
En conclusión, parece relevante recomendar estudio de trombofilia primaria a todos los casos de LLA en niños previamente a iniciar el tratamiento, y realizar monitorización de factores adquiridos variables como la presencia de anticuerpos antifosfolípidos asociados o no a infección. La presencia de trombofilia primaria y/o factores de riesgo variables asociados puede requerir el uso individualizado de tromboprofilaxis. Analizadas las posibles alternativas, la más eficaz podría ser la administración de plasma fresco congelado junto con cada dosis de asparraginasa, ya que aporta tanto factores procoagulantes como anticoagulantes y podría restablecer el equilibrio hemostático, y a la vez es segura al controlar el desequilibrio hacia la hemorragia. Si bien esta estrategia no ha demostrado eficacia cuando no se selecciona a los pacientes19, podría serlo en niños en los que se acumulen factores de riesgo trombótico como trombofilia primaria o factores variables adquiridos sumativos. Son necesarios estudios prospectivos que puedan validar la eficacia y seguridad de estrategias preventivas de trombosis en niños con LLA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.