La infección por citomegalovirus (CMV) es la infección congénita más frecuente en los países desarrollados y aparece entre un 0,3 y un 2,4% de los recién nacidos1. La gran mayoría se produce tras una primoinfección materna durante el embarazo. En este caso, el 40% de los fetos se infectan y un 10% de los fetos presentan síntomas al nacimiento2. En más de la mitad de estos niños y en un 13% de los que nacen sin síntomas se desarrollan secuelas permanentes, especialmente hipoacusia neurosensorial1. La sordera suele ser moderada o grave (entre 50 y 100 db), en un 60% es bilateral y puede progresar dentro de los primeros 6 años de vida3. El tratamiento con ganciclovir intravenoso disminuye el riesgo de hipoacusia progresiva en los niños con infección sintomática y afectación del sistema nervioso central (SNC), aunque debe administrarse por vía intravenosa durante 6 semanas4. El valganciclovir es un profármaco del ganciclovir con buena biodisponibilidad oral que puede ser una opción viable para el tratamiento prolongado de los niños con infección congénita por CMV5. A continuación se presenta el caso de una lactante con CMV congénito sintomático tratada con valganciclovir oral de forma prolongada.
Caso clínicoSe trata de una recién nacida a término que ingresa en la Unidad de Neonatología de su hospital de origen para estudio por hidrocefalia.
Historia gestacionalSe trata del segundo embarazo de una mujer de 37 años, sin afección médica destacable y con una hija sana de 4 años. Se controla el embarazo en un centro privado. La madre es inmune frente a la rubéola y la serología gestacional para virus de la hepatitis B, virus de la inmunodeficiencia humana (VIH), sífilis y toxoplasma es negativa. Su ginecólogo le realiza también serología para CMV en la semana 16, a pesar de que no forma parte del cribado serológico habitual, y la inmunoglobulina G (IgG) resulta positiva. No se realiza inmunoglobulina M (IgM) ni se determina la avidez de la IgG. En la semana 20 de gestación se evidencia hidrocefalia, que se confirma mediante una resonancia magnética (RM) fetal. Se realiza amniocentesis para la determinación de cariotipo, que resulta normal. No se realiza cultivo ni la reacción en cadena de la polimerasa (PCR) para CMV en líquido amniótico. El parto se produce en la semana 37; se realiza cesárea por presentación de nalgas, sin complicaciones.
Historia neonatalEl peso al nacimiento fue de 2.680 g (p3-10), la talla fue de 48 cm (p25) y el perímetro cefálico fue de 32 cm (p10-25). La temperatura fue de 36 °C y la presión arterial fue de 73/44.
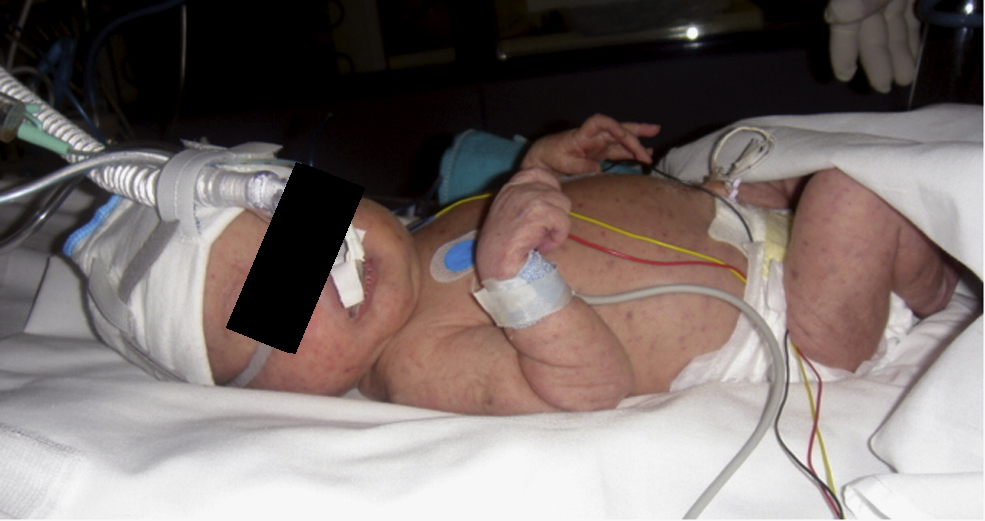
En la exploración física presenta petequias generalizadas y lesiones papulares azul violáceas características de eritropoyesis extramedular (fig. 1), hepatomegalia de 3 cm, esplenomegalia de 4 cm, soplo sistólico de 1 a 2/6, hipotonía axial, llanto y succión débiles; el resto de la exploración fue normal. En la analítica se observa 16 g/dl de hemoglobina; 47,7% de hematrocitos; un recuento de leucocitos de 15,680×109/l (41%N, 38%L, 10%M); plaquetas de 20×109/l; PCR de 0,82 mg/l.
Figura 1. Exantema petequial y fenómenos de eritropoyesis extramedular.
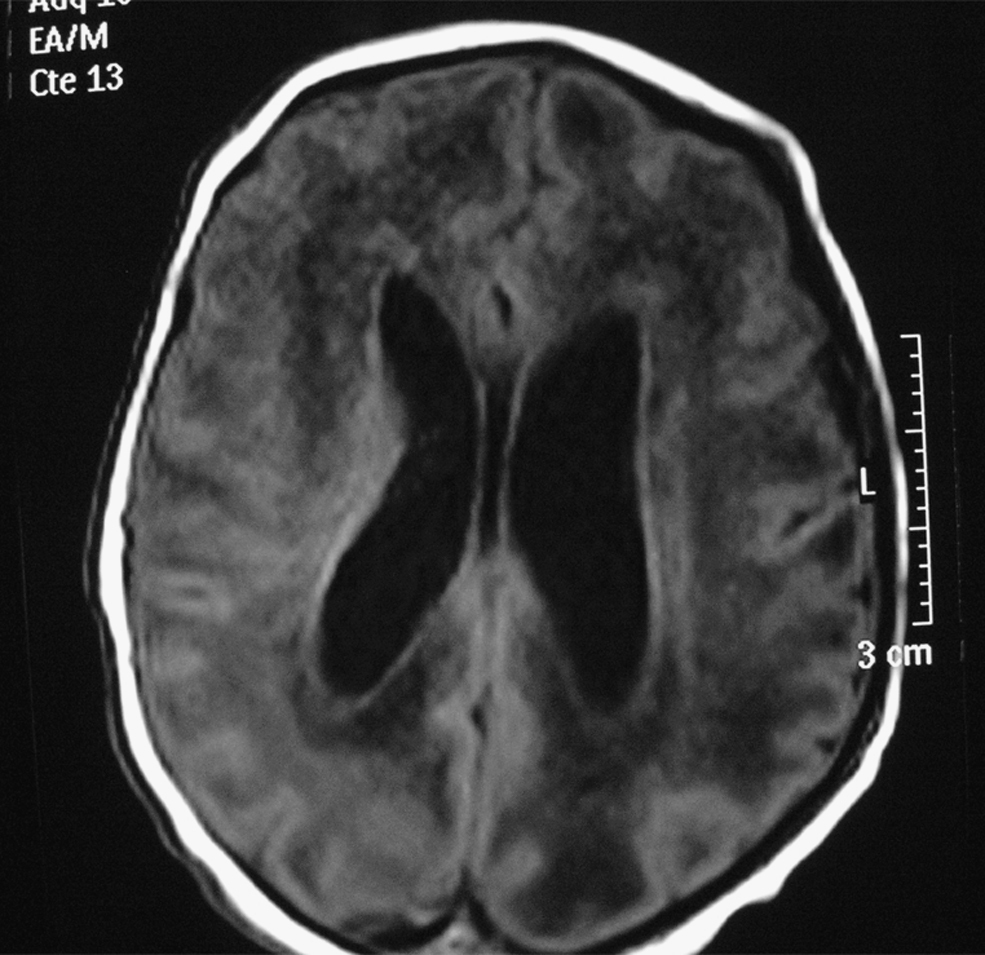
En la bioquímica se observaron 243 U/l de aminotransferasa glutamicoxalacética (GOT), 218 U/l de aminotransferasa glutámico pirúvica (GPT) y 258 U/l de gammaglutamil transpeptidasa. El estudio de coagulación fue normal. La ECO cerebral mostró ventriculomegalia leve, un parénquima cerebral hiperecogénico y vasculopatía de las arterias tálamo-estriadas. No hubo signos de hemorragia. La RM cerebral mostró ventriculomegalia y alteración difusa de la señal en sustancia blanca (fig. 2). El electroencefalograma mostró un trazado normal. La ECO abdominal mostró hepatoesplenomegalia homogénea. El electrocardiograma y la ecocardiografía fueron normales. Se realizó serología para sífilis, toxoplasma, VIH y parvovirus que resultó negativa y serología para CMV, IgM e IgG, que resultó positiva. La punción lumbar fue de 15×106 cél/l, la glucosa fue de 61 mg/dl, las proteínas fueron de 90 mg/dl. El cultivo de orina a los 7 días de vida fue positivo para CMV. La PCR para CMV en sangre y el líquido cefalorraquídeo fueron positivos. El fondo de ojo fue normal. Los potenciales evocados auditivos mostraron ausencia de respuesta a >110 dB en el oído izquierdo (OI) y normalidad en oído derecho (OD). En el primer día y en el tercer día de vida, la niña precisó transfusión de plaquetas, y requirió alimentación por sonda nasogástrica hasta el octavo día. También se inició ventilación no invasiva (presión positiva continua en la vía respiratoria nasal) hasta la semana de vida por pausas de apnea con bradicardia. Se decide no iniciar tratamiento con ganciclovir al considerar que no mejoraba el pronóstico de su enfermedad y por presentar importantes efectos secundarios. Se le da de alta a los 15 días de vida.
Figura 2. Resonancia magnética cerebral en la que se aprecia ventriculomegalia y alteración difusa de la sustancia blanca.
Historia en nuestra unidadA los 2 meses de vida los padres buscan una segunda opinión en este servicio. En la exploración física se apreció una hipotonía axial, con escasa motilidad espontánea y llanto débil. Los reflejos osteotendinosos fueron normales y simétricos; la fontanela, amplia, normotensa, con perímetro craneal en el p25. La hepatomegalia fue de 3 cm y el resto fue normal.
En la analítica destacaron un recuento de plaquetas de 103×109/l y un aumento de aminotransferasas (GOT de 146 U/l y GPT de 166 U/l). La cuantificación de viremia de CMV por PCR (affigene® CMV trender) fue de 5,6×105 copias/ml. Se repitieron potenciales evocados auditivos y persistieron ausentes (>110 db) en el OI, pero mostraron una pérdida moderada (40 db) en el OD. Se decide iniciar tratamiento con ganciclovir intravenoso (12 mg/kg/día en 2 dosis) durante 15 días, con disminución de la carga viral en sangre y orina y normalización de las plaquetas y de las aminotransferasas. Tras solicitar autorización como uso compasivo, se continuó el tratamiento con suspensión oral de valganciclovir a 30 mg/kg/día en 2 dosis durante 6 meses. La medicación fue bien tolerada, sin observarse diarrea ni toxicidad hematológica y con concentraciones plasmáticas adecuadas (5 μg/ml en pico y 0,25 μg/ml en valle) a los 15 días de su administración. Al mes de tratamiento la detección de CMV en orina fue negativa y la viremia se hizo indetectable. A los 6 meses el cultivo de orina para CMV persiste negativo, los potenciales evocados muestran una leve mejoría en la audición del OD (20 dB) y la niña presenta un retraso psicomotor leve.
DiscusiónEl ganciclovir se utiliza en neonatos con infección congénita sintomática por CMV en un intento de disminuir las secuelas. En un estudio de fase iii , aleatorizado y controlado con placebo, se estudió la eficacia del ganciclovir intravenoso (12 mg/kg/día en 2 dosis durante 6 semanas) en la prevención de la sordera neurosensorial en niños con infección congénita y afectación del SNC4. No se observó deterioro auditivo en ningún niño tratado con ganciclovir a los 6 meses de seguimiento, en comparación con el 41% de los controles (p<0,01). Sin embargo, no pudo demostrarse el efecto beneficioso en el desarrollo psicomotor a medio plazo. La desaparición del virus en sangre y orina se ha relacionado con un mejor pronóstico neurológico6, si bien no hay en este momento ensayos amplios que avalen esta hipótesis. La aparición de secuelas es mucho más frecuente en niños con microcefalia, convulsiones o alteraciones estructurales cerebrales7; sin embargo, el desarrollo psicomotor de los niños con infección sintomática es muy variable e impredecible al nacimiento. Por tanto, todos los niños con infección congénita sintomática y afectación del SNC deben recibir tratamiento antiviral durante el primer mes de vida para prevenir el desarrollo de sordera y mejorar en el futuro su capacidad de lenguaje y aprendizaje.
En esta paciente el tratamiento no se inició de forma precoz y se detectó hipoacusia progresiva a los 2 meses de vida. El tratamiento de los niños mayores de un mes es más controvertido por la falta de ensayos clínicos controlados. Sin embargo, los autores de este artículo opinan que estos pacientes también pueden beneficiarse de un tratamiento antiviral, que mejora rápidamente la trombocitopenia y la hepatitis por CMV y previene la progresión de la hipoacusia que puede desarrollarse hasta los 6 años de vida2.
Los efectos beneficiosos en la prevención de la sordera en niños tratados con ganciclovir durante 6 semanas se mantienen al año de seguimiento, si bien en un 21% se desarrolla algún grado de hipoacusia4. Muchos autores sugieren que un tratamiento antiviral más prolongado podría obtener mayores beneficios, tanto neurológicos como auditivos8. Dos estudios han evaluado la eficacia del ganciclovir oral de forma prolongada en niños sintomáticos con afectación del SNC9,10. Ningún paciente tuvo deterioro de la función auditiva tras una media de seguimiento de hasta 2 años9. Sin embargo, este fármaco tiene la gran desventaja de su pobre biodisponibilidad oral, por lo que se precisan concentraciones muy elevadas a fin de conseguir valores aceptables10.
El valganciclovir es un profármaco del ganciclovir con una biodisponibilidad aproximadamente del 60% y está indicado en el tratamiento de la retinitis por CMV en pacientes con síndrome de inmunodeficiencia adquirida y en la prevención y el tratamiento de la enfermedad por CMV en pacientes seronegativos con trasplante de órgano sólido11. En su ficha técnica, no se recomienda la administración en niños debido a la escasez de datos sobre seguridad y eficacia11, por lo que debe solicitarse como uso compasivo. El fármaco se comercializa en comprimidos de 450 mg y en polvo para suspensión oral (50 mg/ml). Un reciente estudio de farmacocinética en neonatos ha establecido que las dosis de 16 mg/kg por vía oral son equivalentes a 6 mg/kg de ganciclovir intravenoso12,13. Los efectos secundarios son los mismos que tras la administración de ganciclovir, los efectos más frecuentes son la aparición de neutropenia, anemia y diarrea11. La administración de valganciclovir en neonatos es bien tolerada y consigue inhibir la replicación viral de forma prolongada14–16, incluso en prematuros de muy bajo peso16. En esta paciente se alcanzaron buenas concentraciones plasmáticas y se suprimió la eliminación del virus en orina durante su administración, además se observó una leve disminución de la hipoacusia en el oído menos afectado, que se ha mantenido al año de seguimiento.
En conclusión, el valganciclovir puede ser una buena alternativa al ganciclovir intravenoso en los niños con infección congénita sintomática por CMV, puede facilitar su tratamiento ambulatorio y puede obviar los problemas derivados de un acceso intravenoso prolongado. Sin embargo, son necesarios más estudios para definir la duración óptima del tratamiento y su impacto en la disminución de la sordera progresiva de estos pacientes.
Autor para correspondencia.
F. Baquero-Artigao
Dirección: fbaquero@terra.es