Introducción
A pesar de los avances significativos que el tratamiento del asma ha experimentado en las últimas décadas, las crisis o ataques o exacerbaciones asmáticas (asma aguda) siguen siendo la causa más común de consultas en las unidades de emergencia (UE) en pediatría1. Cerca de dos millones de niños consultan anualmente por asma aguda y un 20 % de ellos recaen y requieren una nueva visita a la UE en las tres semanas siguientes2; y el 30 % de los niños tratados por crisis asmáticas en las UE tienen que ser hospitalizados por fracaso del tratamiento3. En Estados Unidos, las visitas a las UE y las hospitalizaciones por asma aguda representan tres cuartos de los costos directos por asma, lo que significa unos 6.200 millones de dólares anuales4. En España, casi el 6 % de las urgencias hospitalarias se deben a asma aguda5. En Chile, las consultas por crisis obstructivas posinfecciones virales son la primera causa de consulta en las UE en los meses de invierno en pediatría6.
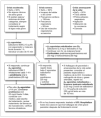
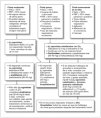
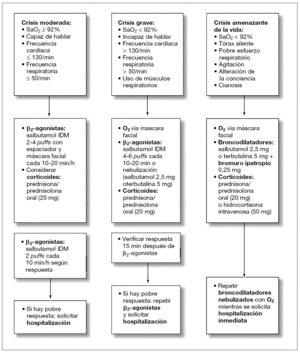
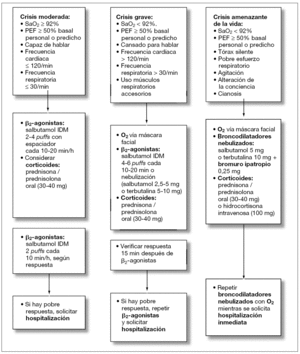
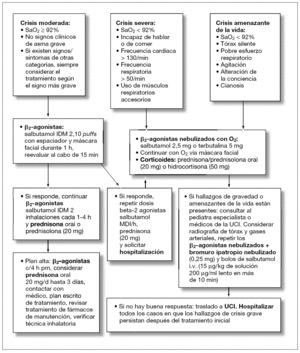
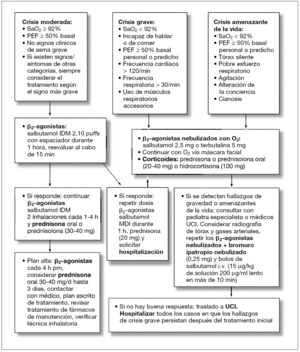
El asma aguda es una emergencia médica que debe ser diagnosticada y tratada rápidamente. Los niños con crisis asmática deben ser evaluados en dos dimensiones, una fase estática (determinación de la gravedad de la crisis al ingreso) y una fase dinámica (su respuesta al tratamiento). Avances en la elaboración de protocolos de tratamiento de la crisis asmática en la atención primaria (figs. 1 y 2) y en las UE (figs. 3 y 4) y la identificación de factores de riesgo para predecir qué niños son los que no van a responder al tratamiento en las UE han sido diseñados con el objetivo de modificar este panorama.
Figura 1. Tratamiento del asma aguda en niños de 2-5 años en la atención primaria.
Figura 2. Tratamiento del asma aguda en niños de más de 5 años en la atención primaria.
Figura 3. Tratamiento del asma aguda en niños 2-5 años en la unidad de emergencia.
Figura 4. Tratamiento del asma aguda en niños de más de 5 años en la unidad de emergencia.
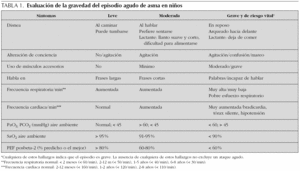
En general y en cualquier nivel de atención, antes de que el paciente reciba el tratamiento específico para el asma aguda, es fundamental evaluar la gravedad del cuadro (tabla 1). Por eso, la historia y el examen clínico rápido y detallado deben realizarse junto con el pronto inicio del tratamiento. La historia debe incluir antecedentes como la gravedad y duración de los síntomas, limitación al ejercicio, despertares nocturnos, tiempo de inicio de la crisis y sus probables causas desencadenantes, drogas usadas como terapia de mantenimiento y durante previas crisis asmáticas y la existencia de factores de riesgo para el asma casi fatal. Deben registrarse los siguientes signos clínicos: frecuencia cardíaca (el incremento de la taquicardia generalmente denota un empeoramiento del asma, y una caída de la frecuencia cardíaca en un niño con asma casi fatal señala un episodio preterminal), frecuencia respiratoria y grado de dificultad respiratoria (prestar atención a si el paciente no logra completar una frase en una sola toma de aire o no puede alimentarse), uso de músculos respiratorios accesorios (la palpación en el cuello es el mejor modo de evidenciarlo), sibilancias (si son bifásicas o menos aparentes sugieren un incremento de la obstrucción), grados de agitación y de conciencia. Por último, se debe hacer un esfuerzo por identificar toda complicación potencial como neumonías, atelectasia, neumotórax o neumomediastino. Sin embargo, no se aconseja realizar radiografía de tórax de forma sistemática, salvo que clínicamente se sospeche la existencia de alguna enfermedad parenquimal7-9.
Los síntomas clínicos son una medida sensible de la crisis asmática, ya que, por lo general, preceden el deterioro del pico espiratorio forzado (PEF), especialmente en pacientes con historia de asma casi fatal. Aquellos pacientes con alto riesgo de asma casi fatal (p. ej., historia previa de intubación o ventilación mecánica, hospitalización o consulta previa a la UE el año anterior, uso de corticoides orales, no uso de corticoides inhalados, sobredependientes de los β2-agonistas o con un consumo de 1 canister/mes, historia de problemas psicosociales o psiquiátricos incluyendo uso de sedantes e historia de falta de adherencia al plan de tratamiento del asma) requieren una monitorización más cercana y deberían ser vistos en el nivel terciario lo más precoz durante sus exacerbaciones asmáticas8.
Sin embargo, también se sabe que los signos clínicos pueden correlacionar pobremente con el grado de obstrucción bronquial, y algunos niños con crisis asmática grave no presentan aparentemente dificultad respiratoria. Por lo tanto, es esencial contar con medidas objetivas funcionales como espirometría, PEF y saturación de oxígeno (SaO2) en todos los pacientes con crisis asmáticas. Por eso se aconseja que todos los niveles de atención (primarios o secundarios) en los que se atienda a este tipo de pacientes deban contar con dichos equipos (espirómetro o flujómetro y saturómetro). Los niños menores de 5 años son la excepción para realizar espirometrías o PEF, pero en los niños mayores se deberá hacer el intento de realizarlas y consignar la mejor de tres medidas y expresarla como porcentaje del mejor PEF personal o, alternativamente, como tanto por ciento del PEF predicho o del volumen espiratorio forzado en el primer segundo (VEF1) predicho. No se recomienda la toma sistemática de gases arteriales, pero sí se aconseja efectuarla en aquellos pacientes con PEF de 30-50 % del predicho que no han respondido al tratamiento inicial o si se están deteriorando. Dicho paciente debe estar con aporte de oxígeno mientras se realiza la toma de gases arteriales. Una PaO2 < 60 mmHg y una PaCO2 normal o incrementada (especialmente > 45 mmHg) indican fallo respiratorio7,8.
Schuh et al1 estudiaron 120 niños (5-17 años) con crisis asmática que acudieron a una UE y reportaron que el examen clínico inicial no predijo la necesidad de hospitalización. Sin embargo, 2 h después del tratamiento con broncodilatadores nebulizados, aquellos niños con un VEF1 predicho ≤ 30 % y un puntaje de asma ≥ 6 (sobre un total de 9) tuvieron una alta probabilidad de ser hospitalizados y, por el contrario, aquellos con VEF1 predicho ≥ 60 % y un puntaje de asma < 3 tuvieron alta probabilidad de ser dados de alta y enviados a casa. No obstante, una limitante de ese estudio fue que los pacientes no recibieron corticoides sistémicos. Geelhoed et al10 demostraron que los niños con SaO2 < 91 % fueron significativamente más propensos a requerir hospitalización o a volver a consultar a la UE. Mehta et al11, en un estudio prospectivo, enrolaron a 273 niños (mayores de un año) con crisis asmática y reportaron que el tener una SaO2 ≤ 91 % fue un buen predictor de requerir un tratamiento broncodilatador prolongado por más de 4 h y aquellos con SaO2 ≤ 89 % requirieron tratamiento durante más de 12 h. En este estudio, los niños sí recibieron corticoides sistémicos. Keogh et al12, en un estudio prospectivo diseñado para identificar la necesidad de hospitalización en 278 niños (> de 1 año) que acudieron a una UE por crisis asmática, informaron sobre la combinación de 3 o más factores: historia previa de admisión a la unidad de cuidados intensivos (UCI), SaO2 ≤ 92 % basal más un puntaje clínico de asma ≥ 6 (sobre un total de 9), necesidad de uso muy frecuente de broncodilatadores y una SaO2 ≤ 92 % a la cuarta hora después del tratamiento con corticoides sistémicos; predijeron con el 92-99 % de probabilidad la necesidad de hospitalización. Por todo lo expuesto se puede concluir que una SaO2 < 92 % después del tratamiento inicial con broncodilatadores inhalados selecciona a los pacientes más graves y éstos deben ser hospitalizados para iniciar un tratamiento intensivo7,8.
En lugares donde no cuenten con saturómetros, se pueden seguir usando los puntajes clínicos para evaluar la gravedad de la obstrucción. En un estudio prospectivo con 138 lactantes con crisis obstructivas que acudieron a una UE, demostramos que existe una buena correlación entre el puntaje clínico de Tal modificado y el grado de SaO2. Así, un puntaje ≥ 8 (sobre un total de 12) detecta hipoxemia (SaO2 ≤ 91 %) con 100 % de sensibilidad, 86 % de especificidad y 100 % de valor predictivo negativo13.
Los objetivos del tratamiento del asma aguda pueden resumirse en: mantener una SaO2 adecuada mediante el suplemento de oxígeno, liberar la obstrucción del flujo aéreo mediante la administración repetida de broncodilatadores inhalados (β2-agonistas y anticolinérgicos), reducir la inflamación de la vía aérea y prevenir futuras recaídas o recidivas mediante la administración precoz de corticoides sistémicos7-9.
La mayoría de pacientes con crisis graves de asma deben ser tratados en las UE del nivel terciario (figs. 3 y 4), donde el monitoreo incluya medidas objetivas de la obstrucción de la vía aérea (SaO2, espirometría y función cardíaca, si es posible). Las crisis asmáticas leves (reducción del PEF hasta el 20 %, despertares nocturnos o incremento del uso de los β2-agonistas) pueden ser tratadas en la comunidad (figs. 1 y 2) y si el paciente responde adecuadamente a la primera hora de tratamiento con β2-agonistas, no requerirá una consulta en la UE; en caso de que no responda, se debería buscar ayuda médica para el tratamiento con corticoides sistémicos.
Oxigenoterapia
La hipoxemia que se produce en las crisis asmáticas es generalmente leve o moderada, ya que se produce por una alteración ventilación/perfusión, por lo que para corregirla bastará la administración de pequeños aportes de fracción inspirada de oxígeno (1-3 l/min) mediante
cánula nasal, máscara facial y rara vez a través de halo o caja cerrada en los lactantes. No se aconseja el aporte de altas concentración de oxígeno, ya que puede suponer un riesgo y deteriorar la condición del paciente al producir una hipercapnea como consecuencia de la desaparición de la vasoconstricción pulmonar hipóxica. La administración del oxígeno no debe hacerse de forma esquemática o rígida, sino que debe ser titulada según necesidad y usando como parámetro la SaO2. Los niños con asma grave que tengan una SaO2 < 92 % deberían recibir aporte de oxígeno suficiente como para normalizar la saturación y cuando se alcance una SaO2 > 95 %, éste debe suspenderse. En los casos en los que no se pueda medir la SaO2, el médico se guiará por las condiciones clínicas y evitando siempre el uso de altos flujos de oxígeno.
Broncodilatadores
β2-agonistas inhalados
Los broncodilatadores β2-agonistas son la primera línea de tratamiento del asma grave, ya que presentan un comienzo de acción muy rápida (menos de 5 min) y una duración de aproximadamente 6 h. Existe una vasta evidencia de que la administración del salbutamol vía inhalador dosis medida (IDM) con espaciador no sólo es tan efectiva como la vía nebulizada, sino que es superior en cuanto a mejoría clínica y evita las hospitalizaciones tanto en niños menores de 5 años como en escolares. En consecuencia, es el mejor sistema costo/beneficio para alcanzar una rápida mejoría de la obstrucción bronquial del asma aguda en pediatría.
Además, la administración de los β2-agonistas vía IDM ofrece otras ventajas, como el ser más rápida y tener menos efectos secundarios (taquicardia, desaturaciones) que la misma droga administrada por vía nebulizada, además de dar la oportunidad de enseñar al paciente y a su familia el correcto uso de los sistemas de IDM. Castro-Rodríguez y Rodrigo14 en un metaanálisis que reúne seis estudios aleatorizados, con 491 niños (1-60 meses de edad) que acudieron a la UE por crisis obstructivas de sibilancias o asma, reportaron que la mejoría clínica fue mayor en aquellos que recibieron los β2-agonistas vía IDM con espaciador frente a los que los recibieron vía nebulizada; y la tasa de admisión al hospital (o fracaso del tratamiento) fue significativamente menor en aquellos niños con β2-agonistas vía IDM que en los de la vía nebulizada. El número de pacientes necesarios que tratar (NTT) con IDM para evitar una hospitalización fue de 10.
La dosis y los intervalos de la administración del β2-agonista dependerán de la gravedad y la respuesta del paciente. La inmensa mayoría de niños con crisis leves responde a esquemas de salbutamol vía IDM dos puffs cada 20-30 min y aquellos con crisis más graves, con dos puffs cada 10 min durante la primera hora y luego se debe repetir la dosis cada 10-20 min durante otra hora más (dependiendo de la respuesta y gravedad).
Para lograr una mejor llegada del β2-agonista vía IDM, el tipo de espaciador en el caso de los lactantes y niños no colaboradores debe ser una máscara facial bivalvulada y de volumen pequeño (100-300 ml); si se trata de niños mayores y adolescentes, se aconsejan los espaciadores univalvulados o no valvulados con pieza bucal y de mayor volumen (300-700 ml). Los puffs se deben disparar de uno en uno, agitando el IDM entre cada administración. En los niños no colaboradores y lactantes, la máscara facial bivalvulada debería bloquear la respiración nasal; administrar un puff y esperar hasta que el paciente efectúe cinco inspiraciones o 10 s con el espaciador puesto, tratando en la medida de lo posible que el niño respire a volumen corriente y no llore. En los pacientes colaboradores, se debe indicar expulsar el aire hasta volumen residual, en seguida respirar un puff e inspirar lentamente (para disminuir la impactación inercial) hasta la capacidad pulmonar total. Luego se retiene la respiración durante 10 s (para favorecer el depósito por gravedad de las partículas respirables) y se exhala.
Los β2-agonistas vía nebulización deben restringirse sólo para casos en los que el paciente requiera un aporte de oxígeno para normalizar su SaO2. El procedimiento para nebulizar es usar salbutamol 0,25 mg/kg (máximo de 5 mg) o terbutalina 5-10 mg diluidos en solución salina hasta completar 4 ml de volumen total, durante unos 5 y 7 min, cada 20 min, a un flujo de 6-8 l/min de aire enriquecido con oxígeno y mediante el uso de flujómetros compensados, conectados a una mascarilla completamente adosada a la cara (en los niños pequeños) o a una boquilla con tubo de extensión (en niños mayores de 5 años). Aún queda por evaluar si en los pacientes con requerimiento de oxígeno, la administración del β2-agonista vía MDI con espaciador más un aporte de oxígeno por cánula nasal sería igual de efectiva que la administración vía nebulización con oxígeno. La nebulización continua de β2-agonistas no ofrece grandes ventajas sobre el uso de nebulización intermitente en iguales dosis totales15.
En los casos en que la crisis asmática se esté tratando en la atención primaria, si el niño no mejora después de recibir 10 puffs de β2-agonistas en 1 h se debe derivar al hospital. Mientras se espera el traslado, se debe seguir suministrando los β2-agonistas. El traslado en ambulancia debe hacerse con oxígeno y β2-agonistas nebulizados (figs. 1 y 2).
Alternativas al salbutamol, como el levalbuterol y la adrenalina subcutánea o nebulizada no ofrecen ventajas sobre el tratamiento convencional. Carl et al16 en un estudio aleatorizado con 482 niños (1-18 años) informaron de que el levalbuterol nebulizado redujo significativamente la tasa de hospitalizaciones comparado con el grupo que recibió albuterol racémico nebulizado, pero la duración de la hospitalización fue semejante en ambos grupos; además, el alto costo del levalbuterol es aún un factor crítico para su generalización como fármaco de elección. Un metaanálisis que incluye 121 niños y adolescentes con asma aguda de moderada a grave demostró que la adrenalina nebulizada no mejoró significativamente la función pulmonar comparada con los β2-agonistas (salbutamol o terbutalina) y tampoco hubo diferencias en el porcentaje de taquicardia17.
Anticolinérgicos
Se han publicado dos revisiones sistemáticas del tema. Plotnick et al18 informaron de que sólo las múltiples dosis, pero no las dosis únicas, de bromuro de ipatropio mejoran la función pulmonar y reducen el riesgo de hospitalización en un 30 %. Rodrigo y Castro-Rodríguez19, al revisar 16 estudios pediátricos aleatorizados (1.564 niños y adolescentes con crisis asmáticas moderadas y graves) concluyeron que el uso de dosis múltiples de bromuro de ipatropio combinadas con β2-agonistas fue significativamente eficaz al mejorar la función pulmonar y reducir las hospitalizaciones (el NTT para evitar una hospitalización fue de 7), existía, además, una clara relación dosis-respuesta del bromuro de ipatropio.
Por lo tanto, hay evidencia de la seguridad y ventajas de agregar dosis frecuentes de bromuro de ipatropio (250 μg/dosis mezclada con los β2-agonistas en solución por nebulizar) durante las primeras 2 h en los casos de crisis asmática grave o en los casos de crisis moderada que no respondan al tratamiento inicial con β2-agonistas. Inicialmente, se administran dosis frecuentes cada 20 o 30 min y luego se reducen según la respuesta. Se debe colocar protección ocular cuando se nebulicen los anticolinérgicos. Aquellos pacientes que aun recibiendo esta combinación no respondan o se deterioren, deben ser enviados rápidamente a la UCI.
Salbutamol intravenoso
El papel de los β2-agonistas intravenosos (i.v.) como tratamiento adicional al nebulizado permanece incierto. Un metaanálisis20 demostró que el salbutamol i.v. en bolos no ofreció ventajas clínicas ni funcionales significativas frente a los β2-agonistas inhalados en las crisis asmáticas en las UE, pero sí produjo más efectos adversos como taquicardia, por lo que se restringe el uso i.v. en aquellos pacientes en los que la terapia inhalada no sea posible. Sin embargo, algunas guías de tratamiento aún proponen que en casos de crisis asmática grave la adición precoz de bolos i.v. de salbutamol (15 μg/kg) puede ser un efectivo tratamiento adyuvante.
La infusión continua de β2-agonistas i.v. podría considerarse cuando no se pueda aplicar la vía inhalatoria o para casos de asma grave refractaria. Hay que recordar que dosis sobre 1-2 μg/kg/min (200 μg/ml de solución) deben darse en la UCI, y pueden llegar hasta 5 μg/kg/min, siempre con constante monitorización de electrólitos séricos.
Corticoides
Corticoides sistémicos
Los corticoides sistémicos, es decir, por vía i.v., intramuscular (i.m.) u oral (v.o.), se deben administrar a todos los pacientes con crisis asmáticas moderadas y graves (especialmente si hay fallo de respuesta a los β2-agonistas), antecedentes de que la exacerbación ocurrió estando aún con corticoides v.o. o si hay historia de exacerbaciones previas que requirieron uso de corticoides sistémicos7-9.
Dos metaanálisis, uno en adultos21 y otro que incluye población infantil22, sugieren que los corticoides sistémicos son extremadamente eficaces en reducir la inflamación presente en el asma aguda, y se requieren de 4 a 24 h para mejorar la función pulmonar y reducir el riesgo de hospitalizaciones. Además, los corticoides por vía i.v. como por v.o. tienen efectos equivalentes y la curva dosis-respuesta es plana (por lo que no habría un beneficio extra al usar dosis más altas) y la administración posterior de corticoides v.o. una vez dado de alta de la UE reducen significativamente las recaídas.
Scarfone et al23, en un estudio aleatorizado con 75 niños (1-17 años) con crisis asmática moderada que consultaron a una UE, demostraron que el grupo de niños con prednisona (2 mg/kg v.o., máximo 60 mg) tuvieron una significativa y mayor mejoría clínica y menor necesidad de ser hospitalizados que el grupo placebo en las primeras 4 h del tratamiento. Previamente, Tal et al24 informaron de la superioridad de la administración de metilprednisolona (4 mg/kg i.m.) frente a placebo en la reducción de la hospitalización a las 3 h postratamiento en 74 niños (6-60 meses) con crisis de sibilancias. Gartner et al5 demostraron, en 54 niños (6-14 años) con crisis asmática moderada, que el deflazacort (1,5 mg/kg v.o.) y la prednisolona (1 mg/kg v.o.) fueron similares en mejoría clínica, valores espirométricos e índice de hospitalización al segundo y séptimo día postratamiento.
Lo ideal es que los niños con crisis asmática reciban precozmente el corticoide v.o. como prednisona o prendisolona (una dosis de 20 mg en niños de entre 2 y 5 años y 30-40 mg para niños de más de 5 años). En general, se prefiere la administración v.o. que la i.v. porque es menos invasiva y más económica; y la administración de corticoides i.v. como hidrocortisona (4 mg/kg, repetida cada 4 h) debe reservarse para casos graves o cuando los niños no son capaces de retener la v.o. Aquellos niños que en el momento de la crisis asmática ya estaban con terapia de mantenimiento con corticoides v.o., deberán recibir 2 mg/kg de prednisolona con un máximo de 60 mg.
Al alta de la UE, se debe seguir con el mismo corticoide v.o. durante 3 a 5 días (en dosis fija y sin necesidad de reducir la dosis al final del tratamiento). Sin embargo, un reciente estudio aleatorizado25 sugiere que una dosis única de dexametasona v.o. (0,6 mg/kg, máximo 18 mg) es clínicamente igual de efectiva que 5 días de prenisolona v.o. (1 mg/kg, máximo 30 mg, dos veces al día) en el tratamiento de exacerbaciones asmáticas leves o moderadas en niños de 2-16 años.
Si el paciente que es dado de alta de la UE requiere terapia con corticoides v.o. pero hay dudas de su adherencia al tratamiento, se podría administrar una dosis de dexametasona i.m. (~1,7 mg/kg)26.
Se ha postulado que el tiempo en el que los corticoides sistémicos producen la mejoría de la función pulmonar y evitan la hospitalización es debido a su efecto en la transcripción y alteración en la síntesis proteica (efecto genómico: efecto clásico antiinflamatorio que involucra la modificación de la expresión genética y que ocurre con una latencia de horas o días).
Corticoides inhalados
Si bien las guías7-9 señalan que para el tratamiento del asma aguda no deben preferirse los corticoides inhalados frente a los corticoides v.o., es importante saber que los primeros poseen un efecto de acción más rápido (efecto no genómico: efecto tópico vasoconstrictor sobre la mucosa de la vía aérea, vía modulación del control simpático del tono vascular, que básicamente ocurre en cuestión de minutos, que es reversible -corta duración- y dependiente de la dosis) y sería el sustento científico para su uso durante las crisis asmáticas.
Se han publicado diversos estudios en niños que comparan la administración de corticoides vía inhalada frente a la vía sistémica. Scarfone et al27, en un estudio aleatorizado con 111 niños (1-17 años) con exacerbación asmática moderada, informaron de que los niños del grupo que recibió el fármaco nebulizado (dexametasona 1,5 mg/kg) tuvieron una mayor proporción de altas de la UE a las 2 h postratamiento, una menor proporción de recaídas a las 48 h y menores efectos secundarios (vómitos) que aquellos que recibieron la v.o. (prednisona 2 mg/kg). Curiosamente, el subgrupo de pacientes que recibió la dexametasona nebulizada vía máscara facial tuvo mayor porcentaje de hospitalizaciones frente a los que recibieron la nebulización con boquilla. Volovitz et al28 estudiaron 22 niños (6-16 años) con crisis asmática moderada o grave y no comunicaron diferencias clínicas o del PEF durante las primeras 4 h de recibir de manera aleatorizada budesonida inhalador en polvo seco (1.600 mg, dosis única) o prednisona oral (2 mg/kg). Devidayal et al29 compararon budesonida nebulizada (800 mg en 3 dosis) frente a prednisolona oral (2 mg/kg) en 80 niños con crisis moderadas o graves de asma y aquellos con el tratamiento nebulizado tuvieron una significativa mejoría clínica a las 2 h postratamiento y fueron dados de alta de la UE en mayor proporción que el grupo que recibió la v.o. Sin embargo, en algunos otros estudios aleatorizados30,31, los niños que recibieron los corticoides v.o. (prednisona o prednisolona 2 mg/kg) tuvieron una significativa mayor mejoría clínica, menor tasa de hospitalización y de recaídas frente a los que recibieron corticoides por vía inhalatoria (fluticasona 2 mg vía IDM con espaciador). Estos autores sugieren que los corticoides inhalados no deben reemplazar a los v.o. en el tratamiento de los niños mayores de 5 años con crisis asmática grave30, ni en las crisis leves o moderadas31. Pero es importante señalar que en estos últimos dos estudios, el efecto en la función pulmonar se midió de forma tardía (es decir, después de las 4 h de la administración) no dejando así la posibilidad de evaluar el efecto no genómico de los corticoides inhalados.
Recientemente, Rodrigo GJ32 en un metaanálisis (que incluyó a 663 niños y adolescentes con crisis asmáticas) demostró que la administración de múltiples dosis de corticoides inhalados a intervalos cortos (tres o más dosis administradas en intervalos de 30 min o menos entre 90 y 120 min) tienen un beneficio clínico y espirométrico precoz (durante la primera o segunda hora), incrementando así la probabilidad de ser dados de alta más rápidamente de la UE frente al grupo que recibió los corticoides vía sistémica o placebo. Además, los corticoides inhalados redujeron las tasas de hospitalización a las 2 y 4 h (el NTT para evitar una hospitalización fue de 10). Este efecto precoz de los corticoides inhalados se alcanza cuando el sujeto los recibe concomitantemente con los β2-agonistas inhalados, lo cual se explica debido a que el efecto vasoconstrictor de los corticoides inhalados se ve potenciado cuando se administran los broncodilatadores inhalados al disminuir el aclaramiento de la vía aérea. La dosis que recomiendan son 500 μg cada 15 min de fluticasona nebulizada o 800 μg cada 30 min de budesonida nebulizada o 500 μg cada 10 min vía IDM con aerocámara o 400 mg cada 30 min de budesonida vía IDM con aerocámara. Estas dosis deberían ser administradas durante un período mínimo de 90 min. Sin embargo, aún se necesitan más estudios para clarificar la relación ente la dosis administrada, la gravedad del asma aguda y la respuesta al tratamiento y para establecer su relación costo/beneficio en pediatría.
Lo que sí está muy claramente establecido en todas las guías internacionales7-9 es el uso de corticoides inhalados tras el alta de la crisis asmática de la UE en los niños con asma crónica. Sin embargo, esta conducta no siempre se cumple. Blais y Beauchesne33 informaron de que una cohorte de 4.042 asmáticos (5-17 años) que fueron atendidos en una UE por crisis asmáticas, sólo el 68 % de los niños y 51 % de los adolescentes tenían prescripción de corticoides inhalados al mes del evento de la UE y estas cifras sólo aumentaron un 10 % adicional entre el segundo y el sexto mes del episodio. Dentro de los factores asociados para un mayor uso de corticoides inhalados al primer mes estaban: tener menor edad (niños frente a adolescentes), uso previo de corticoides inhalados y uso de corticoides v.o. en el mes posterior al episodio de la UE. Sin embargo, curiosamente el haber tenido una hospitalización previa por asma o haber acudido a la UE en los seis meses previos al ataque no influyó en un mayor uso de corticoides inhalados. Esto genera un círculo vicioso en el que los pacientes no controlados son los que más frecuentemente son admitidos en la UE por crisis asmáticas y son los que luego probablemente usen menos corticoides inhalados, lo que ocasiona mayor asma no controlada y mayor riesgo de reincidir en consultas por crisis asmáticas a las UE.
No está demostrado que aumentar la dosis del corticoide inhalado sea efectivo para el tratamiento del asma aguda, pero es una buena práctica que aquellos pacientes que ya venían usando los corticoides inhalados continúen con ellos (conservando su dosis usual de mantenimiento). Por otra parte, los niños con asma crónica que no estén recibiendo un tratamiento preventivo regular con corticoides inhalados pueden beneficiarse con su inicio inmediatamente después de la crisis asmática.
Otras terapias
Aminofilina
No hay evidencia que la aminofilina i.v. sea beneficiosa en casos de crisis asmática leve o moderada. Por el contrario, ocurren considerables efectos secundarios, por lo que su uso tanto como monoterapia o como asociada a los broncodilatadores no se aconseja. En un estudio en niños con asma casi fatal34, la administración de teofilina intravenosa (concentraciones séricas de 12-17 μg/ml) ofreció una mejoría significativa en pacientes con asma aguda que estaban en la UCI con un tratamiento agresivo (nebulización continua de albuterol, bromuro ipatropio inhalado y metilprednisolona i.v.), pero con mayores efectos secundarios. En estos casos excepcionales, de crisis asmáticas graves o broncospasmo refractarios al tratamiento agresivo, en que sea necesario su uso, éste debe hacerse siempre en una UCI y bajo monitorización de la concentración sérica de teofilina.
Sulfato de magnesio
Es un fármaco seguro y barato. Se han usado dosis de infusión i.v. lenta de sulfato de magnesio (40 mg/kg/día, máximo 2 g) en las crisis asmáticas graves refractarias al tratamiento convencional; sin embargo, no hay suficientes datos para aconsejar su uso tanto por vía sistémica como inhalada7,8.
Otras
Antagonistas de leucotrienos, ketamina, lidocaína, furosemida y mezclas de helio con oxígeno (heliox) no han demostrado ser eficaces en el tratamiento del asma aguda. No hay suficiente evidencia que soporte o refute el uso de los antibióticos en el asma aguda, pues la mayoría de ataques de asma son desencadenados por infecciones virales. Su uso, pues, no debe darse de forma rutinaria a no ser que se sospeche de infección bacteriana7,8.
No existe evidencia que sustente la aplicación de quinesioterapia respiratoria en el curso de la crisis asmática y algunas maniobras quinésicas, como la percusión torácica, están claramente contraindicadas.
Fluidos intravenosos
Algunos niños con ataque prolongado de asma grave usualmente no toleran la v.o. y requieren hidratación i.v. Se debe proporcionar dos terceras partes del requerimiento de mantenimiento para evitar el potencial desarrollo del síndrome de secreción inapropiada de hormona antidiurética. Debe realizarse mediciones de electrólitos y corregir la hipopotasemia, si hubiera. El uso de electrocardiograma es obligatorio para todo tratamiento i.v.
Hospitalización e ingreso en la UCI
Existen consensos7,8 para definir qué paciente debe ser dado del alta de la UE o ser ingresado en el hospital. Pacientes con valores de VEF1 o PEF por debajo del 25 % del predicho o de su mejor valor personal pretratamiento o aquellos con VEF1 o PEF < 40 % del predicho o de su mejor valor personal postratamiento, usualmente van a requerir hospitalización. Pacientes con una PEF y/o VEF1 superior al 75 % de su mejor valor o predicho y SaO2 de más de 94 % pueden ser dados de alta sin problemas. Pacientes con una función pulmonar postratamiento de 40-60 % pueden ser dados de alta, pero asegurándose un seguimiento y una adherencia adecuados. El tratamiento del paciente con asma en la UCI y hospitalizado está fuera del alcance de este artículo.
Todos los pacientes dados de alta de la UE deben recibir un curso corto de corticoides orales (de 3 a 5 días es suficiente en la mayoría de los niños) asociado con el β2-agonista vía IDM con espaciador. La dosis y frecuencia de los β2-agonistas dependerá de que los síntomas y medidas objetivas como el PEF vuelvan a su basal previa a la crisis. Es poco probable que la administración de bromuro de ipatropio aporte algún beneficio en esta etapa, por lo que debe ser suprimida. Los pacientes deben iniciar o continuar con tratamiento regular de corticoides inhalados. También se debe aprovechar esta instancia para revisar la correcta técnica inhalatoria y de la medición del PEF. Se debe tratar de identificar los factores que precipitaron la crisis asmática y diseñar estrategias para evitarlos. Se ha demostrado que aquellos pacientes que fueron dados de alta de la UE con un plan escrito y un flujómetro tuvieron una mejor respuesta que aquellos que no contaban con dichas herramientas. La familia debe ser instruida para que contacte con su médico general en la primera semana y con un especialista en asma durante el primer mes. Un estudio prospectivo35 realizado en pacientes (6-59 años) que fueron vistos por un especialista en tratamiento del asma tras el alta de la UE evolucionaron mejor que los que fueron vistos por un médico general. En esas visitas, se deben evaluar la respuesta al tratamiento de la crisis asmática, el plan de acción escrito y revisar el uso de los fármacos controladoros.
Tratamiento del asma aguda en niños menores de dos años
El diagnóstico de asma en esta edad es difícil, y otras condiciones no asmáticas pueden producir crisis agudas de sibilancias, como es el caso de los lactantes sibilantes transitorios, en quienes las infecciones virales desencadenan frecuentemente episodios agudos de sibilancias. Sin embargo, podemos estar más seguros de que realmente se trata de crisis asmáticas si aquellos lactantes tienen un índice predictivo de asma o asthma predictive index positivo36. Más causas de crisis agudas de sibilancias son prematuridad, bajo peso al nacer, bronquiolitis, traqueomalacia, aspiración de un cuerpo extraño, fibrosis quística, neumonitis aspirativa y anomalías congénitas, entre otras. Las siguientes pautas están destinadas a lactantes en los que se piensa que la causa de su crisis aguda de sibilancias se debe al asma y no al tratamiento de otras como la bronquiolitis.
Broncodilatadores β2-agonistas
En casos de crisis asmáticas leves o moderadas, el tratamiento de elección es el salbutamol vía MDI más espaciador con máscara facial bien sellada a la cara del lactante (2 puffs cada 10 min durante 1 o 2 h según la respuesta)6,14. Si no hay respuesta entonces, se debe revisar su diagnóstico y considerar otras opciones terapéuticas, y si persiste el diagnóstico de asma hay que agregar corticoides. Los β2-agonistas por v.o. no se deben usar.
Corticoides
En casos de crisis asmáticas de moderadas a graves, la administración de corticoides v.o. (10 mg de prednisona) junto con los β2-agonistas en la UE han demostrado que reducen la necesidad de hospitalización6. Un estudio aleatorizado realizado en 123 lactantes demostró beneficios similares al comparar budesonida nebulizada y prednisolona v.o.37.
Anticolinérgicos
En los casos de crisis asmáticas agudas, se puede considerar el uso de bromuro de ipatropio nebulizado en combinación con los β2-agonistas19. Esta estrategia mejora la sintomatología y reduce la necesidad de aplicar un tratamiento más intensivo, pero no reduce la duración de hospitalización.
Correspondencia: Dr. J.A. Castro-Rodríguez.
Lira, 44, 1.º, casilla 114-D. Santiago. Chile.
Correo electrónico: jacastro17@hotmail.com
Recibido en junio de 2007.
Aceptado para su publicación en junio de 2007.