La adquisición de la competencia para la alimentación oral (CAO) representa un desafío en RN prematuros y puede verse afectada por diversos factores.
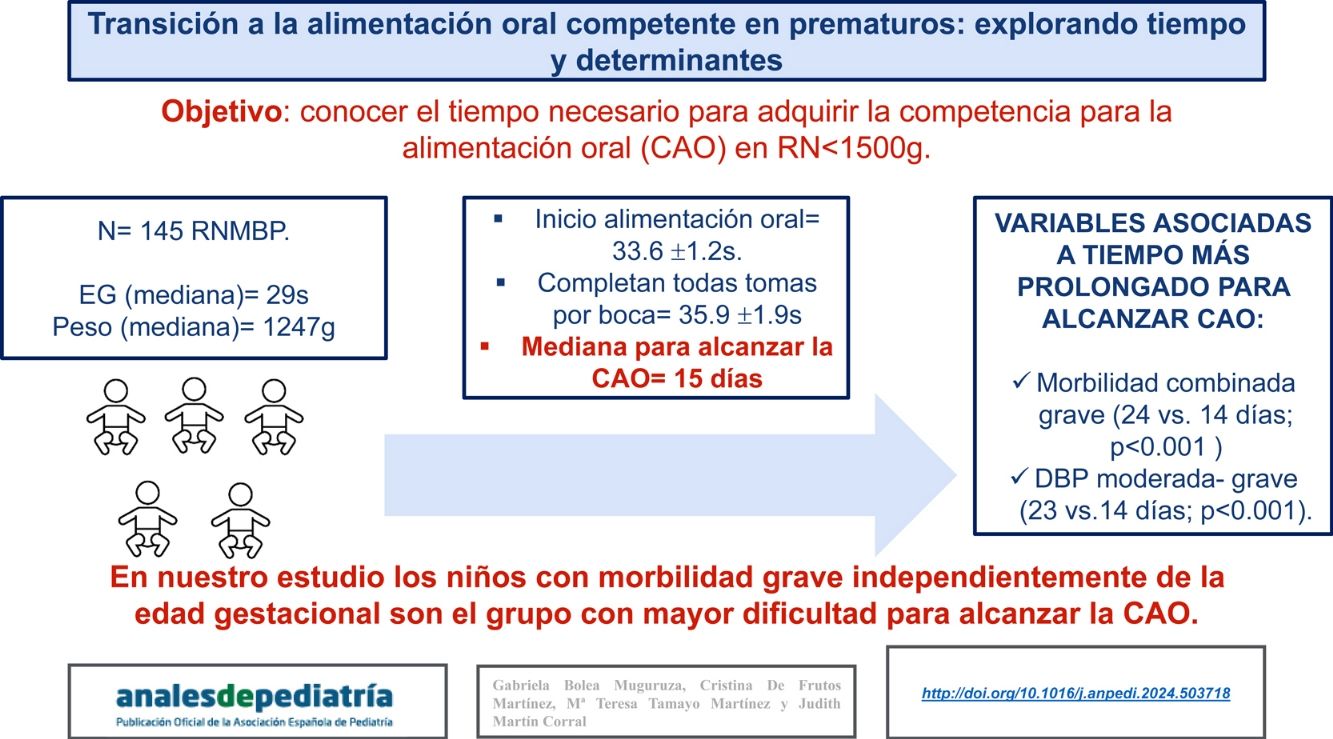
ObjetivoEs conocer el tiempo necesario para adquirir la CAO en RN <1500g (RNMBP) e identificar factores asociados a mayor dificultad para alcanzar dicha habilidad.
Población y métodosEstudio observacional, longitudinal y prospectivo durante 7 años (2016-2022) en RNMBP. Se registran variables perinatales, prácticas de alimentación y complicaciones asociadas a la prematuridad. Se analiza número de días necesarios para alcanzar la CAO y qué variables permiten predecir la necesidad de más tiempo para conseguir dicha competencia.
ResultadosSe incluyen 145 RNMBP con una mediana de edad gestacional (EG) 29s y peso 1247g. La alimentación oral se inicia a las 33,6±1,2s y se completan todas las tomas por boca a las 35,9±1,9s. La CAO se consigue en una mediana de 15 días (8-22,5). Las variables asociadas a un tiempo más prolongado para alcanzar la CAO fueron: morbilidad combinada grave (MCG) (24 vs. 14 días; p<0,001) y DBP moderada-grave (23 vs. 14 días; p<0,001). En la población sin MCG, no se encontraron diferencias en número de días para la CAO en función de EG menor o mayor de 28s (p=0,131).
ConclusionesResaltamos la importancia de estructurar el proceso de transición a la alimentación oral e identificar a la población de más riesgo, que en nuestro estudio fueron los niños con morbilidad grave independientemente de la edad gestacional, para dirigir a ellos las posibles intervenciones.
The achievement of oral feeding competence (OFC) is a challenge in preterm infants and can be affected by several factors.
ObjectiveThe aim of our study was to determine the time elapsed to development of OFC in very low birth weight (VLBW, weight <1500g) preterm infants and to identify factors associated with greater difficulty in achieving this skill.
Population and methodsObservational, longitudinal and prospective study in VLBW infants over a period of 7 years (2016-2022). We collected data on perinatal variables, feeding practices and complications associated with prematurity. We analyzed the number of days needed to achieve OFC and which variables predicted greater delay in achieving OFC.
ResultsWe included 145 VLBW infants with a median gestational age (GA) of 29 weeks with a weight of 1247g. Oral feeding was initiated at 33.6 weeks (SD, 1.2) and full oral feeding was achieved at 35.9 weeks (SD, 1.9). The median time to achievement of OFC was 15 days (8-22.5). The variables associated with longer delay of OFC were severe combined morbidity (24 vs 14 days; P <.001) and moderate/severe bronchopulmonary dysplasia (23 vs 14 days; P <.001). In infants without severe combined morbidity, we found no differences in the days elapsed to achievement of OFC between those born before or after 28 weeks of GA (P=.131).
ConclusionsOur findings highlight the importance of structuring the transition to oral feeding and identifying the most at-risk group, which in our study were infants with severe morbidity associated with prematurity, for the purpose of targeting potential interventions.
Durante el segundo y tercer trimestre de gestación, ocurren en el feto una serie de eventos complejos e interrelacionados que posibilitan el correcto desarrollo cerebral y permiten la maduración de sistemas anatómicos y funcionales del recién nacido (RN)1,2. El nacimiento prematuro implica inmadurez y una frecuente asociación con otras patologías y alteraciones del desarrollo3,4. Entre otras condiciones, encontramos dificultades en la alimentación relacionadas con la incapacidad de los recién nacidos prematuros (RNPT) para coordinar la succión-deglución-respiración5, y la necesidad de ser alimentados por sonda nasogástrica (SNG) durante un periodo de tiempo variable.
La adquisición de la competencia para la alimentación oral (CAO) representa un desafío para los RNPT, especialmente para aquellos con menor edad gestacional (EG) (prematuros extremos, EG<28 semanas) y con complicaciones graves6,7. Sabemos que la eficacia para conseguir una alimentación oral segura y competente en el RNPT está influida por múltiples factores como EG, tono muscular y madurez del sistema nervioso y aparato gastrointestinal, así como la presencia de comorbilidad grave8–10. Sin embargo, la implicación de estos en el proceso de destete de la SNG no ha sido bien descrita11. Es frecuente observar cómo RNPT tras superar morbilidades graves y desarrollar patologías relacionadas con la prematuridad como displasia broncopulmonar (DBP), hemorragia intraventricular (HIV) o enterocolitis necrosante (NEC), prolongan su ingreso debido a la dificultad para alimentarse por boca de forma segura y eficaz12. Dado que lograr una alimentación oral independiente y sin compromiso cardiorrespiratorio es uno de los criterios recomendados para el alta hospitalaria6, cuanto más tarden en alcanzar la CAO, más prolongada será su hospitalización 8,13,14. Además, las dificultades en la alimentación durante este periodo pueden conducir a una inadecuada nutrición, que a su vez se asocia con retraso posnatal de crecimiento (RPC) y mayor riesgo de desarrollo neurológico adverso15,16.
A pesar de la relevancia clínica del tema, existen pocos estudios que analicen el proceso de adquisición de la CAO, los factores que inciden y las potenciales intervenciones para optimizar el proceso de transición17–19. A grandes rasgos, existen estrategias de transición a la alimentación oral dirigidas por condiciones establecidas como la edad gestacional o el peso del RNPT, frente a otras basadas en la observación de las competencias para alimentarse que muestra el bebé, promoviendo una transición a la alimentación oral guiada por el niño20,21. Una revisión reciente de la Cochrane concluye que no existe evidencia suficientemente fuerte para recomendar una u otra estrategia destacando las limitaciones metodológicas de los estudios22,23. Más paradójico aún es el hecho de que no existe consenso en la definición de CAO24 con la consiguiente variabilidad de criterios para la retirada definitiva de la SNG en los estudios y guías de práctica clínica. Pese a la falta de evidencia robusta, parece apropiado evaluar y apoyar el proceso de alimentación de manera individualizada, con el fin de lograr una alimentación oral completa, segura y competente.
ObjetivoConocer el tiempo necesario para la adquisición de la CAO en recién nacidos prematuros de muy bajo peso (RNMBP; peso al nacer <1500g) de nuestra unidad e identificar factores asociados a una mayor dificultad para alcanzar dicha habilidad.
Población y métodoDiseño del estudioEstudio observacional longitudinal y prospectivo en una cohorte de RNMBP ingresados en nuestra unidad, sobre la que ya se han realizado otros estudios relacionados con las prácticas de lactancia25. El periodo de estudio fue de 7 años (2016-2022). El estudio fue aprobado por el Comité de Ética de Investigación del Hospital.
Descripción de la unidadSe trata de una unidad neonatal de nivel IIIB, con una media de 1800 nacimientos y 25-30 RNMBP ingresados cada año.
Población de estudioSe incluyeron todos los RNMBP que ingresaron durante el periodo de estudio. Se excluyeron los RN que ingresaron en la unidad con más de 7 días de vida, los trasladados a otros centros antes de los 28 días de vida y los fallecidos.
Al igual que en estudios similares y para poder establecer comparaciones, se dividió al conjunto de la población en dos grupos en función de la EG (mayor y menor o igual de 28 semanas), tratando de analizar la implicación de esta en las prácticas de alimentación. También se analizan otros factores como la presencia de complicaciones relacionadas con la prematuridad o comorbilidades graves, tipo de lactancia recibida, oportunidades de amamantamiento directo al pecho, condición de CIR (crecimiento intrauterino retardado) y de RPC.
Protocolo de nutriciónNuestra unidad dispone de un protocolo de soporte nutricional para los RNMBP que cumple en líneas generales las recomendaciones establecidas. Se inicia nutrición parenteral en el primer día con aporte inicial de hidratos de carbono 6-8g/kg/día, proteínas 2-2,5g/kg/día y lípidos 1,5- 2g/kg/día, seguido de un aumento gradual de nutrientes. Desde 2017 disponemos de un protocolo específico para la extracción y administración de calostro orofaríngeo (COF). La nutrición enteral trófica se inicia tan pronto como la estabilidad clínica del paciente lo permite, con leche materna (LM) propia preferiblemente. Hasta junio de 2018 no se disponía de leche donada (LD), por lo que, en ausencia de LM propia, se usaron fórmulas artificiales adaptadas para prematuros. Se realizan incrementos graduales de nutrición enteral (20-30ml/kg/día) hasta un máximo de 160-180ml/kg/día. Se introduce la fortificación cuando se toleran volúmenes de 100ml/kg/día; durante el periodo de estudio, se utilizó la fortificación multicomponente estándar de leche materna y en el último año la fortificación proteica ajustada por niveles de urea sérica. Ningún paciente del estudio recibió probióticos.
No se dispone de un protocolo específico para guiar el proceso de adquisición CAO. La unidad promueve el cuidado madre canguro (CMC), así como la succión no nutritiva (SNN) al pecho o con chupete, independientemente de la EG. El momento de inicio de la alimentación oral es decisión del médico responsable, habitualmente basado en criterios establecidos como la EG, estabilidad clínica y la percepción subjetiva de las competencias durante la SNN. Para la alimentación oral, se utilizó biberón en casi todos los casos, si bien en los últimos años, las primeras tomas se administran con jeringa y dedo o cánula. La estabilidad cardiorrespiratoria durante la toma y el volumen de ingesta son los criterios utilizados para avanzar hacia la retirada de la SNG. Desde 2019 se promueve la alimentación a semidemanda al pecho, así como el uso de pezonera cuando es preciso facilitar el enganche. El criterio para asumir la CAO fue que el niño fuera capaz de completar todo el volumen de leche previsto, en ausencia de eventos cardiorrespiratorios adversos moderados-graves (definidos por descenso de frecuencia cardiaca <80 lpm o saturación transcutánea de O2 <80% en la monitorización continua) y con una ganancia de peso superior a 15g/kg/día.
Variables clínicasSe recogieron datos demográficos y perinatales, así como de somatometría al nacimiento y al alta. Se registró así mismo la presencia de NEC, ductus arterioso persistente (DAP) con cierre quirúrgico, y DBP moderada-grave. Para la definición de DBP se utilizó la clasificación del consenso del 200026. Dada la baja prevalencia de complicaciones graves en la muestra, para tener un número representativo y poder analizar su impacto, se definió la condición de morbilidad combinada grave (MCG) por la existencia de al menos uno: DBP, cierre quirúrgico del DAP, NEC, HIV grado mayor 2, leucomalacia, enfermedad genética o malformativa con riesgo vital. Para la valoración somatométrica se utilizaron los estándares Intergrowth-21st27.
La variable principal de estudio fue el tiempo necesario para alcanzar la CAO, tratando de determinar qué factores se asociaron a la necesidad de más tiempo para conseguir dicha competencia. Para ello, se registraron variables relacionadas con prácticas de alimentación: días de nutrición parenteral; días de vida al inicio de la nutrición enteral; edad posmenstrual (EPM) al inicio de la alimentación oral y al alcanzar la CAO; días desde la CAO hasta el alta; días de ingreso; EPM y peso al alta; tipo de lactancia y práctica de amamantamiento durante el ingreso y al alta. Se definió lactancia materna exclusiva (LME) como alimentación exclusiva con leche materna (propia y/o donada); LM suplementada como alimentación con leche materna (propia y/o donada) y fórmula artificial. Se definió como amamantamiento la realización de tomas al pecho. Al alta, ningún paciente cumplía indicación para administrar LD, por lo que la LM al alta siempre fue LM propia. Se definió CIR por un peso al nacer inferior a p10 y RPC por una caída superior a 1 punto z en el peso desde el nacimiento hasta el alta. Dado el largo periodo de estudio y la introducción en 2018 de medidas específicas de apoyo a la LM con disponibilidad de LD, se analizaron las posibles diferencias entre ambos periodos.
Análisis estadísticoPara el análisis, los datos se procesaron mediante el software estadístico IBM SPSS 19 v25. Para la descripción de las variables cuantitativas continuas se utilizaron la media y la desviación estándar (DE) en caso de normalidad; de lo contrario, se analizaron la mediana y el rango intercuartílico. Las variables cualitativas se describen mediante frecuencias absolutas y frecuencias relativas expresadas como porcentaje.
Las comparaciones entre variables cuantitativas continuas entre grupos independientes se evaluaron mediante pruebas paramétricas, utilizando la prueba t de Student. Cuando no se cumplen condiciones de normalidad, se utilizaron pruebas no paramétricas (U de Mann- Whitney). El análisis de frecuencia entre variables cualitativas se realizó mediante la prueba de chi-cuadrado o test de Fisher cuando fue necesario. El nivel de significación estadística se estableció para p<0,05.
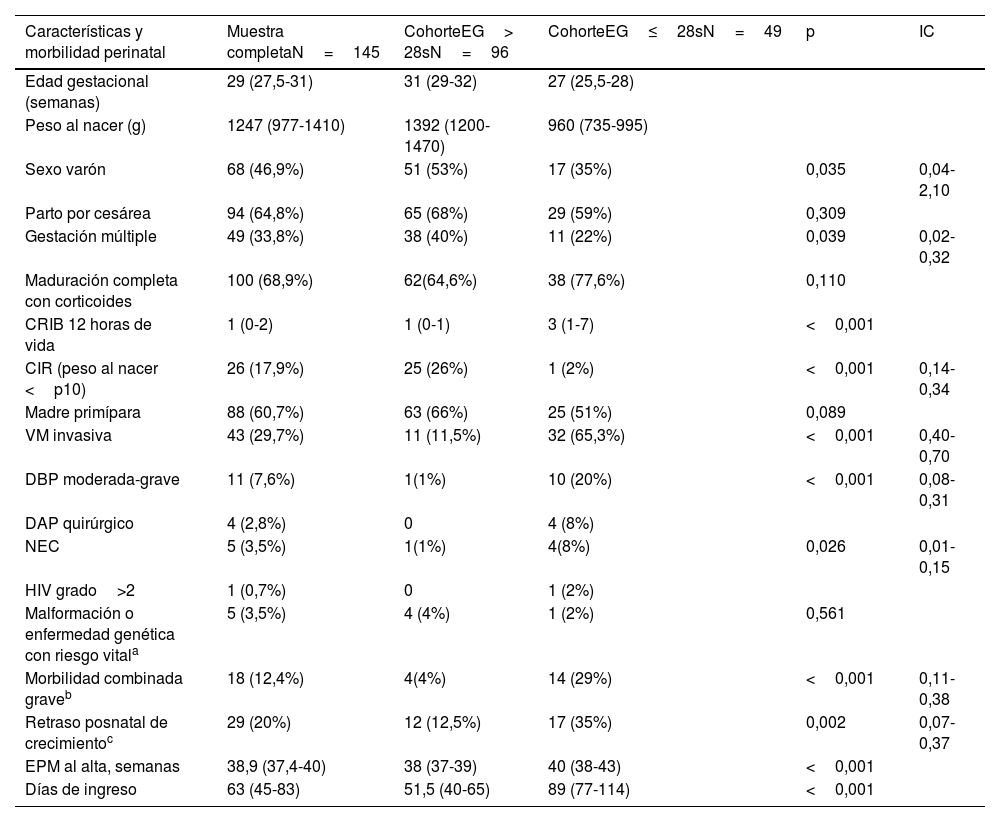
ResultadosDurante el periodo de estudio se incluyeron un total de 145 RNMBP (46,9% varones) con una mediana de EG 29 semanas y peso 1247g. Los datos referidos a las características perinatales se describen en la tabla 1. Como es de esperar, el grupo de RNPT de EG≤28s presentó mayor complejidad, precisó más recursos, acumuló mayor incidencia de complicaciones y requirió ingresos más prolongados, con una EPM superior al alta. Por otra parte, todos los pacientes CIR salvo uno pertenecían al grupo de EG>28s.
Descripción de la muestra
| Características y morbilidad perinatal | Muestra completaN=145 | CohorteEG> 28sN=96 | CohorteEG≤28sN=49 | p | IC |
|---|---|---|---|---|---|
| Edad gestacional (semanas) | 29 (27,5-31) | 31 (29-32) | 27 (25,5-28) | ||
| Peso al nacer (g) | 1247 (977-1410) | 1392 (1200-1470) | 960 (735-995) | ||
| Sexo varón | 68 (46,9%) | 51 (53%) | 17 (35%) | 0,035 | 0,04-2,10 |
| Parto por cesárea | 94 (64,8%) | 65 (68%) | 29 (59%) | 0,309 | |
| Gestación múltiple | 49 (33,8%) | 38 (40%) | 11 (22%) | 0,039 | 0,02-0,32 |
| Maduración completa con corticoides | 100 (68,9%) | 62(64,6%) | 38 (77,6%) | 0,110 | |
| CRIB 12 horas de vida | 1 (0-2) | 1 (0-1) | 3 (1-7) | <0,001 | |
| CIR (peso al nacer <p10) | 26 (17,9%) | 25 (26%) | 1 (2%) | <0,001 | 0,14-0,34 |
| Madre primípara | 88 (60,7%) | 63 (66%) | 25 (51%) | 0,089 | |
| VM invasiva | 43 (29,7%) | 11 (11,5%) | 32 (65,3%) | <0,001 | 0,40-0,70 |
| DBP moderada-grave | 11 (7,6%) | 1(1%) | 10 (20%) | <0,001 | 0,08-0,31 |
| DAP quirúrgico | 4 (2,8%) | 0 | 4 (8%) | ||
| NEC | 5 (3,5%) | 1(1%) | 4(8%) | 0,026 | 0,01-0,15 |
| HIV grado>2 | 1 (0,7%) | 0 | 1 (2%) | ||
| Malformación o enfermedad genética con riesgo vitala | 5 (3,5%) | 4 (4%) | 1 (2%) | 0,561 | |
| Morbilidad combinada graveb | 18 (12,4%) | 4(4%) | 14 (29%) | <0,001 | 0,11-0,38 |
| Retraso posnatal de crecimientoc | 29 (20%) | 12 (12,5%) | 17 (35%) | 0,002 | 0,07-0,37 |
| EPM al alta, semanas | 38,9 (37,4-40) | 38 (37-39) | 40 (38-43) | <0,001 | |
| Días de ingreso | 63 (45-83) | 51,5 (40-65) | 89 (77-114) | <0,001 |
Variables categóricas expresadas en n (%); variables cuantitativas expresadas en mediana (RIC) o media±desviación estándar.
CIR: restricción intrauterina de crecimiento; DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; EG: edad gestacional; EPM: edad postmenstrual; HIV: hemorragia intraventricular; NEC; enterocolitis necrosante; s: semanas; VM: ventilación mecánica.
Incluye: atresia anal distal (1), malrotación con vólvulo (1), enfermedad de Hirschprung de segmento largo que precisa intervención quirúrgica (1), síndrome de Witteveen-Kolk (1), atresia de esófago (1).
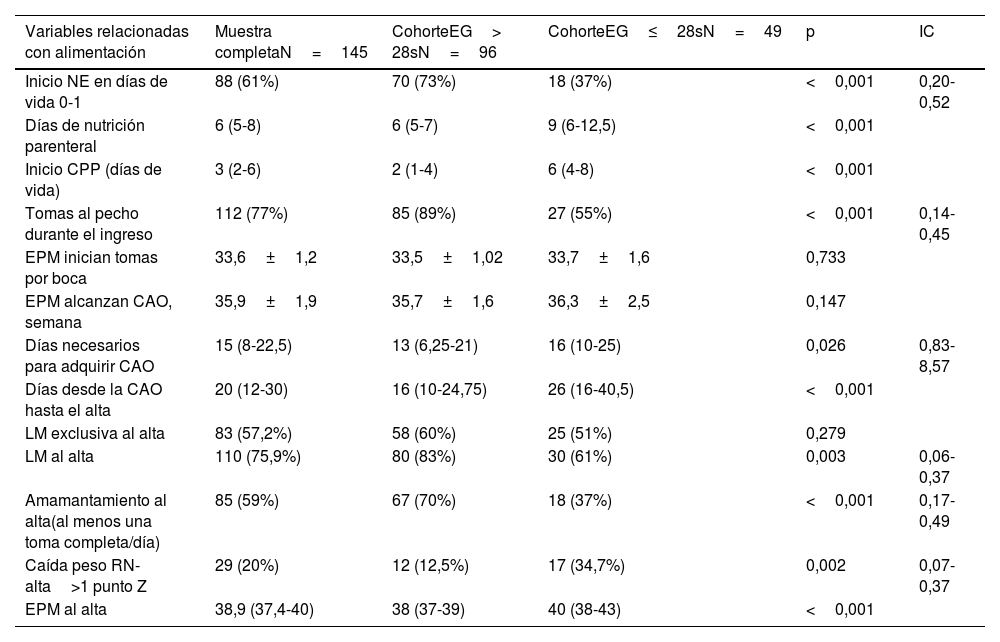
Con respecto a las prácticas de alimentación (tabla 2), la nutrición enteral se inició en los días 0 o 1 de vida en el 61% de la muestra, si bien esto fue infrecuente en el grupo de EG≤28s (73% vs. 37%; p<0,001). Recibieron nutrición parenteral durante una mediana de 6 días (RIC 5-8). El 57% de los pacientes fueron dados de alta con LME, y el 58% completaba al menos una toma al pecho. Los niños de EG≤28s precisaron más días de nutrición parenteral y tuvieron menores tasas de LM y amamantamiento en el momento del alta.
Variables relacionadas con la alimentación
| Variables relacionadas con alimentación | Muestra completaN=145 | CohorteEG> 28sN=96 | CohorteEG≤28sN=49 | p | IC |
|---|---|---|---|---|---|
| Inicio NE en días de vida 0-1 | 88 (61%) | 70 (73%) | 18 (37%) | <0,001 | 0,20- 0,52 |
| Días de nutrición parenteral | 6 (5-8) | 6 (5-7) | 9 (6-12,5) | <0,001 | |
| Inicio CPP (días de vida) | 3 (2-6) | 2 (1-4) | 6 (4-8) | <0,001 | |
| Tomas al pecho durante el ingreso | 112 (77%) | 85 (89%) | 27 (55%) | <0,001 | 0,14-0,45 |
| EPM inician tomas por boca | 33,6±1,2 | 33,5±1,02 | 33,7±1,6 | 0,733 | |
| EPM alcanzan CAO, semana | 35,9±1,9 | 35,7±1,6 | 36,3±2,5 | 0,147 | |
| Días necesarios para adquirir CAO | 15 (8-22,5) | 13 (6,25-21) | 16 (10-25) | 0,026 | 0,83-8,57 |
| Días desde la CAO hasta el alta | 20 (12-30) | 16 (10-24,75) | 26 (16-40,5) | <0,001 | |
| LM exclusiva al alta | 83 (57,2%) | 58 (60%) | 25 (51%) | 0,279 | |
| LM al alta | 110 (75,9%) | 80 (83%) | 30 (61%) | 0,003 | 0,06- 0,37 |
| Amamantamiento al alta(al menos una toma completa/día) | 85 (59%) | 67 (70%) | 18 (37%) | <0,001 | 0,17-0,49 |
| Caída peso RN-alta>1 punto Z | 29 (20%) | 12 (12,5%) | 17 (34,7%) | 0,002 | 0,07-0,37 |
| EPM al alta | 38,9 (37,4-40) | 38 (37-39) | 40 (38-43) | <0,001 |
Variables categóricas expresadas en n (%); variables cuantitativas expresadas en mediana (RIC) o media±desviación estándar.
CAO: competencia para la alimentación oral; CPP: contacto piel con piel; EG: edad gestacional; EPM: edad posmenstrual; NE: nutrición enteral; LM: lactancia materna, incluye exclusiva y suplementada.
De forma global, la alimentación por boca se inició alrededor de las 34 semanas de edad posmenstrual (sEPM) (33,6±1,2) y se completaron las tomas por boca cerca de la 36 sEPM. La CAO se consiguió en una mediana de 15 días (8-22,5). El grupo RNPT≤28s inició la alimentación oral a una EPM similar a los niños con EG>28s, pero necesitaron más días para conseguir la CAO (mediana 16 vs. 13 días). Además, una vez alcanzada la CAO, precisaron una mediana de 20 días más de ingreso, siendo significativamente mayor el tiempo necesario en el grupo≤28s (26 vs. 16 días).
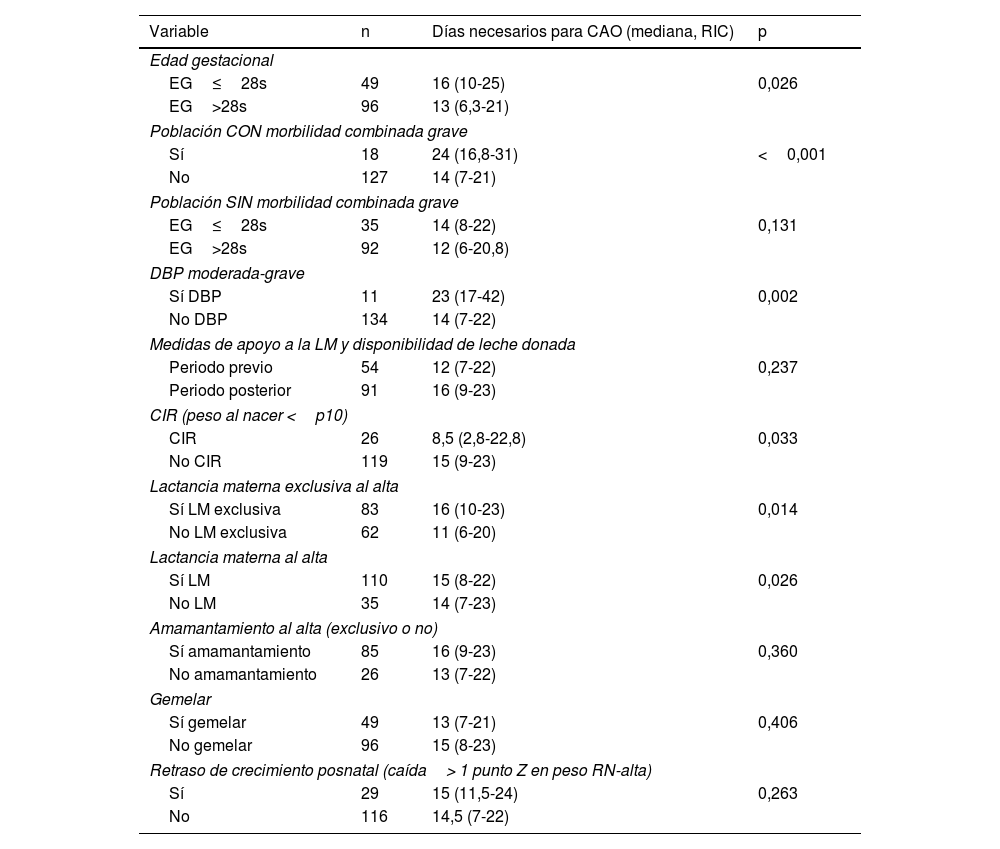
Las variables asociadas a un tiempo más prolongado para alcanzar la CAO fueron la presencia de MCG y DBP moderada-grave (tabla 3). En presencia de MCG, los pacientes precisaron una mediana de 10 días más para alcanzar la CAO. Dado que la mayoría de los pacientes con MCG tienen EG≤28s, se analizó el tiempo necesario para la CAO controlando este factor. En la población sin MCG, no se encontraron diferencias significativas en el número de días para la CAO en función de la EG menor o mayor de 28s (p=0,131).
Análisis de factores que influyen sobre la adquisición de la competencia en la alimentación oral
| Variable | n | Días necesarios para CAO (mediana, RIC) | p |
|---|---|---|---|
| Edad gestacional | |||
| EG≤28s | 49 | 16 (10-25) | 0,026 |
| EG>28s | 96 | 13 (6,3-21) | |
| Población CON morbilidad combinada grave | |||
| Sí | 18 | 24 (16,8-31) | <0,001 |
| No | 127 | 14 (7-21) | |
| Población SIN morbilidad combinada grave | |||
| EG≤28s | 35 | 14 (8-22) | 0,131 |
| EG>28s | 92 | 12 (6-20,8) | |
| DBP moderada-grave | |||
| Sí DBP | 11 | 23 (17-42) | 0,002 |
| No DBP | 134 | 14 (7-22) | |
| Medidas de apoyo a la LM y disponibilidad de leche donada | |||
| Periodo previo | 54 | 12 (7-22) | 0,237 |
| Periodo posterior | 91 | 16 (9-23) | |
| CIR (peso al nacer <p10) | |||
| CIR | 26 | 8,5 (2,8-22,8) | 0,033 |
| No CIR | 119 | 15 (9-23) | |
| Lactancia materna exclusiva al alta | |||
| Sí LM exclusiva | 83 | 16 (10-23) | 0,014 |
| No LM exclusiva | 62 | 11 (6-20) | |
| Lactancia materna al alta | |||
| Sí LM | 110 | 15 (8-22) | 0,026 |
| No LM | 35 | 14 (7-23) | |
| Amamantamiento al alta (exclusivo o no) | |||
| Sí amamantamiento | 85 | 16 (9-23) | 0,360 |
| No amamantamiento | 26 | 13 (7-22) | |
| Gemelar | |||
| Sí gemelar | 49 | 13 (7-21) | 0,406 |
| No gemelar | 96 | 15 (8-23) | |
| Retraso de crecimiento posnatal (caída> 1 punto Z en peso RN-alta) | |||
| Sí | 29 | 15 (11,5-24) | 0,263 |
| No | 116 | 14,5 (7-22) | |
CAO: competencia para la alimentación oral; CIR: crecimiento intrauterino restringido; DBP: displasia broncopulmonar; LM: lactancia materna.
Los pacientes alimentados con LM al alta, exclusiva o no, precisaron más tiempo para adquirir la CAO, independientemente de la EG o la presencia de MCG. Sin embargo, el hecho de realizar tomas al pecho no se asoció a diferencias en el tiempo necesario para la CAO.
Los pacientes con CIR tenían una EG superior a la del resto de la muestra (32 vs. 29 semanas; p<0,001) y probablemente por ello precisaron menos días para la CAO (mediana de 8,5 vs. 15 días; p=0,033).
Otros factores como gemelaridad, restricción posnatal de crecimiento, disponibilidad de LD y la implantación de medidas de apoyo a la lactancia, no mostraron impacto.
DiscusiónEl presente estudio describe la secuencia temporal para la adquisición de la alimentación oral competente en RNMBP bajo una estrategia de alimentación pautada. También analizamos qué factores influyen en el tiempo necesario para adquirir la CAO. Desarrollamos nuestro estudio en una muestra de RNMBP con largos periodos de hospitalización como consecuencia entre otras circunstancias, de la dificultad para lograr una ingesta oral adecuada. Los resultados permiten identificar qué grupos de niños presentan más dificultades y serían más susceptibles de intervención con el objetivo de mejorar la transición a la alimentación oral.
Todos los RNMBP del estudio, independientemente de su EG alcanzaron la CAO antes del alta. De forma similar a otros estudios10 encontramos que los niños de nuestra cohorte completan todas las tomas por boca a una mediana de 36 sEPM.
A pesar de que la EPM a la que se inicia la alimentación oral no difiere según la EG, nuestros resultados son consistentes con otros trabajos que muestran cómo, a menor EG, mayor es el tiempo necesario para lograr una alimentación oral completa9,10,28; en esta línea encontramos que los RNPT>28 semanas alcanzan la CAO una mediana de 3 días antes que el grupo ≤28s. Aunque la diferencia estadística existe, la relevancia clínica de 3 días nos parece escasa en relación al tiempo total de ingreso que precisan estos pacientes. Además, una vez controlada la presencia de MCG, más prevalente en la cohorte de EG≤28s, la EG no fue un factor estadísticamente significativo.
Según nuestros resultados, y a diferencia de otros trabajos, es la presencia de MCG lo que tiene impacto negativo en la CAO, y no la EG menor o mayor de 28s. Los pacientes con MCG precisan una mediana de 24 días para la CAO, frente a los 14 días de la cohorte sin MCG. La alimentación oral se inicia y se completa a una EPM más avanzada en este grupo de pacientes complejos. Un grupo importante de pacientes con MCG son niños con DBP moderada-grave que, de forma independiente, precisaron más tiempo para la CAO, dato ya referido en otros estudios29,30. Este hallazgo parece relacionarse con la necesidad prolongada de soporte respiratorio que alteraría las aferencias sensoriales y el establecimiento de reflejos oromotores en periodos críticos del desarrollo31.
En relación con el tipo de alimentación, los resultados de nuestro estudio muestran que los niños dados de alta con LME precisan una mediana de 5 días más para alcanzar la CAO (16 vs. 11; p 0,014). Pensamos que podría deberse a que los niños que reciben LME y realizan tomas al pecho, necesitan más tiempo para conseguir una transferencia eficiente de leche que permita retirar la SNG sin repercusión ponderal. Puesto que la mayoría de los niños alimentados con LME reciben alguna toma al día de leche materna diferida administrada mediante biberón, en estos utilizamos los mismos criterios para la definición de la CAO; sin embargo, no podemos descartar que la interferencia del biberón dificultara y por tanto retrasara la adquisición de la CAO.
Por el contrario, la condición de CIR implica menos días para alcanzar la CAO; probablemente en relación con una EG superior, lo que implica una mayor madurez y estabilidad fisiológica.
Nuestro estudio evidencia aquellos factores que implican un retraso en la adquisición de la CAO bajo una estrategia de alimentación ajustada por horario y volumen, habitual en muchas UCIN. Revisiones sistemáticas publicadas8 plantean la posibilidad de que una alimentación receptiva, guiada por el niño o basada en señales, pudiera facilitar la instauración de una alimentación oral completa. Parece lógico pensar que cuando la alimentación oral no sigue una pauta fija, sino que es guiada por las competencias que muestra el paciente, se conseguirían mejores resultados. Aunque la revisión Cochrane22 no ha mostrado evidencia al respecto, incide en que muchas dificultades son metodológicas: no existe una definición consensuada de la CAO, y por ello los estudios son difícilmente comparables. Un resultado llamativo es que desde que se adquiere la CAO, definida en nuestro caso por la retirada definitiva de la SNG en ausencia de episodios de inestabilidad cardiorrespiratoria relevantes, pasa un largo tiempo hasta el alta: una mediana de 20 días, más aún para el grupo de menores de 28s y/o MCG. El. motivo principal para retrasar el alta hospitalaria es la presencia de bradicardias y/o desaturaciones leves durante las tomas. Esto nos lleva a plantearnos qué estamos aceptando como competencia para la alimentación oral y si estaremos retirando la SNG antes de que el niño esté realmente preparado.
Como limitación del estudio destacamos la falta de registro de ciertas variables como el tiempo de presencia de los padres o de cuidado canguro, que claramente se relacionan con la adquisición de la CAO. Además, la unidad no dispone de un protocolo específico para guiar la transición hacia la alimentación oral, lo que puede llevar a prácticas individuales subjetivas, pero por otra parte esta es la realidad (claramente mejorable) en muchas unidades neonatales. A pesar de ello, pensamos que nuestro estudio contribuye a una mejor comprensión de los factores que impactan en el desarrollo de las habilidades de alimentación en RNMBP.
ConclusionesConsideramos necesario unificar criterios y tratar de estandarizar el proceso para alcanzar la alimentación oral competente en los RNMBP. Esto permitiría desarrollar estudios metodológicamente correctos, identificar a la población de riesgo y explorar intervenciones dirigidas a mejorar sus competencias.
Todos los RNMBP deben tener la oportunidad de recibir cuidados basados en el cuidado madre canguro precoz, frecuente y continuado, succión no nutritiva, amamantamiento y alimentación basada en señales para mejorar su competencia oral. Con los resultados de nuestro estudio, pensamos que el grupo de pacientes con MCG podría beneficiarse de terapias específicas para mejorar la CAO.
Parte de los resultados de este trabajo han sido previamente presentados en el XII Congreso Español de Lactancia Materna celebrado los días 18-20 de abril de 2024 en las Palmas de Gran Canaria.