A pesar de la vacunación, se siguen describiendo esporádicamente casos y brotes de tos ferina, algunos de ellos en niños en edades muy tempranas, en quienes la potencial gravedad de la enfermedad es mayor. La intención de este estudio fue valorar el impacto de esta infección en niños menores de 12 meses en una región con elevadas coberturas vacunales en la población pediátrica.
Pacientes y métodosEstudio retrospectivo observacional, por revisión de historias clínicas, de los casos confirmados microbiológicamente de tos ferina durante una década (1999-2008), mediante una técnica de reacción en cadena de la polimerasa que amplifica la secuencia genética IS481 de Bordetella pertussis.
ResultadosSe confirmaron 54 casos, 33 (61,1%) en menores de 3 meses de edad. Se detectaron casos todos los años, con brotes periódicos (1999, 2004 y 2008). La mitad de los casos ocurrieron en verano. El 55% de los niños, debido a su corta edad, no había recibido ninguna dosis de vacuna y sólo el 11% las tres primeras dosis. Treinta y nueve casos (72%) fueron hospitalizados y 17 (31,5%) necesitaron el apoyo de la unidad de cuidados intensivos pediátricos, falleciendo un niño a los 49 días de vida, nacido prematuro, con un cuadro compatible con tos ferina maligna.
ConclusionesPese a la elevada cobertura de la vacunación antipertúsica, los menores de 6 meses continúan siendo un grupo de riesgo para tos ferina grave. Es necesario introducir nuevas estrategias preventivas que disminuyan aún más el impacto de esta enfermedad.
Despite vaccination, reports of cases and outbreaks of pertussis (whooping cough) continue to appear sporadically, sometimes in young children who are at higher risk of severe disease. The aim of the present study was to evaluate the impact of this infection in infants in a region with high vaccination coverage in the pediatric population.
Patients and methodsWe performed a retrospective observational chart-review study of pertussis cases occurring over a decade (1999-2008), microbiologically confirmed through a polymerase chain reaction technique that amplifies the IS481 Bordetella pertussis sequence.
ResultsThere were 54 confirmed cases, of which 33 (61.1%) occurred in infants aged less than 3 months. Cases were detected in all the study years, with periodic outbreaks (1999, 2004 and 2008). Half of the cases occurred in summer. Due to their young age, 55% of the infants had not received a vaccine dose and only 11% had received the first three doses. Hospitalization was required in 39 cases (72%) and admission to the pediatric intensive care unit in 17 cases (31.5%). One premature infant, with symptoms compatible with malignant pertussis, died at 49 days of life.
ConclusionsDespite the high pertussis vaccination coverage, infants aged less than 6 months continue to be at risk of severe disease. New preventive strategies are required to further reduce the impact of this infection.
A pesar de la elevada cobertura vacunal alcanzada frente a Bordetella pertussis (B. pertussis) en los países desarrollados pocos años después de la introducción de la vacunación sistemática, la tos ferina persiste como un problema importante de salud pública, observándose incrementos periódicos en su incidencia, cada 2 a 5 años1,2. En España, la vacuna frente a la tos ferina se introdujo en el calendario vacunal en 1965, siendo la actual recomendación la administración de 5 dosis de vacuna acelular (combinada con los toxoides diftérico y tetánico [DTPa]), incluyendo una serie inicial de 3 dosis a los 2, 4 y 6 meses de vida y 2 dosis de refuerzo (15-18 m y 4-6 años)3. La eficacia de las actuales vacunas infantiles se sitúa en torno a 70-85% y se correlaciona con el número de dosis recibidas, habiéndose asociado a una importante reducción en la frecuencia y la gravedad de la enfermedad1,4.
En los lactantes parcialmente vacunados, y sobre todo en los no vacunados, la enfermedad puede cursar con cuadros graves y prolongados, en ocasiones causando complicaciones, secuelas respiratorias y neurológicas y muerte5,6. El objetivo de este trabajo ha sido evaluar la situación de la tos ferina en los menores de 12 meses de edad y sus características clínico-epidemiológicas en Guipúzcoa (País Vasco, España), territorio en el que la cobertura mínima anual frente a B. pertussis (3 primeras dosis) es > 91% desde hace dos décadas7.
Material y métodosEstudio retrospectivo observacional de pacientes menores de 12 meses de edad diagnosticados de infección por B. pertussis entre enero de 1999 y diciembre de 2008 en Guipúzcoa. Se seleccionó a los niños con diagnóstico de tos ferina confirmado microbiológicamente, obtenidos de los registros informatizados del servicio de microbiología del Hospital Universitario Donostia, centro de referencia para el diagnóstico de esta infección en la provincia de Guipúzcoa. Para la confirmación microbiológica se utilizó la detección de ADN de B. pertussis mediante una técnica de reacción en cadena de la polimerasa (PCR) que amplifica la secuencia genética IS481, empleando como muestras clínicas aspirado nasofaríngeo o, en el caso del medio extrahospitalario, frotis faríngeo.
Se revisaron las historias clínicas de los pacientes, obteniendo la información referente a las siguientes variables cualitativas: sexo, antecedentes personales, vacunación, motivo de consulta, datos clínicos y de la exploración física, expresión clínica, necesidad de ingreso, resultados de las técnicas de imagen, coinfecciones, tratamiento recibido y evolución. Se analizaron como variables cuantitativas la edad, las constantes vitales, los datos analíticos y los días de hospitalización. Para la recogida de la información se diseñó una base de datos (Access®), realizándose posteriormente el análisis estadístico con el programa Statgraphics Centurion 15.2.14 (XV). Se utilizaron las pruebas de la chi al cuadrado para la comparación de proporciones y la U de Mann-Whitney para la comparación de variables cuantitativas, respectivamente, considerando significativos los valores de p<0,05. Para el cálculo de la tasa anual de incidencia de hospitalización se utilizó como numerador el número de niños menores de un año de edad diagnosticados de infección por B. pertussis confirmada microbiológicamente en el año o período plurianual considerado, y como denominador los niños menores de 1 año viviendo en Guipúzcoa en dicho período, según datos disponibles en el Instituto Vasco de Estadística (Eustat).
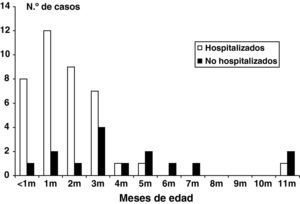
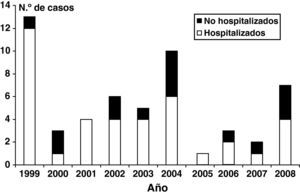
ResultadosEn el período de estudio se confirmaron 54 casos de infección por B. pertussis en menores de 12 meses de edad, con una edad media de 92 días (rango: 16-354 días, mediana 68 días), siendo 49 (90,7%) y 33 (61,1%) menores de 6 meses y menores de 3 meses de edad, respectivamente (fig. 1). Veinticinco casos (46,3%) fueron varones y 29 mujeres (53,7%). Aunque 13 de los pacientes (24,1%) fueron diagnosticados en 1999, se detectaron casos todos los años del estudio, con brotes de menor entidad en los años 2004 (n=10, 18%) y 2008 (n=7, 11%) (fig. 2). Veintisiete casos (50%) se detectaron en los meses de verano (julio-septiembre), aunque la bacteria se detectó en cualquier mes del año.
Se conoció la situación vacunal de 49 (90,7%) pacientes, no habiéndose dispuesto de esta información en 5 niños atendidos en medio ambulatorio. Un total de 27 niños (55,1%) no había recibido ninguna dosis de vacuna, 26 de los 27 menores de 3 meses de edad (96,3%). De los 21 niños mayores de 3 meses de edad sólo 1 (11 meses de edad) no había recibido ninguna dosis de vacuna (4,8%). Por otra parte, de los 22 pacientes que habían recibido alguna dosis de vacuna, sólo 6 (2 de 5,5 meses de edad y 4 de 6 o más meses) habían recibido la serie completa de la vacunación inicial infantil DTPa.
En los 41 pacientes asistidos en el Hospital Universitario Donostia se analizó en detalle la forma de presentación de la enfermedad. El 100% presentó tos, en la mayoría de los casos (85,4%) en forma de accesos paroxísticos. Otros signos y síntomas referidos con frecuencia fueron rinorrea (68,3%), rechazo de la toma (58,5%), episodios de cianosis (48,8%), apnea (36,6%) y vómitos desencadenados por la tos (31,7%). El gallo inspiratorio típico estuvo presente sólo en 7 casos (17%) y un 75,6% no presentaron fiebre. En el 75% de los casos se observó afectación del estado general, y en más del 50% signos de dificultad respiratoria (taquipnea, disnea, tiraje subcostal e intercostal, aleteo nasal), siendo los diagnósticos iniciales más frecuentes bronquiolitis (34%), infección de vías aéreas superiores (23%) o tos paroxística-accesos de tos (22%). Diagnósticos menos frecuentes fueron episodios de cianosis (9,8%), neumonía (7,3%) y laringitis (2,4%). Un caso se catalogó de tos ferina maligna (2,4%).
Treinta y nueve de los 54 (72,2%) pacientes requirieron ingreso hospitalario, oscilando la tasa de incidencia anual de hospitalización por tos ferina entre 13,9 y 195,8 casos por 100.000 niños menores de 1 año (media 57,8). La edad media de los pacientes ingresados fue de 70 días (rango 16-354 días; mediana 56 días), menor que la de los no ingresados, con una edad media de 141 días (rango 22-343 días; mediana 97 días) (p=0,004). Veintinueve de los 33 menores (87,8%) de 3 meses fueron hospitalizados, frente a 10 de los 21 (47,6%) de los de 3-< 12 meses de edad (p=0,001). La estancia media fue de 14,4 días (rango 2-66 días; mediana 12 días). La radiografía de tórax fue patológica en 11 de los 36 casos (30,6%), con patrón de infiltrados y atelectasias laminares. Se detectaron coinfecciones víricas (virus en aspirado nasofaríngeo) en 6 casos (11,1%) hospitalizados, 4 de ellos en la unidad de cuidados intensivos pediátricos (UCIP).
Diecisiete pacientes (31,5%) fueron hospitalizados en la UCIP, 14 (82,4%) de ellos menores de 3 meses de edad (tabla 1), siendo la estancia media en la UCIP 12,3 días (rango: 1-47). Las causas más frecuentes de hospitalización en esta unidad fueron la necesidad de soporte respiratorio y la monitorización estrecha por apnea. Otras causas fueron neumonía (n=3), convulsiones (n=2) y tos ferina maligna (n=1). La cifra de leucocitos al ingreso fue de 23.915/μl (rango 5.920-54.000/μl), siendo la PCR 26,7mg/l (rango 1-209), ambas mayores que las obtenidas en los hospitalizados en planta (16.923/μl y 10,7mg/l, respectivamente), si bien sólo la diferencia observada en la cifra de leucocitos alcanzó significación estadística (p=0,03). Dos pacientes presentaron hiponatremia marcada al ingreso (114 mEq/l y 124 mEq/l) precisando ambos ingreso en la UCIP y asistencia respiratoria con ventilación mecánica convencional. El resto de los niños fueron tratados con oxígeno suplementario.
Características principales de los casos hospitalizados en la unidad de cuidados intensivos pediátricos (n=17)
| Fecha | Sexo | Edad (días) | Dosis de vacuna | Motivos de ingreso |
| 05/07/1999 | Mujer | 16 | 0 | Apnea, cianosis |
| 16/07/1999 | Mujer | 46 | 0 | Cianosis |
| 20/07/1999 | Varón | 31 | 0 | Apnea, cianosis |
| 27/09/1999 | Varón | 47 | 0 | Apnea, cianosis |
| 26/10/1999 | Mujer | 26 | 0 | Apnea, cianosis |
| 20/05/2000 | Mujer | 52 | 0 | Apnea, cianosis, distrés respiratorio |
| 07/09/2001 | Mujer | 108 | 2 | Apnea, cianosis |
| 12/04/2002 | Mujer | 51 | 0 | Apnea, distrés respiratorio |
| 14/06/2002 | Varón | 27 | 0 | Apnea, cianosis, distrés respiratorio |
| 26/12/2002 | Mujer | 22 | 0 | Cianosis |
| 07/05/2004 | Mujer | 354 | 3 | Distrés respiratorio |
| 30/07/2004 | Varón | 20 | 0 | Apnea, cianosis |
| 07/05/2005 | Varón | 69 | 1 | Apnea, neumonía |
| 25/09/2006 | Mujer | 27 | 0 | Cianosis |
| 25/09/2006 | Varón | 91 | 1 | Apnea, cianosis |
| 03/04/2008 | Mujer | 45 | 0 | Apnea, distrés respiratorio |
| 28/12/2008 | Varón | 26 | 0 | Apnea, cianosis |
La evolución fue favorable en el 98% de los casos, habiendo recibido todos los casos tratamiento con macrólidos (eritromicina en el 89% de los casos). Sin embargo, un niño falleció a los 49 días de vida, que debutó 4 días antes con un cuadro clínico de apneas con cianosis e hipoxemia refractaria, presentando posteriormente convulsiones y shock de rápida progresión con fracaso multiorgánico, compatible con tos ferina maligna.
DiscusiónEl presente estudio documenta que la tos ferina continúa siendo una enfermedad endémica, con picos cíclicos aún detectables, causante de una morbilidad importante entre menores de 12 meses de edad. La circulación de B. pertussis se mantiene a pesar de que la incidencia de tos ferina se redujo muy notablemente en Guipúzcoa desde la introducción de la vacunación infantil7, y de que la cobertura vacunal mínima en los últimos 20 años ha sido elevada (> 91% para las 3 dosis iniciales)7. La protección de la vacunación se desvanece tras 4-12 años de su administración8, lo que permite el mantenimiento de la transmisión y el incremento de tos ferina en adolescentes y adultos, pese a las elevadas coberturas vacunales infantiles1,2. La enfermedad en adolescentes y adultos es normalmente leve y atípica (tos persistente es la manifestación más habitual) e infradiagnosticada, constituyendo ambos una fuente importante de B. pertussis para la población infantil no vacunada o que no haya completado la primovacunación9–11. Por tanto, las actuales estrategias vacunales no protegen adecuadamente a los menores de 6 meses contra esta enfermedad2.
La tasa de incidencia anual de hospitalización por tos ferina en menores de 12 meses observada en Gipúzcoa se situó en el rango inferior de la referida para el conjunto de España en general (139,4 entre 1999 y 2005, rango 96-303/100.000 habitantes)12 y en particular para Cataluña13 y Gran Canaria14, siendo más elevada que la comunicada en La Rioja12. Aunque estas tasas están en línea con las referidas en algunos países desarrollados con cobertura vacunal elevada15,16, las comparaciones deben ser valoradas con precaución, debido a diferencias en los períodos de vigilancia considerados, en los sistemas de vigilancia empleados en unos y otros países2, y al importante hecho de que sólo algunos estudios se basan en casos confirmados microbiológicamente.
El 72% de los menores de 12 meses de edad con tos ferina fueron hospitalizados, siendo este porcentaje claramente superior en los de menor edad (88% de los menores de 3 meses). Es conocido que en las primeras semanas y meses de vida se presentan los cuadros clínicos más graves, siendo esta la edad en la que ocurren la mayoría de las complicaciones graves y se realizan la mayor parte de las hospitalizaciones12,15,17,18. La edad de los que precisan el apoyo de la UCIP y de los que fallecen es aún menor18–20, y de hecho, el 82% de los niños de esta serie hospitalizados en la UCIP fueron menores de 3 meses. En esta mayor gravedad pueden influir, entre otras razones, la inmadurez propia de su corta edad y el que estos niños son demasiado jóvenes para haber sido vacunados, siendo conocido que desde la primera dosis, la vacunación presenta un efecto protector frente a la hospitalización y los cuadros clínicos más graves15,17,18.
La tos sigue siendo la principal seña de identidad, habitualmente en forma de accesos, paroxismos, tos quintosa o como tos de evolución prolongada19,20. En los lactantes es infrecuente la presencia del típico gallo inspiratorio. La ausencia de sintomatología claramente reconocible explica el frecuente diagnóstico y tratamiento tardío, y favorece la aparición de un mayor número de complicaciones. En menores de 12 meses, la cianosis, los episodios de apnea, la tos accesual no quintosa y la tos emetizante son signos y síntomas que orientan al diagnóstico de sospecha de tos ferina19.
Apnea, neumonías y convulsiones se consideran las manifestaciones asociadas a la tos ferina que más frecuentemente requieren el apoyo de la UCIP16. En nuestra cohorte observamos los mismos resultados, siendo la apnea la manifestación clínica grave y motivo más frecuente de hospitalización en UCIP, seguidos de neumonía (3 casos) y convulsiones (2 casos). En los exámenes complementarios no observamos hiperleucocitosis (> 100.000 leucocitos/μl), considerada como marcador independiente de gravedad21, aunque el niño fallecido presentó una cifra elevada (77.000 leucocitos/μl).
Coinfecciones víricas se han descrito también en otros estudios, en ocasiones en mayor porcentaje14, especialmente con el virus respiratorio sincitial en menores de 6 meses de edad22,23. El bajo porcentaje de coinfecciones detectado en nuestra región puede ser debido a la circulación preferencial de B. pertussis en meses cálidos en los que la actividad de los virus respiratorios es menor.
Por su corta edad (91% de los casos de esta serie eran menores de 6 meses), la mayor parte de los niños no estaba vacunado o había recibido menos de 3 dosis. Dada la elevada incidencia de la tos ferina en lactantes, y las graves consecuencias que con frecuencia acarrea, es urgente el desarrollo de nuevas estrategias vacunales que contribuyan a proteger a este grupo de población1. La vacunación global de adolescentes y la vacunación de padres, hermanos y convivientes con los neonatos, son dos estrategias ya recomendadas por la Global Pertussis Initiative y algunos países y comités de vacunación2,9,18. Se ha observado que la principal fuente de contagio de los lactantes son los convivientes, especialmente padres y hermanos11,20,24, probablemente por el mantenimiento de la circulación de B. pertussis en adolescentes-adultos que han perdido parcialmente la inmunidad10,15. Otras alternativas son la vacunación de neonatos o la administración de una dosis de vacuna a las gestantes, que incrementaría la transferencia pasiva materno-filial de anticuerpos en la fase final del embarazo16. En la actualidad, la protección que todas estas opciones proporcionan a los lactantes, está en estudio16, no habiendo recibido aún el respaldo de la OMS1. Otra posible medida sería armonizar el momento de administración de la primera dosis con el recomendado por la OMS (6 semanas)1,15. Se ha estimado que adelantar la vacunación dos semanas (de la semana 8 a la semana 6 de vida) evitaría un 9% de las hospitalizaciones en niños de corta edad25. Finalmente, se debe insistir en que la vacunación se efectúe en la edad estipulada, sin retrasos que permitan una exposición indebida a la bacteria.
En conclusión, pese a las altas tasas de cobertura vacunal, los niños menores de 6 meses continúan siendo un grupo de riesgo para tos ferina grave. Es esencial mantener una vigilancia estrecha sobre la tos ferina, tanto en lactantes como en el resto de la población, para comprender mejor su epidemiología en esta época posvacunal y diseñar estrategias preventivas que disminuyan aún más su impacto. Pediatras y médicos de atención primaria deben tener también un papel importante en este terreno, tratando de confirmar las sospechas diagnósticas. Los nuevos métodos diagnósticos de infección por B. pertussis, como la PCR en tiempo real, y los métodos serológicos (antitoxina pertúsica), más sensibles que el cultivo tradicional, facilitan esta labor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.