La encefalopatía hipóxico-isquémica neonatal como consecuencia de la falta de oxígeno en el cerebro del recién nacido aparece asociada a secuelas neurológicas severas como la parálisis cerebral, pudiendo incluso desencadenar la muerte del recién nacido asfíctico. Actualmente, la hipotermia es la única terapia empleada en las unidades de cuidados intensivos neonatales, gracias, principalmente, a su capacidad para disminuir la acumulación de aminoácidos excitatorios y a su efecto antioxidante, antiinflamatorio y antiapoptótico. Sin embargo, la hipotermia no presenta beneficio clínico significativo en aproximadamente la mitad de los casos, haciéndose necesario encontrar u optimizar una terapia eficaz que disminuya las secuelas neurológicas derivadas de la asfixia perinatal, mediante su aplicación en solitario o en combinación con la hipotermia.
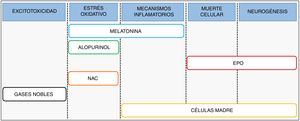
Dentro de estas terapias con potencial terapéutico demostrado destacan la melatonina, el alopurinol y la eritropoyetina, con ensayos clínicos en marcha, y otras como las células madre, la N-acetilcisteína o los gases nobles, con trabajos preclínicos publicados. La melatonina desarrolla un notable efecto antioxidante y antiinflamatorio, actuando como secuestrador de radicales libres y regulando diversos mediadores proinflamatorios. Por su parte, el alopurinol ejerce una potente función antioxidante mediante la inhibición de la enzima xantina oxidasa. La eritropoyetina, en cambio, tiene su principal diana terapéutica en la muerte celular y en la estimulación de la neurogénesis.
Teniendo en consideración las diferentes dianas y estrategias terapéuticas, el futuro del tratamiento de la encefalopatía hipóxico-isquémica podría hallarse en la combinación de uno o varios de estos tratamientos junto con la hipotermia terapéutica.
Neonatal hypoxic-ischaemic encephalopathy due to the lack of oxygen at birth can have severe neurological consequences, such as cerebral palsy, or even the death of the asphyxiated newborn. Hypothermia is currently the only therapy included in intensive care neonatal units. This shows a clinical benefit in neonates suffering from hypoxic-ischaemic encephalopathy, mainly because of its ability to decrease the accumulation of excitatory amino acids and its anti-inflammatory, antioxidant, and anti-apoptotic effects. However, hypothermia is not effective in half of the cases, making it necessary to search for new, or to optimize current therapies, with the aim on reducing asphyxia-derived neurological consequences, either as single treatments or in combination with cooling. Within current potential therapies, melatonin, allopurinol, and erythropoietin stand out among the others, with clinical trials on the way. While, stem cells, N-acetylcysteine and noble gases have obtained promising pre-clinical results. Melatonin produces a powerful antioxidant and anti-inflammatory effect, acting as free radical scavenger and regulating pro-inflammatory mediators. Through the inhibition of xanthine oxidase, allopurinol can decrease oxidative stress. Erythropoietin has cell death and neurogenesis as its main therapeutic targets. Keeping in mind the whole scenario of current therapies, management of neonates suffering from neonatal asphyxia could rely on the combination of one or some of these treatments, together with therapeutic hypothermia.
Con una incidencia de 1-3 por cada 1.000 recién nacidos a término1, la encefalopatía hipóxico-isquémica (EHI) es una de las causas más frecuentes de lesión cerebral en el neonato. Teniendo en cuenta el creciente número de recién nacidos de alto riesgo por causas como el incremento en la edad materna y el número de embarazos múltiples, entre otros, la EHI persiste como un problema relevante en el ámbito hospitalario para el cual todavía no existe una solución definitiva.
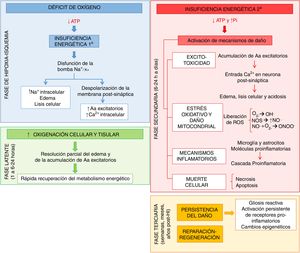
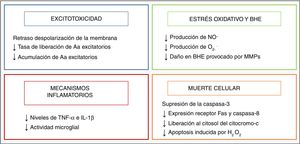
El estudio de la fisiopatología tras la asfixia perinatal ha permitido comprender el complejo proceso que acontece a nivel celular y tisular durante el desarrollo del daño cerebral ante la falta de oxígeno. Muchos de estos mecanismos lesivos son agrupados con base en el tiempo que discurre desde su aparición, describiéndose 4fases principales (fig. 1): de hipoxia-isquemia (HI), latente, secundaria y terciaria. En un primer momento, la lesión viene desencadenada por un déficit en el aporte de oxígeno a las células y los tejidos, provocando una insuficiencia energética primaria. Posteriormente, los niveles de fosfatos de alta energía parecen recuperados, constituyendo la fase latente. Sin embargo, esta mejora es transitoria, dando paso a la fase secundaria, en la que se ponen en marcha muchos de los mecanismos fisiopatológicos implicados en el desarrollo del daño cerebral neonatal, destacando: excitotoxicidad, entrada masiva de Ca2+ en la célula, estrés oxidativo, reacción inflamatoria y, en la mayoría de los casos, muerte celular por necrosis o apoptosis. Por último, la fase terciaria se caracteriza por la persistencia del daño cerebral semanas, meses e incluso años después de la agresión hipóxico-isquémica.
Principales mecanismos desencadenados tras la asfixia en las fases de hipoxia-isquemia (HI, azul), latente (verde), secundaria (rojo) y terciaria (naranja).
Aa: aminoácidos; ATP: adenosín trifosfato; Ca2+: ion calcio; K+: ion potasio; Na+: ion sodio; NO.: óxido nítrico; NOS: especies reactivas del nitrógeno; O2–.: anión superóxido; OH.: radical libre hidroxilo; ONOO-: peroxinitrito; Pi: fósforo inorgánico; ROS: especies reactivas del oxígeno.
Este conocimiento de la fisiopatología ha permitido describir potenciales dianas terapéuticas con el objetivo de reducir el daño cerebral derivado de la asfixia, con el consiguiente desarrollo de numerosas estrategias terapéuticas. Algunos de estos tratamientos, actualmente en ensayo, buscan actuar de forma sinérgica con la hipotermia terapéutica, la única terapia frente a la EHI que se ha incorporado a las unidades de cuidados intensivos neonatales.
HipotermiaEl origen de la hipotermia como terapia neuroprotectora neonatal surge del descubrimiento de la puesta en marcha de un mecanismo endógeno de enfriamiento por parte del recién nacido que ha sufrido algún daño durante el nacimiento2. Su efecto neuroprotector está relacionado principalmente con la reducción del metabolismo cerebral, con un descenso del 5% por cada grado de temperatura3, consiguiendo de esta forma modular algunas de las rutas metabólicas lesivas desencadenadas tras la asfixia, resumidas en la figura 2.
Terapia combinadaAnte la evidencia de que los actuales protocolos de hipotermia parecen óptimos4 y que su eficacia en la práctica clínica se ha demostrado limitada5, se hace necesario ampliar el elenco de agentes terapéuticos frente a la EHI6. Investigaciones recientes se centran en el desarrollo e implementación de terapias que puedan ser utilizadas en combinación con la hipotermia, tratando de actuar a distintos niveles de protección de la cascada fisiopatológica o fomentando la sinergia entre ambas terapias (fig. 3).
La melatonina (N-acetil-5-metoxitriptamina) es una neurohormona sintetizada por la glándula pineal, secretada siguiendo un ciclo diurno/nocturno y encargada, principalmente, de regular el ritmo circadiano. Un punto clave para ser utilizada como terapia frente a la EHI radica en su notable poder antioxidante y antiinflamatorio7 y en su capacidad de atravesar la barrera hematoencefálica y de llegar al sistema nervioso central8.
Previo paso a su ensayo en neonatos, la melatonina ha demostrado ser capaz de incrementar el nivel de protección desarrollado por la hipotermia, mediante la optimización del metabolismo energético cerebral en un estudio con lechones9. A nivel clínico, en un trabajo publicado por Aly et al.10, la mitad de los recién nacidos asfícticos fueron tratados con hipotermia y 5 dosis de 10mg/kg/día de melatonina por vía oral. Los autores observaron una reducción de los niveles en suero de superóxido dismutasa y óxido nítrico en los sujetos tratados con la terapia combinada frente al grupo que únicamente fue sometido a hipotermia, demostrando de esta forma el efecto beneficioso de su aplicación conjunta frente al estrés oxidativo.
Con el objetivo de evaluar la seguridad, la farmacocinética, la posología y la efectividad del uso de la melatonina en combinación con hipotermia, un estudio reciente conducido por Balduini et al. ha demostrado que la hipotermia no afecta a la farmacocinética de esta neurohormona11, pudiendo alcanzarse valores elevados en sangre con dosis inferiores a las empleadas en modelos experimentales. Actualmente, se encuentra en proceso de reclutamiento de pacientes el estudio MELPRO (NCT03806816), en el que se pretende incluir a 100 neonatos. Este y otros trabajos son indispensables previo desarrollo de ensayos clínicos de fase iii y posterior aplicación de la melatonina en la práctica clínica.
AlopurinolLa base sobre la que se sustenta la utilización de alopurinol como terapia frente a la EHI es su efecto inhibitorio sobre el enzima xantina oxidasa, implicada en el daño oxidativo. Además, este medicamento posee la capacidad de quelar el hierro libre y de actuar como secuestrador de radicales hidroxilo12,13. Resultados preclínicos obtenidos con un modelo de rata neonatal en el que los animales fueron incluidos en 5 grupos experimentales (grupo control, grupo de HI, grupo tratado con hipotermia, grupo tratado con alopurinol y grupo de terapia combinada), mostraron que, 72 h tras la HI, la mayor reducción de volumen infartado se dio en el grupo de la terapia combinada14.
Respecto a sus características farmacológicas, el alopurinol es capaz de atravesar la placenta y alcanzar rápidamente la concentración adecuada en el neonato, dato comprobado mediante un estudio realizado en gestantes a las que se les administró 500mg iv de alopurinol, obteniéndose, a los 5 min, niveles óptimos en muestras de cordón umbilical15. Con el fin de evaluar su posible efecto antioxidante en el neonato asfíctico, un estudio realizado por van Bel et al. en 1998 concluyó que, en el grupo de neonatos con EHI severa, la administración de 40mg/kg iv de alopurinol conseguía reducir la formación de radicales libres13. Sin embargo, un ensayo posterior realizado por Benders et al. en 2006 no encontró diferencias entre el grupo tratado con alopurinol y el grupo control16. Las conclusiones de los autores señalaron la extrema gravedad de la EHI en los neonatos incluidos en la muestra como una posible causa de la ausencia de diferencias significativas. También consideraron que el periodo transcurrido hasta la aplicación del alopurinol (3-4 h posreperfusión) podría haber sido relativamente tardío para obtener resultados favorables. En relación con este último punto, Gunes et al. administraron la misma dosis de alopurinol que los 2ensayos previos, pero dentro de las primeras 2h de vida, obteniendo, en el grupo de tratamiento, una aparente mejoría en el neurodesarrollo17. En línea con estos resultados, la administración de alopurinol iv a la madre durante el parto de fetos con hipoxia o hipoxia incipiente ha demostrado aumentar la eficacia del tratamiento, reduciendo los niveles en sangre de la arteria umbilical de la proteína S-100β, utilizada como biomarcador de daño cerebral18. Actualmente está en marcha un ensayo clínico Effect of Allopurinol for Hypoxic-ischemic Brain Injury on Neurocognitive Outcome (NCT03162653), que trata de evaluar su potencial terapéutico administrando el inhibidor enzimático en los primeros minutos de vida.
EritropoyetinaLa eritropoyetina (EPO) es una citocina de 30,4 kDa que en el periodo fetal es sintetizada por el hígado para, posnatalmente, ser sintetizada por el riñón y el cerebro en desarrollo, donde actúa como factor de crecimiento y agente neuroprotector19. El uso tanto de la EPO como de la EPO recombinante humana (rhEPO) en la EHI se fundamenta en su acción a través de su receptor, presente en neuronas y glía20, capaz de desarrollar una potente actividad antiapoptótica (favoreciendo la transcripción de genes antiapoptóticos Bcl-2 y Bcl-xL), así como antiinflamatoria y antioxidante19,21. Además de su efecto neuroprotector, la EPO es capaz de promover procesos reparativos a largo plazo, tales como la angiogénesis, la oligodendrogénesis y la neurogénesis22,23.
Ensayos preclínicos en los que se ha evaluado el efecto sinérgico de la coadministración de EPO o rhEPO con hipotermia han obtenido resultados contradictorios. Utilizando un modelo similar de daño cerebral hipóxico-isquémico en ratas neonatales P7, Fang et al. mostraron que su administración conjunta no generaba un efecto neuroprotector significativo24. Sin embargo, en otro trabajo realizado por Fan et al.25, los autores sí observaron un ligero efecto beneficioso en la función sensorio-motora de las ratas neonatales, aunque esto no se reflejó en la histología de muestras cerebrales.
Estudios en recién nacidos con EHI han demostrado que la rhEPO es segura en dosis entre 300 y 2.500 U/kg. Dosis bajas de rhEPO se muestran eficaces en pacientes con daño moderado, cuya administración aparece asociada a un menor riesgo de discapacidad o mortalidad26. Dosis más elevadas (de hasta 2.500 U/kg) son capaces de disminuir las convulsiones y las anomalías neurológicas a los 6 meses27.
A día de hoy, se encuentran en curso 3ensayos clínicos en fase iii en los que se pretende incluir a un total de 840 neonatos para evaluar la seguridad y la eficacia de dosis altas de EPO (1.000 U/kg) en combinación con hipotermia (Erythropoietin for Hypoxic Ischaemic Encephalopathy in Newborns, NCT03079167; High-dose Erythropoietin for Asphyxia and Encephalopathy, NCT02811263; Erythropoietin in Management of Neonatal Hypoxic Ischemic Encephalopathy, NCT03163589). El objetivo primario de los 2primeros ensayos es la reducción de muerte o discapacidad a los 2 años, mientras que el último evaluará estos parámetros tras un año. Habrá que esperar a los resultados de estos y otros estudios para poder determinar si la EPO o alguno de sus derivados presentan eficacia terapéutica y de qué manera debe ser implementada, evaluando factores como la dosis mínima efectiva, su vía de administración, la duración de la terapia, etc.
Células madreEl empleo de células madre es un campo cada vez más explorado para tratar todo tipo de enfermedades, entre ellas la EHI. Esta terapia podría facilitar la reparación y la regeneración del tejido cerebral dañado tras la agresión hipóxico-isquémica, a través de su interacción con células del sistema inmunitario localizadas en órganos alejados del cerebro tales como el bazo, alterando de esta forma la respuesta inmune/inflamatoria. Así mismo, la recuperación funcional obtenida tras su administración puede deberse en parte a una interacción entre las células trasplantadas y el tejido cerebral, con la consiguiente producción de factores de crecimiento, cuyo efecto final se refleja en un aumento de la proliferación celular y de la neurogénesis.
Pese a que aún es necesario aumentar los conocimientos que nos permitan su aplicación como terapia efectiva, trabajos realizados en modelos experimentales han demostrado que células madre de diversa naturaleza son capaces de sobrevivir al hospedarse en el cerebro lesionado, diferenciarse en neuronas o células gliales, integrarse en el tejido diana y modificar favorablemente los resultados conductuales (revisados en Bennet et al.28). Estudios recientes han descrito que la administración de células madre mesenquimales junto a 24 h de hipotermia en ratas P7 ha obtenido mejores resultados que cada terapia de forma individual29, incrementando, además, la ventana terapéutica para su administración hasta 2 días después del evento hipóxico-isquémico30. A su vez, las células madre pueden modular la respuesta inmunitaria mediante su interacción con células localizadas en órganos alejados del cerebro tales como el bazo, cuya movilización ha demostrado capacidad de exacerbar la respuesta inflamatoria y el daño HI en el cerebro inmaduro, pudiendo incrementar de esta forma la neuroprotección31,32.
La terapia con células madre, exclusiva o en combinación con hipotermia, es un campo de investigación prometedor que todavía requiere de ensayos clínicos para determinar, entre otros, los tipos de progenitores más efectivos, la dosis óptima y el periodo de administración más adecuado para la obtención de los mejores resultados terapéuticos28. Uno de estos trabajos en marcha en fase de reclutamiento (Study of hCT-MSC in Newborn Infants With Moderate or Severe HIE, NCT03635450) incluirá una muestra de 6 neonatos de 36 o más semanas de gestación con EHI moderada-severa, que serán tratados con hipotermia e infusión de 2dosis de células mesenquimales estromales derivadas de cordón umbilical (hCT-MSC, por sus siglas en inglés). Este ensayo en fase i ha establecido como objetivos principales evaluar la seguridad de la administración de hCT-MSC y analizar la supervivencia y el neurodesarrollo de los neonatos a los 6 y 16 meses, respectivamente. En otro estudio también en fase i (NCT00593242), el trasplante autógeno de células de cordón umbilical obtuvo resultados prometedores, donde un 74% de los neonatos que recibieron células madre presentaron puntuaciones por encima de 85 en los 3dominios del test de Bayley, frente al 41% que recibió solo hipotermia33.
N-acetilcisteínaLa N-acetilcisteína (NAC) es un precursor de la cisteína que puede actuar como secuestrador de radicales libres y es capaz de contribuir al mantenimiento del glutatión34, regulando de esta forma el estrés oxidativo. Respecto a su aplicación junto con hipotermia, la NAC mostró una mayor reducción en el volumen cerebral infartado al comparar el grupo de terapia combinada con los grupos que solo recibieron un tratamiento. Además, se obtuvieron valores similares a los animales del grupo control con relación a los reflejos y al daño en la sustancia blanca35. Gracias a la ausencia de efectos teratogénicos tras su administración durante el embarazo y a su capacidad de atravesar la placenta36, la NAC ha sido catalogada como uno de los agentes terapéuticos más prometedores para su inclusión en las unidades de cuidados intensivos neonatales. Sin embargo, a día de hoy no encontramos ningún estudio clínico en marcha para analizar su uso frente a la EHI, limitándose a ensayos relacionados con inflamación intraamniótica, corioamnionitis o síndrome de estrés respiratorio.
Gases noblesGases nobles como el xenón y el argón han demostrado efectos neuroprotectores en modelos experimentales de HI neonatal. Numerosos trabajos han evaluado la posibilidad de utilizar el xenón como agente terapéutico (para revisión, véase Lobo et al.37), debido a su capacidad de disminuir la excitotoxicidad post-HI mediante la modulación de los receptores glutamatérgicos NMDA38,39.
Con un tamaño muestral de 92 neonatos de entre 36 y 43 semanas, el ensayo clínico multicéntrico Total Body hypothermia plus Xenon (TOBY- Xe) ha empleado este gas en combinación con hipotermia. Pese a que los resultados no han mostrado diferencias significativas entre grupos40, y con el objetivo de profundizar en algunas de las variables que hayan podido influir en el tratamiento con este gas noble como la dosis o la duración del tratamiento, actualmente se desarrolla un ensayo clínico en fase ii denominado CoolXenon3 Study (NCT02071394).
El argón, por su parte, no presenta estudios clínicos hasta la fecha, pero ha demostrado mejorar los resultados obtenidos por la hipotermia respecto al biomarcador N-acetil-aspartato/lactato, el cual aparece relacionado con un incremento en los valores de muerte cerebral y con el desarrollo de secuelas neurológicas en el recién nacido41. Estos prometedores resultados, junto con su mayor biodisponibilidad y su menor coste en comparación con el xenón, convierten al argón en una molécula con elevado potencial traslacional para tratar la EHI.
ConclusionesObtener un tratamiento eficaz contra la EHI es uno de los grandes retos para la medicina moderna. Por ello, a lo largo de los años, se han invertido ingentes esfuerzos en estudiar los mecanismos de daño neuronal desarrollados tras la asfixia perinatal y, de esta manera, poder desarrollar terapias efectivas que puedan bloquearlos. Actualmente, pediatras y neurocientíficos tratan de desarrollar nuevos compuestos que puedan ser utilizados de forma sinérgica con la hipotermia, con el objetivo de reducir al máximo las secuelas neurológicas derivadas de la EHI. Por otro lado, recientes investigaciones comienzan a incluir el sexo como una variable a tener en cuenta a la hora de tratar la EHI, ya que se han observado diferencias sexuales dimórficas tanto en los mecanismos de daño (animales de experimentación hembras han mostrado mayores déficits de memoria, mientras que los machos son más susceptibles al estrés oxidativo), como en las vías de actuación de los diferentes tratamientos ensayados. Pese a los prometedores avances conseguidos con el empleo de la melatonina o de compuestos como la EPO, todavía se requiere del desarrollo de estudios preclínicos para profundizar en el conocimiento de las vías de actuación de estas moléculas, así como el desarrollo de ensayos clínicos con mayor número de sujetos en los que determinar las dosis y vías óptimas de administración de estas y otras terapias.
FinanciaciónAyuda otorgada por la UPV/EHU dentro del programa de ayudas a grupos de investigación de la universidad (GIU 17/018).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.