El trasplante hepático (TH) es el único tratamiento efectivo existente para las enfermedades hepáticas en fase terminal. La desproporción entre demanda y oferta de órganos constituye su principal limitación, planteando la necesidad de buscar alternativas de tratamiento.
El trasplante de hepatocitos humanos o trasplante celular hepático (TCH) constituye, en el momento actual, la mejor opción terapéutica puente al restablecimiento de la función hepática o al trasplante hepático. Consiste en trasplantar hepatocitos humanos totalmente diferenciados a un órgano receptor, en cantidad suficiente para que estos sobrevivan y restauren la función hepática normal, basándose en la capacidad de regeneración hepática.
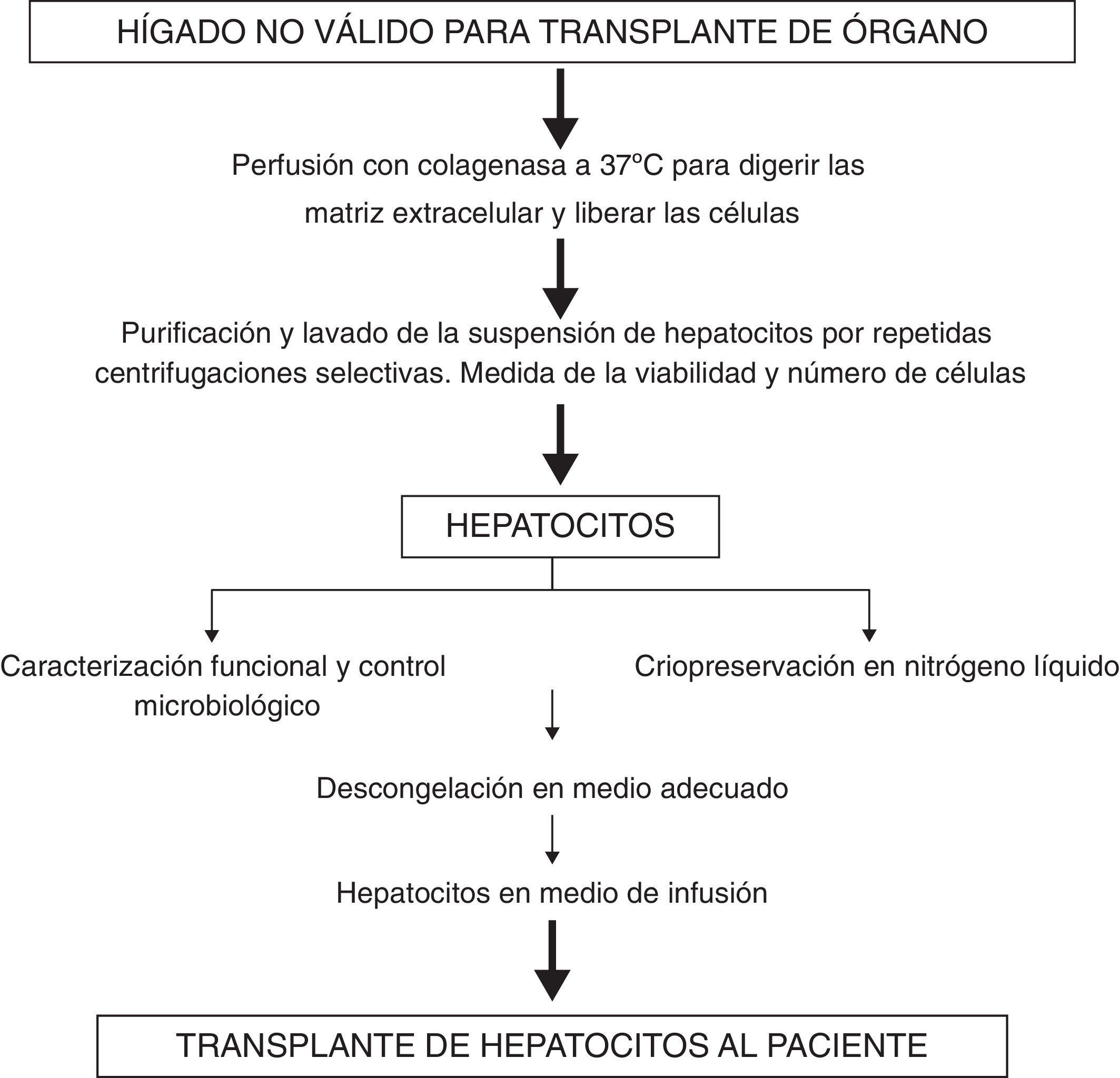
El TCH consta básicamente de 4 pasos: el aislamiento de los hepatocitos a partir de injertos hepáticos descartados para TH, la preparación de las suspensiones celulares, la criopreservación de los hepatocitos aislados y, finalmente, su implante en el receptor.
Esta terapia se ha llevado a cabo en pacientes con insuficiencia hepática aguda de distintas etiologías con intención de sustituir o servir de puente al TH y en el tratamiento de pacientes pediátricos con errores congénitos del metabolismo con objetivo de reemplazar el déficit enzimático causante de la enfermedad.
En el Hospital La Fe de Valencia hemos puesto en marcha una Unidad de Terapia Celular Hepática y llevado a cabo el primer TCH en España, abriendo una nueva línea de trabajo dentro del Programa de Trasplante Hepático.
Liver transplantation has been remarkably effective in the treatment of patients with end-stage liver disease. However, disparity between solid-organ supply and increased demand is the main limitation, resulting in longer waiting times and an increase in the mortality of transplant recipients. This situation creates the need to seek alternatives to orthotopic liver transplantation. Hepatocyte transplantation or liver cell transplantation has been proposed as the best method to support patients, a bridge to restore liver function or liver transplant.
The procedure consists in transplanting individual cells in a recipient organ in enough quantity to survive and restore the function. The capacity of hepatic regeneration constitutes the biological basis of hepatocyte transplantation. Liver cell transplantation is carried out by means of the isolation of hepatocytes from donor liver rejected for orthotopic transplantation, to prepare a cell suspension for infusion, cryopreservation and, finally, hepatocytes are implanted into the recipient.
This may be an optional therapeutic procedure in some patients with inborn errors of metabolism, fulminant hepatic failure, and acute and chronic liver failure, as a bridge to orthotopic liver transplantation.
The first hepatocyte transplantation in Spain was performed in the Cell Therapy Unit of the Hospital La Fe of Valencia, creating a new research line in the transplant program.
La terapia celular hepática o trasplante de hepatocitos (TCH) se considera hoy en día una estrategia terapéutica de vanguardia complementaria al trasplante de órgano sólido. Pese a que en el momento actual, el TCH no constituye una opción terapéutica definitiva, es aplicable a pacientes con insuficiencia hepática aguda, con intención de sustituir o servir de puente al trasplante hepático (TH) y a pacientes pediátricos con errores congénitos del metabolismo, en los cuales la enzima deficitaria se exprese en el hepatocito.
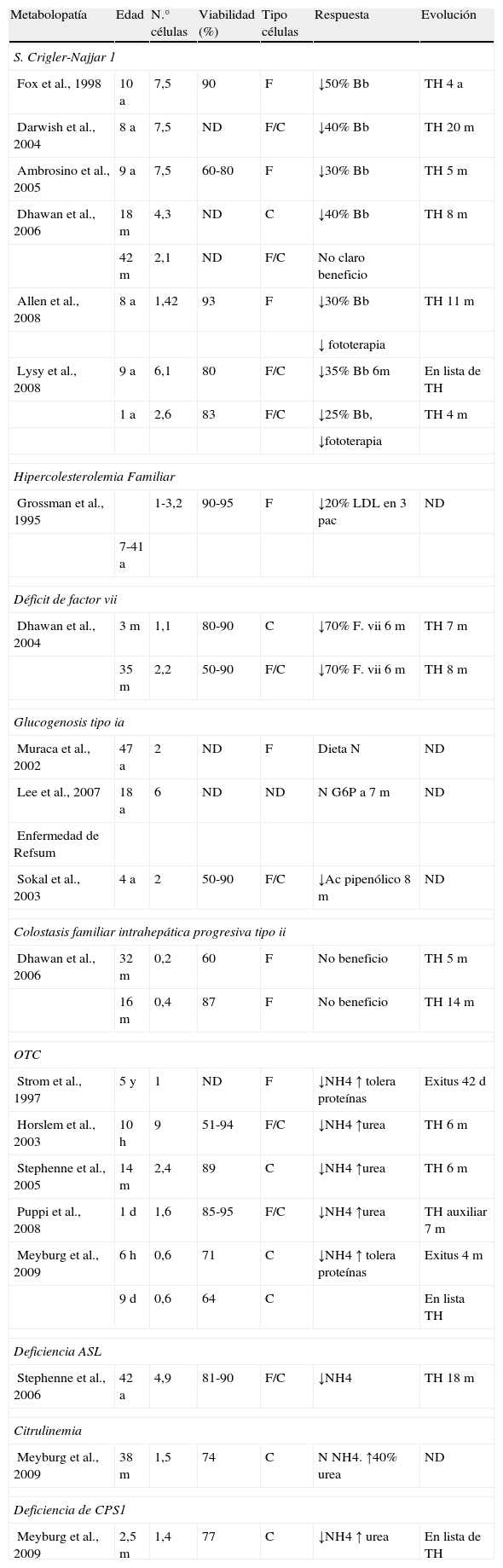
Determinados niños con enfermedades metabólicas congénitas, resultado de un déficit enzimático hepático, aun siendo candidatos potenciales para la realización de un TH, pueden ver limitado su acceso a esta opción terapéutica1. En los últimos años, el TCH se propone como una alternativa terapéutica prometedora para este tipo de afecciones. Tras el implante de los hepatocitos, es esperable que se produzca un aumento de la actividad enzimática deficitaria, que se traduce en una mejoría de la condición clínica del paciente, de la gravedad de la enfermedad y, por ende, de su calidad de vida. El TCH se ha llevado a cabo con resultados clínicos satisfactorios en el tratamiento de pacientes pediátricos afectados de diferentes metabolopatías, tales como el síndrome de Crigler-Najjar I, deficiencias del factor vii, defectos de ciclo de la urea, glucogenosis tipo ia y iib, hipercolesterolemia familiar y la enfermedad de Refsum, entre otros, cuando el TH no constituye la primera opción terapéutica2–19 (tabla 1).
Experiencia en trasplante de hepatocitos
| Metabolopatía | Edad | N.° células | Viabilidad (%) | Tipo células | Respuesta | Evolución |
| S. Crigler-Najjar 1 | ||||||
| Fox et al., 1998 | 10 a | 7,5 | 90 | F | ↓50% Bb | TH 4 a |
| Darwish et al., 2004 | 8 a | 7,5 | ND | F/C | ↓40% Bb | TH 20 m |
| Ambrosino et al., 2005 | 9 a | 7,5 | 60-80 | F | ↓30% Bb | TH 5 m |
| Dhawan et al., 2006 | 18 m | 4,3 | ND | C | ↓40% Bb | TH 8 m |
| 42 m | 2,1 | ND | F/C | No claro beneficio | ||
| Allen et al., 2008 | 8 a | 1,42 | 93 | F | ↓30% Bb | TH 11 m |
| ↓ fototerapia | ||||||
| Lysy et al., 2008 | 9 a | 6,1 | 80 | F/C | ↓35% Bb 6m | En lista de TH |
| 1 a | 2,6 | 83 | F/C | ↓25% Bb, | TH 4 m | |
| ↓fototerapia | ||||||
| Hipercolesterolemia Familiar | ||||||
| Grossman et al., 1995 | 1-3,2 | 90-95 | F | ↓20% LDL en 3 pac | ND | |
| 7-41 a | ||||||
| Déficit de factor vii | ||||||
| Dhawan et al., 2004 | 3 m | 1,1 | 80-90 | C | ↓70% F. vii 6 m | TH 7 m |
| 35 m | 2,2 | 50-90 | F/C | ↓70% F. vii 6 m | TH 8 m | |
| Glucogenosis tipo ia | ||||||
| Muraca et al., 2002 | 47 a | 2 | ND | F | Dieta N | ND |
| Lee et al., 2007 | 18 a | 6 | ND | ND | N G6P a 7 m | ND |
| Enfermedad de Refsum | ||||||
| Sokal et al., 2003 | 4 a | 2 | 50-90 | F/C | ↓Ac pipenólico 8 m | ND |
| Colostasis familiar intrahepática progresiva tipo ii | ||||||
| Dhawan et al., 2006 | 32 m | 0,2 | 60 | F | No beneficio | TH 5 m |
| 16 m | 0,4 | 87 | F | No beneficio | TH 14 m | |
| OTC | ||||||
| Strom et al., 1997 | 5 y | 1 | ND | F | ↓NH4 ↑ tolera proteínas | Exitus 42 d |
| Horslem et al., 2003 | 10 h | 9 | 51-94 | F/C | ↓NH4 ↑urea | TH 6 m |
| Stephenne et al., 2005 | 14 m | 2,4 | 89 | C | ↓NH4 ↑urea | TH 6 m |
| Puppi et al., 2008 | 1 d | 1,6 | 85-95 | F/C | ↓NH4 ↑urea | TH auxiliar 7 m |
| Meyburg et al., 2009 | 6 h | 0,6 | 71 | C | ↓NH4 ↑ tolera proteínas | Exitus 4 m |
| 9 d | 0,6 | 64 | C | En lista TH | ||
| Deficiencia ASL | ||||||
| Stephenne et al., 2006 | 42 a | 4,9 | 81-90 | F/C | ↓NH4 | TH 18 m |
| Citrulinemia | ||||||
| Meyburg et al., 2009 | 38 m | 1,5 | 74 | C | N NH4. ↑40% urea | ND |
| Deficiencia de CPS1 | ||||||
| Meyburg et al., 2009 | 2,5 m | 1,4 | 77 | C | ↓NH4 ↑ urea | En lista de TH |
a: años; Bb: bilirrubina; C: congeladas; F: frescas; G6P: glucosa 6 fosfatasa; h: horas; m: meses; N: normal; ND: no disponible; TH: trasplante hepático.
La elaboración de este manuscrito tiene por objeto realizar una puesta al día y difundir en el ámbito científico el estado actual del TCH en el tratamiento de los pacientes pediátricos con errores congénitos del metabolismo, aportando nuestra experiencia al respecto y poniendo a disposición de los distintos grupos de trabajo la posibilidad de acceso a esta nueva modalidad terapéutica actualmente utilizada con éxito en nuestro hospital.
Trasplante de hepatocitosEl TCH se fundamenta en trasplantar células totalmente diferenciadas, los hepatocitos, en un número suficiente para que sean capaces de sobrevivir y restaurar las funciones hepáticas. La terapia celular hepática tiene como objetivo la recuperación y el mantenimiento de las funciones hepáticas hasta disponer de un órgano compatible, sustituyendo de forma temporal la función de los hepatocitos. En los niños con errores congénitos del metabolismo, el objetivo es reemplazar el déficit enzimático causante de la enfermedad, bien como puente al TH o bien hasta conseguir una recuperación de la función enzimática, suficiente para mejorar la situación clínica del paciente. En el fallo hepático agudo (viral, por tóxicos, etc.), el TCH trata de ser una alternativa terapéutica parcial o total al trasplante convencional basado en la extraordinaria capacidad replicativa del hepatocito de regeneración permitiría ganar tiempo hasta la eventual recuperación de la población celular perdida2–19.
Con el objetivo de desarrollar esta iniciativa terapéutica de vanguardia, se creó en nuestro hospital, en el año 2007, la Unidad de Terapia Celular Hepática (UTCH), cuyo objetivo fundamental es trasladar la investigación básica a la clínica20. Esta unidad, constituida por un equipo multidisciplinar, está integrada por el Servicio de Hepatología Infantil, la Unidad de Cirugía y Trasplante Hepático Adulto e Infantil y la Unidad de Hepatología Experimental; cuenta con la acreditación de sus instalaciones de acuerdo con la normativa europea EN-ISO 14644 sobre salas limpias y locales anexos, obteniendo el informe de conformidad con dicha norma, procediendo a la validación de la Sala limpia como ISO clase 6 y las zonas anexas ISO clase 7. La UTCH dispone de la infraestructura necesaria para realizar el aislamiento, la caracterización y la criopreservación de los hepatocitos, así como la aplicación clínica de los mismos.
Hemos establecido procedimientos optimizados, a fin de obtener hepatocitos humanos de la máxima calidad, estableciendo criterios de calidad y control que aseguran la conservación y el almacenamiento de las células, así como un adecuado control de calidad de las mismas tras la descongelación, de forma previa a la realización del TCH21–27. La preparación de estas células en gran escala se realiza bajo condiciones de buena práctica de producción (Good Manufacturing Practices [GMP]), de forma que los hepatocitos obtenidos son aptos y seguros para su administración a humanos23,25,28. El adecuado almacenamiento de las células en bolsas permite un fácil uso posterior y facilita la aplicación clínica.
La actividad clínica de nuestra Unidad está centrada en niños con errores congénitos del metabolismo y pacientes con insuficiencia hepática aguda, con o sin hepatopatía de base. El Programa de Trasplante Celular Hepático en el Hospital La Fe de Valencia se inició en mayo del año 2008. Hasta el momento actual, se han llevado acabo 9 TCH: 5 adultos con clínica de insuficiencia hepática aguda de distinta etiología y 4 pacientes pediátricos con errores congénitos del metabolismo.
Indicaciones del trasplante celular hepáticoLa indicación más aceptada en el momento actual para la realización del TCH la constituyen los errores congénitos del metabolismo2–19. La tabla 2 muestra una lista de los desórdenes genéticos de origen hepático que cursan con disfunción hepática.
Indicaciones del trasplante celular hepático: enfermedades potencialmente tratables
| 1. Fallo hepático agudo/fulminante |
| 2. Enfermedades metabólicas |
| Crigler-Najjar |
| Trastornos del ciclo de la urea |
| Dislipidemias |
| Déficit hereditario de factor vii |
| Enfermedad por almacenamiento de glucógeno tipo 1° |
| Hiperoxaluria primaria |
| Aciduria orgánica |
| Aminoaciduria |
| Déficit de alfa-1-antitripsina |
| Hiperamoniemia |
| 3. Otras enfermedades genéticas |
| Enfermedad de Wilson |
| Tirosinemia tipo 1 |
| Protoporfiria eritropoyética |
| Lipoidosis (Niemann Pick…) |
| Adrenoleucodistrofia ligada al x |
| Amiloidosis familiar |
| Fibrosis quística |
| Enfermedad de Refsum |
| Galactosemia |
| Enfermedades lisosomales |
| Oxalosis |
| 4. Alteraciones de la coagulación: hemofilia A y B; déficit de proteína C y S; déficit del factor vii |
| 5. Alteraciones inmunológicas: angioedema hereditario |
En nuestra UTCH, la indicación para TCH en los niños con errores congénitos del metabolismo se realiza basándose en el nivel de gravedad de la metabolopatía, el pronóstico de la enfermedad y los beneficios esperados. En todos los casos, las medidas terapéuticas tomadas con anterioridad habían fracasado, no siendo capaces de estabilizar la enfermedad, presentando los pacientes un deterioro progresivo de los parámetros analíticos y clínicos.
Otras indicaciones para el TCH comprenden el fallo hepático fulminante, la cirrosis hepática en pacientes que presentan episodios de descompensación aguda y la insuficiencia hepática severa tras resección hepática29,30,19,31–33.
Nuestro objetivo se centra en la identificación de pacientes susceptibles de TCH en la población controlada, tanto en el Hospital Infantil La Fe como en el conjunto de la Comunidad Valenciana. Tras realizar esta evaluación, hemos clasificado a los pacientes en distintos niveles (tabla 3). Con el fin de intentar ofrecer esta terapia de vanguardia a todos los pacientes susceptibles de beneficiarse de este tratamiento, hemos elaborado un protocolo para difundir y aplicar este tratamiento.
Pacientes susceptibles de trasplante celular hepático
| Nivel 1a | Pacientes con enfermedad hepática o metabólica, sin tratamiento alternativo en la actualidad y con mala situación clínica y/o mala calidad de vida |
| Nivel 1b | Pacientes con fallo hepático fulminante, como puente a la recuperación espontánea o como puente al TH |
| Nivel 2a | Pacientes con enfermedad hepática o metabólica, sin tratamiento alternativo en la actualidad, con situación clínica estable (aceptable control metabólico), con pronóstico a medio-largo plazo desfavorable y/o mala calidad de vida |
| Nivel 2b | Pacientes con alteración hepática o metabólica, que pese a tratamiento específico (dietético, fototerápico, farmacológico) presentan situación clínico- metabólica inestable y mala calidad de vida |
| Nivel 3 | Pacientes con alteración hepática o metabólica, en los que, pese a una situación clínica estable con tratamiento específico, el trasplante de hepatocitos puede ser una alternativa terapéutica de mayor eficacia. La aceptación de estos pacientes como candidatos será postergada según resultados en pacientes previos |
La obtención de los hepatocitos humanos es un proceso complejo por la escasez de fuentes aptas de tejido hepático para el aislamiento celular, la infraestructura necesaria para llevar a cabo dicho aislamiento y la conservación de los hepatocitos.
La técnica del TCH se basa en la obtención de hepatocitos viables y funcionalmente activos, que se criopreservan, se caracterizan funcionalmente y se almacenan en nitrógeno líquido para ser finalmente se implantados en el receptor20,22. La disponibilidad de hepatocitos en número y viabilidad suficiente, con una adecuada calidad metabólica funcional, constituye uno aspectos fundamentales que condiciona el éxito de este tratamiento20,25,27.
Fuentes de obtención de hepatocitosLa obtención de hepatocitos para TCH se realiza en colaboración con la Organización Nacional de Trasplantes (ONT)34 a partir de órganos descartados para TH. Los criterios que se exigen para aceptar estos injertos para el aislamiento celular son los mismos que para la donación en el TH. Desde el inicio del programa del trasplante celular en 2008, nuestra Unidad ha llevado a cabo el aislamiento de hepatocitos a partir de donantes descartados para TH por distintos motivos, tales como arteriosclerosis, serología vírica dudosa no confirmada, donantes a corazón parado, split, fibrosis hepática y anoxia cerebral en recién nacido, lo que permite el aprovechamiento de injertos no aptos para el TH convencional29,30,35, pero que constituyen una buena fuente de obtención de células.
Aislamiento de hepatocitosNuestro laboratorio posee un protocolo estandarizado de aislamiento de hepatocitos a partir de biopsias hepáticas quirúrgicas. Este protocolo ha sido optimizado y adaptado para realizar aislamientos a gran escala a partir de órganos descartados para trasplante22. Todos los injertos son perfundidos con Celsior®, dado que en nuestra experiencia su uso produce una mayor preservación del tejido y de la viabilidad celular, en comparación con otros líquidos de preservación28.
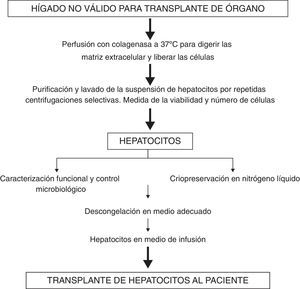
El aislamiento de hepatocitos se realiza mediante la perfusión del hígado con colagenasa, enzima proteolítica que permite la digestión del tejido hepático y el aislamiento de sus componentes celulares (fig. 1), con un rendimiento entre 6×106 y 2×107 hepatocitos vivos/g tejido hepático y una viabilidad media del 89%20,22,36.
Preparación de suspensiones celulares para implanteTras el aislamiento, las células se resuspenden, bien en el medio de infusión adecuado para ser transplantadas en fresco, o en el medio de congelación si son crioconservadas25,36. Para criopreservar los hepatocitos, utilizamos como medio de congelación solución de Wisconsin (UWS) con 10% de DMSO como agente crioprotector24,25.
En nuestra Unidad, siempre administramos a los pacientes células criopreservadas, ya que ello nos permite efectuar controles microbiológicos exhaustivos, evitando el riesgo de transmisión de infecciones, la caracterización funcional (capacidad ureogénica y para metabolizar fármacos: isoenzimas del citocromo P450 y enzimas de conjugación) previamente a ser implantados, lo que permite seleccionar la preparación celular mas adecuada funcionalmente para cada receptor, y la realización del transplante de forma programada25,36.
Implante de hepatocitos/infusión de hepatocitosAl igual que en el TH, la realización del TCH debe respetar la compatibilidad ABO, siendo necesario un régimen inmunosupresor (corticoides con inhibidores de la calcineurina) para evitar el rechazo.
El TCH se lleva a cabo en la Unidad de Trasplante Pediátrico, con monitorización exhaustiva de los pacientes. Requiere la infusión manual de hepatocitos humanos en suspensión 5-10ml/kg por hora1. Se consideran aspectos clave a la hora de realizar el TCH: la vía de infusión, el número de células administradas por infusión, el número de infusiones y la viabilidad de dichas células. Trasplantamos entre el 5 y el 10% de la masa celular hepática teórica estimada del receptor, mediante infusión vía portal (previa colocación de un port-a-cath en la vena porta) de células criopreservadas, precisando para ello realizar un número variable de infusiones2–19. Es necesario tener en cuenta el número máximo de células por infusión con objeto de evitar efectos secundarios, especialmente la aparición de un aumento de la presión portal.
Se recomienda para el uso clínico hepatocitos con viabilidad superior al 60%, determinada mediante el test de exclusión del azul tripán, que mide la integridad de la membrana celular37. Con el fin de evaluar la calidad del hepatocito, realizamos en nuestra Unidad una determinación de la funcionalidad de las células, mediante estudio metabonómico de enzimas de biotransformación de fases i y ii, y capacidad de ureogénesis23,27. Antes, durante y después del TCH, realizamos un eco-Doppler para el control de la presión portal y la prevención de las posibles complicaciones.
La pauta de inmunosupresión en nuestros pacientes se basa en la administración de un bolo de corticoides de forma previa a la infusión celular seguida de doble terapia con corticoides e inhibidores de la calcineurina (tacrolimús), con niveles entre 5 y 10 ng/ml.
Experiencia y resultados del trasplante celular hepático en pacientes con errores congénitos del metabolismoLos mayores logros del TCH se han obtenido en niños con errores congénitos del metabolismo. En 1998, se llevó a cabo el primer TCH en una niña de 10 años con enfermedad de Crigler-Najjar tipo i; 9 meses después de la infusión de hepatocitos, la actividad enzimática permanecía estable, recibiendo un injerto hepático posteriormente3.
Las alteraciones en el ciclo de la urea (OTCA) constituyen una de las indicaciones más frecuentes del TCH. Cinco de los 7 pacientes recogidos en la literatura con esta metabolopatía, que han recibido un TCH, han sido sometidos posteriormente a un TH. El grupo de Pittsburgh, tras una revisión, comunica un total de 20 niños sometidos a TCH por errores congénitos del metabolismo (tabla 1); en 11 de ellos la indicación del trasplante celular era como puente al trasplante definitivo, 10 de los cuales recibieron un TH y uno un trasplante auxiliar8-10,12,16,18. En el King's College, el TCH en 2 pacientes con déficit del factor vii tuvo un resultado satisfactorio, que permitió disminuir en un 80% los requerimientos de factor viia exógeno. Ambos pacientes recibieron un injerto a los 7 y 8 meses respectivamente5,6. Dos niños con glucogenosis tipo i evolucionaron satisfactoriamente tras el TH, apreciándose una corrección enzimática parcial, una mejoría significativa de las hipoglucemias y una disminución de los niveles de triglicéridos en un 30-40%4.
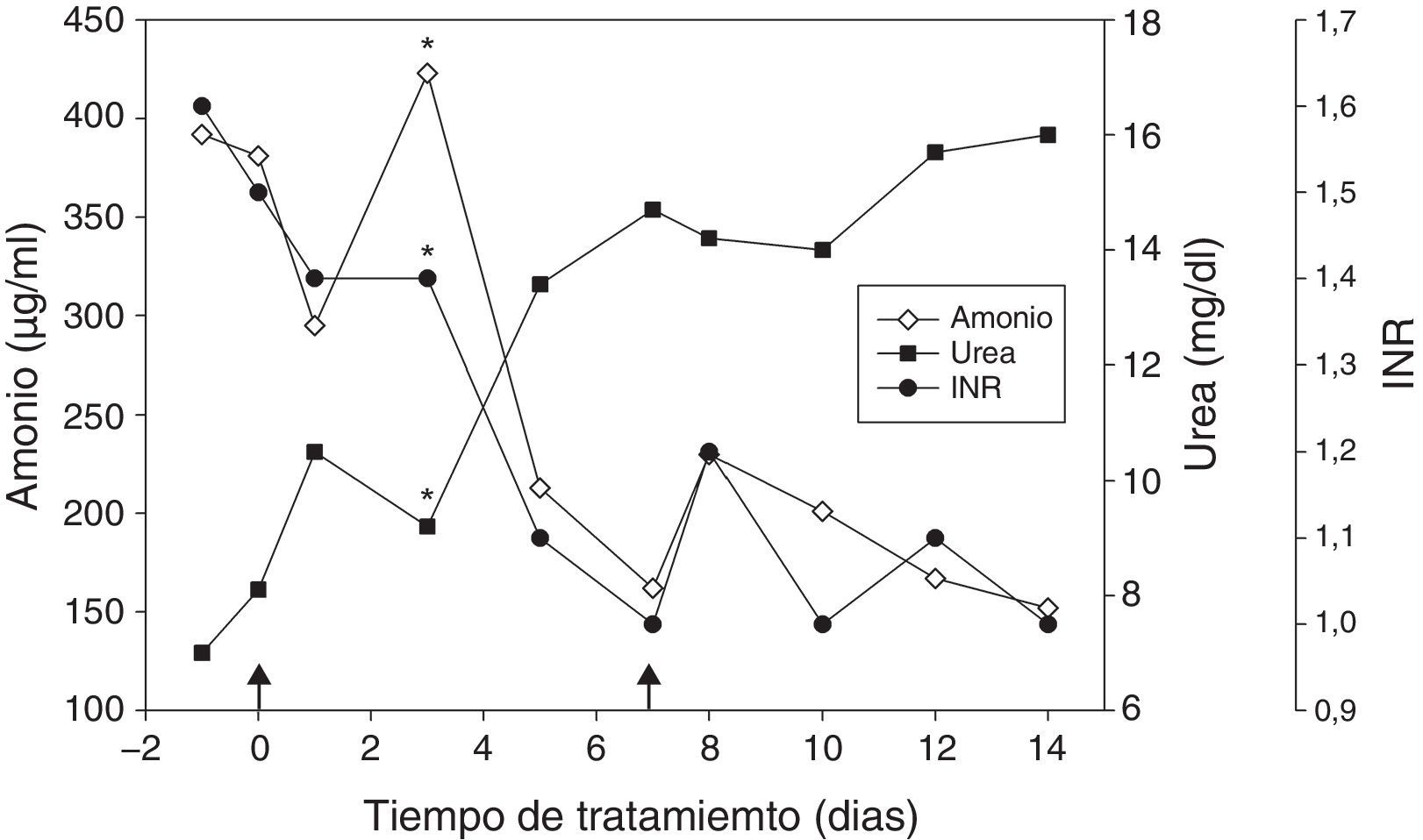
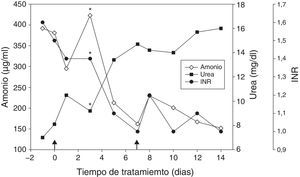
El primer TCH en España se llevó a cabo en el Hospital La Fe de Valencia, en el año 2008. Se trataba de una niña de 12 años con un déficit del ciclo de la urea, diagnosticado en el estudio genético, que evidenció que era portadora de la mutación c.533C >T/p.Thr178Met. La paciente presentaba una alteración neurológica secundaria, restricciones dietéticas severas y múltiples episodios de descompensación responsables de los reiterados ingresos hospitalarios de la paciente. El objetivo del TCH en esta paciente era mejorar su calidad de vida. Se realizaron 2 infusiones portales de células criopreservadas, a través del port-a-cath, con un intervalo de una semana, administrándose un total de 8,7×108 células. Inicialmente, constatamos una disminución de los niveles de amonio y un aumento del índice de Quick, logrando restaurar la ingesta de proteínas a 1g/kg/día (fig. 2). Sin embargo, la paciente presentó un cuadro séptico que motivó una descompensación clínica con deterioro de la función hepática, falleciendo por una aspergilosis masiva al mes del TCH en la Unidad de Cuidados Intensivos13.
Nuestra segunda paciente es una niña de 9 meses, con enfermedad de Crigler-Najjar tipo i, que precisaba fototerapia domiciliaria continua. La confirmación de la enfermedad se realizó mediante la secuenciación del gen UGT1A1, que mostró cambio homocigótico en el nucleótido c.120 delG (p.Trp40CysfsX2). Hasta el momento actual se han realizado 9 infusiones celulares, a través de la vena porta, durante 5 meses, administrando un total de 26,63×108 células (viabilidad 47-75% tras la descongelación). A nivel analítico, hemos objetivado una disminución de la bilirrubina sérica de 28 a 15 mg/dl y han disminuido los requerimientos de la fototerapia, permitiendo un uso intermitente; ello ha supuesto una importante mejoría en la calidad de vida de la niña y, por ende, de la familia, permitiendo la escolarización en un centro especializado13. El TCH ha proporcionado estabilidad metabólica a la paciente durante aproximadamente 2 años observándose posteriormente un incremento lento pero progresivo de los niveles de bilirrubina total y no conjugada.
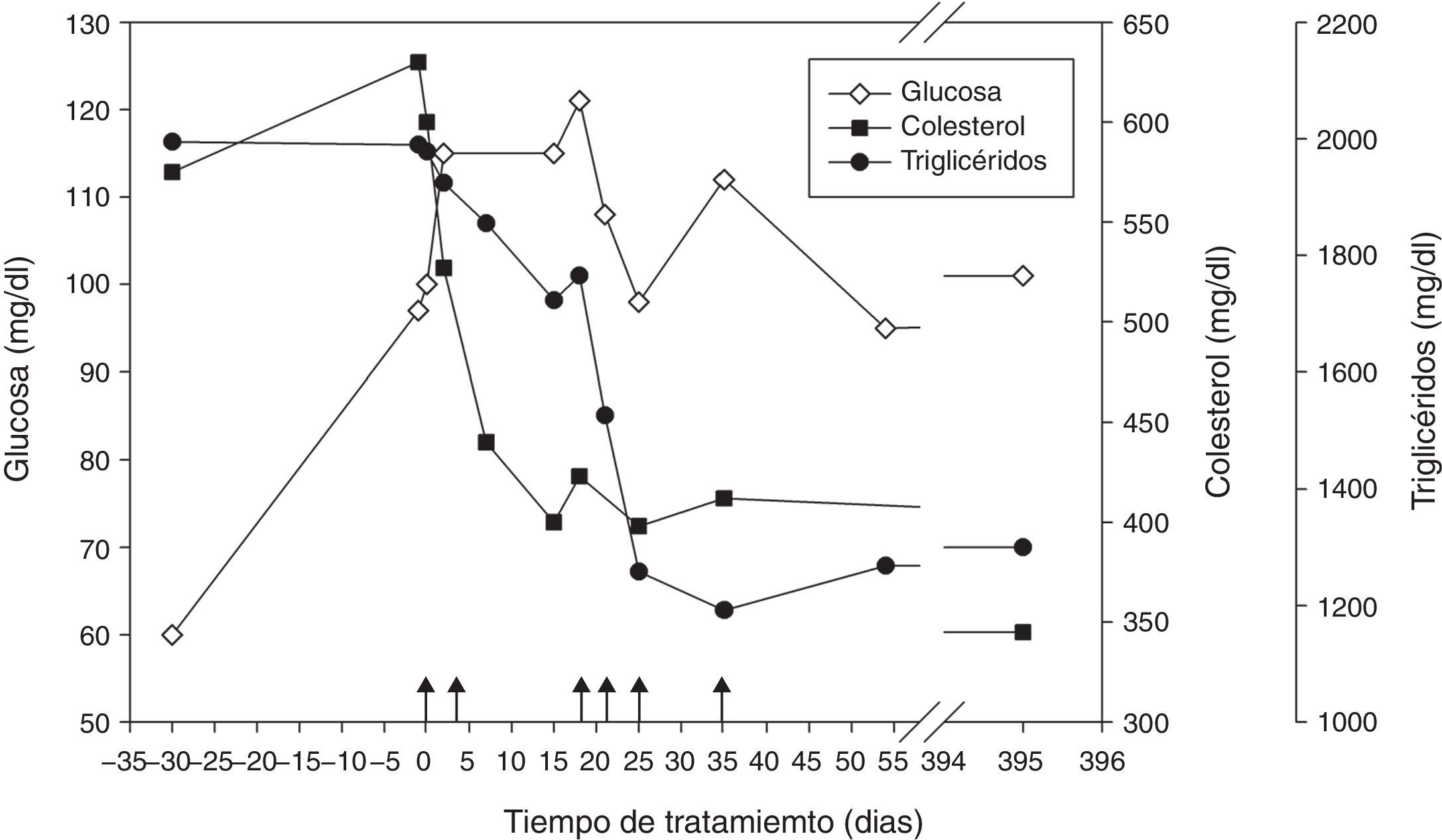
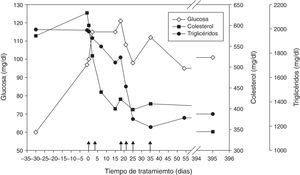
Se realizó el TCH en una tercera paciente, una niña de 6 años con glucogenosis tipo i; presentaba una mutación homocigótica p.Arg83Cys en el exón 2 del gen G6PC (i.e., glucogenosis tipo ia). La paciente presentaba episodios de hipoglucemia muy frecuentes que obligaban al ingreso hospitalario para su control; a nivel analítico se detectaban valores elevados de triglicéridos, colesterol y acido úrico. Tras el TCH, se ha conseguido estabilizar de los niveles de glucemia, desapareciendo las crisis de hipoglucemia, mejorando todos los parámetros metabólicos especialmente los niveles de ácido láctico; ello ha permitido la escolarización de la paciente normalizando su régimen de vida acorde con su edad. A nivel analítico ha habido una mejora de los parámetros bioquímicos y no ha requerido nuevas hospitalizaciones desde la última infusión hace 4 años y permanece estable desde entonces13 (fig. 3).
Ambas pacientes continúan su seguimiento en nuestras consultas, encontrándose estables desde el punto de vista analítico y clínico.
Nuestro cuarto paciente, un niño de 45 días, había sido remitido a nuestro hospital con un diagnóstico de sospecha de tirosinemia tipo ia. Al ingreso presentaba una alteración de las pruebas de función hepática, especialmente de los factores de coagulación; sin embargo, la succinil acetona en orina era negativa; en espera del estudio genético, se realizaron 2 infusiones de hepatocitos que permitieron estabilizar al paciente (mejoría de la hemostasia). Ante la no respuesta a tratamiento con NTBC, y el estudio genético confirmando que era portador de las mutaciones IVS6-1 G>T y IVS12+5G>A en el gen de la enzima fumarilacetoacetato hidrolasa, se llevó a cabo un trasplante de órgano completo, con evolución favorable posterior13, permaneciendo estable desde entonces. Este paciente continúa su seguimiento en nuestras consultas.
Consideraciones actuales del trasplante celular hepáticoLa terapia celular surge con el reciente desarrollo de la medicina regenerativa; con ella se abren nuevas formas de actuación terapéutica para determinadas enfermedades, cuya causa reside en el deterioro celular de un órgano o tejido, y en las que no está indicado o no es recomendable la realización de un trasplante del órgano sólido.
El TCH presenta como ventajas el hecho de no ser un proceso quirúrgico mayor, con menor morbilidad, mortalidad y coste, y ser una terapia mucho menos invasiva que el TH convencional, ofreciendo la posibilidad de maximizar recursos, al poder utilizar un mismo donante para varios receptores. La posibilidad de criopreservar los hepatocitos permite su disponibilidad para ser utilizados en el momento en que sean necesarios, haciendo posible efectuar el procedimiento de manera semiprogramada. Permite recuperar y mantener las funciones hepáticas hasta disponer de un injerto adecuado y sustituir temporalmente la función de los hepatocitos, hasta lograr la recuperación suficiente de la función enzimática o como puente al TH. La necesidad de inmunosupresión a largo plazo es menor y se suspende a largo plazo, con la consiguiente disminución de morbilidad asociada a efectos secundarios.
Por otra parte, la consolidación del procedimiento de TCH en todas sus vertientes y el dominio de los aspectos técnicos, fundamentalmente, abren perspectivas terapéuticas de enorme impacto científico sanitario y social. Así, en un futuro, las células hepáticas podrían ser modificadas genéticamente «in vitro» para regular funciones específicas. Presumiblemente, la manipulación génica podría realizarse utilizando células del propio paciente, lo que equivaldría a un trasplante autólogo, que no requeriría tratamiento inmunosupresor posterior.
Sin embargo, la principal limitación del TH reside en la falta de fuentes adecuadas para la obtención de hepatocitos viables y funcionales. Existe, por otra parte, un desconocimiento de los mecanismos que permiten la integración y supervivencia de los hepatocitos implantados, no teniendo un conocimiento exacto de la eficacia clínica del TH. Los resultados del TCH están limitados por la baja eficiencia de la integración de las células trasplantadas en el receptor; sin embargo, en el momento actual, resulta muy difícil realizar una previsión respecto la duración de la efectividad del TCH, dado que los casos que han recibido un TCH son muy heterogéneos en lo que respecta al diagnostico, la situación clínica en el momento del trasplante celular y los protocolos terapéuticos utilizados.
En el momento actual se plantea la necesidad de realizar ensayos clínicos controlados en humanos, que permitan resolver las dudas técnicas y metodológicas y obtener una evidencia científica sobre la eficacia clínica real a medio y largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.