El metotrexato es usado en el tratamiento de la leucemia linfoide aguda; puede causar neurotoxicidad, incluyendo una presentación muy infrecuente con hemiparesia. Se describen los casos de 2 adolescentes quienes durante la aplicación de la fase M del protocolo presentaron hemiparesia, paresia facial y disartria que revirtieron de forma rápida, descartándose compromiso leucémico del sistema nervioso central e ictus. Se revisa brevemente la fisiopatología de la neurotoxicidad del metotrexato, las características de la presentación con paresia focal y los hallazgos en la resonancia magnética nuclear.
Methotrexate used in the treatment of acute lymphocytic leukemia, can cause neurotoxicity, including a rare presentation with hemiparesis. We describe two teenagers, who during the implementation of the M phase of the protocol, suffered hemiparesis, facial paresis and dysarthria which quickly reversed. Leukemia involvement of the central nervous system and stroke, were ruled out. We briefly review the pathophysiology of methotrexate neurotoxicity, the characteristics of the focal paresis presentation and magnetic resonance image findings.
El metotrexato usado en leucemia linfoide aguda (LLA) puede causar neurotoxicidad, pero los clínicos no suelen estar familiarizados con una rara presentación con hemiparesia. Se presentan los casos de 2 adolescentes en tratamiento para LLA con el protocolo BFM-Asociación Colombiana de Hemato-Oncología Pediátrica 2006 (BFM-ACHOP-2006) (modificación del German Berlin-Frankfurt-Munster protocol), quienes recibieron metotrexato y desarrollaron hemiparesia y parálisis facial.
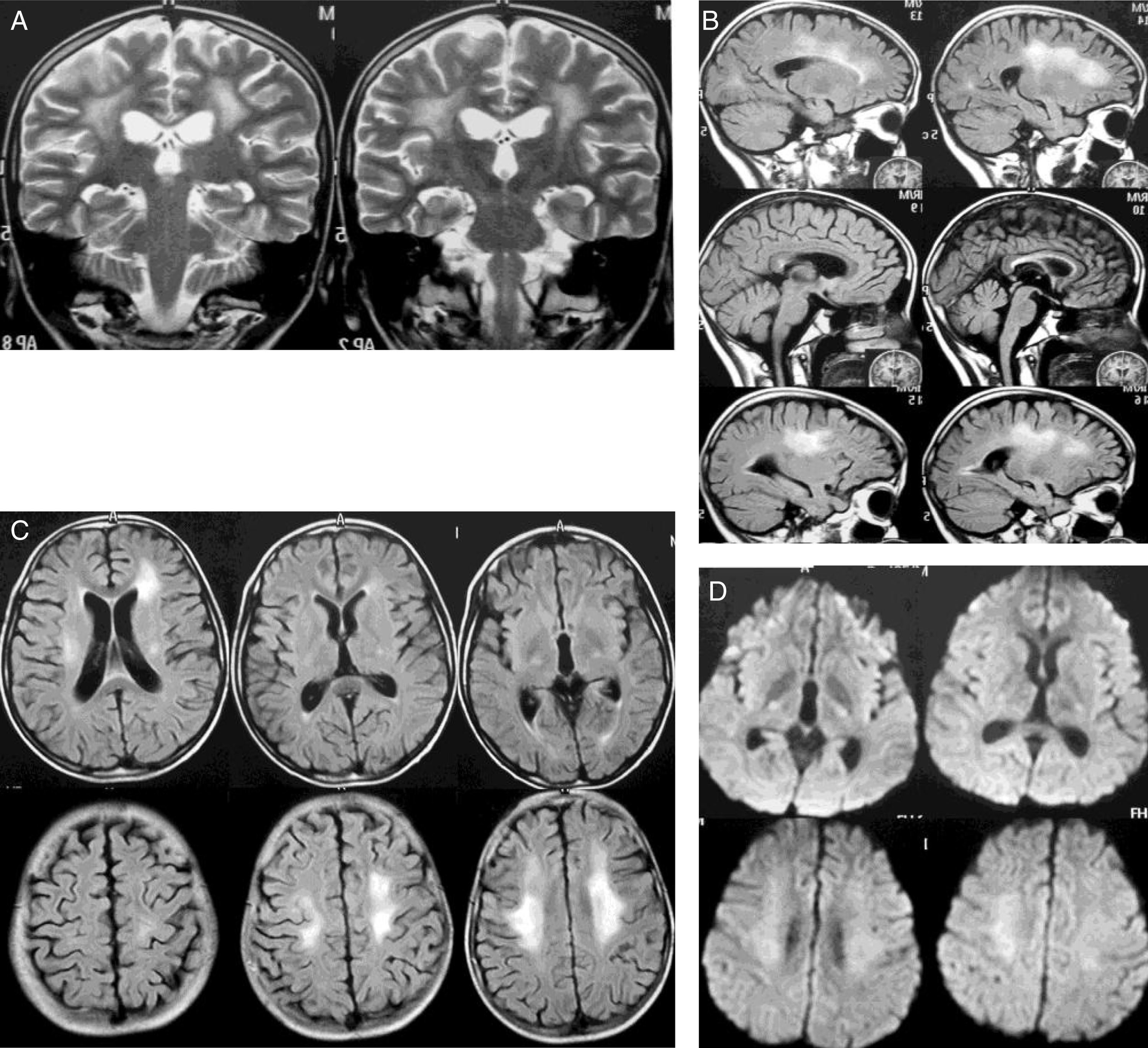
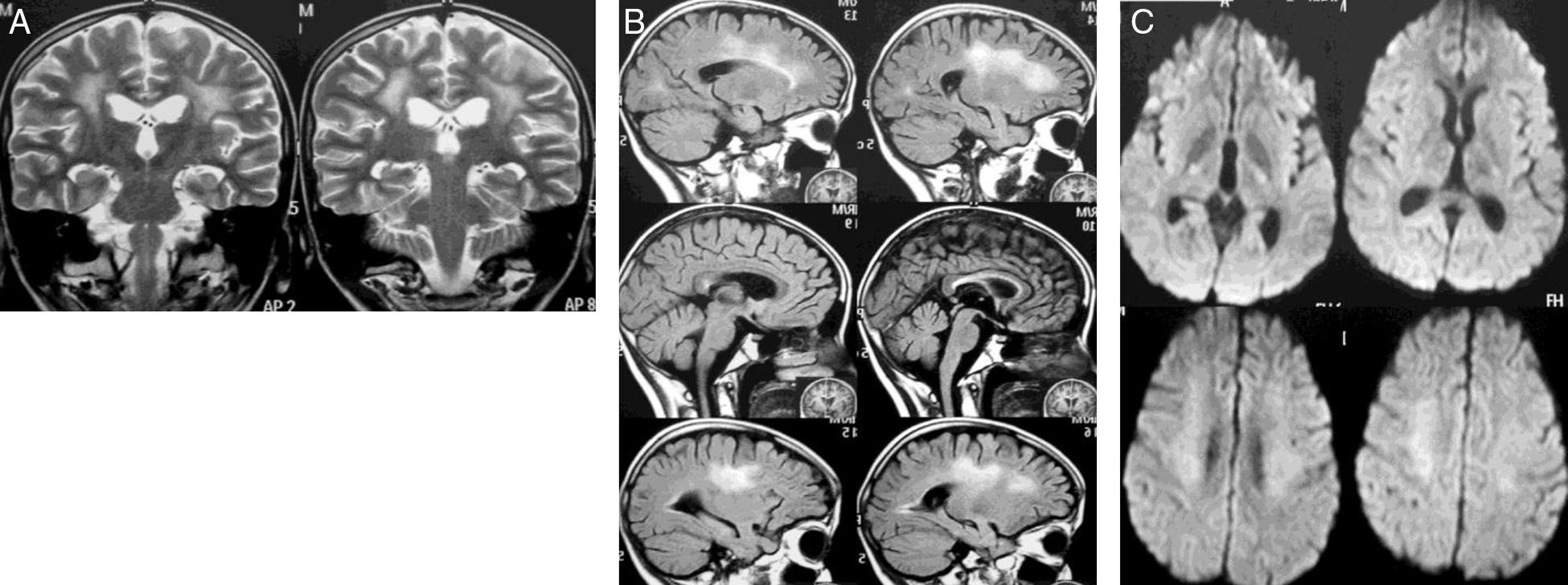
Caso 1Mujer de 12 años diagnosticada de LLA de precursores B, fenotipo común (1 de septiembre de 2010). Sin compromiso del sistema nervioso central (SNC) y riesgo estándar recibió 28 días prednisolona, 4 dosis de vincristina, 2 de daunorrubicina, 8 de L-asparraginasa, 3 de metotrexato y dexametasona intratecal (IT). En la intensificación recibió 2 dosis de ciclofosfamida, 16 de citarabina, 28 días 6-mercaptopurina y 2 dosis de metotrexato IT. El 1 de diciembre de 2010 inició la fase M (fase de dosis altas de metotrexato a 2g/m2), una sexta dosis de quimioterapia IT y ácido folínico. Dos semanas más tarde recibió la segunda dosis de fase M, presentando 12 días después hemiparesia derecha, disartria y paresia facial central derecha, descartándose compromiso leucémico del SNC (citoquímico de líquido cefalorraquídeo [LCR] con 0 células, proteínas y glucosa normal y citología sin presencia de blastos). Fue dada de alta con mantenimiento corto con 6-mercaptopurina y metotrexato oral. El 26 de enero de 2011 recibió la tercera dosis de fase M sin complicaciones. Catorce días después, con resolución de la paresia, inició la cuarta dosis. El 2 de marzo presentó hemiparesia izquierda con predominio en el miembro superior. En la resonancia magnética (RM) cerebral había extenso compromiso de la sustancia blanca paraventricular, principalmente izquierda (fig. 1). La paciente mejoró rápida y completamente. Cuatro meses después la RM mostró reducción importante de las alteraciones en la sustancia blanca (fig. 2). Durante el protocolo iii (fase de reinducción y reintensificación) presentó sepsis y falleció.
La RM inicial presenta compromiso extenso de la sustancia blanca paraventricular incluyendo regiones frontoparietales altas (mayor al lado izquierdo) y de la región insular con extensión al territorio posterior de cápsulas en este lado. Se aprecia tanto en secuencias T1 más gadolinio (A), donde se observan focos de disminución de la intensidad, como en secuencias T2 (coronal T2 [B]) y FLAIR (C) donde es muy notoria la hiperintensidad multifocal, y finalmente la restricción de la difusión en DWI (D). Aunque más extenso y multifocal que en el otro caso, el comportamiento de la señal y la restricción de la difusión muestran similar aspecto.
En el estudio de control, 4 meses después del primero, se obtuvieron imágenes por RM encontrando reducción importante de las alteraciones de señal mejor definidas en secuencias T2 (coronal T2 [A], FLAIR sagital [B]), lo mismo que la restricción de la difusión (DWI) (C), mejoría más notoria del compromiso multifocal izquierdo persistiendo distribución simétrica en la sustancia blanca frontoparietal de las hiperdensidades, que representan cambios de edema y restricción de la difusión.
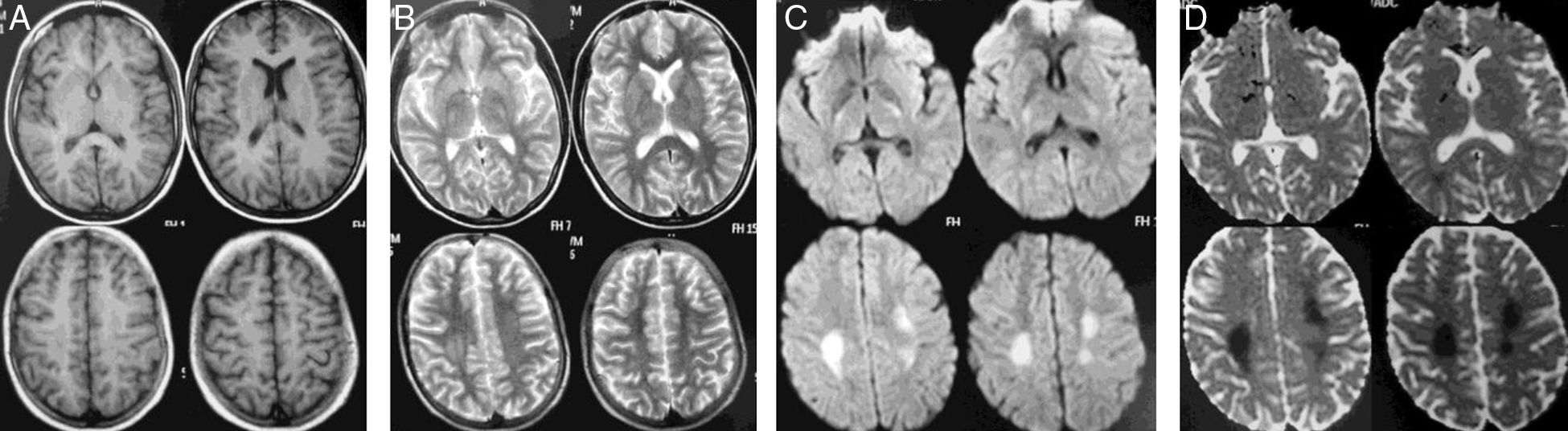
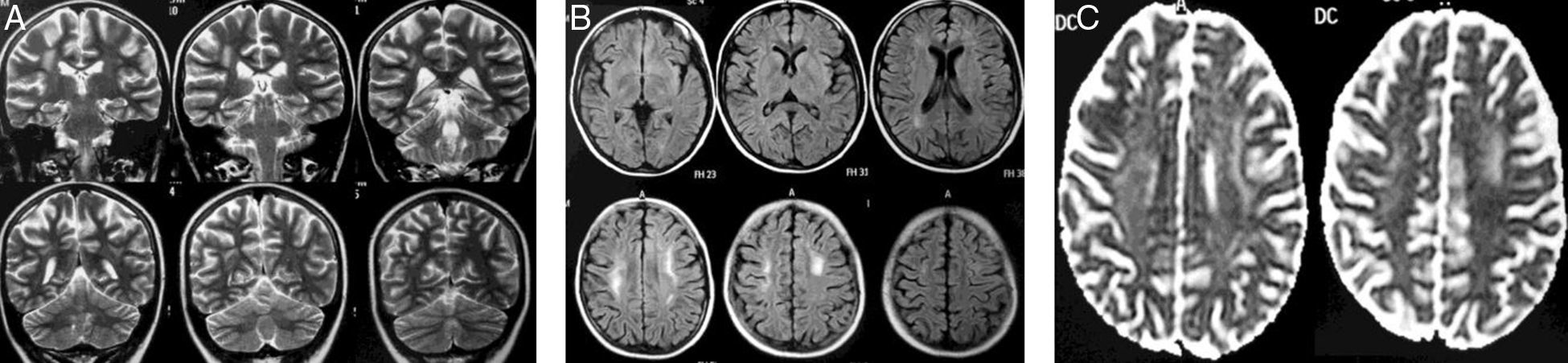
Mujer de 13 años diagnosticada de LLA de precursores B, fenotipo común (8 de noviembre de 2010), sin compromiso del SNC, alto riesgo por mala respuesta en la médula ósea (MO). Recibió en inducción prednisolona por 28 días, 4 dosis de vincristina, 4 de daunorrubicina, 8 de L-asparraginasa y 3 de quimioterapia IT, con remisión completa en la MO. Recibió la segunda parte del protocolo i (fase de intensificación) con 2 dosis de ciclofosfamida, 16 de citarabina, 28 días mercaptopurina y 2 dosis más de quimioterapia IT triple. El 18 de febrero de 2011 inició la fase M. El 15 de abril recibió la última dosis de fase M que se había aplazado por neutropenia afebril y rescate con ácido folínico sin complicaciones. Consulta a la semana por paresia en la mano izquierda y posterior hemiparesia ipsilateral, disartria y paresia facial central izquierda. La RM mostró alteración de las señales en la sustancia blanca bilateralmente (fig. 3). Recibió dexametasona IV a 10mg/m2/d, con recuperación en 24h. La RM a los 5 meses mostró reducción en la extensión de las lesiones (fig. 4) Finalizó el tratamiento en diciembre de 2012, sin secuelas motoras, con buen rendimiento académico, y se encuentra en consultas de seguimiento.
Imágenes de RM que muestran alteración de la señal en la región paraventricular alta de la sustancia blanca, de aspecto más o menos simétrico, con hipointensidad en T1 (A) e hiperintensidad en T2 (B) y que se hace más evidente en las secuencias para difusión (DWI, b1000) (C) y coeficiente aparente de difusión (ADC) (D) como zonas de restricción de la difusión.
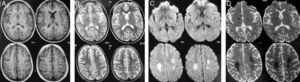
El control por RM 5 meses después del estudio inicial muestra una importante reducción en la extensión e intensidad de lo previamente descrito, definibles en las secuencias de T2 (coronal T2 [A], axial FLAIR [B]) e imágenes para difusión (DWI) (C). Nótese la persistencia de un área hiperintensa a nivel de la sustancia blanca paraventricular bilateralmente en imágenes FLAIR. En T1 y T1 más gadolinio (no incluidas) los cambios fueron imperceptibles.
En estos casos se descartó el compromiso leucémico en el SNC (citoquímico y citología de LCR normales) e ictus. Esta presentación es una forma rara de toxicidad subaguda del metotrexato; la sintomatología inicia 5-14 días después de administrado el metotrexato IV o IT con cefalea, náuseas, vómitos, convulsiones, corea, alteración de la conciencia, visión borrosa, hemiparesia que puede ser alternante, parálisis facial, disfasia con adecuada comprensión del lenguaje, visión borrosa y angustia, con rápida progresión y recuperación, usualmente sin secuelas1–5, como en las 2 pacientes reportadas.
El metotrexato inhibe la dihidrofolato reductasa (DHFR) impidiendo el paso de dihidrofolato a tetrahidrofolato, que depleciona 5,10 metilentetrahidrofolato, metionina, S-adenosil metionina (SAM), etc. La fisiopatología de su neurotoxicidad no es bien conocida, se ha involucrado un aumento de la homocisteína generando lesión endotelial;6,7 metabolitos de la homocisteína, que son aminoácidos que actúan como neurotrasmisores excitatorios8,9 y disminución de SAM afectando reacciones de trasmetilación de neurotrasmisores y de la proteína básica de mielina y reduciendo la producción de lípidos de membranas neuronales causando desmielinización10,11.
En el Hospital St. Jude entre 2000 y 2006 la incidencia de encefalopatía subaguda por metotrexato en leucemia fue del 0,8%12. La susceptibilidad podría deberse a una mayor vulnerabilidad en el sitio de acción del metotrexato13, menor funcionamiento de bombas de eflujo en la barrera hematoencefálica con acumulación del fármaco13 y genotipos que afectan las enzimas de la vía del folato y de la metionina, habiéndose descrito polimorfismos asociados a neurotoxicidad por metotrexato en la 5,10 metilentetrahidrofolato reductasa, metionina reductasa y transcobalamina 27,14.
Se ha encontrado relación con altas dosis de metotrexato y la adolescencia, o con una edad cercana a ella, como en las pacientes que reportamos15. Generalmente los eventos de hemiparesia no ocurren al inicio de la quimioterapia, y el reporte más temprano ocurrió al día 20 de inducción4,5,15. La infiltración leucémica del SNC no tiene asociación1,4,12,15,16.
La RM muestra frecuentes anormalidades en la sustancia blanca en niños en tratamiento para LLA con metotrexato17. Creemos que una razón por la que no ocurren síntomas con más frecuencia podría ser el corticoide empleado en el tratamiento antileucémico. Los corticoides son usados para el tratamiento de la encefalomielitis aguda diseminada (enfermedad que cursa con desmielinización y puede causar hemiparesia)18 y esto podría explicar por qué los síntomas son infrecuentes.
La RM es el examen de elección ante sospecha de neurotoxicidad. Los cambios han sido descritos desde 1h después del inicio de los síntomas, evidenciando hiperintensidad simétrica en las imágenes de difusión ponderada (DWI), con disminución del coeficiente de difusión aparente (ADC) de la sustancia blanca, sin compromiso de la corteza y sustancia gris profunda19. Diferentes trabajos señalan alteraciones similares que preceden a las variaciones en las imágenes de inversión-recuperación con atenuación de fluido (FLAIR)20. Las alteraciones en las DWI son indicativas de edema citotóxico e identifican áreas de la sustancia blanca lesionadas antes de que sean evidentes en otras secuencias.
En la mayoría de los casos de hemiparesia las alteraciones neurológicas y los hallazgos por pruebas de imagen se resuelven sin intervención específica3,15,16,20.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.


![La RM inicial presenta compromiso extenso de la sustancia blanca paraventricular incluyendo regiones frontoparietales altas (mayor al lado izquierdo) y de la región insular con extensión al territorio posterior de cápsulas en este lado. Se aprecia tanto en secuencias T1 más gadolinio (A), donde se observan focos de disminución de la intensidad, como en secuencias T2 (coronal T2 [B]) y FLAIR (C) donde es muy notoria la hiperintensidad multifocal, y finalmente la restricción de la difusión en DWI (D). Aunque más extenso y multifocal que en el otro caso, el comportamiento de la señal y la restricción de la difusión muestran similar aspecto. La RM inicial presenta compromiso extenso de la sustancia blanca paraventricular incluyendo regiones frontoparietales altas (mayor al lado izquierdo) y de la región insular con extensión al territorio posterior de cápsulas en este lado. Se aprecia tanto en secuencias T1 más gadolinio (A), donde se observan focos de disminución de la intensidad, como en secuencias T2 (coronal T2 [B]) y FLAIR (C) donde es muy notoria la hiperintensidad multifocal, y finalmente la restricción de la difusión en DWI (D). Aunque más extenso y multifocal que en el otro caso, el comportamiento de la señal y la restricción de la difusión muestran similar aspecto.](https://static.elsevier.es/multimedia/16954033/0000007900000006/v1_201311210121/S1695403313002099/v1_201311210121/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)
![En el estudio de control, 4 meses después del primero, se obtuvieron imágenes por RM encontrando reducción importante de las alteraciones de señal mejor definidas en secuencias T2 (coronal T2 [A], FLAIR sagital [B]), lo mismo que la restricción de la difusión (DWI) (C), mejoría más notoria del compromiso multifocal izquierdo persistiendo distribución simétrica en la sustancia blanca frontoparietal de las hiperdensidades, que representan cambios de edema y restricción de la difusión. En el estudio de control, 4 meses después del primero, se obtuvieron imágenes por RM encontrando reducción importante de las alteraciones de señal mejor definidas en secuencias T2 (coronal T2 [A], FLAIR sagital [B]), lo mismo que la restricción de la difusión (DWI) (C), mejoría más notoria del compromiso multifocal izquierdo persistiendo distribución simétrica en la sustancia blanca frontoparietal de las hiperdensidades, que representan cambios de edema y restricción de la difusión.](https://static.elsevier.es/multimedia/16954033/0000007900000006/v1_201311210121/S1695403313002099/v1_201311210121/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)
![El control por RM 5 meses después del estudio inicial muestra una importante reducción en la extensión e intensidad de lo previamente descrito, definibles en las secuencias de T2 (coronal T2 [A], axial FLAIR [B]) e imágenes para difusión (DWI) (C). Nótese la persistencia de un área hiperintensa a nivel de la sustancia blanca paraventricular bilateralmente en imágenes FLAIR. En T1 y T1 más gadolinio (no incluidas) los cambios fueron imperceptibles. El control por RM 5 meses después del estudio inicial muestra una importante reducción en la extensión e intensidad de lo previamente descrito, definibles en las secuencias de T2 (coronal T2 [A], axial FLAIR [B]) e imágenes para difusión (DWI) (C). Nótese la persistencia de un área hiperintensa a nivel de la sustancia blanca paraventricular bilateralmente en imágenes FLAIR. En T1 y T1 más gadolinio (no incluidas) los cambios fueron imperceptibles.](https://static.elsevier.es/multimedia/16954033/0000007900000006/v1_201311210121/S1695403313002099/v1_201311210121/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)


