Introducción
Las recomendaciones sobre el uso y aplicaciones del broncoscopio flexible en la infancia, del Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica (SENP)1, se completan ahora con un nuevo capítulo en el que se incluyen los procedimientos que, con fines diagnósticos y/o terapéuticos, se aplican con mayor frecuencia durante la broncoscopia: el lavado broncoalveolar y las biopsias bronquial y transbronquial.
Se intenta con ello establecer unas bases que faciliten la aplicación de ambas técnicas, recogiendo sus indicaciones, forma de realización, procesamiento de las muestras, valores de referencia para la población infantil y rendimiento de las mismas en diversas enfermedades y edades.
Lavado broncoalveolar
El lavado broncoalveolar (LBA) es un procedimiento sencillo y bien tolerado que permite obtener información acerca de los constituyentes celulares y bioquímicos de la superficie epitelial del tracto respiratorio inferior, a través de la instilación y posterior aspiración de líquido en uno o varios segmentos o subsegmentos pulmonares. Se estima que con la realización del LBA se toma muestra de alrededor de un millón de alvéolos (1 % de la superficie pulmonar), obteniéndose aproximadamente 1 ml de secreciones reales pulmonares en el total del líquido recuperado.
Se diferencia del lavado o aspirado bronquial en el que se aspiran pequeñas cantidades de suero fisiológico instilado en las vías respiratorias grandes2.
Generalmente el LBA se efectúa a través del broncoscopio (LBA broncoscópico [LBA-B]), aunque en ocasiones se realiza directamente con una sonda a través de un tubo endotraqueal (LBA no broncoscópico [LBA-NB]).
En la infancia, la aplicación de la técnica se ha visto limitada por el inadecuado tamaño de los fibrobroncoscopios disponibles en relación al calibre de la vía aérea de los niños de menor edad y por su mayor grado de "invasividad", cuando se utilizaba bajo anestesia. Sin embargo, tanto el LBA-NB como el uso creciente de sedación han favorecido su utilización en cualquier niño, sea cual sea su edad o condición3,4. A pesar de ello, hasta el año 2000 no existía ninguna normativa pediátrica que estandarizara su metodología y aplicaciones clínicas. Desde ese año, gracias a la labor desarrollada por el Grupo de Trabajo en Lavado Broncoalveolar en niños de la Sociedad Europea Respiratoria (ERS)2, se dispone de una guía pediátrica que recoge todos estos aspectos, los valores de normalidad en la infancia y las futuras líneas de investigación. A ella se hará referencia completando sus contenidos con las aportaciones de la literatura médica en estos últimos 2 años y con nuevos apartados, como el referido al LBA-NB.
Indicaciones y aplicaciones diagnósticas y terapéuticas
Infecciones pulmonares
El LBA se ha usado ampliamente en el diagnóstico de las infecciones pulmonares5-8, pero su sensibilidad y especificidad varían en función de que se trate de un enfermo inmunocompetente, o no, del microorganismo causal, de la técnica empleada y de la utilización, o no, de antibioterapia previa.
Niños inmunocomprometidos
Es una de las principales aplicaciones del LBA en la infancia2, con un alto rendimiento diagnóstico (alrededor del 80 %)5,8.
El hallazgo de Pneumocystis carinii, uno de los patógenos más comúnmente identificados6, de Mycobacterium tuberculosis, Legionella pneumophila, Nocardia, Histoplasma, Cryptococcus, Blastomyces, Coccidioides, virus Influenza y virus respiratorio sincitial es significativo de infección pulmonar, con un valor similar al obtenido con la biopsia a cielo abierto2. Tan sólo en aquellos casos en los que se sospeche una infección viral o fúngica la muestra tisular es más fiable por lo que, si no está contraindicada, puede ser aconsejable la práctica simultánea de una biopsia transbronquial9. La detección de organismos como Aspergillus, Candida, micobacterias atípicas, citomegalovirus, virus del herpes simple y flora común del tracto respiratorio superior no les implica necesariamente como agentes etiológicos de la enfermedad2. Los recuentos celulares diferenciales también pueden ayudar en el diagnóstico de los infiltrados pulmonares10.
Niños inmunocompetentes
El LBA puede estar indicado en las neumonías graves que no responden de forma adecuada al tratamiento o que precisan ventilación mecánica así como en el estudio de las neumonías nosocomiales en niños intubados y ventilados11. En estos últimos pueden utilizarse diferentes métodos (LBA-B, LBA-NB, catéteres protegidos o cepillos protegidos), ya que en los diversos estudios practicados no se aprecian diferencias importantes en cuanto a sensibilidad y especificidad (sensibilidad entre el 60 y el 80 % y especificidad entre el 70 y el 90 %).
Dada la posibilidad de contaminación se han de efectuar siempre cultivos cuantitativos e investigar la presencia de bacterias intracelulares en el examen directo de la muestra2. En algunos casos se podría realizar un doble lavado, en un lóbulo sano y en el afectado, con ánimo de aclarar dudas sobre la posible contaminación del fibrobroncoscopio por flora orofaríngea12.
La utilización del LBA en la obtención de muestras para el diagnóstico de tuberculosis es discutida, dado que no aumenta la sensibilidad del aspirado gástrico13,14. A pesar de ello, cuando se utilizan ambos procedimientos se dobla el rendimiento diagnóstico del obtenido en cada uno por separado15.
Enfermedades pulmonares no infecciosas
El LBA puede ser diagnóstico en enfermedades como proteinosis alveolar, hemorragia alveolar, histiocitosis pulmonar y neumonía por acumulación de lípidos2,16 (tabla 1).
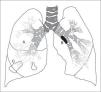
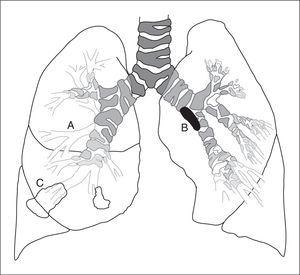
Figura 2.Esquema que muestra la diferente localización en que se realizaA)la biopsia de la mucosa bronquial en una carina segmentaria o subsegmentaria,B)la biopsia bronquial de una lesión endobronquial, yC)la biopsia transbronquial o biopsia pulmonar broncoscópica en posición subpleural.
1.En la proteinosis es característico el aspecto macroscópico lechoso del líquido del LBA, la presencia de material extracelular lipoproteináceo positivo al ácido peryódico de Schiff y negativo al azul alcián de los característicos cuerpos lamelares al microscopio electrónico17.
2.El aspecto rojizo del líquido del LBA, que aumenta en las sucesivas alícuotas, podría ser indicativo de hemorragia. Con la tinción de Pearls18 se pueden identificar los hemosiderófagos, aunque su ausencia no excluye la posibilidad de hemorragia alveolar reciente (< 48 h) o remota (> 12 días)9. En adultos se considera positiva la tinción cuando hay más del 25 % de macrófagos teñidos, pero en niños un ligero aumento puede ser ya significativo19. En 1999, Ahrens et al19 presentan los primeros valores de referencia en niños, junto a una puntuación diagnóstica de la enfermedad.
3.En la histiocitosis la fórmula celular del LBA es inespecífica9. La identificación de células de Langerhans mediante el empleo de anticuerpos monoclonales OKT-6 y/o microscopia electrónica hacen sospechar la existencia de una histiocitosis X20. Se requiere la presencia de igual o más del 5 % de células CD1a(+) para confirmar el diagnóstico, ya que hasta el 3 % de ellas pueden estar presentes en sujetos normales20.
Existen otras enfermedades en las que los hallazgos del LBA no son patognomónicos, pero son útiles para el diagnóstico diferencial (tabla 1). Por ejemplo, en la neumonía eosinofílica aguda en la que el porcentaje de eosinófilos en el lavado es superior al 25 %21,22. En la neumonitis por hipersensibilidad existe linfocitosis, como en el adulto, pero la relación CD4/CD8 no se encuentra elevada. La valoración de las células natural killer y de la expresión del antígeno-DR en los leucocitos humanos parece ser útil23.
El hallazgo de macrófagos cargados de lípidos se han asociado a síndromes aspirativos24,25 pero su valor diagnóstico cada día está más discutido26,27.
En la enfermedad pulmonar intersticial el valor del LBA es controvertido. A pesar de ello sus resultados permiten diferenciar la existencia o no de esta enfermedad y su estadio evolutivo28, aportan información sobre el patrón celular y pueden ayudar a valorar el proceso inflamatorio alveolar y a orientar el diagnóstico2. En niños inmunocomprometidos o con sida, el LBA puede evitar la biopsia en el diagnóstico de la neumonía intersticial linfoide pero aunque refleja el grado de inflamación pulmonar29 no informa del curso evolutivo posterior30.
Como resumen de sus indicaciones podríamos plantear un LBA2 en:
1.Niños inmunocomprometidos, trasplantados o con problemas oncológicos que comienzan a presentar de forma aguda taquipnea, disnea e hipoxemia con hallazgos radiográficos de nuevos infiltrados intersticiales difusos en la radiografía de tórax. En este caso, la técnica se debe efectuar antes de iniciar antibioterapia y siempre que no exista mejoría tras 48 h de tratamiento, tanto si tenían o no un LBA positivo previo.
2.Neumonías intersticiales crónicas o bronconeumonías recurrentes o crónicas en niños infectados por el virus de la inmunodeficiencia humana en las que no se detecta el posible organismo causal por técnicas no invasivas.
3.Enfermedad pulmonar intersticial de niños inmunocompetentes y en trasplantados con enfermedad pulmonar, junto a biopsia transbronquial o abierta.
Neonatos
El LBA es una técnica muy útil para la investigación de procesos respiratorios en este grupo de edad. Es segura y fácil de realizar, incluso en los niños sometidos a ventilación mecánica. Hasta el momento sólo se cuenta con valores de referencia obtenidos en recién nacidos ventilados, mediante LBA-NB, por lo que no pueden considerarse estrictamente normales2. En Pediatric Pulmonology31 existe una excelente revisión al respecto.
Indicaciones y aplicaciones terapéuticas
La utilización terapéutica del LBA no está bien definida. Una aplicación generalizadamente aceptada es el tratamiento de la proteinosis alveolar. En los niños no es posible utilizar como en los adultos, un tubo endotraqueal de doble luz y ventilar un pulmón mientras se lava el otro. La técnica habitual consiste en colocar, con la ayuda del broncoscopio flexible, un catéter con balón en un bronquio, inflar el balón para aislar este árbol bronquial y realizar un LBA masivo a través del catéter, mientras se ventila el otro pulmón mediante una mascarilla laríngea32,33.
La utilidad de los lavados en el tratamiento de las atelectasias no está clara, aunque algunos autores la aplican con éxito34, incluso sin utilizar el fibrobroncoscopio35. Existen numerosas aportaciones de lavados terapéuticos en pacientes con fibrosis quística que presentan graves impactos mucosos, aunque en los niños de menor edad, el pequeño canal del fibrobroncoscopio es insuficiente, para aspirar el moco espeso y viscoso que invade sus vías respiratorias.
Lavado broncoalveolar broncoscópico
Requisitos previos
La realización de un LBA se ha de apoyar siempre en un estudio clínico previo que lo justifique. Se debe disponer de radiografías de tórax y, a ser posible, de una tomografía computarizada (TC) que permitan delimitar el segmento más idóneo donde efectuarlo.
La cifra de plaquetas debe ser superior a 60.000 cél./ml, y el tiempo de Quick superior al 50 %, que debe corregirse previamente si están alteradas.
Instrumental y material necesario
Lo más habitual es que se plantee en el curso de una fibrobroncoscopia convencional por lo que, además del instrumental necesario para ella1, sólo se precisarán jeringas para la instilación y aspiración del líquido y recipientes estériles para recoger y transportar el material recuperado.
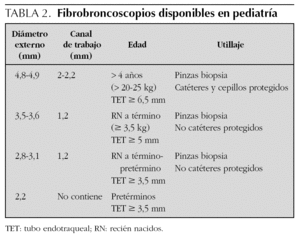
La edad y el peso del niño van a limitar la utilización del fibrobroncoscopio convencional pediátrico que, con un diámetro externo de 3,6 mm y un canal interno de 1,2 mm, obturaría por completo la vía aérea de los recién nacidos o de los lactantes con pesos inferiores a 3 kg. En la actualidad, sólo uno de los cuatro tamaños de broncoscopios flexibles disponibles en niños (tabla 2), el de diámetro externo 2,8-3,1 mm puede ser empleado en recién nacidos con peso inferior a 3,5 kg y ningún fibrobroncoscopio puede introducirse a través de tubos endotraqueales iguales o inferiores a 3,5-4 mm, lo que impide la realización de lavados broncoscópicos en niños intubados, con tubos de este diámetro. En ellos se pueden efectuar LBA no broncoscópicos.
Técnica
Hasta la realización del lavado los pasos a dar son idénticos a los propugnados para la fibrobroncoscopia1, aunque con ciertas precauciones9:
1.Si se van a solicitar estudios bacteriológicos debe ser la primera prueba que se realice, antes de explorar el árbol bronquial, evitando aspirar previamente secreciones con el fin de impedir o reducir la contaminación del canal de succión por la flora orofaríngea36,37.
2.Se debe evitar la instilación de anestesia tópica en el segmento que va a ser lavado, ya que podría inhibir el crecimiento bacteriano en los cultivos38.
3.Se debe efectuar antes que otras técnicas (biopsia, cepillado o punción) que podría provocar hemorragias y falsear los resultados del lavado.
Localización del lavado
El LBA se puede realizar en cualquier territorio pulmonar. En niños con patología pulmonar localizada debe efectuarse en el segmento o lóbulo más afectado o de previsible mayor rendimiento (zona de mayor actividad inflamatoria identificada por una TC previa).
Cuando se trata de una enfermedad difusa cualquier zona podría ser idónea para realizar este estudio, ya que los resultados del LBA son reproducibles sea cual sea el lugar escogido para hacerlo39. En estos casos, los segmentos más apropiados son el lóbulo medio y la língula, tanto por su accesibilidad y facilidad para la impactación del fibrobroncoscopio, como por la mayor recuperación del líquido instilado en ellos40 ya que cuando el niño se coloca en posición supina, quedan situados anterior y superiormente, lo cual favorece la acción de la gravedad. En cualquier caso, dependiendo de la naturaleza de la enfermedad y de su heterogeneidad, el lavado de más de una zona del pulmón podría reducir las posibilidades de error41. En los lactantes es más fácil realizar el lavado en el lóbulo inferior derecho2.
Líquido utilizado y métodos de instilación y recuperación
Debe emplearse suero salino isotónico estéril (cloruro sódico al 0,9 %), a temperatura ambiente9,42,43, o a temperatura corporal (37 °C)2. Esta última parece reducir la tos y el broncospasmo, provocar menor deterioro de la función pulmonar y favorecer la recuperación del líquido instilado44,45. Sin embargo, los grupos que utilizan soluciones a temperatura ambiente, no aprecian estos efectos negativos5,42.
La solución salina se introduce con una jeringa a través del canal de trabajo del fibrobroncoscopio, en forma de embolada, seguida por la instilación de una cantidad de aire suficiente que asegure el vaciado de todo el canal de succión.
La recuperación del líquido mediante aspiración manual con la misma jeringa no es tan efectiva como en el adulto, sobre todo en los niños más pequeños6,39,42,43, por lo que se suele utilizar un sistema de varios recipientes interconectados, unidos a su vez por uno de sus de extremos con el canal de trabajo del fibrobroncoscopio y, por el otro, con un aspirador, al que se aplica, de forma intermitente, una presión negativa entre 25 y 100 mmHg2. Una llave de tres pasos permite la utilización consecutiva del canal del fibrobroncoscopio para introducir el líquido desde la jeringa, o para aspirarlo hacia el recipiente de plástico. Se debe evitar una excesiva presión negativa que podría ocasionar el colapso de la vía aérea distal impidiendo la recuperación del líquido del lavado.
Volúmenes de líquido que se deben utilizar
No existe acuerdo acerca de la cantidad de líquido o del número idóneo de alícuotas necesarias que permitan obtener datos significativos del compartimento alveolar en niños de diferentes pesos y edades.
Se han utilizado varios protocolos:
1.Algunos usan, de forma similar a los adultos, de 2 a 5 fracciones del mismo volumen (10-20 ml), independientemente del peso y edad del niño7,39,40.
2.Otros calculan entre 0,25-1 ml/kg/alícuota5,44, con volúmenes finales que oscilan entre el 10-15 % de la capacidad residual funcional6,43.
3.En algunos casos los volúmenes se corrigen de acuerdo con la edad, de forma que en los niños menores de 20 kg se utiliza un total de 3 ml/kg dividido en tres fracciones iguales, mientras que los niños con un peso superior a 20 kg reciben alícuotas de 20 ml, hasta un volumen final de 3 ml/kg43,46,47.
Tan sólo dos estudios evalúan la influencia del volumen utilizado sobre los resultados del LBA: Midulla et al39 observan que el recuento celular diferencial apenas se ve afectado por él, que la segunda fracción proporciona resultados similares a los de las siguientes muestras y que dos alícuotas son suficientes para separar la muestra bronquial de la alveolar. Por ello, para simplificar la técnica, propugnan la utilización de un volumen fijo por alícuota. Pohunek et al40 también recomiendan utilizar volúmenes fijos, de 20 ml, que proveen una correcta información de los compartimentos bronquial y alveolar. Sin embargo, Ratjen y Bruch46 consideran que durante la infancia las vías aéreas crecen paralelamente al tamaño corporal, por lo que el volumen necesario para lavar los bronquios debe adecuarse a la edad y el peso de cada niño. En cualquier caso los escasos trabajos que en los últimos años han tratado de aplicar protocolos de LBA en niños sanos para obtener valores de referencia, utilizan volúmenes calculados de acuerdo con el peso6,43,46,48.
Nuestra recomendación sería utilizar la tercera opción (alícuotas de 1 ml/kg hasta un máximo de 20 ml, hasta completar un volumen total de 3 ml/kg), y en los adolescentes de más de 50 kg de peso utilizar tres alícuotas de 50 ml.
Procesamiento del líquido recuperado
El LBA-B puede ser considerado técnicamente aceptable si el líquido recuperado es igual o superior al 40 % del instilado y contiene escasas células epiteliales2. Algunos autores aceptan como muestra adecuada una recuperación de, al menos, el 10 %49. En los niños normales se logra aspirar entre el 43 y el 85 % del volumen introducido, aunque la primera muestra suele ser claramente menor (36-40 %) que las restantes6,43,46,48.
En el LBA-NB la cantidad del líquido recuperado suele ser baja y se necesitan estudios comparativos entre LBA-B y no B que permitan valorar si los resultados de ambas técnicas son similares para los constituyentes celulares y no celulares2.
En general se considera que la primera alícuota es una muestra bronquial. Contiene más neutrófilos y menos linfocitos que las restantes39,40,48 por lo que, si se mezcla con ellas, puede interferir el análisis global37. Por este motivo, la mayor parte de autores5,39,48 separan esta primera alícuota y la destinan a cultivos microbiológicos, mientras que todas las restantes, como ofrecen resultados comparables40,48, se procesan mezcladas en un solo "pool"6,40,43,46,48. En los casos en que se sospeche inflamación bronquial (asma, bronquitis) el análisis celular de la primera muestra podría ofrecer información al respecto40.
El procesamiento del líquido obtenido durante el LBA (L-LBA) debe ser inmediato, dentro de las 4 h posteriores a su obtención9,35, manteniéndose hasta entonces a 4 °C, para favorecer la viabilidad celular2. La muestra se debe recoger en recipiente plástico o de vidrio con silicona para evitar la adherencia selectiva al vaso, sobre todo de los macrófagos.
Evaluación del líquido recuperado
Se pueden analizar diversos componentes: células, sustancias químicas en solución, microorganismos, partículas minerales, etc. Se debe anotar el volumen instilado y el recuperado, el recuento celular total, el porcentaje de los distintos tipos de células y para los componentes no celulares, la concentración por mililitro del L-LBA.
Células
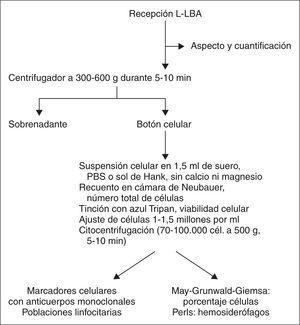
Se debe tener en cuenta el método empleado en la cuantificación y tipificación celular, ya que puede afectar de manera significativa a los resultados9,50. En la figura 1 se resume el procesamiento habitual del LBA para el análisis celular9.
Figura 1. Procesamiento del líquido del lavado broncoalveolar (L-LBA) para estudio celular9.
Los procedimientos citológicos de aplicación clínica habitual en el líquido de LBA incluyen el recuento celular (se considera válido si > 300-500 cél./ml), la fórmula diferencial de los diferentes tipos celulares presentes y la visualización de gérmenes en la tinción realizada. En ocasiones, según la patología sospechada es útil solicitar la práctica de tinciones de PAS si se sospecha una proteinosis alveolar, de Pearls (para el estudio de macrófagos cargados de hemosiderina) y oil-red (para el estudio de macrófagos cargados de lípidos). También, como se ha comentado, en algunas enfermedades puede ser de interés el estudio de poblaciones linfocitarias o de algunos marcadores tumorales (proteína S-100 en la histiocitosis X).
Valores de normalidad
No existe acuerdo unánime en la literatura médica sobre los valores normales de la celularidad en el LBA por varias razones2:
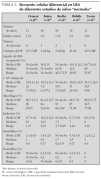
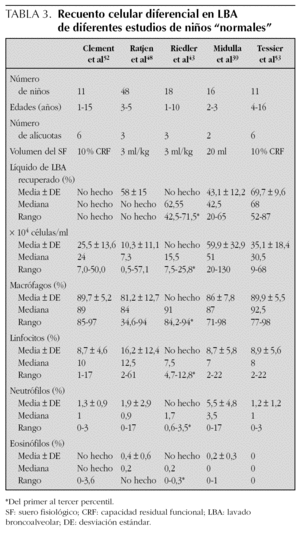
1.Los estudios realizados en niños son escasos39,43,48,51-54, y con un número pequeño de casos. La tabla 3 muestra un resumen de los mismos.
TABLA 3. Recuento celular diferencial en LBA de diferentes estudios de niños "normales"
2.La mayor parte de los estudios parten de una población control, no de niños totalmente sanos.
3.La técnica de LBA empleada en ellos no es idéntica.
Recuento celular total. Se observa una amplia variabilidad interindividual39,48, lo que dificulta su utilización para diferenciar la existencia o no de enfermedad pulmonar. El número de células es mayor en los niños de menor edad48, lo cual podría estar relacionado con el proceso de crecimiento activo, bronquial y alveolar, que se da en este grupo de edad39 pero, en general, tanto la concentración total de células como el porcentaje de los distintos tipos son similares a los encontrados en el adulto2,43,55 (tabla 3).
Tipos de células. El porcentaje de linfocitos es similar al de los adultos43,49,53. Riedler et al43, encuentran una correlación positiva con la edad, sobre todo durante los primeros 2 años de vida. Sin embargo, en los estudios de Ratjen et al47,48 el número de linfocitos está constantemente aumentado. Los neutrófilos son más numerosos en los niños menores de 12 meses, quizá porque en ellos el porcentaje de líquido bronquial es mayor que el alveolar en la muestra del L-LBA39,48.
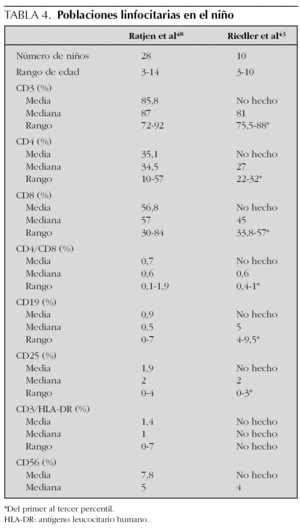
Poblaciones linfocitarias. Son las que ofrecen mayor diferenciación con el adulto. Lo más llamativo es la disminución del cociente CD4/CD8, debido a un aumento absoluto de los CD8, ya que los recuentos CD4 son similares a los del adulto43,47. Este cociente es inferior al encontrado en sangre periférica durante la infancia. Las células T helper (Th) son aproximadamente la mitad de las células T citotóxicas, con una relación entre ellas de 0,58 comparada con 1,8-2,7 encontrada en adultos43. Esto podría reflejar el proceso de maduración del sistema inmunitario en los pulmones del niño, o la respuesta a las frecuentes infecciones virales respiratorias que éstos sufren, ya que una de las funciones fundamentales de los CD8 es la eliminación de organismos infecciosos, como los virus.
En la tabla 4 se expresan los valores encontrados en niños normales.
Sustancias químicas
El estudio de otros solutos como la urea o albúmina para la cuantificación del líquido de recubrimiento epitelial, o de marcadores de la inflamación tiene un carácter fundamentalmente experimental2,9,39,46,56-58.
Microorganismos
Dado que el fibrobroncoscopio arrastra microorganismos de la flora orofaríngea y contamina la vía aérea, normalmente estéril, los cultivos bacterianos habituales del líquido efluyente son difíciles de interpretar.
Para el diagnóstico de infecciones bacterianas se debe realizar una tinción de Gram y un cultivo cuantitativo del L-LBA. En adultos, se valoran como significativos los aislamientos de 10.000 UFC/ml9. La elección de un determinado punto de corte es discutible ante el desconocimiento de la dilución de la secreción respiratoria en el líquido recuperado. La detección de más de 1 % de células escamosas epiteliales puede indicar una excesiva contaminación de la muestra por secreciones orofaríngeas. Existen otros métodos capaces de medir el crecimiento bacteriano59 y técnicas para minimizar la contaminación, tales como el LBA con catéteres protegidos60, que no pueden aplicarse en los niños menores de 4-5 años a causa del pequeño tamaño del canal del fibrobroncoscopio. En las neumonías localizadas existe la posibilidad de realizar un doble lavado: en el lugar afectado y en un segmento contralateral sano12.
Citocinas
Desempeñan un papel esencial en la inflamación y en la regulación de la respuesta inmunitaria y su estudio en el LBA constituye uno de los campos de investigación más prometedores61-63. Su detección puede realizarse mediante análisis biológicos, inmunoanálisis o técnicas de biología molecular9.
Lavado broncoalveolar no broncoscópico
Sus aplicaciones se dirigen especialmente a recién nacidos o lactantes intubados con tubos endotraqueales menores de 3,5-4 mm de diámetro interno en los que, como se ha comentado anteriormente, es imposible la utilización de fibrobroncoscopios con canal de trabajo. En ellos, algunos autores han desarrollado métodos sencillos y reproducibles para realizar la técnica del LBA sin fibrobroncoscopio35,42,44,64, siempre que se trate de una enfermedad pulmonar difusa, que no precisa un lugar de lavado concreto. También se puede realizar en niños mayores intubados. Las principales indicaciones son el estudio de las neumonías de mala evolución, neumonías nosocomiales en pacientes intubados y neumonías en pacientes inmunodeprimidos.
Se han utilizado catéteres de presión, en cuña, 4F, con balón incorporado44, simples sondas de alimentación, 8F, de 2,5 mm de diámetro externo35, catéteres de succión5,64, o incluso, en los neonatos más pequeños, catéteres para canalización de la arteria umbilical42. Lo más adecuado es utilizar un doble catéter protegido.
En cualquier caso, se introducen, a través de un adaptador, por el tubo endotraqueal, manteniendo la cabeza inclinada hacia el lado opuesto al pulmón que va a ser estudiado, haciéndolo avanzar hasta notar una pequeña resistencia. Se retira entonces unos 3 mm, reintroduciéndolo de nuevo hasta el lugar de resistencia, considerado ya como posición en cuña5,35,44.
La cantidad de líquido que se debe instilar no está estandarizada. Recomendamos realizar 3 instilaciones de suero fisiológico de 1 ml/kg, hasta un máximo de 10 ml en cada instilación. La aspiración del líquido introducido se puede realizar manualmente con la jeringa, o utilizando un aspirador con una presión de succión continua, con la que el porcentaje de líquido recuperado es mayor35.
Complicaciones y efectos secundarios del LBA
El LBA es un procedimiento seguro que no incrementa el riesgo de la fibrobroncoscopia y puede ser aplicado a niños de cualquier edad o enfermedad pulmonar2,5,6,42,44, o incluso con hipoxemias relativamente graves65.
En lactantes o niños pequeños la impactación del fibrobroncoscopio es más proximal, por lo que la proporción de pulmón lavado y obstruido es mayor. Esto explica, en ellos, la mayor tendencia a la hipoxia, causada por el desequilibrio entre ventilación y perfusión, circunstancia que se evita con la aplicación de oxígeno durante la realización de la técnica.
Aunque en la mayor parte de casos no se describen efectos adversos5,39,44 en un pequeño porcentaje pueden producirse elevaciones pasajeras de la temperatura, generalmente no superiores a 38,5 °C, 4-6 h después del procedimiento47,48. En general se trata de una fiebre autolimitada no relacionada con agentes infecciosos.
Biopsia bronquial
El término biopsia bronquial o biopsia endobronquial engloba el análisis microscópico de lesiones endobronquiales y de la mucosa bronquial (fig. 2). En este último caso se incluye habitualmente el epitelio, la membrana basal y, con menos frecuencia, el músculo liso66.
Figura 2.Esquema que muestra la diferente localizaciónen que se realizaA)la biopsia de la mucosabronquial en una carina segmentaria o subseg-mentaria,B)la biopsia bronquial de una le-sión endobronquial, yC)la biopsia transbron-quial o biopsia pulmonar broncoscópica enposición subpleural.
Indicaciones
Puede ser indicación de biopsia bronquial cualquier alteración de la pared del bronquio desde irregularidades de la mucosa hasta la presencia de masas. En niños se puede utilizar para el diagnóstico de enfermedades granulomatosas (tuberculosis o sarcoidosis), o de otras enfermedades menos frecuentes como tumores endobronquiales, sarcoma de Kaposi y enfermedades fúngicas crónicas67.
La realización de una biopsia de la mucosa bronquial ha sido una indicación ampliamente admitida para obtener células ciliadas en el diagnóstico de la discinesia ciliar primaria68, aunque el cepillado nasal, con igual rendimiento y mayor sencillez, es la técnica más recomendable en estos pacientes69. La biopsia de la mucosa se ha aplicado también experimentalmente en el estudio de la inflamación bronquial en niños con asma o fibrosis quística70-72 y recientemente se ha propuesto su inclusión dentro del protocolo diagnóstico de niños con síntomas respiratorios crónicos de etiología no aclarada73.
La biopsia endobronquial se considera el patrón de referencia para estudiar la inflamación de la pared bronquial con el que se comparan para su validación otros métodos indirectos menos invasores, como el lavado broncoalveolar y el esputo inducido.
Instrumental necesario
Para la práctica de la biopsia es necesario emplear pinzas de biopsia estándar de 1,8 mm de diámetro, iguales a las utilizadas en pacientes adultos, por lo que sólo se puede llevar a cabo a través del broncoscopio de 4,9 mm de tamaño, con un canal de trabajo de 2-2,2 mm. El uso de mascarilla laríngea para la sedación y anestesia permite emplear este broncoscopio para efectuar la biopsia a partir de 2-2,5 años de edad73. Las pinzas más pequeñas, disponibles para el broncoscopio de 3,6 mm, no permiten obtener una muestra suficientemente representativa. Algunos autores utilizan el broncoscopio rígido para la realización de este tipo de biopsias70,74.
Se recomienda usar pinzas de un solo uso, o pinzas reutilizables que no se empleen en más de 5 procedimientos.
Técnica
Biopsia de lesiones endobronquiales
La técnica es sencilla. Se sitúa el extremo del broncoscopio frente a la lesión y se introduce la pinza por el canal de trabajo hasta que sobresale algunos milímetros del mismo. Se abre la pinza y se continúa introduciendo hasta hacer contacto con la lesión. Se cierra la pinza y se retira sin mover el broncoscopio. La maniobra se repite en la misma zona hasta lograr de 3 a 5 muestras óptimas. En ocasiones los resultados obtenidos en lesiones accesibles son negativos debido a la presencia de necrosis o inflamación superficial, o por tratarse de lesiones muy sangrantes que impiden repetir la toma. Otras veces, si la lesión está situada en la pared lateral del bronquio, puede ser difícil realizar la biopsia.
En lesiones muy vascularizadas es aconsejable instilar previamente 1-2 ml de adrenalina al 1/20.000, aunque en estos casos habría que valorar de forma cuidadosa la relación riesgo-beneficio antes de realizarla. Se ha descrito un fallecimiento por hemorragia masiva en un paciente adulto tras la biopsia de una lesión de la mucosa bronquial que en la autopsia se comprobó que correspondía a una arteria intrabronquial anómala75.
Biopsia de la mucosa bronquial
La biopsia se realiza bajo visión directa, en una carina bronquial segmentaria o subsegmentaria, entre la segunda y la quinta generación76 (en niños generalmente entre la tercera y la cuarta73). Tras colocar la pinza sobre la carina elegida se cierra sin una fuerza excesiva para no producir artefactos en la muestra. Se debe mantener unos segundos en esta posición, antes de retirarla76. Normalmente se realizan un mínimo de tres biopsias. El tamaño de las muestras que se obtienen oscila entre 1-2 mm. Los fragmentos de tejido obtenido se introducen en formol al 10 %.
Anestesia y sedación
Para la realización de una biopsia de la mucosa bronquial en niños, es preferible la utilización de sedación profunda o anestesia general, ya que así se evitan los movimientos del paciente durante el procedimiento y se aumenta la seguridad del mismo73,74,76.
Complicaciones
La biopsia de la mucosa bronquial es bien tolerada y no se han descrito casos de neumotórax ni de sangrado importante, no siendo necesario instilar adrenalina73,74. Por este motivo algunos autores consideran que no es necesario disponer de forma rutinaria de pruebas de coagulación antes de la realización de la prueba76, aunque puede ser prudente obtenerlas. Tampoco es necesaria la práctica habitual de una radiografía de tórax tras efectuar una biopsia endobronquial68.
Aspectos éticos
La biopsia de las lesiones endobronquiales tiene una justificación clínica, por lo que requiere únicamente el consentimiento informado de los responsables del niño.
La biopsia de la mucosa bronquial, inicialmente realizada en pacientes adultos, se está extendiendo a pacientes pediátricos66. Se ha publicado una normativa realizada por un grupo de expertos en la que se dan recomendaciones éticas y metodológicas para la realización de estas técnicas76. Se considera que cualquier proyecto de investigación debe estar aprobado por un comité de ética y que en ningún caso la broncoscopia puede realizarse únicamente con propósitos de investigación. No existen en cambio contraindicaciones éticas para realizar una biopsia endobronquial si se está realizando una broncoscopia indicada clínicamente o si el niño está intubado para la realización de otro procedimiento (intervención quirúrgica), que permite introducir el broncoscopio a través del tubo endotraqueal76. En esta situación sería más discutible y probablemente no éticamente aceptable, la realización de una biopsia transbronquial, ya que tiene unos riesgos superiores a los de la biopsia bronquial.
Biopsia transbronquial
La biopsia transbronquial o biopsia pulmonar broncoscópica constituye un método relativamente no invasivo y seguro de obtener parénquima pulmonar para su estudio, pudiendo evitar la necesidad de realizar una toracotomía77,78 (fig. 2).
En los últimos años, la necesidad de monitorizar los episodios de rechazo agudo en los pacientes trasplantados de pulmón ha dado un mayor impulso a la utilización de esta técnica, lo que explica que el mayor porcentaje de biopsias en niños se realice en este tipo de pacientes79. No obstante, la biopsia transbronquial puede ayudar también al diagnóstico de otras enfermedades pulmonares pediátricas67.
Indicaciones
La indicación general de esta técnica es la investigación de infiltrados pulmonares localizados o difusos, con patrón intersticial, alveolar, miliar o nodular fino, tanto en pacientes inmunocompetentes como en inmunodeprimidos, siempre que no sea posible su diagnóstico por otros métodos menos invasivos.
La biopsia transbronquial puede ser útil en la investigación de los nódulos pulmonares localizados, sobre todo con la ayuda de la fluoroscopia, aunque en estos casos suele ser más útil la biopsia pulmonar transtorácica.
Utilidad diagnóstica
La biopsia transbronquial es la técnica de elección para el diagnóstico y vigilancia de los episodios de rechazo en los niños trasplantados de pulmón, ya que su sensibilidad diagnóstica en estos casos es del 72-94 % y su especificidad del 90-100 %. Se debe realizar siempre que haya sospecha de rechazo agudo y de forma electiva a los 7-15 días, 6 semanas, 3, 6 y 12 meses del trasplante80. Algunos equipos, a partir de los 6 meses, la indican únicamente en la sospecha de rechazo. La biopsia transbronquial tiene menos valor para el diagnóstico de rechazo crónico o bronquiolitis obliterante, ya que la distribución de las lesiones pulmonares es muy parcheada.
En las neumopatías intersticiales ofrece unos resultados variables. Con la aplicación de criterios diagnósticos estrictos, la positividad diagnóstica en estos pacientes ha sido del 19 a 39 %81. En el estudio de las neumopatías intersticiales idiopáticas suele ser necesaria una biopsia abierta para establecer un diagnóstico anatomopatológico.
En las enfermedades granulomatosas como la sarcoidosis o tuberculosis miliar, y en la linfangitis carcinomatosa, se puede conseguir un alto porcentaje de diagnósticos positivos. Otras enfermedades en las que puede proporcionar buenos resultados son la alveolitis alérgica extrínseca, la neumonía eosinofílica, vasculitis, proteinosis alveolar, histiocitosis X, microlitiasis alveolar, neumonía intersticial linfoide y enfermedad de injerto contra huésped pulmonar.
La biopsia transbronquial puede ser también útil para diagnosticar algunas enfermedades pulmonares en el paciente inmunodeprimido82. Tal es el caso de la neumonía por P. carinii que puede detectarse en un 60-90 % de los casos, aunque dado que el lavado broncoalveolar proporciona mejores resultados no debería realizarse sistemáticamente una biopsia transbronquial si se sospecha este patógeno.
La infección por citomegalovirus es difícil de diagnosticar mediante broncoscopia. El aislamiento del virus a partir de muestras de lavado broncoalveolar puede representar una contaminación. Para establecer un diagnóstico cierto se necesita la demostración de inclusiones intranucleares en el tejido pulmonar, por lo que la biopsia transbronquial puede ser útil, aunque, dada la naturaleza focal de la infección, la frecuencia de resultados positivos es del 11 al 55 %.
Contraindicaciones
Son contraindicaciones absolutas la inestabilidad hemodinámica, la hipoxemia marcada refractaria, la diátesis hemorrágica no corregida, o la no autorización del paciente para la realización del procedimiento.
Son contraindicaciones relativas la presencia de hipertensión pulmonar grave o de cardiopatías congénitas cianosantes con aumento de vasos colaterales bronquiales, la insuficiencia respiratoria grave, la incapacidad de controlar la tos del paciente durante el procedimiento y la presencia de alteraciones de la coagulación (hemofilia, uremia, plaquetopenia o tratamiento anticoagulante).
Condiciones para la exploración
Son aplicables las medidas generales de toda broncoscopia flexible.
Se debe explicar la técnica a los padres y al niño o niña, en términos adecuados para su edad, y solicitar el consentimiento informado.
El procedimiento se puede realizar de forma ambulatoria si se trata de pacientes previamente no hospitalizados. Sólo el 10-20 % de los pacientes adultos, según sus condiciones basales, precisan ingresar para la realización de la prueba. En niños se recomienda que se mantengan en observación hasta el día siguiente del procedimiento68.
Antes de iniciar la prueba es necesario contar con una radiografía de tórax, hemograma con plaquetas, pruebas de coagulación y, en caso de alteración de la función renal, con la urea, creatinina y electrolitos séricos. Además, se deben corregir las alteraciones de los tiempos de coagulación hasta rango normal, y administrar plaquetas hasta conseguir un recuento superior a 60.000/ml. Hay que tener en cuenta que en los pacientes urémicos el riesgo de hemorragia es mayor.
Anestesia y sedación
La exploración se puede realizar con anestesia local y sedación "consciente" o con anestesia general mediante la utilización de intubación traqueal o mascarilla laríngea67. En niños es recomendable usar anestesia general ya que la colocación de un tubo endotraqueal o de una mascarilla laríngea permite un mejor manejo de la vía aérea, en el caso de que el paciente sangre, y facilitan la inserción y retirada repetidas del broncoscopio. El tubo endotraqueal permite la introducción de una sonda gruesa de aspiración en caso de sangrado importante, mientras que la mascarilla laríngea permite inspeccionar también las cuerdas vocales y la tráquea, y utilizar, en los niños pequeños, un broncoscopio de mayor tamaño que con el tubo endotraqueal. En cualquier caso, son indicaciones absolutas de anestesia general la existencia de una vía aérea inestable, la presencia de problemas en la oxigenación o ventilación y los pacientes difíciles de sedar.
Equipo y material necesario
Fluoroscopia
Aunque no es totalmente imprescindible, la fluoroscopia facilita la realización de la técnica, ya que permite visualizar la localización de las pinzas en el momento de hacer la biopsia y la distancia de éstas a la pleura. Su empleo es más importante en los niños que en el adulto, ya que en el niño el tórax es más pequeño y el pulmón más flexible, y hay menor sensibilidad táctil con las pinzas de biopsia. El uso de la fluoroscopia disminuye en gran parte el riesgo de neumotórax83.
Tipo de broncoscopio
La biopsia se puede realizar con un broncoscopio rígido, tal como se describió inicialmente o con el broncoscopio flexible.
Broncoscopio flexible. En los niños a partir de 4 años, con el empleo de la mascarilla laríngea o con sedación, es posible utilizar el broncoscopio de 4,9 mm que permite el paso de las pinzas estándar. En algunos casos se puede también emplear este broncoscopio en niños de 2 años de edad a través de una mascarilla laríngea, pero si el niño está intubado sólo se podría realizar a través de tubos endotraqueales iguales o superiores a 6 mm de diámetro interno. En los niños más pequeños se debe usar el broncoscopio de 3,6 o de 2,8 mm, ya que el broncoscopio de 2,2 mm, al no tener canal de succión, no permite la realización de la biopsia broncoscópica. Se ha ideado un método indirecto en el que se emplea este broncoscopio, pero no se utiliza mucho actualmente84.
Broncoscopio rígido. El broncoscopio rígido ofrece una buena protección de la vía respiratoria y control de la ventilación. Algunos autores lo consideran de elección para la realización de las biopsias en los niños pequeños, ya que permite utilizar las pinzas estándar de mayor tamaño67. Con el broncoscopio rígido es más difícil posicionar las pinzas en el segmento deseado y acceder a los lóbulos superiores. También el riesgo de neumotórax es mayor.
Pinzas de biopsia
Con el broncoscopio de 4,9 mm, o con el broncoscopio rígido, se pueden utilizar las pinzas de biopsia estándar de adulto de 1,8 mm de diámetro. Existen diferentes tipos: dentadas o de "cocodrilo", y de bordes lisos. Las dentadas tienen un mayor efecto de desgarro sobre el tejido pulmonar. Se cree, en cambio, que las de bordes lisos pueden proporcionar una muestra mayor y con más tejido alveolar que las dentadas, que proporcionarían más muestra de pared bronquiolar. En cualquier caso, no se ha demostrado que un tipo de pinza tenga mayor utilidad diagnóstica que otro. Para el broncoscopio de 3,6 mm se han desarrollado unas pinzas de biopsia de bordes lisos de 1,1 mm de diámetro, que pasan por el canal de 1,2 mm. Son menos utilizadas, ya que la cantidad de tejido que extraen es menor y no tan adecuada y estandarizada para estudio histológico.
Otros materiales
Se debe disponer de suero fisiológico frío y adrenalina para aplicarlos en caso de hemorragia.
Como es lógico la sala de exploración debe disponer de monitorización adecuada y de material de reanimación cardiopulmonar.
Técnica de la biopsia
Se introduce el broncoscopio y se sitúa aproximadamente 1-2 cm por encima de la entrada al lóbulo pulmonar que se va a biopsiar. Con ayuda de la fluoroscopia, la pinza de biopsia se introduce en el segmento pulmonar deseado y se avanza con cuidado hasta notar resistencia o hasta estar próximos a la periferia del pulmón, justo por debajo de la pleura. En ese momento se retira 1 o 2 cm la pinza y se abre. Entonces, se avanza a la posición subpleural con una ligera presión, se cierra la pinza mientras el paciente está en espiración y se retira con suavidad. Si el niño está en ventilación mecánica o manual, se interrumpe la ventilación momentáneamente antes de cerrar la pinza.
Tras cada una de las biopsias obtenidas, se realiza un lavado con suero fisiológico (ayuda a la hemostasia y previene la formación de coágulos en el canal de aspiración) y al finalizarlas se comprueba que no existe hemorragia antes de retirar el broncoscopio.
Finalizada la técnica, se valora con fluoroscopia si se ha producido neumotórax. Se debe realizar una radiografía de control a las 2-4 h para descartar neumotórax68.
Si la afectación es focal, la biopsia se efectúa en el segmento o lóbulo pulmonar alterado; si es difusa, se suele realizar en el lóbulo inferior derecho que es la localización más fácil y segura. Es conveniente evitar el lóbulo medio y la língula, porque hay más riesgo de neumotórax. Las biopsias siempre se realizarán en un solo pulmón en cada sesión, para evitar la posibilidad de provocar un neumotórax bilateral.
Existe cierta controversia en cuanto al número de biopsias necesarias. Es razonable obtener de 4 a 6 buenas muestras de tejido (no intentos) para el estudio histológico. Las biopsias se obtienen de diferentes segmentos del lóbulo biopsiado. Si se necesita realizar estudios microbiológicos se obtendrá una muestra más.
Procesamiento y validez de las muestras
Normalmente se obtienen varias muestras de pulmón de 1-2 mm de longitud, que se deben colocar inmediatamente en suero salino o formol, ya que la exposición al aire origina atelectasias y artefactos de desecación81. Para poder desprenderlas de las pinzas nos podemos ayudar, si es necesario, de una aguja de punción intramuscular. Normalmente se colocan en suero salino y posteriormente se añade una cantidad equivalente de formol al 20 %, para enviarlas en formol al 10 % al laboratorio de anatomía patológica.
La destinada a cultivo microbiológico se recoge por separado y se suele enviar en suero salino estéril.
El aspecto macroscópico del tejido obtenido no se correlaciona con su validez histológica. El hecho de que un fragmento flote en la superficie del líquido indica que se ha obtenido tejido que contiene aire, pero no garantiza su validez. Por el contrario, un fragmento de biopsia que se hunde puede contener material útil, ya que un infiltrado patológico extenso en el tejido pulmonar puede llenar o comprimir los espacios aéreos.
Se considera que una biopsia es adecuada cuando contenga, al menos, un fragmento de parénquima pulmonar con alvéolos. Algunos autores consideran que debe contener como mínimo 20 alvéolos. Ocasionalmente una biopsia podría no tener alvéolos y ser útil, por ejemplo, si contiene fragmentos de pared bronquial en la que se aprecien lesiones específicas como granulomas.
En la muestra pueden aparecer artefactos que dificultan el trabajo del patólogo: lo más frecuente y presente hasta cierto grado en casi todas las biopsias es la presencia de atelectasias, que si son muy intensas pueden hacer que no se distingan bien los compartimentos intersticiales y aéreos. También es frecuente la hemorragia intraalveolar relacionada con la propia técnica, y es necesaria la presencia de hemosiderina, además de hematíes, para considerarla significativa81.
Complicaciones de la biopsia transbronquial
La biopsia transbronquial tiene más riesgos que una broncoscopia flexible normal con realización de lavado broncoalveolar.
Las complicaciones específicamente asociadas con la biopsia transbronquial son el neumotórax y la hemorragia.
La complicación más frecuente es la aparición de neumotórax. Con el broncoscopio rígido se han descrito incidencias del 8-10 % en las primeras series, aunque en estudios posteriores evitando realizar la biopsia en el lóbulo medio y en la língula, y ayudándose del control fluoroscópico, ha disminuido su frecuencia67. Con el broncoscopio flexible la incidencia oscila entre menos del 1 y el 3,5 %. La presentación del neumotórax es más frecuente en caso de lesiones bullosas pulmonares, localización periférica de la lesión, ventilación mecánica y en pacientes inmunodeprimidos77-78.
Al realizar la biopsia siempre se produce una mínima hemorragia que es autolimitada. Se han descrito sangrados moderados (> 25 ml) a graves (> 100 ml) entre el 0,6 y el 5,4 % de los pacientes que en algún caso han producido fallecimientos (1-2/1.000 procedimientos)77. Es importante realizar una adecuada selección de los pacientes y no realizar la biopsia en los que tengan riesgo de hemorragia aumentado: inmunodepresión, uremia, linfoma, leucemia, trasplante renal y trastornos de la coagulación.
Las medidas que se deben emplear en caso de hemorragia importante serían las siguientes:
1.Realizar lavados con alícuotas de 5 ml de suero fisiológico frío o de 2-3 ml de suero fisiológico frío con adrenalina (1 ml de adrenalina 1:1.000 diluido en 20 ml de suero fisiológico).
2.Enclavar el broncoscopio en un bronquio segmentario o subsegmentario y aspirar de forma continua durante 3-5 min con lo que las paredes del bronquio, al colapsarse sobre el extremo distal del broncoscopio, suelen detener la hemorragia.
3.Colocar al paciente en decúbito lateral, con el pulmón que sangra en posición declive.
Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica
D. Álvarez Gil (Hospital Infanta Margarita, Cabra, Córdoba); V. Alzina de Aguilar (Clínica Universitaria de Navarra, Pamplona); A. Andrés Martín (Hospital Universitario de Valme, Sevilla); C. Antelo Landeira (Hospital Infantil La Paz, Madrid); O. Asensio de la Cruz (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona); M.I. Barrio Gómez de Agüero (Hospital La Paz, Madrid); J. Blanco González (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid); M. Bermejo Pastor (Hospital Materno-Infantil Badajoz); A. Bonillo Perales (Hospital Torrecárdenas, Almería); M. Bosque García (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona); G. Cabrera Roca (Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria); M. Carrasco Zalvide (Hospital Juan Ramón Jiménez, Huelva); A. Cordón Martínez (Hospital Universitario Carlos Haya Materno-Infantil, Málaga); I. Cortell Aznar (Hospital Universitario La Fe, Valencia); J. Elorz Lambarri (Hospital de Cruces, Baracaldo, Bizkaia); A. Escribano Montaner (Hospital Clínico Universitario, Valencia); J. Figuerola Mulet (Hospital Son Dureta, Palma de Mallorca); D. Gómez-Pastrana Durán (Hospital de Jerez de la Frontera, Cádiz); M.D. Gutiérrez Guerra (Hospital Juan Ramón Jiménez, Huelva); C. Landaluce Ugarte (Hospital de Txagorritxu, Vitoria); S. Liñán Cortés (Hospital Materno-Infantil Vall d'Hebron, Barcelona); C. Luna Paredes (Hospital Universitario 12 de Octubre, Madrid); M. Machuca Contreras (Hospital Virgen del Rocío, Sevilla); C. Martínez Carrasco (Hospital Infantil la Paz, Madrid); A. Martínez Jimeno (Hospital Universitario 12 de Octubre, Madrid); A. Moreno Galdó (Hospital Materno-Infantil Vall d'Hebron, Barcelona); C. Oliva Hernández (Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife); B. Osona Rodríguez de Torres (Hospital Son Dureta, Palma de Mallorca); T. Pascual Sánchez (Hospital de San Joan, Reus, Tarragona); L. Pardos Rocamora (CAP Balaguer, Lleida); J. Pérez Frías (Hospital Universitario Carlos Haya Materno-Infantil, Málaga); G. Pérez Pérez (Hospital Universitario Virgen Macarena, Sevilla); E. Pérez Ruiz (Hospital Universitario Carlos Haya Materno-Infantil, Málaga); C. Reverté Bover (CAP Amposta, Tarragona); A. Salcedo Posadas (Hospital Universitario Niño Jesús, Madrid); J. Sánchez Jiménez (Hospital de San Jaume, Calella, Barcelona); E. Sánchez Sánchez (CAP Premià del Mar, Barcelona); L. Sanz Borrell (Hospital de San Joan, Reus, Tarragona); A. Sequeiros González (Hospital Universitario Niño Jesús, Madrid); J. Sirvent Gómez (Complejo Hospitalario Juan Canalejo, A Coruña); J.M. Tabarés Lezcano (Hospital Cristal-Piñor, Orense); J.M. Torres Simón (Hospital de Palamós, Girona); M.I. Úbeda Sansano (CAP Godella, Valencia); J.R. Villa Asensi (Hospital Universitario Niño Jesús, Madrid).