La supervivencia del cáncer infantil supera en la actualidad el 80-85% en países desarrollados. La población superviviente ha crecido considerablemente, presentando una elevada morbimortalidad secundaria al cáncer o a su tratamiento, representada por un riesgo incrementado de mortalidad prematura, segundos tumores y efectos tardíos (ET), en la esfera física y psicosocial, afectando la calidad de vida. El seguimiento a largo plazo y de por vida en supervivientes de cáncer infantil (SCI) está recomendado para prevenir, detectar y tratar sus problemas de salud. A pesar de los avances producidos, el manejo de los SCI no es adecuado. En este artículo se plantean los retos pendientes, como: 1)Cuantificar la carga real de morbimortalidad, proponiendo nuevas medidas de frecuencia (recuento acumulado medio y carga acumulada), que ofrecen resultados más exactos de la multimorbilidad que presentan, y la utilización de modelos de simulación, para conocer el riesgo individual de eventos. 2)Impacto de factores que determinan el riesgo de presentar ET relacionados con el paciente, tumor, tratamientos, estilo de vida, comorbilidades, genética y envejecimiento. 3)Importancia de la armonización de las guías de seguimiento a largo plazo a nivel mundial, para ofrecer recomendaciones homogéneas, basadas en la evidencia y un plan individualizado de seguimiento. 4)Problemas en la implementación del seguimiento, con diferentes modelos de atención, adaptados al riesgo y a las necesidades del paciente, con especial atención a la transición. Finalmente, se comenta la situación actual de los SCI en España y consideramos las perspectivas futuras que contribuyan a mejorar la salud y la calidad de vida de esta población.
Rates of childhood cancer survival in developed countries have risen to over 80-85%. In consequence, the population of childhood cancer survivors (CCS) has grown considerably. Nevertheless, CCS present a high morbidity and mortality due to cancer or its treatment, with an increased risk of premature mortality, second primary tumors and late side effects, both physical and psychosocial, all of which decrease the quality of life. Long-term follow-up (LTFU) of CCS is recommended to prevent, detect and treat those health problems. Despite the advances achieved, the management of CCS is still not optimal. Among the areas for improvement discussed in this manuscript are: 1)Quantifying the real burden of morbimortality, by implementing new frequency measures (mean cumulative count and cumulative burden), to obtain more accurate assessments, and using simulation models, to determine individual risks. 2)Assessing the impact of risk factors for late side effects, related to the patient, tumor type, treatments, lifestyle, comorbidities, genetics and ageing. 3)Considering the impact of the international harmonisation of long-term follow-up guidelines, to generate homogeneous, evidence-based recommendations and an individualized LTFU. 4)Challenges to LTFU implementation, considering models of care adapted to patient risk and needs, with special attention to the transition to adult-care follow-up. Finally, we comment on the situation of CCS in Spain and consider future prospects for improving the health and quality of life of this population.
El cáncer en la edad pediátrica constituye un grupo heterogéneo de neoplasias malignas que en las últimas décadas ha visto aumentar ostensiblemente su supervivencia global, superando en la actualidad el 80-85% en la mayoría de los países desarrollados1-4. Avances en métodos diagnósticos, técnicas quirúrgicas, quimioterapia intensiva y terapias dirigidas, modalidades de radioterapia, tratamientos de soporte, mayor conocimiento de la biología del tumor, el abordaje multidisciplinar y la creación de grandes grupos colaborativos multi-institucionales e internacionales son, en conjunto, factores fundamentales en el aumento de la supervivencia. La participación en ensayos clínicos se considera hoy el estándar de atención3.
Sin embargo, como enunció D’Angio en 19755, «la cura no es suficiente». La mejora en la supervivencia ha conducido a aumentar considerablemente el número de supervivientes de cáncer infantil (SCI) que llega a la edad adulta4. Décadas de investigación han demostrado que la curación trae consigo, en comparación con la población general, un aumento del riesgo de mortalidad prematura, aparición de segundas neoplasias y una amplia gama de efectos tardíos médicos y psicosociales relacionados con la enfermedad o el tratamiento recibido3,6-10. El reconocimiento de la toxicidad tardía ha llevado a estratificar a los pacientes en grupos de riesgo para cada tipo de cáncer, basándose en características clínicas, biológicas o genéticas, modulando la intensidad y la toxicidad del tratamiento, sin detrimento del porcentaje de curabilidad, con la consiguiente reducción de mortalidad secundaria a efectos tardíos en SCI tratados más recientemente10,11, y a un cambio en los modelos de riesgo para determinados problemas crónicos2. El seguimiento a largo plazo de por vida se considera fundamental y está indicado en todos los SCI en orden a prevenir, detectar precozmente los problemas y tratarlos o realizar intervenciones para prevenirlos o mejorarlos12.
A día de hoy, la producción científica relacionada con SCI en un amplio rango de áreas de investigación ha aumentado en progresión geométrica, haciendo necesaria la elaboración de resúmenes basados en la evidencia científica para procesar información de calidad, mejorando de forma significativa el manejo de los supervivientes. Aun así, existen retos actuales que queremos considerar en este artículo, como son: conocer la magnitud real de morbimortalidad en largos SCI, el impacto de los factores que determinan el riesgo individual de eventos tardíos, la importancia de la armonización de las guías de seguimiento a largo plazo y los problemas en su implementación. Finalmente, se comentará brevemente la situación actual de España en cuanto al seguimiento de SCI y las perspectivas futuras de esta población.
Carga de morbimortalidad en largos supervivientes de cáncer infantilLos efectos tardíos comunes del cáncer pediátrico abarcan varias esferas que incluyen el crecimiento y el desarrollo, la función de órganos y sistemas, segundas neoplasias, mortalidad prematura y problemas psicosociales3,8,10,13. Esto impacta en la salud física, cognitiva y emocional e influye en la adecuada participación en los roles en el hogar, la escuela, el trabajo y la comunidad14, afectando la calidad de vida relacionada con la salud. Globalmente se estima que entre un 60-90% de los SCI desarrollan uno o más problemas crónicos de salud y entre un 20-80% sufren complicaciones graves o amenazantes para la vida6,15. La patología descrita en SCI se clasifica tradicionalmente en:
- a)
Mortalidad prematura: Los SCI presentan mayor riesgo comparado con la población general9,10, en su mayor parte debido a segundas neoplasias, complicaciones de efectos tardíos y del envejecimiento acelerado descrito en supervivientes de cáncer16,17.
- b)
Problemas físicos. Excelentes revisiones publicadas han estudiado déficits neurológicos y neurocognitivos10,13,18, endocrino-metabólicos10,19, cardiovasculares10,20,21, digestivos10,22, respiratorios10,21, musculoesqueléticos10,23, renales10,22, reproductivos10,24, sensoriales10,25 y segundos tumores10,26. La descripción detallada de estos problemas no se abordará debido a la limitación en la extensión del artículo, por lo que remitimos al lector a la bibliografía indicada.
- c)
Problemas psicosociales. A menudo se combinan y aparecen con más frecuencia en aquellos supervivientes con mayor carga de problemas orgánicos. Así, y aunque el 80-90% de SCI dicen sentirse bien13, los problemas mentales y psicológicos son más prevalentes que en hermanos y población general10,13. Se han descrito distrés psicológico13, ansiedad27, depresión28,29, ideas de suicidio28, somatización y estrés postraumático13,27. Otros muestran actitudes positivas de crecimiento postraumático y resiliencia27. Por su parte, en la esfera social, bien por la presencia de problemas neurocognitivos, otros efectos tardíos graves o la propia experiencia de cáncer, muestran frecuentemente dificultades de relación con sus iguales, fracaso escolar, limitado acceso a la universidad, que se traduce en problemas vocacionales y desempleo y, como consecuencia, menor independencia del hogar, menos recursos económicos, dificultades en la relación de pareja, se dan menos matrimonios y tienen menor descendencia13,27,28.
Teniendo en cuenta la diversidad de patología asociada, conocer la magnitud real de la carga de morbimortalidad en SCI supone un auténtico reto para clínicos e investigadores. Desde hace décadas se ha acumulado una abundante producción científica en torno a este tema, y la variabilidad en los datos obedece a la amplia heterogeneidad metodológica en cuanto a población de estudio (edad, tamaño muestral, representatividad, tipo de cáncer, base hospitalaria o poblacional, tiempo de seguimiento), al tipo de diseño (transversales, casos y controles, cohortes, ensayos clínicos, revisiones sistemáticas), a la fuente de obtención de datos (registros poblacionales, autoinformes de pacientes, valoraciones clínicas), al tipo de evento a estudiar (mortalidad, efecto adverso) y a la medida del evento (supervivencia, prevalencia, incidencia acumulada, riesgos), con limitaciones por sesgos de selección e información que han influido en la fiabilidad de los resultados y en la comparabilidad entre estudios.
Igualmente, la diversidad de efectos comunicados precisa de un sistema de clasificación y gradación que utilice un lenguaje común en la evaluación de los mismos. El Instituto Nacional del Cáncer elaboró en 2016 los «Criterios de Terminología Común para Eventos Adversos» (Common Terminology Criteria for Adverse Events [CTCAE]), estableciendo 168 problemas crónicos específicos con 5 categorías de gravedad: grado1, leve; grado2, moderada; grado3, grave/incapacitante; grado4, potencialmente mortal, y grado5, mortal. Dado que estas pautas no evaluaban adecuadamente los eventos adversos que afectan al crecimiento y al desarrollo físico e intelectual de SCI, Hudson et al.30 adaptaron la clasificación y la gravedad de eventos de salud a largo plazo para hacerla aplicable a SCI, modificando algunos de los criterios CTCAEv4.03 existentes e introduciendo otros no incluidos o no abordados de manera óptima, resultando la adaptación en 208 problemas tardíos médicos o neuropsicológicos, sin incluir segundas neoplasias.
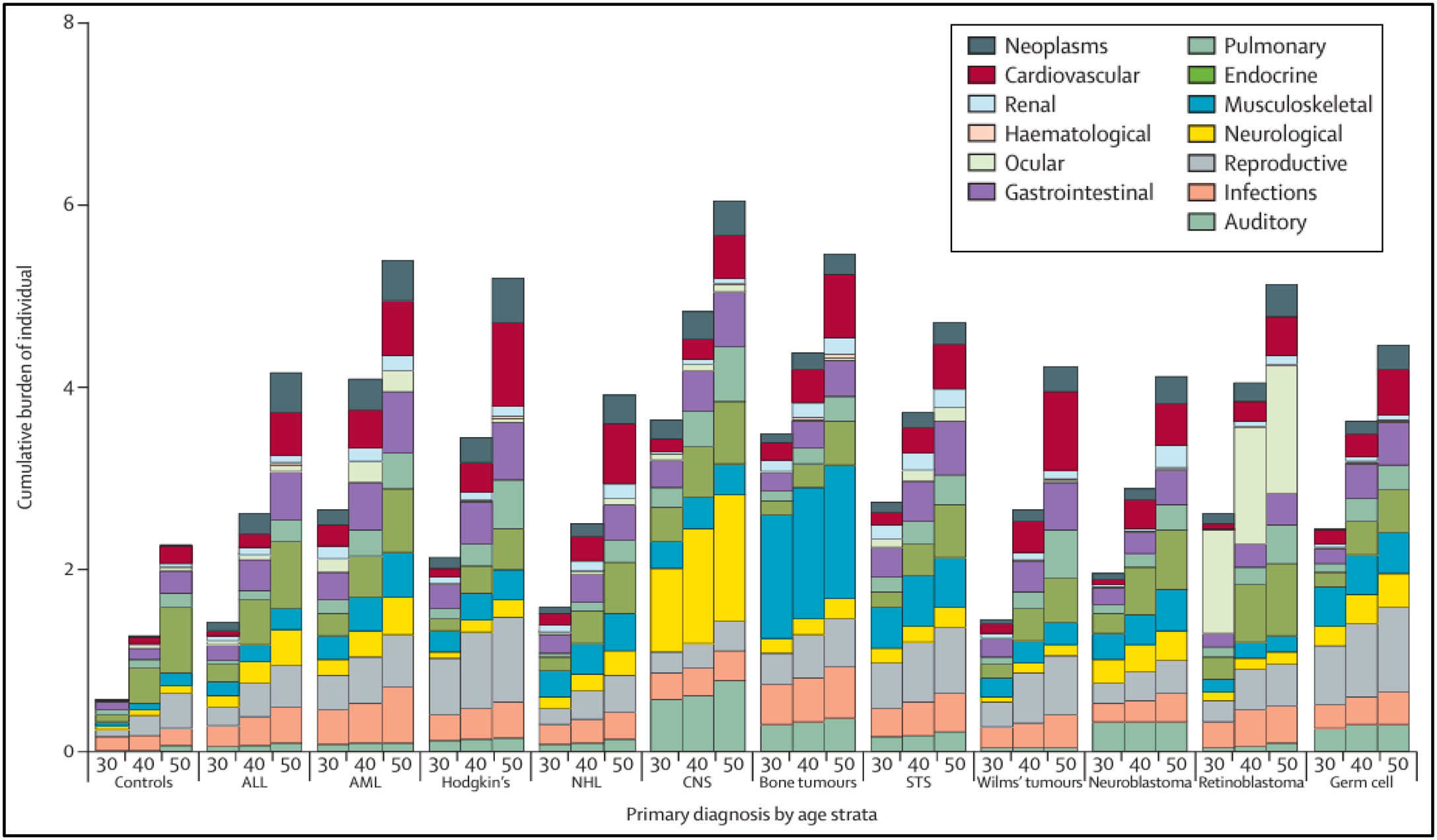
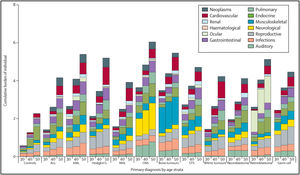
Por otra parte, las medidas tradicionales, como prevalencia o incidencia acumulada, utilizadas con frecuencia para estimar la magnitud de eventos, solo realizan recuentos simples o proporciones observadas hasta el primer evento7,14, infraestimando la magnitud. El verdadero precio de la curación se refleja en la carga acumulativa de la enfermedad, o la morbilidad total por enfermedad experimentada, después de tener en cuenta la aparición y la gravedad de múltiples afecciones médicas y eventos recurrentes en el mismo paciente, reconocidos con el término «multimorbilidad»31. En función de los determinantes (factores de riesgo del paciente, tumor, estilo de vida…), la multimorbilidad sigue patrones (agrupación de efectos adversos que se combinan entre sí) que pueden cambiar a lo largo del seguimiento. Además, a partir de un evento conocido se podría predecir la aparición del siguiente31. En este sentido, la utilización de nuevas medidas, como el recuento acumulado medio y la carga acumulada (número de eventos, independientemente del tipo), permite un conocimiento más preciso de la multimorbilidad, al describir tanto la gravedad como la diversidad de problemas de salud. Además, estas medidas, a diferencia de las tradicionales, tienen en cuenta los eventos que suponen un riesgo competitivo (evento que modifica la capacidad de observar el evento de interés), ofreciendo resultados más exactos de la ocurrencia del problema7,14. La figura 1 muestra cómo la distribución de la carga acumulada de eventos de grado 3-5 de SCI, significativamente mayor en comparación con controles comunitarios, aumenta en general con la edad y según el tipo de cáncer7.
Distribución de la carga acumulada (grado 3-5) en supervivientes de cáncer infantil de la cohorte SJLIFE comparada con controles comunitarios, por grupo diagnóstico y edad.
ALL: leucemia linfoblástica aguda; AML: leucemia mieloide Aguda; CNS: tumores de sistema nervioso central; NHL: linfoma no Hodgkin; STS: sarcomas de tejidos blandos; Tumores óseos: osteosarcoma y sarcoma de Ewing.
Tomado de Bhakta et al.7.
Otro avance importante lo supone la utilización de modelos de simulación para conocer la probabilidad de riesgo individual de eventos según las características del superviviente (edad, exposición, seguimiento, comorbilidades), extrapolando los datos obtenidos más allá del periodo de observación, con impacto en el conocimiento del riesgo de mortalidad, esperanza de vida, estrategias de cribado y recomendaciones de seguimiento14.
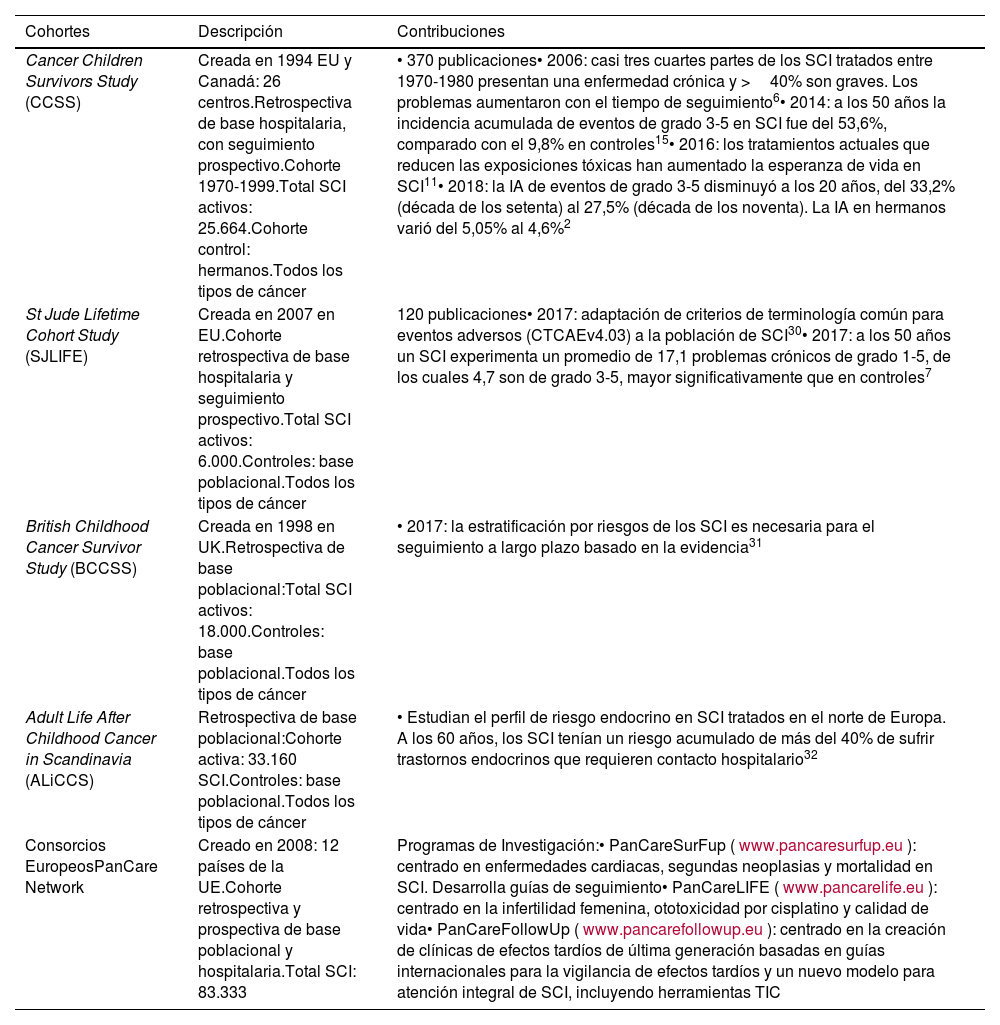
Además, el establecimiento de grandes cohortes de SCI en Europa y en América del Norte en los últimos 25años ha sido fundamental para obtener datos sobre la carga de morbilidad posterior al tratamiento8. En la tabla 1 se exponen algunas de ellas, que destacan por el número de pacientes reclutados y su contribución al conocimiento de los efectos adversos en SCI2,6,8,11,15,30-33.
Grandes cohortes de SCI y su contribución al conocimiento de efectos tardíos
| Cohortes | Descripción | Contribuciones |
|---|---|---|
| Cancer Children Survivors Study (CCSS) | Creada en 1994 EU y Canadá: 26 centros.Retrospectiva de base hospitalaria, con seguimiento prospectivo.Cohorte 1970-1999.Total SCI activos: 25.664.Cohorte control: hermanos.Todos los tipos de cáncer | • 370 publicaciones• 2006: casi tres cuartes partes de los SCI tratados entre 1970-1980 presentan una enfermedad crónica y >40% son graves. Los problemas aumentaron con el tiempo de seguimiento6• 2014: a los 50 años la incidencia acumulada de eventos de grado 3-5 en SCI fue del 53,6%, comparado con el 9,8% en controles15• 2016: los tratamientos actuales que reducen las exposiciones tóxicas han aumentado la esperanza de vida en SCI11• 2018: la IA de eventos de grado 3-5 disminuyó a los 20 años, del 33,2% (década de los setenta) al 27,5% (década de los noventa). La IA en hermanos varió del 5,05% al 4,6%2 |
| St Jude Lifetime Cohort Study (SJLIFE) | Creada en 2007 en EU.Cohorte retrospectiva de base hospitalaria y seguimiento prospectivo.Total SCI activos: 6.000.Controles: base poblacional.Todos los tipos de cáncer | 120 publicaciones• 2017: adaptación de criterios de terminología común para eventos adversos (CTCAEv4.03) a la población de SCI30• 2017: a los 50 años un SCI experimenta un promedio de 17,1 problemas crónicos de grado 1-5, de los cuales 4,7 son de grado 3-5, mayor significativamente que en controles7 |
| British Childhood Cancer Survivor Study (BCCSS) | Creada en 1998 en UK.Retrospectiva de base poblacional:Total SCI activos: 18.000.Controles: base poblacional.Todos los tipos de cáncer | • 2017: la estratificación por riesgos de los SCI es necesaria para el seguimiento a largo plazo basado en la evidencia31 |
| Adult Life After Childhood Cancer in Scandinavia (ALiCCS) | Retrospectiva de base poblacional:Cohorte activa: 33.160 SCI.Controles: base poblacional.Todos los tipos de cáncer | • Estudian el perfil de riesgo endocrino en SCI tratados en el norte de Europa. A los 60 años, los SCI tenían un riesgo acumulado de más del 40% de sufrir trastornos endocrinos que requieren contacto hospitalario32 |
| Consorcios EuropeosPanCare Network | Creado en 2008: 12 países de la UE.Cohorte retrospectiva y prospectiva de base poblacional y hospitalaria.Total SCI: 83.333 | Programas de Investigación:• PanCareSurFup (www.pancaresurfup.eu): centrado en enfermedades cardiacas, segundas neoplasias y mortalidad en SCI. Desarrolla guías de seguimiento• PanCareLIFE (www.pancarelife.eu): centrado en la infertilidad femenina, ototoxicidad por cisplatino y calidad de vida• PanCareFollowUp (www.pancarefollowup.eu): centrado en la creación de clínicas de efectos tardíos de última generación basadas en guías internacionales para la vigilancia de efectos tardíos y un nuevo modelo para atención integral de SCI, incluyendo herramientas TIC |
EU: Estados Unidos de Norteamérica; IA: incidencia acumulada; SCI: superviviente de cáncer infantil; TIC: tecnologías de la información y las comunicaciones; UE: Unión Europea; UK: Reino Unido.
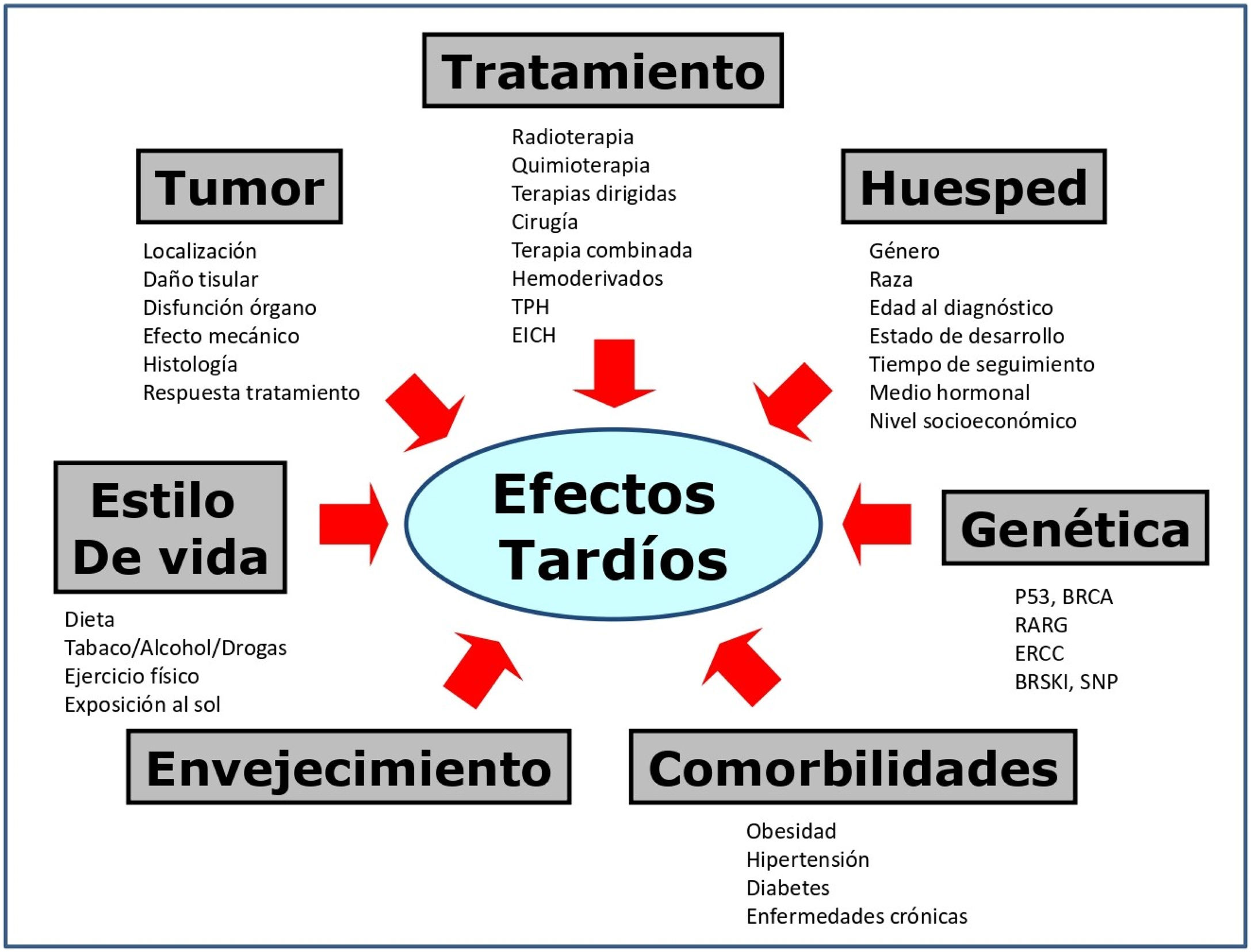
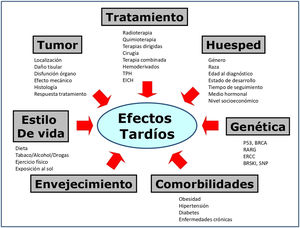
Aunque clásicamente los efectos tardíos se han relacionado con el cáncer y su tratamiento, diversos factores confluyen en el riesgo de presentarlos10,16. La figura 2 expone los más investigados. Las tablas 2 y 3 recogen los riesgos derivados del uso de radioterapia y quimioterapia10,34, incluyendo las nuevas terapias dirigidas, que suponen un tratamiento más eficaz y menos tóxico, mejorando la supervivencia en distintas neoplasias infantiles16. Aun así, se recomienda un seguimiento prolongado para determinar si las terapias emergentes están asociadas con mejores resultados a largo plazo16.
Factores que influyen en el desarrollo de efectos tardíos en SCI.
Tratamiento.Cirugía: incluye amputaciones y procedimientos de salvamento de extremidades; cistectomía; ooforectomía u orquiectomía; resección pulmonar; procedimientos neuroquirúrgicos, etc. Cicatrices y deformidades. Radioterapia: el daño depende de dosis total, dosis fracción, volumen de órgano o tejido irradiado, tipo de técnica de radioterapia (la RT de intensidad modulada y protonterapia reducen los efectos adversos). A menor edad, más daño3. Quimioterapia: depende del agente, intensidad de dosis, dosis acumulativa, esquema. Tratamiento multimodal: más riesgo. TPH: trasplante de progenitores hematopoyéticos y enfermedad de injerto contra huésped (EICH). Ambas presentan múltiples eventos adversos.
Huésped. Edad: <1 año y >10 años, peor pronóstico, excepto en neuroblastomas10 (mejor pronóstico en <1 año). Género, raza y etnia: modifican el riesgo en determinados tumores3. Tiempo de seguimiento: a mayor seguimiento, mayor riesgo. Un año adicional supone un riesgo adicional de desarrollar eventos adversos31. Medio hormonal y estado puberal: influyen en la susceptibilidad a quimioterapia y radioterapia. NSE bajo se asocia con peor superviviencia3.
Tumor. Todos los factores descritos impactan en el riesgo de presentar efectos adversos.
Genética. Segundos tumores: mutaciones relacionadas14,26-27: BRCA (mama), P53 (Li Fraumeni). Miocardiopatía: mutaciones en RARG, genes transportadores de drogas y enzimas responsables de metabolitos cardiotóxicos21. Ototoxicidad: mutaciones en genes que intervienen en la farmacocinética de cisplatino (ERCC)35. Salud reproductiva: variantes del gen BRSKI relacionado con menopausia prematura. Polimorfismos de un solo nucleótido (SNP) del receptor de andrógenos en testículos se asocian a oligospermia y azoospermia14.
Envejecimiento acelerado. Los SCI presentan un envejecimiento acelerado que por sí mismo condiciona la aparición de problemas de salud. Se ha descrito que los SCI a una edad media de 33 años tenían tasas de fragilidad más altas que las observadas en la población general a los 70años16.
Comorbilidades. Obesidad, hipertensión, síndrome metabólico, diabetes, enfermedades crónicas, aumentan el riesgo de efectos tardíos.
Estilo de vida. Estudios de intervención han mostrado que el ejercicio físico se asocia a menor morbilidad en SCI31. El consumo de tóxicos (alcohol, tabaco, drogas ilícitas) se asocia a mayor morbilidad44.
Efectos tardíos comunes relacionados con la quimioterapia
| Agente | Toxicidad |
|---|---|
| Antraciclinas: doxorubicina, daunorubicina, epirubicina, mitoxantrona | Cardiovascular: disfunción sistólica del VI/insuficiencia cardiaca, cardiopatía isquémica, enfermedad pericárdica, arritmias, enfermedad valvular, disfunción vascular periférica y ACV.Segundas neoplasias: cáncer de mama, sarcomas |
| Alquilantes: ciclofosfamida, ifosfamida, procarbazina, temozolamida, dacarbazina, busulfán | Reproducción: oligospermia o azoospermia en varones, alteración función y reserva ovárica, insuficiencia ovárica prematura. disfunción células de Leydig (procarbazina, temozolamida, dacarbazina, busulfán)Renal/vesical: daño glomerular y tubular, síndrome de Fanconi, raquitismo hipofosfatémico, cistitis hemorrágica (ciclofosfamida e ifosfamida)Segundas neoplasias: ciclofosfamida (óseas y tejidos blandos, leucemia mieloide aguda, cáncer de mama), procarbazina (gastrointestinal), dacarbazina y busulfán (síndrome mielodisplásico y leucemia mieloide)Cardiovascular: ACV, disfunción sistólica VI/fallo cardiaco, enfermedad pericárdica, arritmiaRespiratorio: disfunción pulmonar subclínica, neumonitis intersticial, fibrosis pulmonar, enfermedad restrictiva pulmonar, enfermedad obstructiva pulmonar (busulfán)Ocular: cataratas (busulfán)Endocrino: hipotiroidismo primario (busulfán) |
| Metales pesados: cisplatino, carboplatino | Neurológica: neuropatía periférica sensorialAudición: pérdida de audición neurosensorial y conductiva, tinnitus, vértigoRenal/genitourinario: daño glomerular y tubular, síndrome de Fanconi, raquitismo hipofosfatémico. cistitis hemorrágica, fibrosis vesical, reflujo vesicoureteral, hidronefrosis, alteración vaciamiento vesicalReproductiva: insuficiencia ovárica prematura, fallo célula germinal en varones (oligospermia y azoospermia)Cardiovascular: ACV, arritmias, enfermedad vascular e isquemia cardiaca |
| Alcaloides: vincristina, vinblastina | Neurológica: neuropatía periférica sensorial o motoraCardiaco: isquemia cardiaca |
| Antimetabolitos: metotrexato, citarabina | Neurológica: leucoencefalopatía, cefaleas, convulsiones, déficits sensoriales, déficits neurocognitivos (función ejecutiva, memoria, atención, velocidad de procesamiento), déficit de aprendizaje, disminución CI, cambios en comportamientoHepática: disfunciónRenal: insuficiencia renal, hipertensiónHueso: disminución densidad mineral ósea (metotrexato), osteonecrosisCardiaca: enfermedad pericárdica, arritmias, isquemia y fallo cardiaco (citarabina) |
| Mercaptopurina, tioguanina | Hepática: disfunción hepática, fibrosis secundaria a enfermedad venooclusiva |
| Corticoides: prednisona, dexametasona | Hueso: disminución densidad mineral ósea, necrosis avascular, crecimientoOcular: cataratasMetabólico: obesidad, síndrome metabólico |
| Nitrosureas: carmustina, lomustina | Respiratorio: disfunción pulmonar subclínica, neumonitis intersticial, fibrosis pulmonar, enfermedad restrictiva pulmonar, enfermedad obstructiva pulmonarReproductivo: insuficiencia ovárica prematura, fallo célula germinal en varones, disfunción células de LeydigSegundas neoplasias: síndrome mielodisplásico y leucemia mieloide aguda |
| Bleomicina | Respiratorio: disfunción pulmonar subclínica, neumonitis intersticial, fibrosis pulmonar, enfermedad restrictiva pulmonar, enfermedad obstructiva pulmonar, síndrome de distrés respiratorio |
| Inhibidores topoisomerasa: etopósido, tenipósido | Segundas neoplasias: síndrome mielodisplásico y leucemia mieloide aguda |
| Inhibidores de tirosín-kinasa: imatinib, sorafenib, sunitinib | Endocrino: crecimiento, hipotiroidismo primarioCardiovascular: disfunción sistólica VI/fallo cardiaco, arritmias, isquemia, ACV, enfermedad vascular periférica |
| Inhibidores del punto de control inmunitario: nivolumab, ipilimumab | Endocrino: hipofisitis inmune con alteración de pituitaria anterior, tiroiditis autoinmune, crecimientoCardiaca: miocarditis y fallo cardiaco |
| Inhibidores VEGF; bevacizumab | Cardiovascular: enfermedad vascular, isquemia cardiaca, ACV, cardiomiopatía/fallo cardiaco |
| Inhibidores proteasoma: bortezomib | Cardiaco: fallo cardiaco, arritmias e isquemia cardiaca |
La toxicidad cardiaca a antraciclinas depende de la dosis acumulada. Mayor riesgo si >250mg/m2. Mitoxantrona: 4 veces más riesgo que la doxorubicina. Daunoblastina y epiadriamicina, similar riesgo a doxorubicina. La toxicidad testicular por ciclofosfamida depende de dosis acumulada >7,5g/m2, con fallo de célula germinal de testículo (oligospermia o azoospermia). Toxicidad para ifosfamida: dosis acumulada >60g/m2. Prepuberales menos riesgo. La toxicidad auditiva depende de dosis acumulada de cisplatino >400mg/m2. Menos riesgo en infusiones más prolongadas o fraccionadas. Alteraciones dentales: cualquier quimioterapia o radioterapia sobre la cavidad oral. En trasplante de progenitores hematopoyéticos: toxicidad relacionada con pautas de acondicionamiento: alteraciones renales, hepáticas, cutáneas, infecciosas, crecimiento, endocrinas, cardiovasculares, respiratorias y segundas neoplasias.
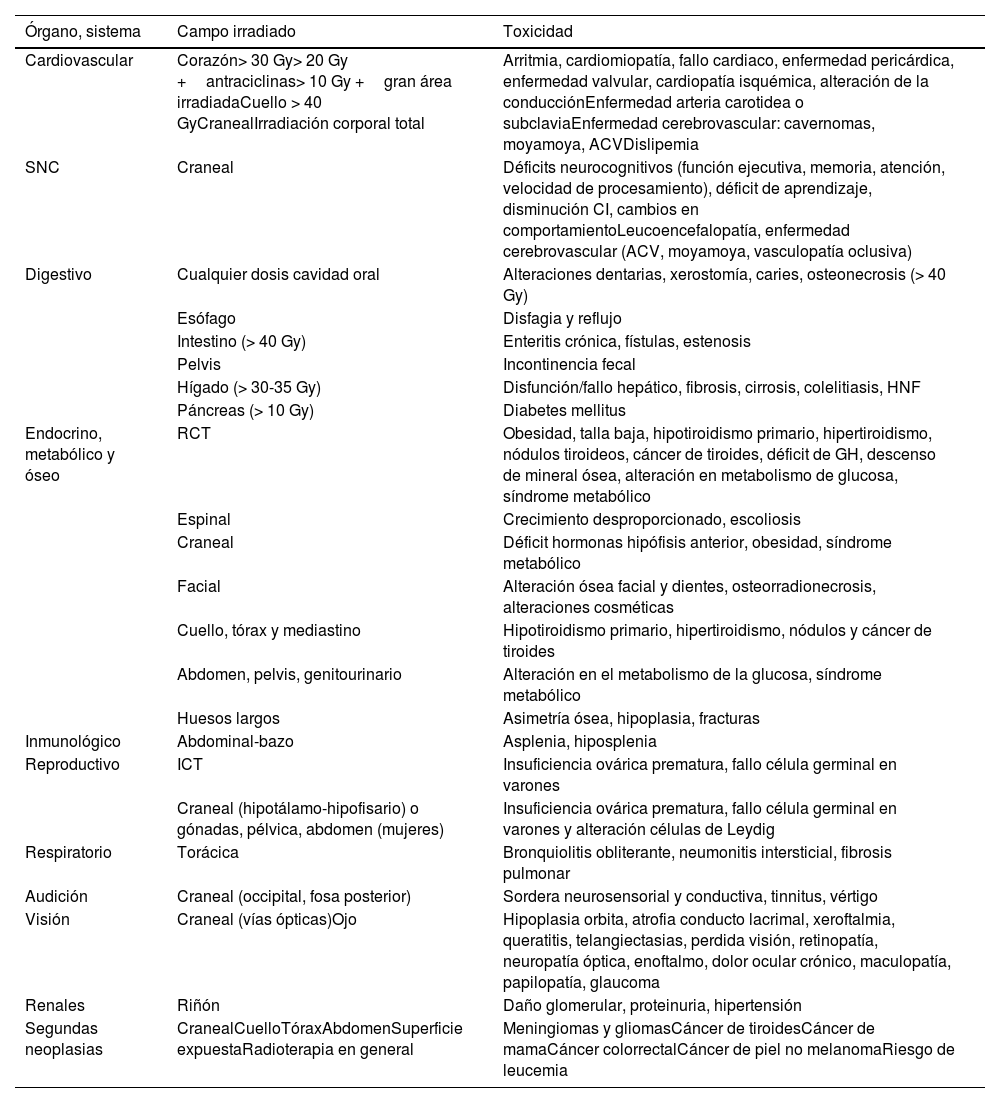
Efectos tardíos comunes relacionados con la radioterapia
| Órgano, sistema | Campo irradiado | Toxicidad |
|---|---|---|
| Cardiovascular | Corazón> 30 Gy> 20 Gy +antraciclinas> 10 Gy +gran área irradiadaCuello > 40 GyCranealIrradiación corporal total | Arritmia, cardiomiopatía, fallo cardiaco, enfermedad pericárdica, enfermedad valvular, cardiopatía isquémica, alteración de la conducciónEnfermedad arteria carotidea o subclaviaEnfermedad cerebrovascular: cavernomas, moyamoya, ACVDislipemia |
| SNC | Craneal | Déficits neurocognitivos (función ejecutiva, memoria, atención, velocidad de procesamiento), déficit de aprendizaje, disminución CI, cambios en comportamientoLeucoencefalopatía, enfermedad cerebrovascular (ACV, moyamoya, vasculopatía oclusiva) |
| Digestivo | Cualquier dosis cavidad oral | Alteraciones dentarias, xerostomía, caries, osteonecrosis (> 40 Gy) |
| Esófago | Disfagia y reflujo | |
| Intestino (> 40 Gy) | Enteritis crónica, fístulas, estenosis | |
| Pelvis | Incontinencia fecal | |
| Hígado (> 30-35 Gy) | Disfunción/fallo hepático, fibrosis, cirrosis, colelitiasis, HNF | |
| Páncreas (> 10 Gy) | Diabetes mellitus | |
| Endocrino, metabólico y óseo | RCT | Obesidad, talla baja, hipotiroidismo primario, hipertiroidismo, nódulos tiroideos, cáncer de tiroides, déficit de GH, descenso de mineral ósea, alteración en metabolismo de glucosa, síndrome metabólico |
| Espinal | Crecimiento desproporcionado, escoliosis | |
| Craneal | Déficit hormonas hipófisis anterior, obesidad, síndrome metabólico | |
| Facial | Alteración ósea facial y dientes, osteorradionecrosis, alteraciones cosméticas | |
| Cuello, tórax y mediastino | Hipotiroidismo primario, hipertiroidismo, nódulos y cáncer de tiroides | |
| Abdomen, pelvis, genitourinario | Alteración en el metabolismo de la glucosa, síndrome metabólico | |
| Huesos largos | Asimetría ósea, hipoplasia, fracturas | |
| Inmunológico | Abdominal-bazo | Asplenia, hiposplenia |
| Reproductivo | ICT | Insuficiencia ovárica prematura, fallo célula germinal en varones |
| Craneal (hipotálamo-hipofisario) o gónadas, pélvica, abdomen (mujeres) | Insuficiencia ovárica prematura, fallo célula germinal en varones y alteración células de Leydig | |
| Respiratorio | Torácica | Bronquiolitis obliterante, neumonitis intersticial, fibrosis pulmonar |
| Audición | Craneal (occipital, fosa posterior) | Sordera neurosensorial y conductiva, tinnitus, vértigo |
| Visión | Craneal (vías ópticas)Ojo | Hipoplasia orbita, atrofia conducto lacrimal, xeroftalmia, queratitis, telangiectasias, perdida visión, retinopatía, neuropatía óptica, enoftalmo, dolor ocular crónico, maculopatía, papilopatía, glaucoma |
| Renales | Riñón | Daño glomerular, proteinuria, hipertensión |
| Segundas neoplasias | CranealCuelloTóraxAbdomenSuperficie expuestaRadioterapia en general | Meningiomas y gliomasCáncer de tiroidesCáncer de mamaCáncer colorrectalCáncer de piel no melanomaRiesgo de leucemia |
ACV: accidente vasculocerebral; CI: cociente intelectual; HNF: hiperplasia nodular focal; RCT: radioterapia corporal total.
Déficit hormonas Hipófisis anterior incluye: GH, FSH/LF, TSH, ACTH, prolactina, pubertad precoz central.
El efecto de la cirugía y de la quimioterapia puede ser aditivo a la radioterapia craneal.
El papel de la genética en la aparición de efectos adversos surge como consecuencia de la variabilidad interindividual observada en el riesgo ante exposiciones similares14. Los estudios se han centrado sobre todo en la miocardiopatía relacionada con antraciclinas21, la ototoxicidad relacionada con el cisplatino35, la salud reproductiva14, el deterioro neuropsicológico14 y las segundas neoplasias14,26,27. La disponibilidad del análisis genómico completo (GWAS) abre la posibilidad del estudio de polimorfismos de un solo nucleótido, mutaciones de genes relacionados con ciertas neoplasias, comprometidos con vías de reparación del ADN o con la farmacocinética de quimioterápicos. Esto constituye un nuevo desafío para el futuro próximo que proporcionará información válida que repercutirá en la toma de decisiones sobre tratamientos de primera línea y en la estratificación de riesgos en el seguimiento. Se necesita más información acerca de si la susceptibilidad genética es aditiva a los riesgos relacionados con la exposición al tratamiento o multiplicativa, y si los mecanismos fisiopatológicos que motivan los efectos tardíos en SCI son diferentes a los observados en la población general16.
El daño inducido por la quimioterapia y la radioterapia sobre células normales no malignas puede explicar el envejecimiento prematuro descrito en SCI, teniendo un papel a considerar en el desarrollo de los efectos tardíos16. Los mecanismos moleculares del envejecimiento fisiológico en la población general pueden verse potenciados en los SCI (senescencia celular, desgaste de telómeros, cambios en patrones de metilación del ADN, acumulación de mutaciones del ADN somático y disfunción mitocondrial)16,17. Esto conduce a una situación de «fragilidad», caracterizada por una disminución de la reserva fisiológica y deterioro en la función de órganos y sistemas, confiriendo mayor vulnerabilidad al estrés, menor rendimiento físico, fatiga y mayor riesgo de mortalidad prematura en SCI en relación a la población general17.
El reto actual lo supone el poder predecir el riesgo individual de presentar problemas adversos en función de la combinación de factores predisponentes.
Importancia de la armonización de las guías de seguimiento a largo plazoLa guías de seguimiento a largo plazo para SCI surgen de la necesidad de resumir la información más relevante, basada en la mejor evidencia científica disponible, sobre los riesgos para la salud derivados del cáncer y su tratamiento y orientar tanto a SCI como a profesionales sobre cómo iniciar una vigilancia proactiva y realizar intervenciones que optimicen su calidad y su esperanza de vida12,36. El reto actual y futuro una vez elaboradas está en difundirlas, implementarlas, evaluar su impacto en la calidad de la atención y resultados en salud y revisarlas periódicamente35. Las guías de práctica clínica (GPC) ofrecen una atención eficiente y uniforme, evitando la variabilidad, disminuyendo costos e incorporando la opinión de los pacientes. Así, en las dos últimas décadas varios grupos norteamericanos y europeos han desarrollado GPC para SCI37-40, cuyas recomendaciones están basadas en el riesgo32, aunque difieren en determinados aspectos. Las norteamericanas suelen abordar los efectos tardíos en relación con la exposición terapéutica y las europeas en relación con el órgano o sistema afectado. Para mejorar la variabilidad, en 2010 se inicia una colaboración mundial para armonizar las GPC de seguimiento de SCI y adultos jóvenes, y surge el Grupo Internacional para la Armonización de Guías (International Guideline Harmonization Group [IGHG]; www.ighg.org) sobre efectos tardíos del cáncer infantil41 para la vigilancia de SCI y adultos jóvenes de todo el mundo, proporcionando recomendaciones, sobre qué pacientes necesitan vigilancia, qué modalidades de vigilancia, cuándo se inicia, con qué frecuencia y qué se debe hacer cuando se identifican problemas, considerando diferentes entornos de atención médica y recursos disponibles. El IGHG constituye un grupo multidisciplinar de expertos en efectos tardíos (oncología pediátrica y radioterápica, subespecialidades médicas y pediátricas, atención primaria, enfermería, defensores de pacientes) y otros expertos en la elaboración de GPC. En la página web aparecen publicadas las recomendaciones de vigilancia disponibles que se exponen en la tabla 4.
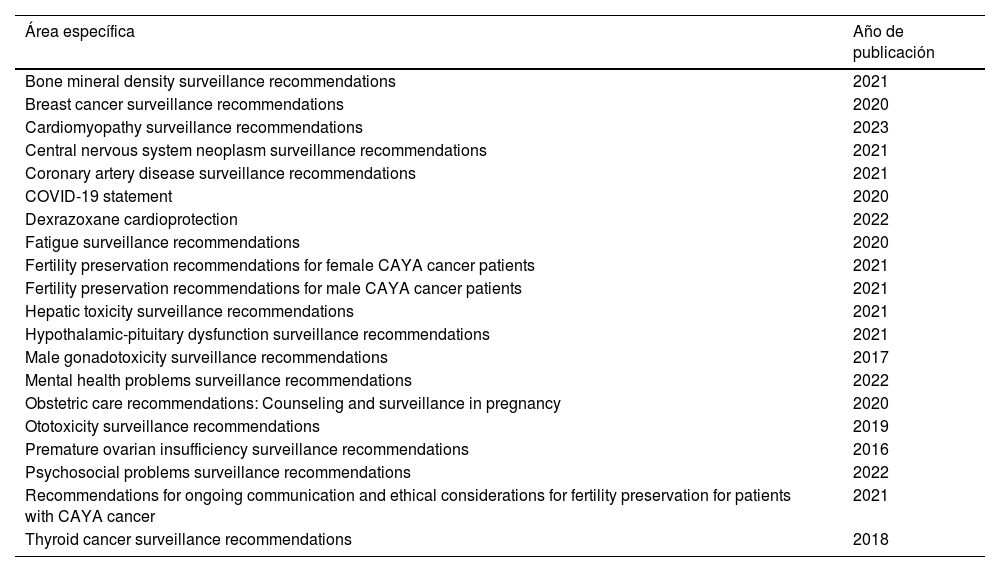
Recomendaciones de vigilancia disponibles del International Guideline Harmonization Group (IGHG), www.ighg.org
| Área específica | Año de publicación |
|---|---|
| Bone mineral density surveillance recommendations | 2021 |
| Breast cancer surveillance recommendations | 2020 |
| Cardiomyopathy surveillance recommendations | 2023 |
| Central nervous system neoplasm surveillance recommendations | 2021 |
| Coronary artery disease surveillance recommendations | 2021 |
| COVID-19 statement | 2020 |
| Dexrazoxane cardioprotection | 2022 |
| Fatigue surveillance recommendations | 2020 |
| Fertility preservation recommendations for female CAYA cancer patients | 2021 |
| Fertility preservation recommendations for male CAYA cancer patients | 2021 |
| Hepatic toxicity surveillance recommendations | 2021 |
| Hypothalamic-pituitary dysfunction surveillance recommendations | 2021 |
| Male gonadotoxicity surveillance recommendations | 2017 |
| Mental health problems surveillance recommendations | 2022 |
| Obstetric care recommendations: Counseling and surveillance in pregnancy | 2020 |
| Ototoxicity surveillance recommendations | 2019 |
| Premature ovarian insufficiency surveillance recommendations | 2016 |
| Psychosocial problems surveillance recommendations | 2022 |
| Recommendations for ongoing communication and ethical considerations for fertility preservation for patients with CAYA cancer | 2021 |
| Thyroid cancer surveillance recommendations | 2018 |
En Norteamérica, los miembros de las GPC del Children's Oncology Group (COG-LTFUv5.0)37 están muy comprometidos con la IGHG. Ofrecen recomendaciones a SCI basadas en el riesgo, proporcionan material educativo para pacientes y han desarrollado el Passport for care, documento de seguimiento individualizado para pacientes. En Europa, el seguimiento de SCI ha estado liderado por el consorcio PanCare (www.pancare.eu)42, que mantiene proyectos de investigación financiados por la Unión Europea: el PanCareSurFup (www.pancaresurfup.eu), para la elaboración de recomendaciones de la IGHG y la transición a adultos; el PanCareLIFE (www.pancarelife.eu), centrado en la infertilidad femenina, la ototoxicidad por cisplatino y la calidad de vida, y el PanCareFollowUp (www.pancarefollowup.eu), que trabaja en la elaboración de guías en desarrollo de la IGHG y diseño del Sur-Pass o Pasaporte del superviviente, con resumen del tratamiento y recomendaciones individuales.
La evaluación periódica del impacto de las GPC constituye un instrumento para garantizar la atención adecuada mediante indicadores de calidad no suficientemente desarrollados para SCI, suponiendo un reto más en el seguimiento de estos pacientes, haciendo énfasis en la atención centrada en el paciente, teniendo en cuenta sus preferencias, la satisfacción y los valores, a la vez que supone un compromiso de responsabilidad personal en su propio cuidado36.
Problemas en la implementación del seguimiento: modelos de atenciónDado el número creciente de supervivientes, uno de los mayores retos actuales en su atención lo supone la implementación del seguimiento a largo plazo, llevando a la práctica diaria las recomendaciones dictadas por las GPC basadas en la evidencia científica. La magnitud del problema compromete no solo a los oncólogos médicos o pediátricos, médicos de atención primaria, personal de enfermería, personal no sanitario, cuidadores y pacientes cuya coordinación es fundamental, sino que precisa de una infraestructura y organización que sea capaz de proporcionar el cuidado y las necesidades individuales de los supervivientes, y que igualmente se sustente en la evidencia científica. La realidad es que muchos SCI no reciben la atención adecuada43.
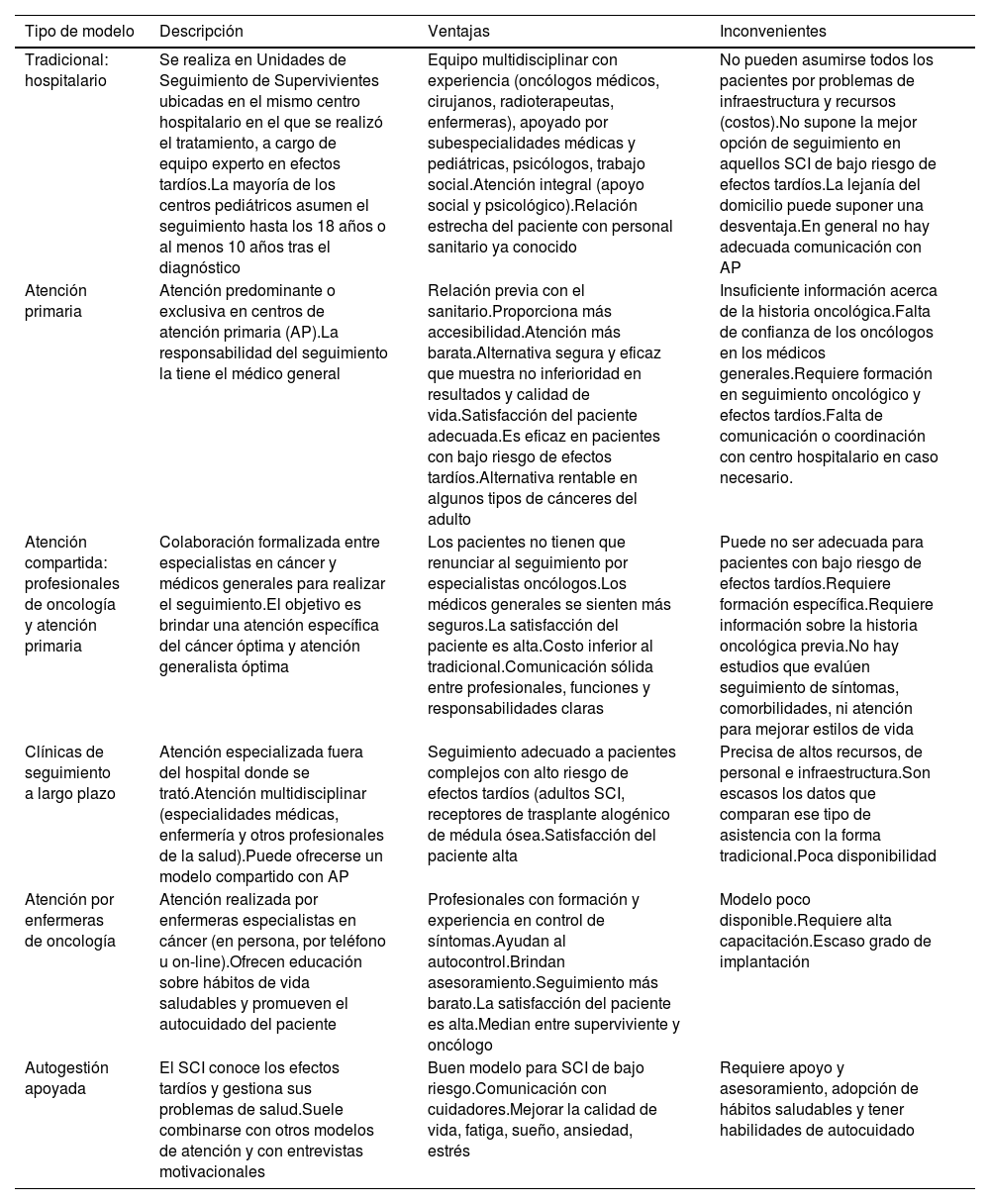
En los últimos 25 años han surgido modelos de atención alternativos al tradicional dirigido por especialistas en cáncer, que sigue siendo el predominante43, apoyados por un equipo multidisciplinar de otras subespecialidades, psicólogos y trabajadores sociales. La tabla 5 resume las características, las ventajas y los inconvenientes de los modelos propuestos. Tonorezos et al.44 analizaron los modelos de seguimiento en SCI en 18 países de los cinco continentes. En general, salvo en países de bajos recursos, la atención a SCI se mantiene hasta los 18años (edad pediátrica) y al menos 10años del diagnóstico, realizándose en unidades pediátricas. La adecuada transición de adultos jóvenes SCI y ofrecer planes de cuidado individualizado son elementos prioritarios en la mayoría de los países. Por otra parte, la formación en efectos tardíos de profesionales y los propios supervivientes se considera fundamental. Los responsables de políticas de salud deberían establecer la infraestructura adecuada en los diferentes sistemas de salud para permitir el seguimiento que merecen los SCI44.
Modelos de atención a supervivientes de cáncer infantil y adolescente
| Tipo de modelo | Descripción | Ventajas | Inconvenientes |
|---|---|---|---|
| Tradicional: hospitalario | Se realiza en Unidades de Seguimiento de Supervivientes ubicadas en el mismo centro hospitalario en el que se realizó el tratamiento, a cargo de equipo experto en efectos tardíos.La mayoría de los centros pediátricos asumen el seguimiento hasta los 18 años o al menos 10 años tras el diagnóstico | Equipo multidisciplinar con experiencia (oncólogos médicos, cirujanos, radioterapeutas, enfermeras), apoyado por subespecialidades médicas y pediátricas, psicólogos, trabajo social.Atención integral (apoyo social y psicológico).Relación estrecha del paciente con personal sanitario ya conocido | No pueden asumirse todos los pacientes por problemas de infraestructura y recursos (costos).No supone la mejor opción de seguimiento en aquellos SCI de bajo riesgo de efectos tardíos.La lejanía del domicilio puede suponer una desventaja.En general no hay adecuada comunicación con AP |
| Atención primaria | Atención predominante o exclusiva en centros de atención primaria (AP).La responsabilidad del seguimiento la tiene el médico general | Relación previa con el sanitario.Proporciona más accesibilidad.Atención más barata.Alternativa segura y eficaz que muestra no inferioridad en resultados y calidad de vida.Satisfacción del paciente adecuada.Es eficaz en pacientes con bajo riesgo de efectos tardíos.Alternativa rentable en algunos tipos de cánceres del adulto | Insuficiente información acerca de la historia oncológica.Falta de confianza de los oncólogos en los médicos generales.Requiere formación en seguimiento oncológico y efectos tardíos.Falta de comunicación o coordinación con centro hospitalario en caso necesario. |
| Atención compartida: profesionales de oncología y atención primaria | Colaboración formalizada entre especialistas en cáncer y médicos generales para realizar el seguimiento.El objetivo es brindar una atención específica del cáncer óptima y atención generalista óptima | Los pacientes no tienen que renunciar al seguimiento por especialistas oncólogos.Los médicos generales se sienten más seguros.La satisfacción del paciente es alta.Costo inferior al tradicional.Comunicación sólida entre profesionales, funciones y responsabilidades claras | Puede no ser adecuada para pacientes con bajo riesgo de efectos tardíos.Requiere formación específica.Requiere información sobre la historia oncológica previa.No hay estudios que evalúen seguimiento de síntomas, comorbilidades, ni atención para mejorar estilos de vida |
| Clínicas de seguimiento a largo plazo | Atención especializada fuera del hospital donde se trató.Atención multidisciplinar (especialidades médicas, enfermería y otros profesionales de la salud).Puede ofrecerse un modelo compartido con AP | Seguimiento adecuado a pacientes complejos con alto riesgo de efectos tardíos (adultos SCI, receptores de trasplante alogénico de médula ósea.Satisfacción del paciente alta | Precisa de altos recursos, de personal e infraestructura.Son escasos los datos que comparan ese tipo de asistencia con la forma tradicional.Poca disponibilidad |
| Atención por enfermeras de oncología | Atención realizada por enfermeras especialistas en cáncer (en persona, por teléfono u on-line).Ofrecen educación sobre hábitos de vida saludables y promueven el autocuidado del paciente | Profesionales con formación y experiencia en control de síntomas.Ayudan al autocontrol.Brindan asesoramiento.Seguimiento más barato.La satisfacción del paciente es alta.Median entre superviviente y oncólogo | Modelo poco disponible.Requiere alta capacitación.Escaso grado de implantación |
| Autogestión apoyada | El SCI conoce los efectos tardíos y gestiona sus problemas de salud.Suele combinarse con otros modelos de atención y con entrevistas motivacionales | Buen modelo para SCI de bajo riesgo.Comunicación con cuidadores.Mejorar la calidad de vida, fatiga, sueño, ansiedad, estrés | Requiere apoyo y asesoramiento, adopción de hábitos saludables y tener habilidades de autocuidado |
La elección del modelo depende de factores del paciente, de las características del sistema de salud y de las políticas nacionales de implementación del seguimiento. Siempre deben tenerse en cuenta las preferencias de los supervivientes. Complemento de los modelos de seguimiento son: la rehabilitación integral multidisciplinar para el abordaje de problemas físicos, psicológicos, vocacionales y sociales en pacientes complejos; intervenciones de salud que recomiendan la actividad física o la utilización de aplicaciones móviles (mHealth), permitiendo una comunicación más sencilla en tiempo real entre supervivientes y profesionales, o modelos de telesalud dirigidos por enfermería con formación43. Ejemplo de intervención conductual es el Oncokompass, aplicación de eSalud para apoyar a supervivientes de cáncer, basada en la autogestión de los síntomas por el propio superviviente (Centro Oncológico de Ámsterdam).
Todo superviviente debe disponer de un plan individualizado de atención (Passport of care o Sur-Pass) en el que conste un resumen del diagnóstico y del tratamiento recibido, las complicaciones y los efectos tardíos, el seguimiento recomendado según riesgo, las recomendaciones de estilo de vida saludables y enlaces de apoyo, los recursos y el material educativo seleccionado. Este documento debe estar disponible en la transición para el profesional encargado del seguimiento.
Seguimiento a largo plazo de SCI en EspañaEn España, el Registro Español de Tumores Infantiles (RETI-SEHOP), que ofrece información sobre incidencia de tumores pediátricos con cobertura del 95%, en su informe de 2022 aparecen registrados 32.266 casos entre 0-14años, con supervivencia global en la cohorte 2014-2016 del 82% (IC95%: 80,1-83,7%) a los 5años del diagnóstico. De ellos, 26.006 (1980-2016) son SCI4. La Sociedad Española de Hematología y Oncología Pediátrica (SEHOP) tiene un grupo de trabajo sobre efectos secundarios y segundos tumores que en 2012 publicó unas recomendaciones de seguimiento basadas en guías internacionales45. España ha asistido a reuniones del consorcio PanCare, que han permitido tener acceso al Survivorship Passport traducido al español, conocer diferentes grupos de trabajo y los requisitos de infraestructura y equipo multidisciplinar, imprescindibles para gestionar el seguimiento en muchos aspectos de la salud. A pesar de todo el interés, en España no se conoce la magnitud de estos problemas de forma general, la implementación del seguimiento no se ha conseguido de forma homogénea, aunque cada vez son más los centros nacionales de oncología pediátrica que han puesto en marcha el seguimiento a largo plazo en consultas especializadas, con profesionales formados y sensibilizados con el problema.
Futuro de los supervivientes de cáncer infantilEl manejo de los SCI es muy complejo, y a pesar de todos los esfuerzos en la realización de guías y recomendaciones de aplicación mundial, la evidencia actual es que la atención sigue siendo subóptima, sobre todo en países de bajos ingresos12.
Los retos planteados conducen a la necesidad de ampliar el conocimiento sobre los efectos tardíos y psicosociales de SCI, incluida la toxicidad de nuevas terapias, la contribución genética al riesgo, la multimorbilidad, los patrones de agrupación y la predicción de riesgos individuales. Debe incentivarse la colaboración internacional con grandes cohortes, lo que conducirá a elaborar estrategias en el tratamiento y el seguimiento adaptadas a fenotipos específicos de SCI, con intervenciones igualmente adaptadas a sus déficits. Esto, unido a las nuevas tecnologías, presagia una nueva era de supervivencia de precisión.
Debe potenciarse y mantenerse la iniciativa de armonización de guías para que el seguimiento a largo plazo sea homogéneo y uniforme, elaborando nuevas recomendaciones basadas en el riesgo y la evidencia científica y revisando el impacto de las actuales.
La implementación del seguimiento, efectivo, factible, de calidad y adecuado al riesgo constituye el mayor reto, casi inalcanzable. Debe realizarse por profesionales apoyados por los sistemas de salud y responsables políticos, con recursos necesarios para garantizar el acceso universal a la atención a la supervivencia. La transición es imperativa, requiriendo igualmente esfuerzos coordinados para superar barreras, creando servicios de atención a la supervivencia centrados en el paciente, ofreciéndole mayor protagonismo y responsabilidad sobre su propio seguimiento. Todo superviviente debe tener su plan de seguimiento individual, con el objetivo final de mejorar su salud futura.
Se requieren esfuerzos continuos y concertados por parte de investigadores, médicos y políticos para abordar las necesidades de los supervivientes y garantizar el seguimiento personalizado a lo largo de la vida para detectar precozmente los problemas de salud y ofrecer apoyo social. El objetivo general es mejorar la salud y la calidad de vida para que el incremento de niños tratados con éxito en la actualidad no se convierta en adultos con enfermedades crónicas en el mañana5.
FinanciaciónEl presente manuscrito no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.