Introducción
Diversos estudios ponen de manifiesto que un elevado porcentaje de los medicamentos que se utilizan en niños, tanto en Europa como en Estados Unidos, no están autorizados por las autoridades sanitarias para su uso en este grupo de edad 1-3. Varias razones explican esta situación, pero la más importante es la inexistencia de ensayos clínicos realizados en niños. Estos son excluidos de forma sistemática de la investigación clínica, lo que después obliga a utilizar en ellos medicamentos estudiados únicamente en población adulta y para los que la información pediátrica no existe o es insuficiente. Desde hace menos de una década existe debate sobre esta situación y se han realizado modificaciones legislativas para resolver la falta de información sobre los efectos de los medicamentos en población infantil, pero si bien los nuevos fármacos pueden verse beneficiados por estos cambios, es difícil que afecten a los medicamentos que fueron introducidos en terapéutica hace años 4-6. En 1968, Shirkey 7 acuñó el término huérfanos terapéuticos para referirse a la situación en que se encontraban los niños al utilizar medicamentos cuya información procede de estudios realizados en adultos. Recientemente se han publicado artículos 8-10 que recuerdan que el panorama no ha mejorado mucho desde entonces.
La hipertensión arterial es diagnosticada cada vez con mayor frecuencia en los niños y su prevalencia en la población de menos de 16 años es del 1 al 3,5 % 11. Hay una asociación clara entre obesidad infantil e hipertensión arterial 12, por lo que dado el aumento de la prevalencia de obesidad se puede prever un incremento de la prevalencia de hipertensión. El tratamiento de la hipertensión incluye cambios en el estilo de vida y el uso de fármacos. Su utilización estará en función de los valores de presión arterial, de la presencia de una etiología definida, y de la evaluación de los posibles factores de riesgo asociados 13. Según las guías actuales 12,14,15, en los niños deberían emplearse los mismos fármacos que en los adultos, considerando de primera línea: diuréticos, bloqueadores β-adrenérgicos, antagonistas del calcio, inhibidores de la enzima conversora de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II), pero utilizando dosis adecuadas al tamaño corporal de los niños.
Para utilizar los fármacos antihipertensivos en niños es necesario disponer de información sobre su pauta de administración. En caso contrario, deben extrapolarse las dosis utilizadas en los adultos con los riesgos que ello conlleva 8. Se han realizado algunos ensayos clínicos con antihipertensivos en niños, si bien sólo en mayores de 6 años y con algunos grupos terapéuticos 12,16. Esto hace que la información disponible sobre tratamiento de antihipertensivos en población infantil sea escasa y con frecuencia procedente, exclusivamente, de estudios realizados en adultos 17.
El Vademécum Internacional (V-I) es un repertorio que contiene información sobre la mayor parte de los medicamentos comercializados en España agrupados por fabricantes y con índices que facilitan la búsqueda. Este repertorio es la fuente de información sobre medicamentos más utilizada por los médicos tanto en su edición impresa, que se distribuye gratuitamente a todos los médicos colegiados, como en su versión electrónica 18.
El objetivo del presente trabajo es investigar si el Vademécum Internacional contiene información suficiente para el uso y dosificación correctos de fármacos antihipertensivos en niños.
Material y métodos
Se han revisado en la edición impresa del V-I (44.ª y 45.ª ediciones de 2003 y 2004 19,20) la información sobre utilización y la pauta de administración en niños contenida en las monografías de los diferentes fármacos antihipertensivos. A partir del índice farmacológico y del alfabético de principios activos, se han seleccionado las especialidades farmacéuticas que contienen diuréticos, bloqueadores β-adrenérgicos, antagonistas del calcio, IECA y ARA II y que están indicadas para el tratamiento de la hipertensión arterial. Se han revisado las especialidades que contienen un solo principio activo, excepto en el caso de una que contiene amilorida e hidroclorotiazida que se ha considerado como monofármaco. Cuando existen varias especialidades para la misma molécula se ha seleccionado la señalada con el logotipo de la Dirección General de Farmacia y Productos Sanitarios (que indica que la información ha sido revisada por ésta) con fecha más reciente. Cuando en la monografía de una especialidad no se obtiene información, se revisan las de otras especialidades con el mismo principio activo por orden de antigüedad del logotipo citado. La información de la edición impresa se ha comparado con de la edición electrónica (vademecum.medicom.es) para las mismas especialidades. Cuando una especialidad que aparece en la edición de 2003 no lo hace en la de 2004, se comprueba en la base de datos de medicamentos del Consejo General de Colegios Farmacéuticos (www.portalfarma.com) si se sigue comercializando. La información obtenida se ha comparado con la del cuarto informe sobre diagnóstico, evaluación y tratamiento de la hipertensión arterial en niños y adolescentes, del National High Blood Pressure Education Program Working Group de Estados Unidos (NHBPEP), publicado en 2004 12.
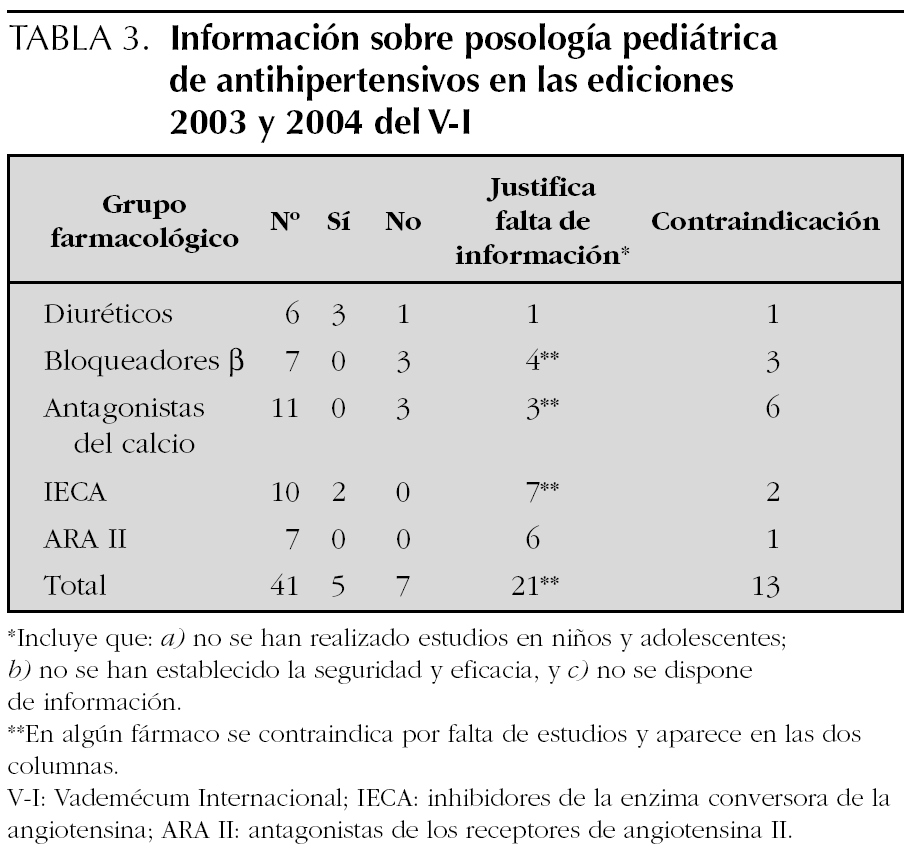
Para cada principio activo se ha registrado la posología pediátrica y las recomendaciones específicas, si existen. En caso contrario, se registra la falta de información o la justificación de ésta, que puede ser: a) no se han realizado estudios en niños y adolescentes; b) no se ha establecido la seguridad y eficacia en niños; c) no se dispone de información, y d) no se recomienda en este grupo de edad.
Resultados
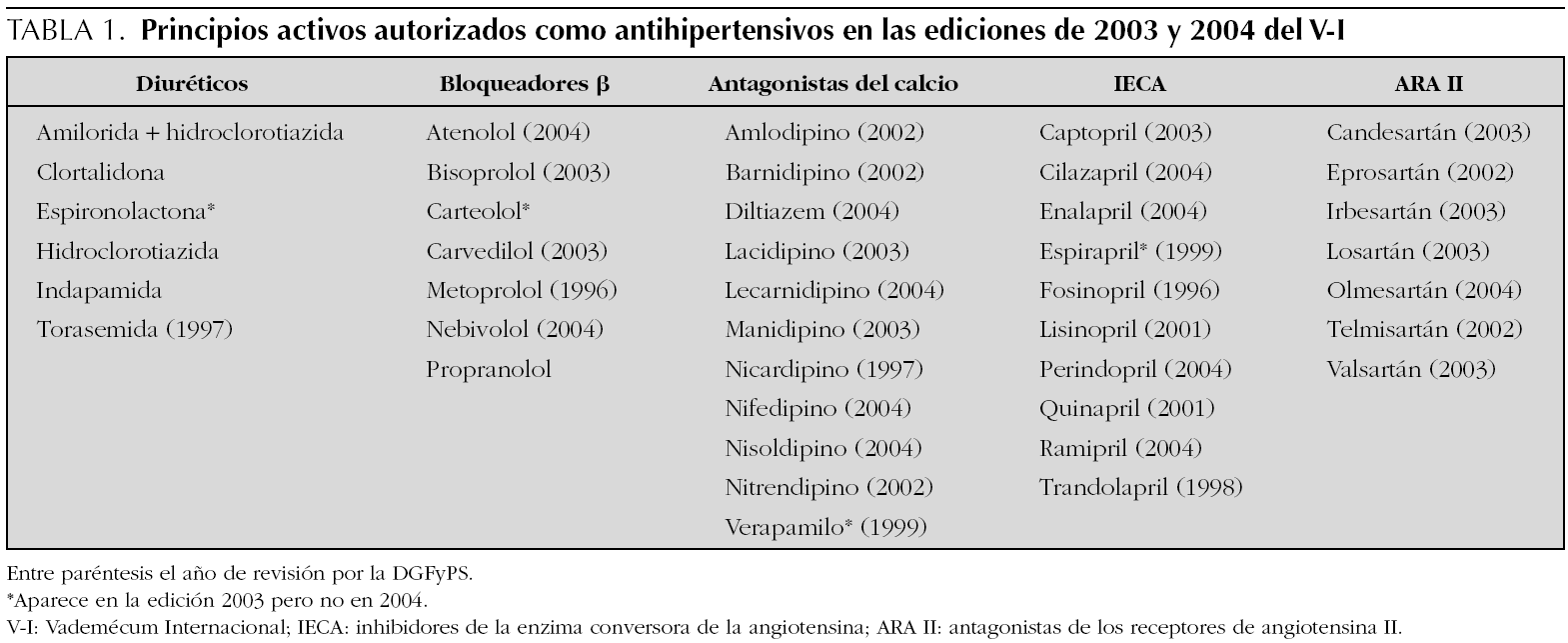
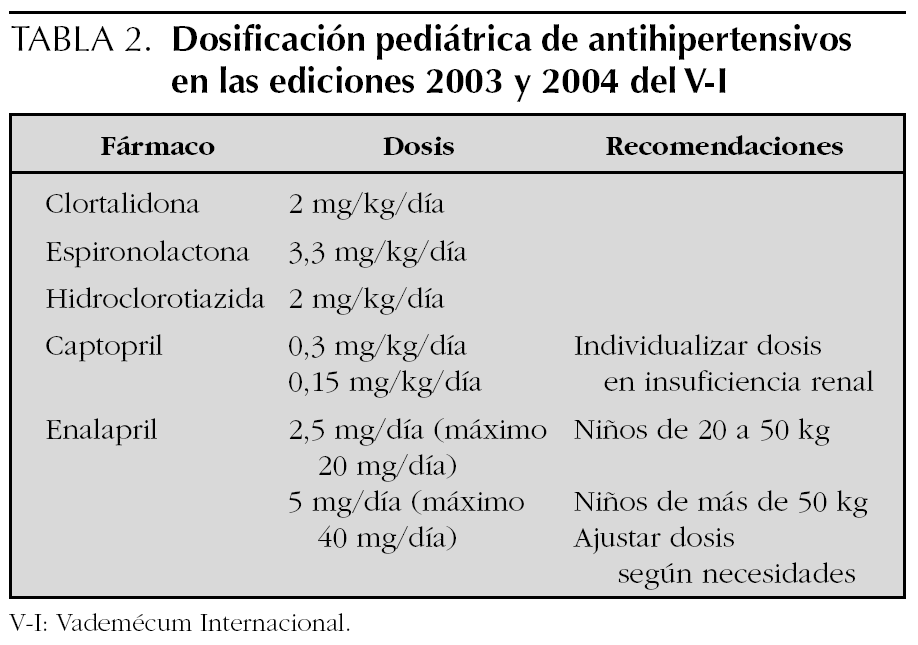
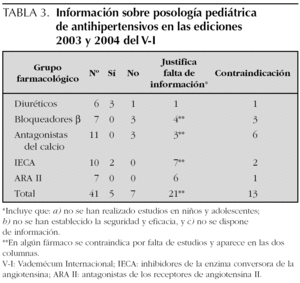
Se han revisado en total las monografías de 111 especialidades farmacéuticas. En la 44.ª edición del V-I aparecen 45 principios activos diferentes con indicación de antihipertensivo, de los que 41 corresponden a los cinco grupos considerados de primera línea y objeto de investigación (tabla 1). La edición más reciente, 45.ª de 2004, contiene 41 y 37 respectivamente, los cuatro principios activos que no aparecen en esta edición: son carteolol, espironolactona, espirapril y verapamilo siguen comercializados según la base de datos del Consejo General de Colegios Farmacéuticos (consultado el 9 de junio de 2005). Sólo para 5 fármacos tres diuréticos (hidroclorotiazida, clortalidona y espironolactona) y dos IECA (captopril y enalapril) existe información sobre la dosis en niños y para los dos IECA se hacen recomendaciones específicas (tabla 2). Para el propranolol se incluyen dosis pediátricas para su empleo en arritmias, feocromocitoma, tirotoxicosis y migraña, pero no en hipertensión arterial. Los otros 35 principios activos revisados advierten de que no se han realizado estudios, no se ha establecido la eficacia y seguridad en niños o no hacen referencia a este grupo de edad. En algunos casos se dice taxativamente que no debe emplearse el fármaco en menores de 18 años, en ocasiones basándose en la falta de estudios para este grupo de edad (tabla 3). La información de la edición impresa de 2004 coincide con la electrónica.
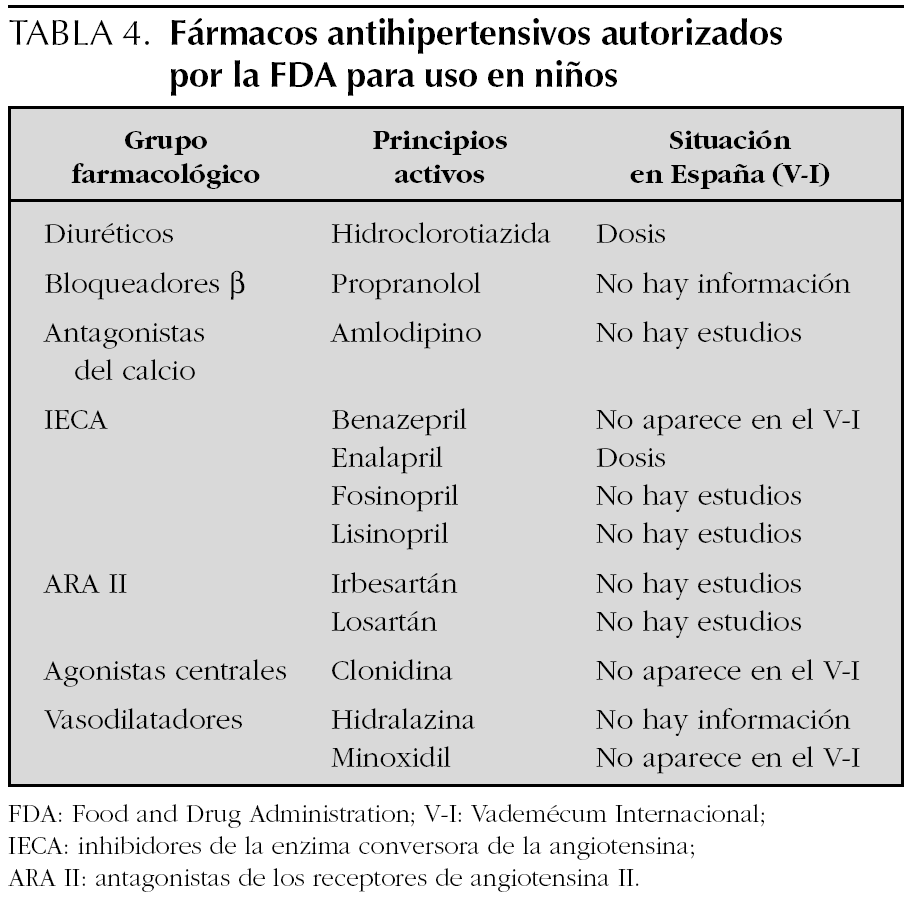
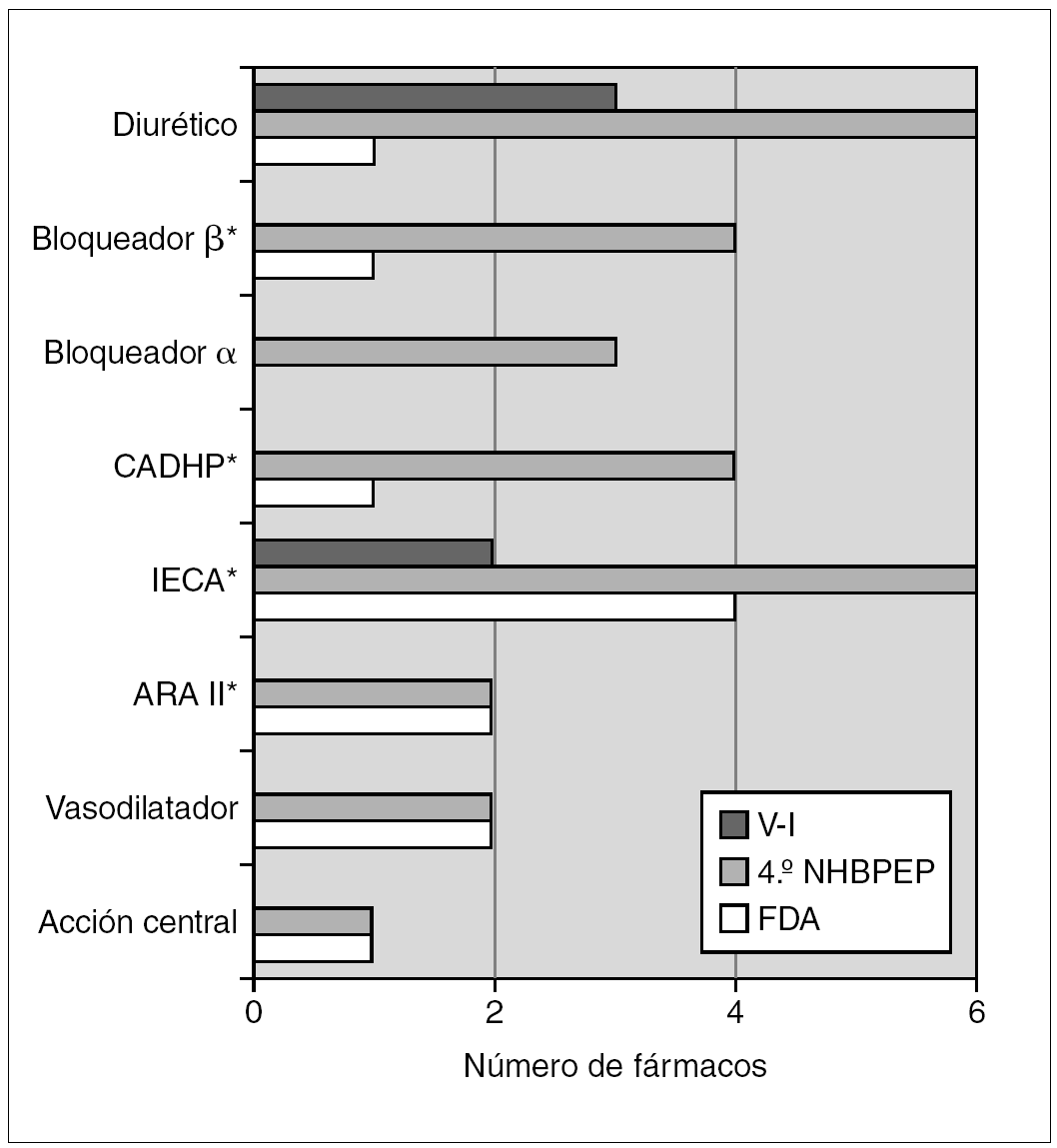
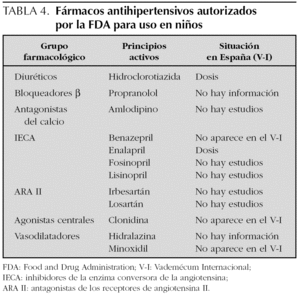
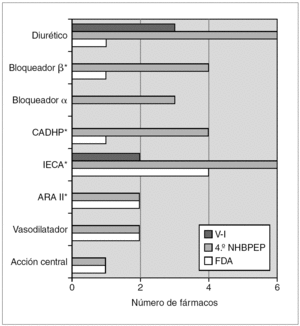
La información contrasta con la incluida en el 4.º informe del NHBPEP 12, que proporciona dosificación pediátrica de 28 fármacos antihipertensivos que en 10 casos (un bloqueador β, dos antagonistas del calcio, seis IECA y un ARA II) procede de ensayos clínicos con asignación aleatoria del tratamiento. De estos 10 fármacos, ocho están comercializados en España, para dos (captopril y enalapril) aparece dosificación pediátrica en el V-I, para otro (propranolol) no aparece información para hipertensión y para los otros cinco (amlodipino, fosinopril, lisinopril, quinapril y losartán) el V-I indica que no existen estudios o que no se ha establecido la eficacia y seguridad en niños (fig. 1). Según el citado cuarto informe de Estados Unidos, la Food and Drug Administration (FDA) ha autorizado 12 antihipertensivos para uso pediátrico (tabla 4 y fig. 1).
Figura 1. Número de fármacos que aparecen en el Vademécum Internacional (V-I), en el 4.º informe del National High Blood Presure Education Program Working Group de Estados Unidos (NHBPEP) y autorizados por la FDA clasificados por grupo terapéutico. *Para algún fármaco del grupo la información procede de ensayos clínicos aleatorios. CADHP: antagonistas del calcio dihidropiridínico.
Discusión
Con la información disponible en el V-I en sus ediciones más recientes, que es tanto como decir con la información que se contiene en las fichas técnicas de los antihipertensivos comercializados en España 18, sólo es posible dosificar de forma correcta 5 fármacos antihipertensivos en los niños, ya que no existe información o se contraindica el uso de los restantes 36 fármacos analizados. En cuatro de los fármacos la dosis se expresa por kg/día, mientras que para enalapril se da la dosis total, si bien se recomienda el ajuste de la misma según las necesidades y se indica la dosis máxima diaria.
El V-I editado por Ediciones Medicom tiene, desde 1987, un convenio de colaboración con la Dirección General de Farmacia y Productos Sanitarios (DGFyPS) para la revisión de los contenidos y por ello, las monografías de algunos medicamentos están señaladas con el logotipo de este organismo. El símbolo indica que la monografía ha sido revisada por la DGFyPS y que contiene los datos más relevantes de la ficha técnica o del último prospecto autorizado para la especialidad farmacéutica correspondiente e incluye el año de la revisión 18. Las monografías de 36 principios activos de los 41 revisados llevan el logotipo de la DGFyPS, la mayoría con fecha 2003 o 2004, a pesar de lo cual no ofrecen información sobre dosificación pediátrica. Sólo 2 (captopril y enalapril) de los 5 fármacos para la que ésta existe, están revisados por la DGFyPS.
De acuerdo con el artículo 10 de la Ley del Medicamento 21 que regula las condiciones para la autorización de especialidades farmacéuticas, debe considerarse que estas especialidades no están autorizadas para su uso en niños, lo que convierte a éstos en auténticos huérfanos terapéuticos en el sentido acuñado por Shirkey 7. La DGFyPS recuerda sistemáticamente en sus notas informativas que la utilización de medicamentos en indicaciones no autorizadas debe seguir los procedimientos legalmente previstos (uso compasivo) y en el caso de que estén implicados los niños señala: "en todo caso se deberá informar a los padres o tutores legales de esta situación especial y obtener su consentimiento" 22.
Se entiende por uso compasivo la utilización de medicamentos en pacientes, al margen de un ensayo clínico, para indicaciones o condiciones de uso distintas de las autorizadas, bajo la exclusiva responsabilidad del médico prescriptor. El uso compasivo está restringido a casos excepcionales en los que no hay una alternativa terapéutica posible y para ello se requiere el consentimiento informado del paciente o de su representante legal, un informe clínico en el que el médico justifique la necesidad de dicho tratamiento, la conformidad del director del centro donde se vaya a aplicar y la autorización de la Agencia Española de Medicamentos y Productos Sanitarios (AEMyPS). El médico debe, además, comunicar a la AEMyPS los resultados del tratamiento y las sospechas de reacciones adversas 23.
La situación española puede crear problemas, no sólo por la falta de información disponible, ya que el especialista podría obtenerla de otras fuentes, sino por la complejidad que supone el uso compasivo, que como es fácil comprender está concebido para condiciones menos habituales que el tratamiento de la hipertensión arterial en niños, aunque de acuerdo con la norma sería la forma correcta de utilizar todos los medicamentos para los que no hay información. Además, la prescripción de antihipertensivos no autorizados en niños puede generar alarma a las familias cuando lean en el prospecto que el medicamento prescrito no ha sido investigado o incluso está contraindicado en este grupo de edad. Esto obliga a los médicos a informar adecuadamente a las familias de las razones para usar el fármaco.
Llama la atención que en Estados Unidos haya 12 antihipertensivos aprobados por la FDA para uso pediátrico, de hecho, el Physicians' Desk Reference de Estados Unidos, equivalente a nuestro V-I incluía en su edición del año 2000 información pediátrica sobre 9 de los 29 antihipertensivos que describía 16. Además, una fuente tan prestigiosa como el 4.º informe del NHBPEP 12 incluye dosificación y recomendaciones para 28 principios activos, información que podría ser fácilmente incorporada en las fichas técnicas españolas. Es también interesante señalar que existen ensayos clínicos realizados en niños, para un buen número de fármacos, cuya monografía en el V-I sigue diciendo que no existen datos o que están contraindicados. Toda esta información podría fácilmente incorporarse al V-I de nuestro país para facilitar el correcto uso de los fármacos para el tratamiento de la hipertensión arterial y evitar los posibles problemas esbozados con anterioridad.
Sería necesario realizar más ensayos clínicos en población pediátrica para caracterizar las condiciones correctas del uso de fármacos para el tratamiento de la hipertensión arterial 17. No obstante, un problema adicional, como ha señalado Flynn 16, es que aunque dispusiésemos de información para el manejo adecuado de antihipertensivos en niños, nos podríamos encontrar con que la inexistencia de formas farmacéuticas idóneas, fundamentalmente preparaciones líquidas, hicieran complicada la dosificación exacta. Más aún cuando en el caso de algunos antihipertensivos como los diuréticos ya se ha llamado la atención de que, incluso para los adultos, las presentaciones disponibles pueden no ser las más adecuadas por contener una cantidad excesiva de principio activo 24. Precisamente por la necesidad de ajustar las dosis a las características de cada niño, no se ha recogido en el presente trabajo la información existente para las asociaciones en dosis fijas, al entender que serían de dosificación complicada en este grupo de edad.
Sería conveniente que las autoridades sanitarias, de acuerdo con el artículo 84.2 de la Ley del Medicamento, que recoge las actuaciones de las Administraciones Públicas sobre información de medicamentos para promover el uso racional de los mismos, mejorasen la información sobre el uso de fármacos en los niños, basándose en las evidencias científicas disponibles y que esta información, según lo previsto en el artículo 19 de la misma ley, apareciese en el prospecto y la ficha técnica de cada especialidad. De esta forma, contribuirían a que los niños dejasen de ser huérfanos terapéuticos y favorecerían el uso racional de los medicamentos.
Después de la aceptación de este trabajo ha aparecido la edición 46.ª del Vademécum Internacional que incluye la revisión en 2005 de 20 principios activos de los recogidos en la tabla 1. La información sobre uso pediátrico no se ha modificado respecto a la contenida en ediciones anteriores.
Correspondencia: Dr. F.J. Morales-Olivas.
Departamento de Farmacología.
Facultad de Medicina y Odontología.
Avda. Blasco Ibáñez, 15.
46010 Valencia. España.
Correo electrónico: morales@uv.es
Recibido en junio de 2005.
Aceptado para su publicación en junio de 2005.