Introducción
El síndrome de apnea-hipopnea obstructiva del sueño (SAHOS) forma parte de los trastornos respiratorios relacionados con el sueño y es una entidad relativamente frecuente en niños. La prevalencia se estima entre el 1-3 % en población general infantil con una distribución similar entre niños y niñas 1. Es más frecuente entre los 2 y 6 años, tal vez por el abundante tejido linfoide de la vía respiratoria superior con relación al diámetro de la misma que hay en estas edades 2.
La causa más frecuente del SAHOS en la infancia es la hipertrofia adenoamigdalar. En su etiología también participan determinadas enfermedades neuromusculares (malformación de Arnold-Chiari I-II, distrofia miotónica y miopatías diversas) y anomalías craneofaciales (microrretrognatia, paladar ojival, síndrome de Down, síndrome de Apert y síndrome de Crouzon, entre otras). Así mismo, diversos factores proinflamatorios como son la proteína C reactiva (PCR), el factor de necrosis tumoral α (TNF-α) y la interleucina 6 (IL-6), que producen inflamación local de la mucosa de la vía aérea, pueden contribuir a la obstrucción de la misma, por lo que también se consideran factores importantes en la etiopatogenia de esta entidad 3,4.
El ronquido y la sospecha de apneas durante el sueño, así como la necesidad de evaluar la indicación de amigdalectomía en los casos de hipertrofia amigdalar, son las indicaciones más frecuentes de estudio de SAHOS en niños. Por este motivo, hemos estimado oportuno comunicar nuestra experiencia en esta patología mediante el estudio con poligrafía respiratoria (PR) durante el sueño nocturno.
Material y métodos
Este es un estudio retrospectivo de una cohorte de niños y niñas de 2 a 14 años, remitidos desde consultas externas de Otorrinolaringología (ORL), Neumología Infantil (UNI) y Atención Primaria (AP) por sospecha de apneas del sueño, ronquido o ambos, entre octubre de 1998 y diciembre de 2004.
Se ha realizado anamnesis detallada y exploración física estandarizada en todos los sujetos a estudio. Así mismo, se practicó radiografía de tórax, radiografía de cavum y PR del sueño en todos los casos (polígrafos Sibelhome 300® y ApnoeScreen Pro®), en régimen de ingreso hospitalario, de 21:00 a 7:00 h, con una duración media de 7 h. Se ha estudiado el flujo oronasal (termistor nasobucal), el esfuerzo torácico y esfuerzo abdominal (sensores piezoeléctricos), la saturación de oxígeno mediante pulsioximetría (SpxO2), la frecuencia cardíaca por onda de pulso, la posición corporal y el ronquido interno, en todos los casos. La actividad muscular se monitorizó en los últimos 4 años (ApnoeScreen Pro®). La lectura final se obtuvo mediante análisis manual diferido por observador único, durante todo el período del estudio.
En todos los casos se han analizado las variables cualitativas sexo, motivo de consulta (ronquido, apneas o ambos), procedencia (consultas externas de ORL, UNI o AP), exploración de la vía aérea superior (hipertrofia amigdalar, hipertrofia adenoidea, hipertrofia adenoamigdalar o normalidad), resultado de poligrafía respiratoria (SAHOS leve, moderado, grave, normalidad o no válido), cirugía y otros diagnósticos.
Las variables cuantitativas analizadas han sido la edad, número total de apneas (n.º A), número total de hipopneas (n.º H), índice de apneas por hora (A/h), índice de hipopneas por hora (H/h), índice de apneas-hipopneas por hora (IAH/h), SpxO2 medio, SpxO2 mínimo, número de ronquidos (n.º R) e índice de ronquidos por hora (IR/h). Las apneas centrales registradas se han excluido en este estudio.
El análisis estadístico ha incluido la t de Student, para estudiar si existe una diferente distribución de IAH/h, número de ronquidos e IR/h entre sexos y análisis de regresión lineal, para medir asociación entre edad, motivo de consulta, procedencia, SpxO2 medio, SpxO2 mínimo como variables independientes e IAH/h como variable dependiente. Así mismo, se ha estudiado la distribución de IAH/h, n.º A, n.º H, n.º R, IR/h entre los diferentes motivos de consulta (ronquido, apneas o ambos) mediante análisis de la varianza (ANOVA).
Se ha definido apnea obstructiva como reducción de la señal de flujo aéreo oronasal mayor de 90 % con esfuerzo respiratorio continuo, hipoxemia mayor o igual a 3 % y duración mayor de dos ciclos respiratorios. La hipopnea obstructiva se ha definido como la disminución del flujo aéreo mayor del 50 % (medida por termistor nasobucal), hipoxemia y duración mayor a 2 ciclos respiratorios 5.
Se ha considerado SAHOS leve si el índice de apneas-hipopneas por hora (IAH/h) estaba comprendido entre 3 y 5; SAHOS moderado, IAH/h entre 6 y 9; y SAHOS grave, IAH/h $ 10 5-8.
Resultados
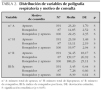
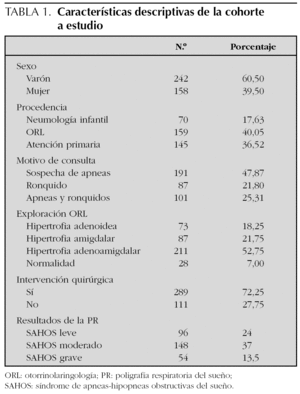
Se ha analizado una cohorte constituida por 400 pacientes estudiados con PR del sueño, 159 casos (40,05 %) remitidos desde consultas externas de ORL, 145 casos (36,52 %) de AP y 70 casos (17,63 %) de la UNI. La edad media de la cohorte fue de 4,95 años (desviación estándar [DE}: 2,3), distribuida por sexos en 242 niños (60,5 %) y 158 niñas (39,5 %).
El motivo de la consulta fue la sospecha clínica de apneas del sueño en 191 (47,87 %), ronquido y apneas en 101 (25 %) y ronquido en 87 casos (21,80 %). En 211 casos (52,75 %) se constató hipertrofia adenoamigdalar; en 87 (21,75 %), hipertrofia amigdalar, y en 73 (18,25 %) hipertrofia adenoidea (tabla 1).
De los 400 niños estudiados con PR del sueño, hubo que repetir el estudio en 24 ocasiones porque los estudios iniciales no fueron válidos (6 %). Se diagnosticó SAHOS en 298 casos (74,5 %), distribuido en los siguientes grados: leve, 96 (24 %); moderado, 148 (37 %), y grave, 54 casos (13,5 %) (tabla 1). La PR del sueño fue normal en 40 casos (10 %) y en 23 casos (5,75 %) se consideró que el estudio no era válido, por problemas técnicos o falta de colaboración.
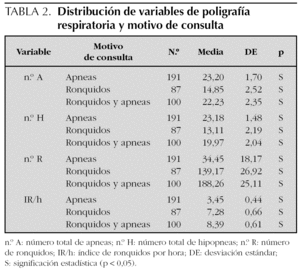
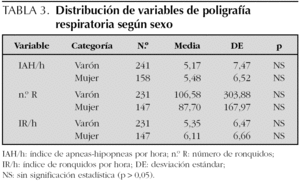
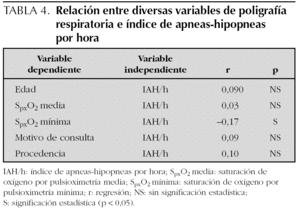
Los resultados de la PR del sueño expresados en medias y desviación estándar son los siguientes: n.º A 21,38 (24,47); n.º H 19,81 (20,74); IA/h 2,58 (2,93); IH/h 2,37 (2,46); IAH/h 5,29 (7,10); SpxO2 medio 94,60 (11,80); SpxO2 mínimo 83,14 (13,45); n.º R 98,27 (254,55) e IR/h 5,68 (6,5). Se han encontrado diferencias estadísticamente significativas entre la saturación de oxígeno mínimo y el IAH/h; por cada incremento unitario en IAH/h disminuye la saturación en un 0,18 % (r = 0,17). Así mismo, se ha hallado asociación entre n.º A, n.º H, n.º R e IR/h y el motivo de la consulta (tabla 2). No se han encontrado diferencias entre IAH/h, N.º R e IR/h y sexo (tabla 3). Tampoco se ha encontrado asociación entre edad, saturación de oxígeno medio, procedencia, motivo de consulta e IAH/h (tabla 4).
De los 298 casos diagnosticados de SAHOS, 54 (18,12 %) habían sido remitidos desde las propias UNI para estudio, 122 (40,93 %) desde consultas externas de ORL y 112 casos (37,58 %) desde Atención Primaria. El motivo del estudio fue en 164 casos (55,03 %) por sospecha clínica de apneas, 56 (18,79 %) por ronquido y 78 (26,17 %) por apneas y ronquido. De los 298 niños afectados de SAHOS, en 284 de ellos (95,3 %) se constató patología adenoamigdalar; en 51 (17,11 %) se constató hipertrofia adenoidea; en 62 (20,8 %), hipertrofia amigdalar, y en 171 casos (57,38 %), hipertrofia adenoamigdalar.
En los 371 casos en los que se constató patología otorrinolaringológica, la PR del sueño fue normal en 40 casos (18,95 %) de los 211 niños con hipertrofia adenoamigdalar, en 23 casos (26,43 %) de los 87 con hipertrofia amigdalar aislada y en 23 casos (31,5 %) de los 73 con hipertrofia adenoidea aislada. Así mismo, de los 29 casos en los que la exploración otorrinolaringología y la radiografía de cavum fueron normales, 16 de ellos (55,17 %) fueron diagnosticados de SAHOS.
Se realizó intervención quirúrgica (adenoamigdalectomía) en 289 casos (72,25 % del total de la cohorte estudiada). De ellos, 283 (97,92 %) tenían diagnóstico de SAHOS. Los 6 casos restantes (2,08 %), que no fueron diagnosticados de SAHOS, fueron intervenidos por otras patologías otorrinolaringológicas.
Por último, de los 400 niños de la cohorte inicial a estudio, en 82 casos diagnosticados de SAHOS (20,5 %) se encontraron, además, los siguientes diagnósticos: asma, 40 (48,78 %); otitis media aguda, 11 (13,41 %); bronquitis recurrente, nueve (10,97 %); dismorfia facial, seis (7,31 %); cardiopatía congénita, cuatro (4,87 %); dermatitis atópica, cuatro (4,87 %); obesidad mórbida, cuatro (4,87 %); rinitis alérgica perenne, tres (4,87 %), y enfermedad neuromuscular (enfermedad de Duchenne), uno (1,21 %).
Discusión
El SAHOS es una entidad muy frecuente en niños y en adultos, en los que alcanza una prevalencia del 1-3 y 2-4 %, respectivamente 9. El grupo de edad con mayor prevalencia de SAHOS es la población preescolar. Sin embargo, el incremento de la obesidad infantil ofrece un nuevo grupo de riesgo, el del adolescente o adulto joven, cuyo patrón de enfermedad recordaría al del adulto 10.
La clínica del SAHOS en la infancia difiere en algunos aspectos respecto a la época adulta. Es característico el ronquido, la hipersudoración, la enuresis y en ocasiones el retraso ponderoestatural. El mecanismo por el que se produce este estancamiento en el desarrollo del niño afectado, aunque es desconocido, sugiere que la secreción anormal de la hormona del crecimiento (GH) podría tener un papel importante en su patogenia. En este sentido, la disminución de concentración en sangre de factor de crecimiento intraepidérmico-I (IGF-I), principal mediador de la acción de la GH, y la disminución de la IGF-I binding protein 3 (IGFBP-3), proteína transportadora de IGF-1 dependiente de GH, reflejarían la disminución nocturna de la secreción de la GH que se ha comunicado en niños afectados de SAHOS 11.
Así mismo, el sueño no reparador en la infancia produce menor somnolencia diurna debido a menor número de microdespertares nocturnos o activaciones corticales. Sin embargo, produce mayores problemas de comportamiento, como hiperactividad y déficit de atención, problemas de relación social y disminución del rendimiento escolar. Estos déficit neurocognitivos se producen quizá por la cronicidad del SAHOS en una época de desarrollo neurológico importante, como es la primera década de la vida 12,13.
La cronicidad de la hipoxemia intermitente y la fragmentación ocasional del sueño activan mecanismos inflamatorios como el de la PCR, la cual se ha asociado recientemente con el índice IAH/h, saturación media de oxígeno y número de despertamientos. La magnitud del proceso inflamatorio puede desarrollar alteraciones cardiovasculares o neurocognitivas en los niños afectados 14.
A pesar de que el ronquido es el síntoma más frecuente del SAHOS, la intensidad del mismo no está relacionada con la gravedad de los trastornos respiratorios relacionados con el sueño. La prevalencia estimada del roncador habitual es de aproximadamente el 10 % (intervalo de confianza (IC) del 95 %: 8,3-11,9 %) 1, y esta prevalencia varía según lo hace la resistencia de la vía respiratoria superior y el índice de masa corporal (IMC) 15. Los roncadores habituales, a diferencia de lo que se creía inicialmente, pueden presentar episodios prolongados de taquicardia, concentraciones de hemoglobina superiores a los no roncadores, menor concentración de IGFBP-3 indicativa de secreción anormal de GH y alteraciones del comportamiento. Todo esto sugiere la existencia de una hipoventilación obstructiva parcial prolongada con hipoxia durante el sueño 16,17.
Recientemente, diversos autores han estudiado la posible agregación familiar del SAHOS y se ha propuesto la interacción de factores genéticos (herencia dominante mendeliana o codominante) y no genéticos (morfología craneofacial y funcionamiento anormal de los mecanismos reguladores de la respiración) que facilitarían la obstrucción de la vía respiratoria superior en los miembros de una misma familia 18,19. Sin embargo, este aumento de prevalencia intrafamiliar no se ha documentado en la infancia y la mayoría de los niños afectados no tienen historia familiar positiva 20.
Así mismo, Suilt et al 21 han comunicado la asociación entre la obesidad, episodios recurrentes de sibilancias y asma. Se han propuesto diferentes mecanismos para explicar estas asociaciones, como son la inflamación local de la vía aérea (aumento de leptina y otras citocinas proinflamatorias), factores mecánicos (fatiga muscular con reducción de volumen tidal y capacidad residual funcional) y genéticos (influencia de receptores estrogénicos y receptores β). Sin embargo, se requieren más estudios para confirmar esta relación entre trastornos respiratorios relacionados con el sueño tipo SAHOS, obesidad y asma, y el efecto del tratamiento de cada una de las entidades en la mejora de la otra 22,23. Nuestros resultados muestran que 82 casos (20,5 %) de la cohorte inicial (n = 400) presentaban además otros diagnósticos, entre los que predominaba el asma (48,7 %).
La polisomnografía (PSG) es el patrón de oro para el diagnóstico del SAHOS en la infancia 24. Sin embargo, debido a la dificultad técnica y económica para realizarla, se han propuesto otras técnicas diagnósticas alternativas, como la PR durante el sueño, técnica validada en adultos para el diagnóstico del SAHOS (sensibilidad 97 % y especificidad 90,0 %) y pendiente de validación en niños 25. Aunque la PR del sueño puede infradiagnosticar los episodios de hipopnea, se considera una técnica de detección adecuada para el estudio del SAHOS en la infancia 26-28. Así mismo, se ha descrito recientemente la posibilidad de realizar con éxito (> 90 %) PR nocturna domiciliaria para el diagnóstico de SAHOS en niños en edad escolar 29.
Si el estudio con PR es negativo y la sospecha clínica es alta, se recomienda la realización de estudio con polisomnografía, debido a los falsos negativos de la prueba con PR.
En niños con edad inferior a 3 años o poco colaboradores, realizamos también un videorregistro nocturno durante 30 min entre las 4:00 y las 4:30 h, utilizando dos registros (vídeo y audio) y estando el sujeto descubierto, con la cara, tórax y abdomen en el mismo plano. Recogemos las variables de posición, ruidos nocturnos y tipo de ruido inspiratorio, movimientos durante el sueño, número de despertares, episodios compatibles con apneas, retracciones torácicas y respiración oral. A pesar de las variaciones según los diferentes centros o series estudiadas, esta técnica complementaria ofrece una sensibilidad del 94 %, especificidad del 68 %, valor predictivo positivo del 50-83 % y valor predictivo negativo del 73-88 % 30-32.
En nuestra serie, hemos diagnosticado SAHOS por PR en el 74,5 % de los casos estudiados (n = 400) y el 50,5 % de ellos fueron de grado moderado o grave. Así mismo, se han encontrado diferencias entre el IAH/h y la saturación de oxígeno mínima (tabla 4). No obstante, debemos recordar la limitación de nuestro estudio, y es que está realizado en niños que habían sido remitidos a estudio de PR del sueño, fundamentalmente desde consultas externas de ORL o atención primaria, por sospecha clínica de apneas del sueño y/o ronquidos, y por tanto, no se trata de población general. Esto podría explicar también las diferencias encontradas entre el número total de apneas, número total de hipopneas, ronquidos e índice de ronquidos por hora y motivo de consulta (tabla 3).
El tratamiento de elección del SAHOS en la infancia es la adenoamigdalectomía, lo que supone una resolución clínica y polisomnográfica del 70-100 % de los casos 33. Así mismo, se ha descrito la normalización de la concentración sanguínea de IGF-I y IGFBP-3 tras intervención quirúrgica en niños afectados. Sin embargo, no ocurre lo mismo en los roncadores habituales que se intervienen. Esto sugiere que la disminución de la concentración nocturna de GH sería secundaria a la obstrucción de la vía aérea en la infancia. Estudios futuros tendrán que demostrar la reversibilidad de las alteraciones neurológicas tras la intervención quirúrgica 11. La repetición de la PSG tras la intervención quirúrgica estaría indicada si la clínica persistiera en el tiempo.
En resumen, queremos señalar en primer lugar que el SAHOS en la infancia es una patología prevalente en la que la PR es un sistema adecuado para el abordaje diagnóstico, aunque al analizar exclusivamente las variables respiratorias y cardíacas, sin evaluar los parámetros neurofisiológicos, infraestima la gravedad del SAHOS. Por tanto, la PR tiene limitaciones obvias, que en parte pueden subsanarse si el personal tiene formación adecuada y los equipos de poligrafía están validados. En segundo lugar, la etiología más frecuente del SAHOS sigue siendo la hipertrofia amigdalar y/o adenoidea y la intervención quirúrgica, adenoamigdalectomía, es curativa en la gran mayoría de los casos.
Correspondencia: Dra. O. Sardón Prado.
Unidad de Neumología Infantil. Hospital Donostia.
Avda. Dr. Beguiristain, s/n.
20014 San Sebastián. España.
Correo electrónico: osardon@chdo.osakidetza.net.
Recibido en noviembre de 2005.
Aceptado para su publicación en noviembre de 2005.