El síndrome de West ligado al cromosoma X (ISSX) presenta una incidencia en torno a un 4,4-4,8%1–3, y el índice de recurrencia entre hermanos, un 1,5-6%1,4,5 (hasta un 30% en gemelos univitelinos1,6 y en algunas enfermedades hereditarias como la esclerosis tuberosa1,7). Las etiologías, las crisis y el pronóstico del síndrome de West (SW) en general están bien documentados; sin embargo, el patrón de herencia, las etiologías, las características clínicas, etc., del ISSX están aún por aclarar.
En los últimos años se ha producido un aumento significativo en el número de comunicaciones destinadas a describir nuevos casos y nuevas alteraciones genéticas relacionadas con el ISSX y el gen aristaless homeobox (ARX) perteneciente al cromosoma X. A pesar de este auge, aún hay serias dudas sobre el papel relativo de este gen y de cada una de sus alteraciones en el desarrollo de ISSX.
Son aún muy escasas las series descritas. Existen varias familias en la literatura y no son pocas las diferentes mutaciones descritas en el gen ARX, un total de 45 variantes. Asimismo, se ha descrito variabilidad fenotípica y genotípica con diferente correlación entre ambas, lo que no hace más que dificultar aún más un claro conocimiento de la entidad. Al revisar la literatura, no se hace mención en nuestro medio a casos de estas características. Es evidente, por lo tanto, la necesidad de realizar estudios multicéntricos que permitan agrupar a los pacientes con este cuadro, para conseguir con ello un mayor conocimiento de los procesos íntimos implicados en él.
Con esta comunicación queremos exponer nuestra experiencia y las dificultades en el manejo diagnóstico de esta afección, recordar su existencia a la hora de realizar el diagnóstico diferencial de enfermedades que asocian la aparición de SW en varios individuos de una misma familia y subrayar la necesidad del estudio genético completo a la hora de abordar a pacientes en los que se sospeche esta posibilidad, algo aún muy complejo en la sanidad pública.
Presentamos a 2 hermanos varones con antecedentes de tío materno con epilepsia no filiada y múltiples abortos de fetos varones de origen desconocido en la rama materna.
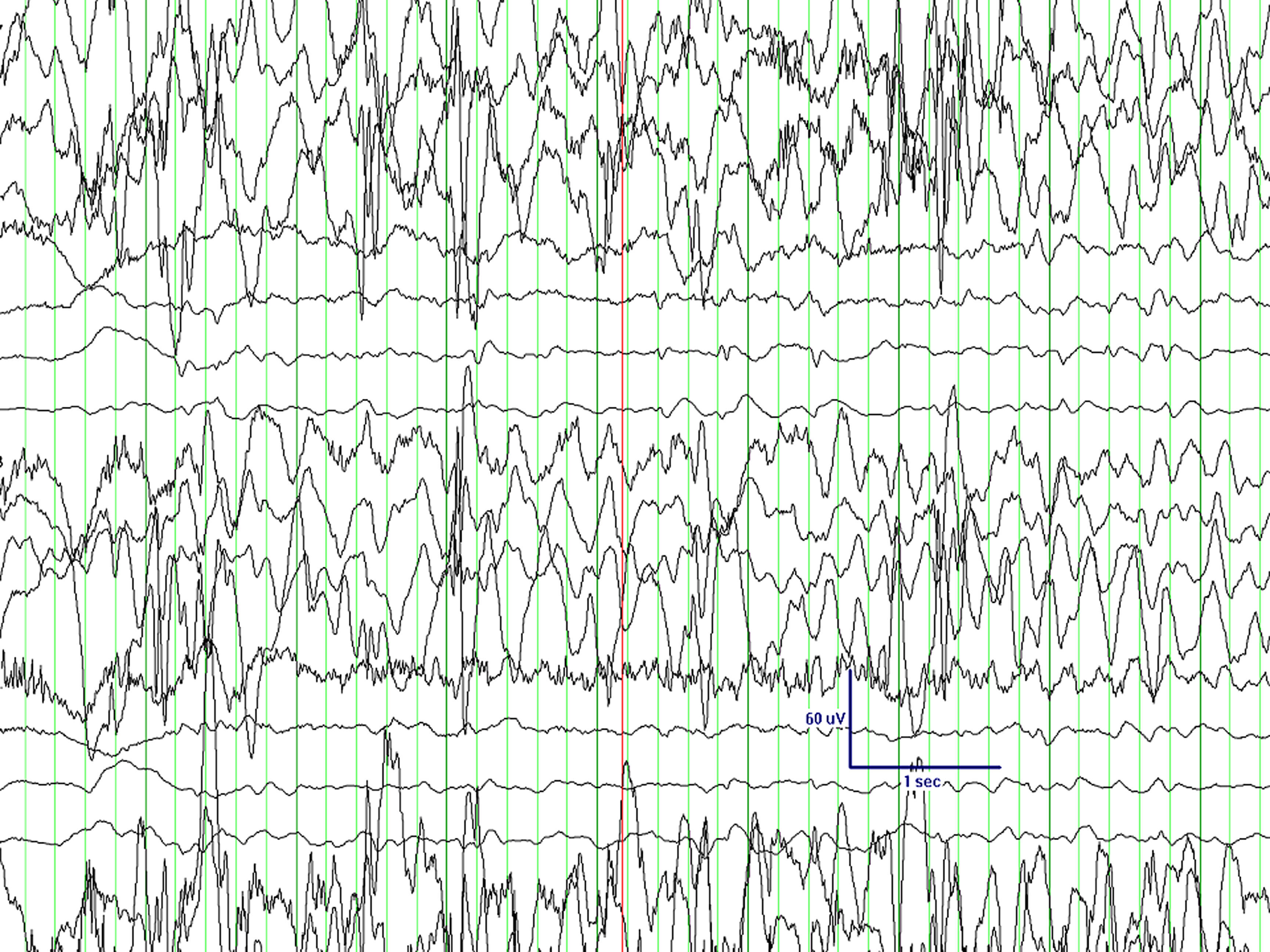
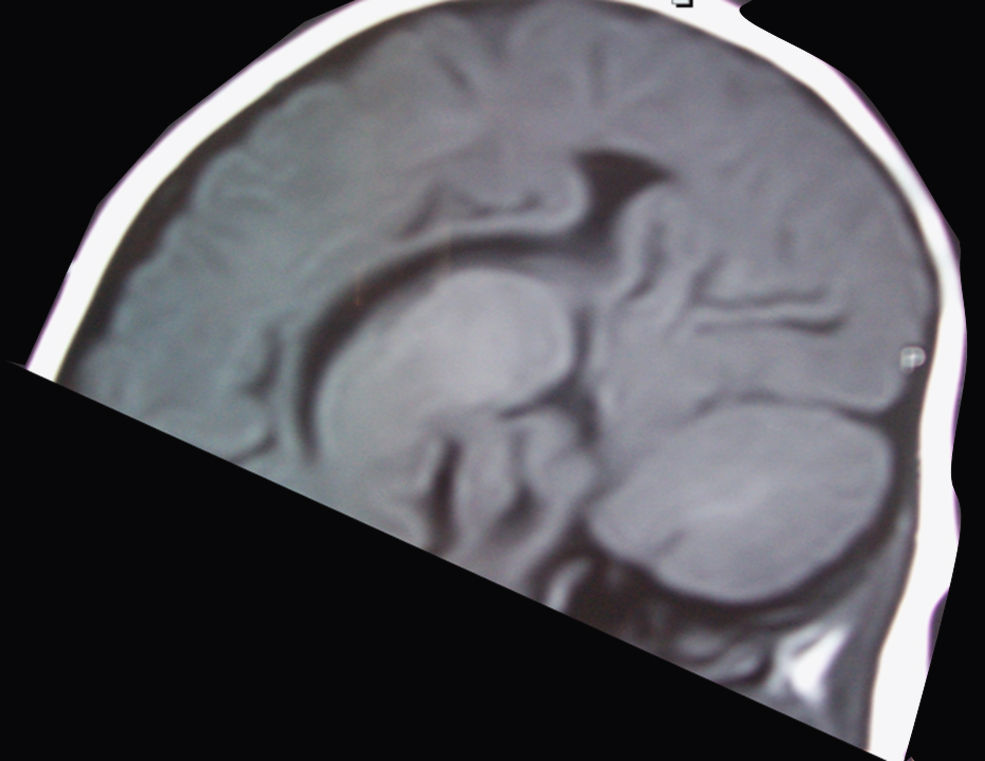
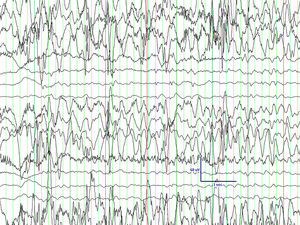
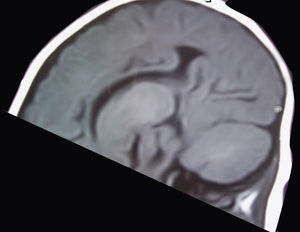
El primero de ellos, tras una gestación de 40 semanas que se desarrolló sin incidencias, nace de parto eutócico sin complicaciones. Al nacimiento se aprecian ligeros rasgos dismórficos (microcefalia leve) sin otros datos de interés. Desde pocos días después del nacimiento, la familia aprecia ciertas dificultades para la lactancia que no dificultaban una adecuada ganancia ponderal. En los controles sucesivos se aprecia un progresivo retraso psicomotor que le permite adquirir sonrisa afectiva y sostén cefálico, pero no la sedesatción. También se aprecia un cierre precoz de la fontanela anterior. Con estos datos, a los 8,5 meses de vida, la familia aprecia una serie de movimientos incoordinados y esporádicos en salvas, que a la exploración fueron catalogados como sospechosos de un cuadro de espasmos sutiles. En el electroencefalograma (EEG) practicado se detecta hipsarritmia franca (fig. 1). Entre la batería de pruebas realizadas para el diagnostico diferencial, se practica una resonancia magnética (RM), en la que se aprecia principalmente una agenesia del cuerpo calloso (fig. 2). La tomografía por emisión monofotónica (SPECT) muestra una hipocaptación en ganglios basales.
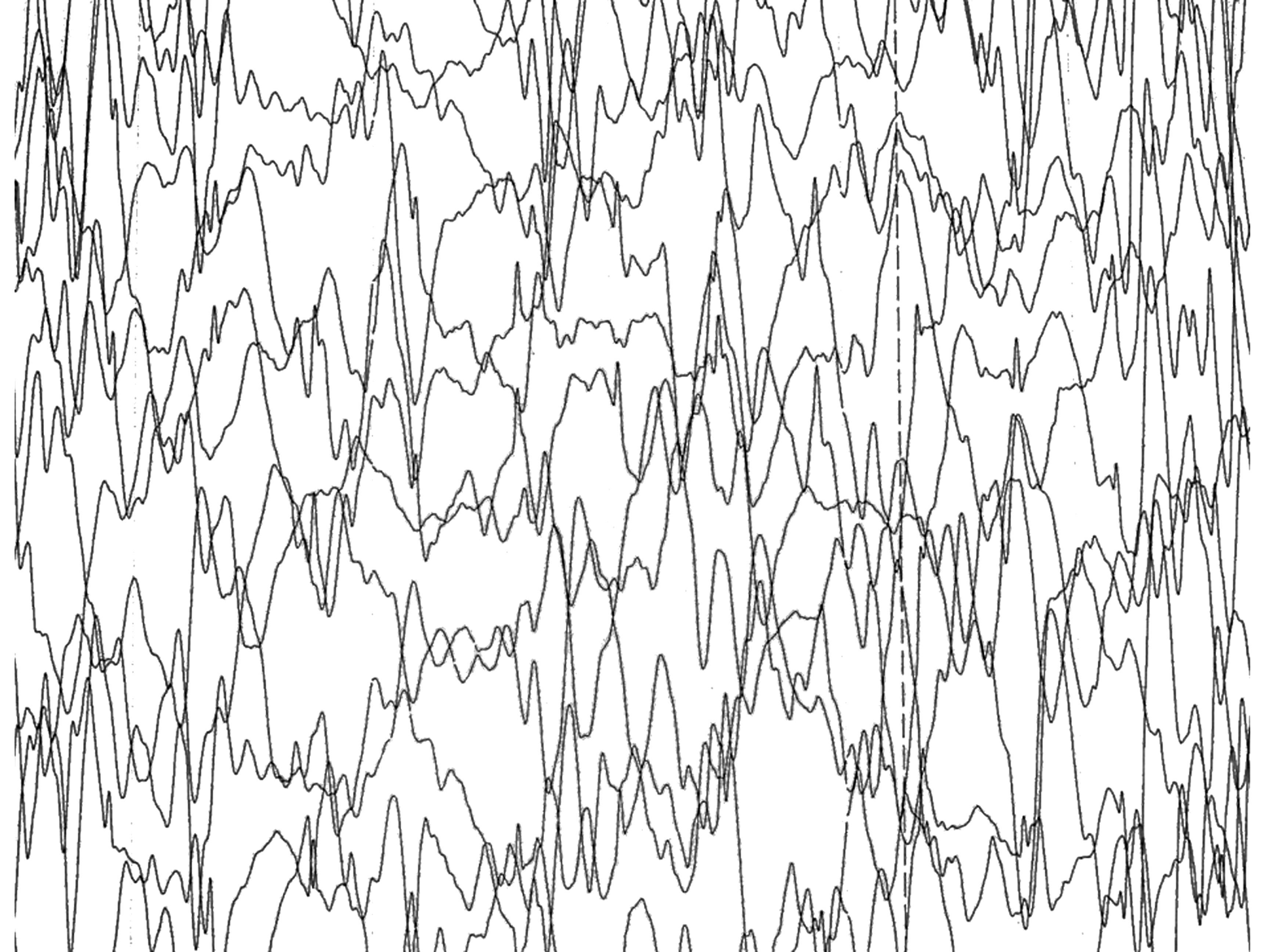
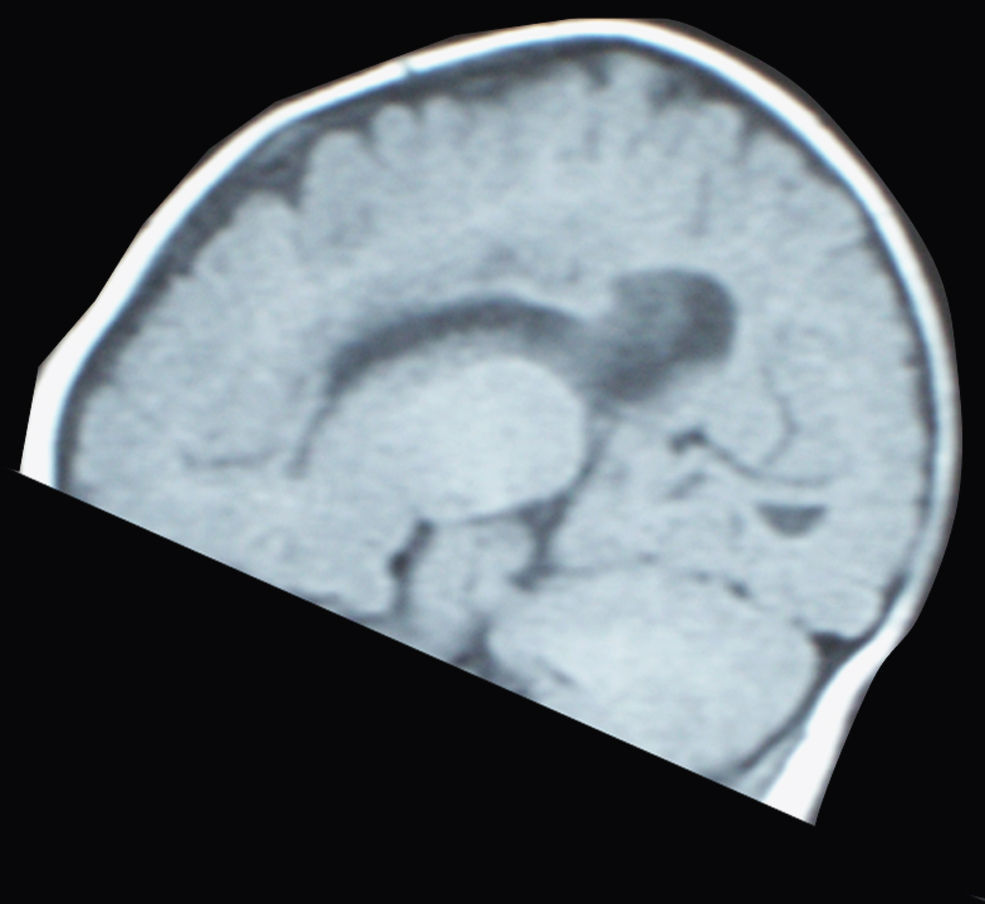
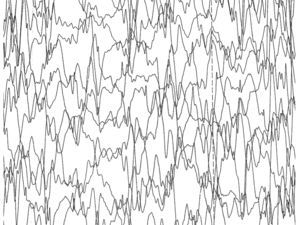
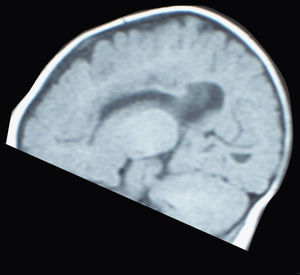
Unos 15 meses después del nacimiento del primer hermano, tras una gestación de 39 semanas de duración y un parto eutócico, nace el segundo. Éste, con una discreta microcefalia y sin otros datos sospechosos de enfermedad, cursa el periodo neonatal sin alteraciones hasta que empieza a presentar progresivamente dificultades para la lactancia de las mismas características del primero. En las sucesivas revisiones se aprecia un progresivo retraso psicomotor, hasta que a los 6 meses la familia aprecia un cuadro de espasmos en extensión que identifica fácilmente por la experiencia del primogénito. Ante estas circunstancias, se practica un EEG (fig. 3), que detecta igualmente hipsarritmia. La RM (fig. 4) presenta también agenesia del cuerpo calloso.
Las encefalopatías epilépticas infantiles (EEI) son uno de los mayores causantes de discapacidades y crisis convulsivas resistentes al tratamiento en pediatría. El reciente interés en su caracterización y su manejo se deriva de que no responden al tratamiento y del pobre desarrollo cognitivo que presentan a pesar de un aceptable control de las crisis8,9.
El SW (espasmos infantiles, EEG con hipsarritmia y retraso psicomotor) es de etiología heterogénea y, en ocasiones, desconocida. El diagnóstico diferencial de los casos sintomáticos, los más frecuentes, incluye lesiones hipóxico-isquémicas, cromosomopatías, etc.10.
La recurrencia familiar ha sido descrita en la literatura con claro predominio en varones, lo que indica un patrón ligado al X1,3,12,13. Hace unos años se describieron mutaciones en dos genes, ARX y STK9, relacionadas con el ISSX11,14.
El gen ARX se localiza en la región Xp22.13. Se compone de 5 exones que transcriben un ARNm de 2,8kb15 que produce una proteína de 562 aminoácidos16,17. La proteína ARX tiene cuatro tractos de polialanina en los que se repiten de 7 a 16 residuos de alanina; tres de los cuatro tractos son codificadas por el exón 2, y los dos primeros son puntos calientes para mutaciones causantes de retraso mental y epilepsia, incluido el SW11,18. Tiene un papel trascendental en el desarrollo. Se expresa en el cerebro fetal y adulto y en el músculo esquelético, donde se han detectado dos isoformas menores de ARNm15. Las expansiones de polialanina se segregan siguiendo unos patrones de herencia recesiva ligada al X. Las mujeres portadoras no están afectadas clínicamente.
El gen CDKL5/STK9 se localiza en la región Xp22.3 y es causante de ISSX y una variante de síndrome de Rett19–24. Aunque la función precisa es desconocida, su expresión en el cerebro de ratón se solapa con la de MECP2, que está mutado en el 80% de los pacientes con síndrome de Rett21–23. Otros fenotipos asociados con mutaciones en CDKL5 son el deterioro intelectual grave, los movimientos estereotípicos de las manos y las alteraciones del desarrollo motor23.
Los casos familiares de SW han sido poco descritos en la literatura, la mayoría como case reports, sin grandes series. Sugai describe algunas características interesantes en su serie, con las que coinciden nuestros casos; por un lado, dentro de un mismo grupo familiar, la etiología siempre ha sido la misma, con una edad muy parecida y discordancia de apenas 1-2 meses al inicio del cuadro. Varias características clínicas, tales como el patrón de las crisis, alteraciones en EEG o la respuesta a un determinado tratamiento, etc., también tienen muchos puntos en común. Incluso la neuroimagen presenta coincidencias interesantes. La existencia de algunos rasgos dismórficos o los problemas de lactancia acaecidos en nuestros pacientes son signos precoces de alarma que se debe tener en cuenta en el futuro.
El cuerpo calloso es una estructura de conexión entre los dos hemisferios cerebrales que se desarrolla entre las semanas 8 y 20 de gestación, y aunque se asocia con frecuencia a retraso psicomotor, actualmente no hay ningún dato clínico específico. Esta alteración, presente en nuestros dos pacientes, es un dato más que tener en cuenta en la caracterización clínica del síndrome.
La epilepsia se asocia con frecuencia al retraso mental. De hecho, se ha señalado una posible asociación genética entre ambas, especialmente en EEIP, EMP, SLG y SW25. No sólo se ha asociado el SW al cromosoma X, hay otras entidades clínicas con sospecha de asociación como el síndrome de Partington (RM y movimientos distónicos de las manos), el síndrome de distonía+epilepsia mioclónica, etc.26.
En nuestros 2 pacientes se realizaron estudios de cariotipo de alta resolución que resultaron normales y una gran bateria de estudios diagnósticos que no aclararon la etiología del cuadro. Asimismo, se estudiaron mutaciones en el gen ARX tras la repetición del cuadro en el segundo hermano, pero no se obtuvieron alteraciones. La posible variabilidad genética del cuadro y las dificultades para un estudio completo de estos genes son dificultades que aún están por superar.
Finalmente, a pesar del progresivo aumento en la investigación y el mayor conocimiento existente sobre las alteraciones genéticas que relacionan el retraso mental, la epilepsia y el cromosoma X, queda mucho trabajo por hacer dentro de la comunidad científica. La biología molecular y sus continuos avances deben ser tenidos en cuenta e incorporados en lo posible a la práctica clínica para poner al alcance de nuestros pacientes todos los medios disponibles en relación también con el consejo genético.